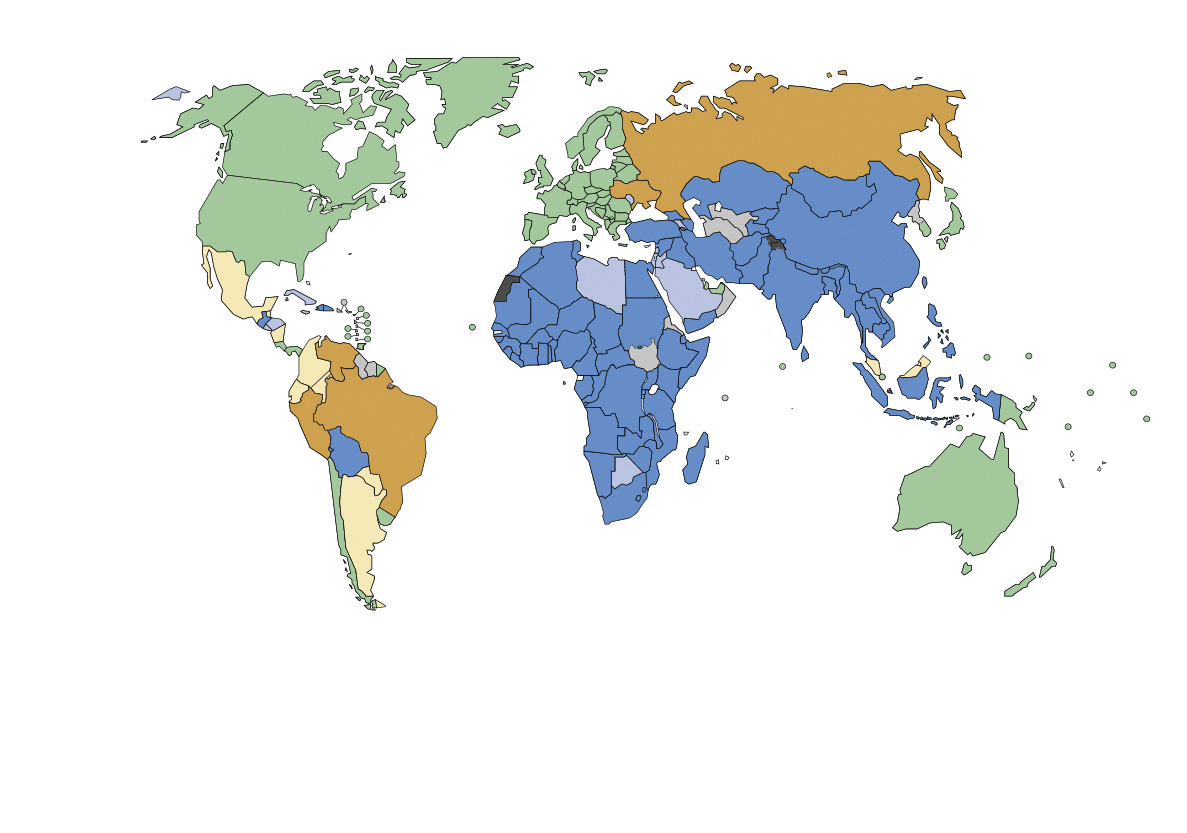
En France, la rage est devenue essentiellement une maladie du voyageur exposé à l’étranger en zone d’enzootie rabique. Mais, dans le monde, elle entraîne 59 000 décès chaque année, du fait de l’absence de contrôle de la maladie chez le chien et des difficultés d’accès à la prophylaxie post-exposition des populations exposées.
La rage est une zoonose d’origine virale responsable de plusieurs dizaines de milliers de décès humains chaque année dans les pays où la rage du chien n’est pas contrôlée et où la prophylaxie post-exposition, efficace à 100 %, n’est pas accessible aux populations les plus vulnérables. En France, la situation épidémiologique est très différente puisque, depuis que notre territoire a été déclaré indemne de rage des mammifères terrestres en 2001, la rage est devenue essentiellement une maladie du voyageur exposé à l’étranger en zone d’enzootie rabique. Cette mise au point est l’occasion de décrire la situation épidémiologique actuelle de la rage dans le monde et en France et de rappeler les situations qui nécessitent une prise en charge dans un centre antirabique.
La rage est médiée par un virus du genre Lyssavirus (famille des rhabdoviridae) qui comprend 16 espèces identifiées à ce jour et deux nouvelles espèces en cours de classification. La quasi-totalité de ces espèces virales a été retrouvée chez les chiroptères (chauves-souris), confirmant ainsi que cet ordre animal correspond probablement au réservoir principal et originel des lyssavirus. L’espèce virale la plus importante en termes de santé publique correspond au lyssavirus de la rage classique ou Rabies lyssavirus (RABV), responsable de la quasi-totalité des décès humains. Ce virus est très largement distribué au niveau mondial chez les carnivores terrestres non volants, et en particulier les chiens, mais également chez les chiroptères sur le continent américain.
La rage est médiée par un virus du genre Lyssavirus (famille des rhabdoviridae) qui comprend 16 espèces identifiées à ce jour et deux nouvelles espèces en cours de classification. La quasi-totalité de ces espèces virales a été retrouvée chez les chiroptères (chauves-souris), confirmant ainsi que cet ordre animal correspond probablement au réservoir principal et originel des lyssavirus. L’espèce virale la plus importante en termes de santé publique correspond au lyssavirus de la rage classique ou Rabies lyssavirus (RABV), responsable de la quasi-totalité des décès humains. Ce virus est très largement distribué au niveau mondial chez les carnivores terrestres non volants, et en particulier les chiens, mais également chez les chiroptères sur le continent américain.
Situation de la rage dans le monde
Au niveau mondial, le chien constitue à la fois le réservoir et le principal vecteur de la rage humaine et est responsable de 99 % des décès humains (v. figure ).1 Cependant, de nombreux carnivores sauvages terrestres peuvent également jouer ces rôles (coyote, moufette et raton laveur en Amérique du Nord, mangouste en Afrique, chien viverrin et renard roux en Europe centrale et de l’Est, renard arctique dans les régions polaires nordiques...). Certaines régions du monde sont indemnes de rage terrestre des mammifères non volants (c’est-à-dire à l’exception de celle circulant chez les chauves-souris), comme l’Antarctique, l’Europe de l’Ouest, l’Australie, la Nouvelle-Zélande, le Japon, ainsi que certaines autres îles plus petites. Les chauves-souris sont, elles, présentes sur la quasi-totalité des continents et constituent des hôtes importants pour les lyssavirus (aboutissant à la rage des chiroptères).
La rage entraîne chaque année le décès d’environ 59 000 personnes et des pertes économiques estimées à plus de 8 milliards de dollars, supportées essentiellement par les deux continents les plus touchés, l’Asie et l’Afrique. Ces nombreux décès humains sont la conséquence de l’absence de contrôle de la rage canine et des difficultés d’accès à la prophylaxie post-exposition des populations les plus exposées.2
La rage entraîne chaque année le décès d’environ 59 000 personnes et des pertes économiques estimées à plus de 8 milliards de dollars, supportées essentiellement par les deux continents les plus touchés, l’Asie et l’Afrique. Ces nombreux décès humains sont la conséquence de l’absence de contrôle de la rage canine et des difficultés d’accès à la prophylaxie post-exposition des populations les plus exposées.2
La rage en Europe de l’Ouest et en France
La rage canine a disparu en Europe de l’Ouest au début du XXe siècle grâce au confinement des animaux domestiques, au port de la muselière et au contrôle des animaux errants. Elle est réapparue chez le renard vers 1940 à la frontière russo-polonaise et a progressé vers l’ouest pour atteindre la France à la fin des années 1960. Les campagnes de vaccination de la faune sauvage, débutées à la fin des années 1970 et menées de façon concertée au niveau européen, se sont montrées très efficaces puisque le dernier cas de rage d’origine vulpine en France a été identifié en Moselle en 1998. La France est déclarée indemne de rage des mammifères terrestres selon les critères de l’Organisation mondiale de la santé animale (OIE) depuis 2001.3 Le risque de réintroduction de la rage sur notre territoire par des animaux importés illégalement de zones d’enzootie canine est surveillé étroitement par les services vétérinaires mais est considéré comme négligeable pour la population (risque estimé à 7,52 x 10-10 d’être exposé un jour donné à un animal enragé importé illégalement).4
En Europe de l’Ouest, cinq espèces de lyssavirus ont déjà été identifiées chez des chauves-souris : European bat 1 lyssavirus (EBLV-1) avec deux sous-types 1a et 1b, European bat 2 lyssavirus (EBLV-2), et plus récemment Bokeloh bat lyssavirus (BBLV), Lleida bat lyssavirus (LLEBV), et Kotalahti bat lyssavirus (KBLV) identifié en 2017 en Finlande et en cours de caractérisation. Les chauves-souris européennes sont insectivores, elles peuvent être observées à proximité ou même dans les habitats humains (greniers) mais sont rarement responsables d’exposition humaine car elles disposent d’un système sophistiqué d’écholocalisation leur permettant d’éviter les contacts. Seulement cinq cas d’encéphalites fatales chez l’homme ont été attribuées aux lyssavirus de chauves-souris en Europe.
La situation épidémiologique est très différente en Guyane, comme dans le reste du continent améri- cain. De nombreuses espèces de chauves-souris sont présentes, dont des chauves-souris insectivores, frugivores et quelques espèces hématophages (ou vampires). Ces dernières chauves-souris sont réservoirs et vecteurs du virus RABV et peuvent être responsables de la rage desmodine. Occasionnellement les chauves-souris hématophages peuvent réaliser des repas sanguins chez l’être humain, en particulier à l’occasion de nuit passée en plein air. En 2008, un homme de 42 ans est décédé de la rage à Cayenne. Ce patient est le premier et unique cas de rage humaine autochtone en France rapporté depuis 1924.5 Aucun autre cas de rage humaine n’a depuis été diagnostiqué dans ce département.
La rage humaine en France est donc de nos jours essentiellement une maladie d’importation. Sur les 14 cas recensés depuis 1980, 13 sont des infections acquises par des voyageurs exposés en zone d’enzootie de rage canine (tableau 1). Aucun de ces patients n’avait reçu une prophylaxie post-exposition adaptée.3 Le dernier cas a été diagnostiqué en 2017 chez un enfant ayant été mordillé à la main par un chiot au Sri Lanka.
En Europe de l’Ouest, cinq espèces de lyssavirus ont déjà été identifiées chez des chauves-souris : European bat 1 lyssavirus (EBLV-1) avec deux sous-types 1a et 1b, European bat 2 lyssavirus (EBLV-2), et plus récemment Bokeloh bat lyssavirus (BBLV), Lleida bat lyssavirus (LLEBV), et Kotalahti bat lyssavirus (KBLV) identifié en 2017 en Finlande et en cours de caractérisation. Les chauves-souris européennes sont insectivores, elles peuvent être observées à proximité ou même dans les habitats humains (greniers) mais sont rarement responsables d’exposition humaine car elles disposent d’un système sophistiqué d’écholocalisation leur permettant d’éviter les contacts. Seulement cinq cas d’encéphalites fatales chez l’homme ont été attribuées aux lyssavirus de chauves-souris en Europe.
La situation épidémiologique est très différente en Guyane, comme dans le reste du continent améri- cain. De nombreuses espèces de chauves-souris sont présentes, dont des chauves-souris insectivores, frugivores et quelques espèces hématophages (ou vampires). Ces dernières chauves-souris sont réservoirs et vecteurs du virus RABV et peuvent être responsables de la rage desmodine. Occasionnellement les chauves-souris hématophages peuvent réaliser des repas sanguins chez l’être humain, en particulier à l’occasion de nuit passée en plein air. En 2008, un homme de 42 ans est décédé de la rage à Cayenne. Ce patient est le premier et unique cas de rage humaine autochtone en France rapporté depuis 1924.5 Aucun autre cas de rage humaine n’a depuis été diagnostiqué dans ce département.
La rage humaine en France est donc de nos jours essentiellement une maladie d’importation. Sur les 14 cas recensés depuis 1980, 13 sont des infections acquises par des voyageurs exposés en zone d’enzootie de rage canine (tableau 1). Aucun de ces patients n’avait reçu une prophylaxie post-exposition adaptée.3 Le dernier cas a été diagnostiqué en 2017 chez un enfant ayant été mordillé à la main par un chiot au Sri Lanka.
Physiopathologie et tableau clinique
La rage est une zoonose d’inoculation. La transmission se fait par contact direct avec la salive d’un animal infecté par morsure, griffure, léchage d’une peau excoriée ou projection sur une muqueuse.1 En dehors de la contamination par morsure ou griffure qui représente l’essentiel des modes de transmission de la rage à l’être humain dans le monde, d’autres situations à risque exceptionnelles ont été décrites : contamination au laboratoire par manipulation de matériel infectant, transmission interhumaine à l’occasion de greffe d’organe solide ou de tissus provenant de donneurs décédés de la rage, transmission en péri-partum d’une mère enragée à son nouveau-né... Un risque théorique existe pour le personnel soignant lors de la prise en charge de patients enragés, cependant aucune transmission interhumaine n’a été décrite dans ce contexte. Il faut rappeler que le sang et les urines ne représentent pas un risque infectieux pour la rage et que le respect des précautions d’hygiène habituelles permet d’écarter tout risque de transmission dans le cadre des soins.
Rage humaine
L’incubation de la rage est silencieuse. Cette phase asymptomatique correspond à la phase de migration du virus depuis le site d’inoculation jusqu’au système nerveux central. Elle dure en moyenne de 1 à 3 mois et reste inférieure à 1 an dans 99 % des cas. Des durées d’incubation extrêmes (quelques jours à plusieurs années) ont été observées de façon exceptionnelle. L’incubation est d’autant plus courte que l’inoculum est important et que la morsure est profonde, multiple, située à proximité des extrémités (très innervées), de la face, ou responsable d’une atteinte directe du système nerveux central (plaies crânio-cérébrales).6
La phase prodromique est inconstante, observée dans 30 à 70 % des cas ; elle est marquée par un syndrome pseudo-grippal, des troubles digestifs et un prurit et/ou des douleurs neuropathiques au site de la morsure qui s’étendent dans un second temps à tout le membre concerné. Après la phase prodromique, l’évolution se fait vers la phase neurologique aiguë qui peut être spastique dans deux tiers des cas (forme encéphalitique ou furieuse) ou paralytique dans le dernier tiers. Des formes de rage non classiques ou atypiques existent et sont le plus souvent associées à une infection par un lyssavirus de chauve-souris.
La forme spastique est caractérisée par l’association de troubles fluctuants de la conscience, d’hydrophobie ou aérophobie, de spasmes inspiratoires et d’une dysfonction du système nerveux autonome (sympathique et parasympathique). La forme paralytique est, quant à elle, marquée par une paralysie flasque ascendante avec hypo- ou aréflexie et des troubles sphinctériens, dont le diagnostic différentiel est le syndrome de Guillain-Barré. L’évolution de la maladie est caractérisée par une aggravation des troubles de la conscience et l’apparition d’un coma avec disparition des spasmes phobiques. Le décès est constant (à de rares exceptions près) et le plus souvent secondaire à une défaillance cardiocirculatoire (troubles du rythme, troubles de conduction, sidération myocardique...). La prise en charge en réanimation avec des soins de support agressifs ne permet pour le moment qu’une prolongation de la phase de coma sans amélioration du pronostic.
La phase prodromique est inconstante, observée dans 30 à 70 % des cas ; elle est marquée par un syndrome pseudo-grippal, des troubles digestifs et un prurit et/ou des douleurs neuropathiques au site de la morsure qui s’étendent dans un second temps à tout le membre concerné. Après la phase prodromique, l’évolution se fait vers la phase neurologique aiguë qui peut être spastique dans deux tiers des cas (forme encéphalitique ou furieuse) ou paralytique dans le dernier tiers. Des formes de rage non classiques ou atypiques existent et sont le plus souvent associées à une infection par un lyssavirus de chauve-souris.
La forme spastique est caractérisée par l’association de troubles fluctuants de la conscience, d’hydrophobie ou aérophobie, de spasmes inspiratoires et d’une dysfonction du système nerveux autonome (sympathique et parasympathique). La forme paralytique est, quant à elle, marquée par une paralysie flasque ascendante avec hypo- ou aréflexie et des troubles sphinctériens, dont le diagnostic différentiel est le syndrome de Guillain-Barré. L’évolution de la maladie est caractérisée par une aggravation des troubles de la conscience et l’apparition d’un coma avec disparition des spasmes phobiques. Le décès est constant (à de rares exceptions près) et le plus souvent secondaire à une défaillance cardiocirculatoire (troubles du rythme, troubles de conduction, sidération myocardique...). La prise en charge en réanimation avec des soins de support agressifs ne permet pour le moment qu’une prolongation de la phase de coma sans amélioration du pronostic.
Rage animale
L’histoire naturelle de la rage chez l’animal est similaire à celle observée chez l’être humain, aboutissant à une encéphalite aiguë rapidement mortelle en quelques jours. La phase de contagiosité chez l’animal débute à la fin de la phase d’incubation quand l’animal peut être encore asymptomatique et se poursuit pendant la phase clinique. La contagiosité débute au maximum 15 jours avant le début des signes cliniques (délai fixé et utilisé en France pour la surveillance des animaux mordeurs) et se poursuit jusqu’à la mort qui survient en quelques jours.
Diagnostic biologique de la rage
Le diagnostic biologique de la rage animale ou humaine est du ressort exclusif de centres de référence habilités. En France, toutes les demandes de diagnostic de rage humaine ainsi que les diagnostics vétérinaires chez des animaux suspects d’être à l’origine de contamination humaine sont traitées par le Centre national de référence de la rage (CNRR)*. La confirmation biologique de la rage repose sur au moins l’un des critères suivants : présence d’antigènes viraux (immunofluorescence directe) ; isolement viral (en culture cellulaire) ; présence d’acides nucléiques détectés par techniques moléculaires (reverse transcriptase polymerase chain reaction [RT-PCR]) ; ou présence d’anticorps spécifiques dans le liquide céphalorachidien (LCR) ou dans le sérum (uniquement chez l’être humain, si non vacciné). La rage humaine et la rage animale font partie des maladies à déclaration obligatoire, et la rage animale fait partie des dangers sanitaires réglementés de catégorie 1.
Diagnostic chez l’homme
La rage est évoquée devant un tableau d’encéphalite notamment en cas de notion de voyage, de morsure, de griffure ou de contexte clinique évocateur. Le diagnostic intra-vitam est réalisé à partir d’une biopsie de peau et de prélèvements de salive. La biopsie cutanée est réalisée dans une zone richement innervée (préférentiellement à la base de la nuque dans une zone avec follicules pileux). Les prélèvements de salive, collectés par écouvillonnage ou par recueil direct, doivent être réalisés au minimum à trois reprises à intervalle de 3 à 6 heures. L’excrétion intermittente du virus dans la salive nécessite en effet de multiplier le nombre d’échantillons. Des prélèvements de LCR et de sérum peuvent également être réalisés, bien que la sensibilité diagnostique soit plus faible. La recherche d’ARN viraux par RT-PCR sur biopsie cutanée et/ou prélèvements salivaires est la méthode de choix.
Le diagnostic est possible avant le décès dans la plupart des situations et permet d’adapter la prise en charge du patient et de débuter un traitement post-exposition chez les personnes exposées au même animal. En post-mortem, le prélèvement de choix est le prélèvement cérébral ou à défaut la biopsie cutanée.7
Le diagnostic est possible avant le décès dans la plupart des situations et permet d’adapter la prise en charge du patient et de débuter un traitement post-exposition chez les personnes exposées au même animal. En post-mortem, le prélèvement de choix est le prélèvement cérébral ou à défaut la biopsie cutanée.7
Diagnostic chez l’animal
Le diagnostic repose en France sur la mise en évidence d’antigènes viraux complétée par l’isolement viral à partir de tissus cérébraux (biopsies de cortex cérébral, d’hippocampe ou de bulbe rachidien). Chaque année, le CNRR reçoit environ 1 300 prélèvements issus d’animaux suspects de contamination humaine décédés ou euthanasiés pendant la période de surveillance vétérinaire.
Traitement et prévention de la rage
Prophylaxie post-exposition
À ce jour, aucun traitement curatif n’est disponible lorsque la rage est déclarée, seule la prophylaxie post- exposition, efficace à 100 %, permet de prévenir cette infection. Les indications de la prophylaxie dépendent du type d’exposition (espèce animale, catégorie d’exposition [tableau 2]) et du pays d’exposition.1 La France (hors Guyane) est indemne de rage des mammifères terrestres non volants et les expositions aux animaux (hors chauves-souris) survenues sur ce territoire ne justifient plus de prophylaxie post-exposition.
Le risque de rage en France est actuellement limité à trois situations qui doivent rapidement conduire à une consultation dans un centre antirabique :
– exposition à une chauve-souris ;
– exposition à un animal connu pour avoir été importé illégalement d’une zone d’endémie rabique ;
– exposition en zone d’enzootie rabique (situation de voyage essentiellement) et en Guyane.
Dans ces trois situations, la prise en charge consiste en un lavage abondant immédiat de toutes les plaies à l’eau savonneuse pendant 15 minutes afin de réduire l’inoculum viral, une désinfection avec un antiseptique et un parage si nécessaire sans suture.1 L’immunité antitétanique est mise à jour et une antibioprophylaxie prescrite en cas de plaie associée à un risque infectieux élevé. La prophylaxie post-exposition antirabique comprend une vaccination pour les expositions de catégorie 2 et une vaccination associée à une sérothérapie pour les expositions de catégorie 3 et toutes les expositions aux chauves-souris (tableau 2). En France, la prophylaxie post-exposition est initiée uniquement dans les centres antirabiques agréés par le ministère de la Santé, et peut être poursuivie dans une antenne antirabique. Le réseau des centres et antennes antirabiques comprend 90 centres de traitement sur tout le territoire. Seuls les vaccins inactivés produits sur culture cellulaire ou tissus sont recommandés par l’Organisation mondiale de la santé (OMS) chez l’être humain (autorisation de mise sur le marché en France : Vaccin rabique Pasteur et Rabipur). Ces vaccins sont très bien tolérés et il n’existe aucune contre-indication à leur utilisation en cas d’exposition au risque de rage (y compris chez la femme enceinte, le nouveau-né, l’individu immunodéprimé...). Trois protocoles de vaccination sont recommandés par l’OMS en post-exposition (tableau 3).1
Les immunoglobulines antirabiques utilisées sont polyclonales, spécifiques et purifiées. Elles peuvent être d’origine humaine ou équine (moins coûteuses dans ce dernier cas). Elles doivent être administrées en une seule fois, au début de la prophylaxie post-exposition ou le plus tôt possible après sa mise en route (et au maximum dans les 7 jours après la première dose de vaccin). Les immunoglobulines antirabiques sont administrées localement dans toutes les plaies.
Dans un contexte d’exposition à un animal suspect, la surveillance vétérinaire est essentielle lorsque l’animal est connu. En France, la mise en observation vétérinaire des animaux domestiques mordeurs (chiens, chats et furets) est une obligation légale imposant trois visites à 7 jours d’intervalle sur une période de 15 jours (J1, J8 et J15) par un vétérinaire sanitaire qui délivre un certificat à la fin de cette surveillance. Si l’animal décède ou est euthanasié pendant la période de surveillance, la tête ou l’encéphale est envoyé au CNRR afin d’éliminer le diagnostic de rage.
Le risque de rage en France est actuellement limité à trois situations qui doivent rapidement conduire à une consultation dans un centre antirabique :
– exposition à une chauve-souris ;
– exposition à un animal connu pour avoir été importé illégalement d’une zone d’endémie rabique ;
– exposition en zone d’enzootie rabique (situation de voyage essentiellement) et en Guyane.
Dans ces trois situations, la prise en charge consiste en un lavage abondant immédiat de toutes les plaies à l’eau savonneuse pendant 15 minutes afin de réduire l’inoculum viral, une désinfection avec un antiseptique et un parage si nécessaire sans suture.1 L’immunité antitétanique est mise à jour et une antibioprophylaxie prescrite en cas de plaie associée à un risque infectieux élevé. La prophylaxie post-exposition antirabique comprend une vaccination pour les expositions de catégorie 2 et une vaccination associée à une sérothérapie pour les expositions de catégorie 3 et toutes les expositions aux chauves-souris (tableau 2). En France, la prophylaxie post-exposition est initiée uniquement dans les centres antirabiques agréés par le ministère de la Santé, et peut être poursuivie dans une antenne antirabique. Le réseau des centres et antennes antirabiques comprend 90 centres de traitement sur tout le territoire. Seuls les vaccins inactivés produits sur culture cellulaire ou tissus sont recommandés par l’Organisation mondiale de la santé (OMS) chez l’être humain (autorisation de mise sur le marché en France : Vaccin rabique Pasteur et Rabipur). Ces vaccins sont très bien tolérés et il n’existe aucune contre-indication à leur utilisation en cas d’exposition au risque de rage (y compris chez la femme enceinte, le nouveau-né, l’individu immunodéprimé...). Trois protocoles de vaccination sont recommandés par l’OMS en post-exposition (tableau 3).1
Les immunoglobulines antirabiques utilisées sont polyclonales, spécifiques et purifiées. Elles peuvent être d’origine humaine ou équine (moins coûteuses dans ce dernier cas). Elles doivent être administrées en une seule fois, au début de la prophylaxie post-exposition ou le plus tôt possible après sa mise en route (et au maximum dans les 7 jours après la première dose de vaccin). Les immunoglobulines antirabiques sont administrées localement dans toutes les plaies.
Dans un contexte d’exposition à un animal suspect, la surveillance vétérinaire est essentielle lorsque l’animal est connu. En France, la mise en observation vétérinaire des animaux domestiques mordeurs (chiens, chats et furets) est une obligation légale imposant trois visites à 7 jours d’intervalle sur une période de 15 jours (J1, J8 et J15) par un vétérinaire sanitaire qui délivre un certificat à la fin de cette surveillance. Si l’animal décède ou est euthanasié pendant la période de surveillance, la tête ou l’encéphale est envoyé au CNRR afin d’éliminer le diagnostic de rage.
Vaccination préventive
La vaccination en pré-exposition est recommandée aux personnes qui ont un risque élevé d’être exposées à la rage, à savoir le personnel de laboratoire manipulant des lyssavirus ou du matériel contaminé (ou susceptible de l’être), le personnel en contact fréquent avec des animaux, les chiroptérologues et certaines catégories de voyageurs séjournant en zone d’enzootie ;1 l’immunité doit être entretenue par des rappels et suivie par des contrôles sérologiques. Cette vaccination préventive ne dispense pas de la vaccination post-exposition en cas de suspicion de contamination mais cette dernière est alors simplifiée (2 injections seulement à J0 et J3 et pas d’immunoglobulines anti- rabiques nécessaires) pour les patients immunocompétents.
OBJECTIF : ÉRADICATION EN 2030
Plus de 130 ans après la première application du protocole vaccinal de Louis Pasteur, la rage est encore responsable d’environ 59 000 morts par an dans le monde et reste, une fois les signes cliniques apparus, la maladie infectieuse connue la plus constamment mortelle. Sa prévention repose toujours aujourd’hui sur le contrôle des réservoirs animaux, la vaccination préventive des sujets à risque et une prise en charge rapide des individus exposés (prophylaxie post-exposition). En France, l’épidémiologie de la rage a changé depuis 20 ans et ne justifie plus l’administration de prophylaxie post-exposition chez les individus exposés à un animal (hors chauve- souris) sur notre territoire sauf en Guyane où le risque de rage desmodine ne peut être écarté. Les efforts doivent donc maintenant se reporter sur la prévention et la prise en charge des expositions survenant en zone d’enzootie rabique. Plus globalement, il est à souhaiter que l’objectif de l’OMS d’éliminer en 2030 la rage humaine médiée par le chien au niveau mondial soit atteint, grâce notamment à la vaccination antirabique de masse des chiens, à l’amélioration de l’accès à la prophylaxie post-exposition dans les pays à ressources limitées et à l’utilisation de schémas de prophylaxie accessibles aux populations les plus vulnérables (schémas plus courts, moins chers, ne nécessitant peu ou pas de chaîne du froid...). V
Références
1. World Health Organization (ed). WHO expert consultation on rabies: third report. Genève: WHO, 2018. https://apps.who.int ou https://bit.ly/2YdXt8E
2. Hampson K, Coudeville L, Lembo T, et al. Estimating the global burden of endemic canine rabies. PLoS Negl Trop Dis 2015;9:e0003709.
3. Parize P, Dacheux L, Larrous F, Bourhy H, The French network of antirabies clinics. The shift in rabies epidemiology in France: time to adjust rabies post-exposure risk assessment. Euro Surveill 2018;23(39). www.eurosurveillance.org ou https://bit.ly/2xSD4tv
4. Ribadeau-Dumas F, Cliquet F, et al. Travel-associated rabies in pets and residual rabies risk, Western Europe. Emerg Infect Dis 2016;22:1268-71.
5. Meynard JB, Flamand C, Dupuy C, et al. First human rabies case in French Guiana, 2008: epidemiological investigation and control. PLoS Negl Trop Dis 2012;6:e1537.
6. Hemachudha T, Ugolini G, Wacharapluesadee S, Sungkarat W, Shuangshoti S, Laothamatas J. Human rabies: neuropathogenesis, diagnosis, and management. Lancet Neurol 2013;12:498-513.
7. Dacheux L, Bourhy H. Diagnostic tests for human rabies. Rev Sci Tech Int Off Epizoot 2018;37:581-93.
2. Hampson K, Coudeville L, Lembo T, et al. Estimating the global burden of endemic canine rabies. PLoS Negl Trop Dis 2015;9:e0003709.
3. Parize P, Dacheux L, Larrous F, Bourhy H, The French network of antirabies clinics. The shift in rabies epidemiology in France: time to adjust rabies post-exposure risk assessment. Euro Surveill 2018;23(39). www.eurosurveillance.org ou https://bit.ly/2xSD4tv
4. Ribadeau-Dumas F, Cliquet F, et al. Travel-associated rabies in pets and residual rabies risk, Western Europe. Emerg Infect Dis 2016;22:1268-71.
5. Meynard JB, Flamand C, Dupuy C, et al. First human rabies case in French Guiana, 2008: epidemiological investigation and control. PLoS Negl Trop Dis 2012;6:e1537.
6. Hemachudha T, Ugolini G, Wacharapluesadee S, Sungkarat W, Shuangshoti S, Laothamatas J. Human rabies: neuropathogenesis, diagnosis, and management. Lancet Neurol 2013;12:498-513.
7. Dacheux L, Bourhy H. Diagnostic tests for human rabies. Rev Sci Tech Int Off Epizoot 2018;37:581-93.