Immunologie. Les patients traités par un anti-TNF sont exposés à un risque accru de réactivation d’une tuberculose latente sur un mode grave et disséminé. Comment comprendre et prévenir cette complication ?
L’apport des inhibiteurs du tumor necrosis factor (TNF) a été un progrès majeur dans la prise en charge de multiples maladies inflammatoires chroniques. Les premiers travaux ont été réalisés au cours de la polyarthrite rhumatoïde et de la maladie de Crohn. Ils ont ensuite été étendus au psoriasis, au rhumatisme psoriasique et à la spondylarthrite ankylosante, et la liste des maladies continue à progresser. Les résultats ont été globalement très favorables, en particulier sur les manifestations cliniques et leurs conséquences à long terme, telle la destruction tissulaire. Ces premiers travaux ont aussi montré une hétérogénéité de réponse, définissant ainsi des groupes de malades répondeurs et non répondeurs.
Au-delà de sa contribution à l’inflammation, le TNF est l’une des cyto-kines centrales pour la protection vis-à-vis des infections. Il était donc prévisible que son inhibition pourrait s’associer à un risque accru d’infections en général, et de certaines en particulier. Ainsi ont été observés des cas de tuberculose, le plus souvent des réactivations de tuberculose latente. C’est l’utilisation à grande échelle de ces inhibiteurs dans la population réelle des patients qui a montré la fréquence et la gravité de cet effet indésirable, non identifié lors des essais clini- ques initiaux. Secondairement, la description d’autres infections opportunistes a fait suspecter un déficit de l’immunité cellulaire, associé à l’inflammation chronique et aggravé lors de l’inhibition du TNF. Une meilleure compréhension de la physio- pathologie des maladies et du rôle du TNF dans la réponse immunitaire vis-à-vis des infections a permis de mieux appréhender cette réactivation et surtout de mettre en place des actions de prévention.
Au-delà de sa contribution à l’inflammation, le TNF est l’une des cyto-kines centrales pour la protection vis-à-vis des infections. Il était donc prévisible que son inhibition pourrait s’associer à un risque accru d’infections en général, et de certaines en particulier. Ainsi ont été observés des cas de tuberculose, le plus souvent des réactivations de tuberculose latente. C’est l’utilisation à grande échelle de ces inhibiteurs dans la population réelle des patients qui a montré la fréquence et la gravité de cet effet indésirable, non identifié lors des essais clini- ques initiaux. Secondairement, la description d’autres infections opportunistes a fait suspecter un déficit de l’immunité cellulaire, associé à l’inflammation chronique et aggravé lors de l’inhibition du TNF. Une meilleure compréhension de la physio- pathologie des maladies et du rôle du TNF dans la réponse immunitaire vis-à-vis des infections a permis de mieux appréhender cette réactivation et surtout de mettre en place des actions de prévention.
Des formes graves et disséminées de tuberculose
L’inhibition du TNF est devenue une référence dans le traitement de multiples maladies. La démonstration initiale de son efficacité dans le traitement de la polyarthrite rhumatoïde repose sur l’étude ATTRACT réalisée chez des mala- des incomplètement améliorés par le méthotrexate.1 Le premier anticorps anti-TNF, l’infliximab, associé au méthotrexate a été comparé au méthotrexate seul. L’association a permis d’obtenir l’amélioration du taux de réponse, passant de 20 à 60 %. Ces résultats favorables restent cependant incomplets, avec environ un tiers de malades non répondeurs. Des résultats proches ont été ensuite obtenus avec l’étanercept, un récepteur soluble du TNF. Il a été initialement comparé au méthotrexate en monothérapie. Depuis, d’autres inhibiteurs du TNF ont été développés et plus récemment des biosimilaires des premières molécules.
Très peu d’effets indésirables avaient été rapportés dans l’étude ATTRACT avec l’infliximab,1 essentiellement des manifestations d’intolérance locale ou systémique lors de l’administration par voie intraveineuse. Après la mise sur le marché, en France en 2000, les centres de pharmacovigilance ont signalé rapidement l’apparition d’infections sévères surtout tuberculeuses. L’étude ATTRACT n’en rapportait qu’un seul cas, et sur les 2 000 malades ayant pris part aux premiers essais thérapeutiques ayant permis l’enregistrement, seuls 2 malades avaient développé une tuberculose, soit 1 cas/1 000. Rapidement au niveau mondial, plusieurs centaines de cas ont été rapportés, avec 200 cas sur les premiers 200 000 malades traités, soit exactement la même fréquence de 1/1 000.2
Ces tuberculoses avaient des particularités inhabituelles faisant évoquer d’emblée un contexte de déficit immunitaire acquis. Il s’agissait d’un délai de survenue rapide, dans les 3 mois après le début du traitement, et d’une fréquence inhabituelle des formes disséminées et graves, avec des atteintes ganglionnaires, médullaires, rendant compte d’une mortalité initiale de 20 %. La sévérité et la fréquence de ces réactions ont imposé rapidement la rédaction de recommandations et de précautions d’emploi pour prévenir ces complications. Dans le même temps, les progrès de la compréhension des mécanismes ont permis de conclure que cet effet indésirable était prévisible.
Très peu d’effets indésirables avaient été rapportés dans l’étude ATTRACT avec l’infliximab,1 essentiellement des manifestations d’intolérance locale ou systémique lors de l’administration par voie intraveineuse. Après la mise sur le marché, en France en 2000, les centres de pharmacovigilance ont signalé rapidement l’apparition d’infections sévères surtout tuberculeuses. L’étude ATTRACT n’en rapportait qu’un seul cas, et sur les 2 000 malades ayant pris part aux premiers essais thérapeutiques ayant permis l’enregistrement, seuls 2 malades avaient développé une tuberculose, soit 1 cas/1 000. Rapidement au niveau mondial, plusieurs centaines de cas ont été rapportés, avec 200 cas sur les premiers 200 000 malades traités, soit exactement la même fréquence de 1/1 000.2
Ces tuberculoses avaient des particularités inhabituelles faisant évoquer d’emblée un contexte de déficit immunitaire acquis. Il s’agissait d’un délai de survenue rapide, dans les 3 mois après le début du traitement, et d’une fréquence inhabituelle des formes disséminées et graves, avec des atteintes ganglionnaires, médullaires, rendant compte d’une mortalité initiale de 20 %. La sévérité et la fréquence de ces réactions ont imposé rapidement la rédaction de recommandations et de précautions d’emploi pour prévenir ces complications. Dans le même temps, les progrès de la compréhension des mécanismes ont permis de conclure que cet effet indésirable était prévisible.
Rôle des lymphocytes T dans la défense contre les infections
Au sein du système immunitaire, les lymphocytes T ont un rôle central dans la protection contre les infections.3 Tout déficit inné ou acquis touchant les lymphocytes T revêt une gravité particulière avec des infections par des germes opportunistes. Les lymphocytes T regroupent des sous-populations différentes aptes à combattre des types d’infections différentes. Dans les années 1980, les lymphocytes T ont été classés en deux groupes :
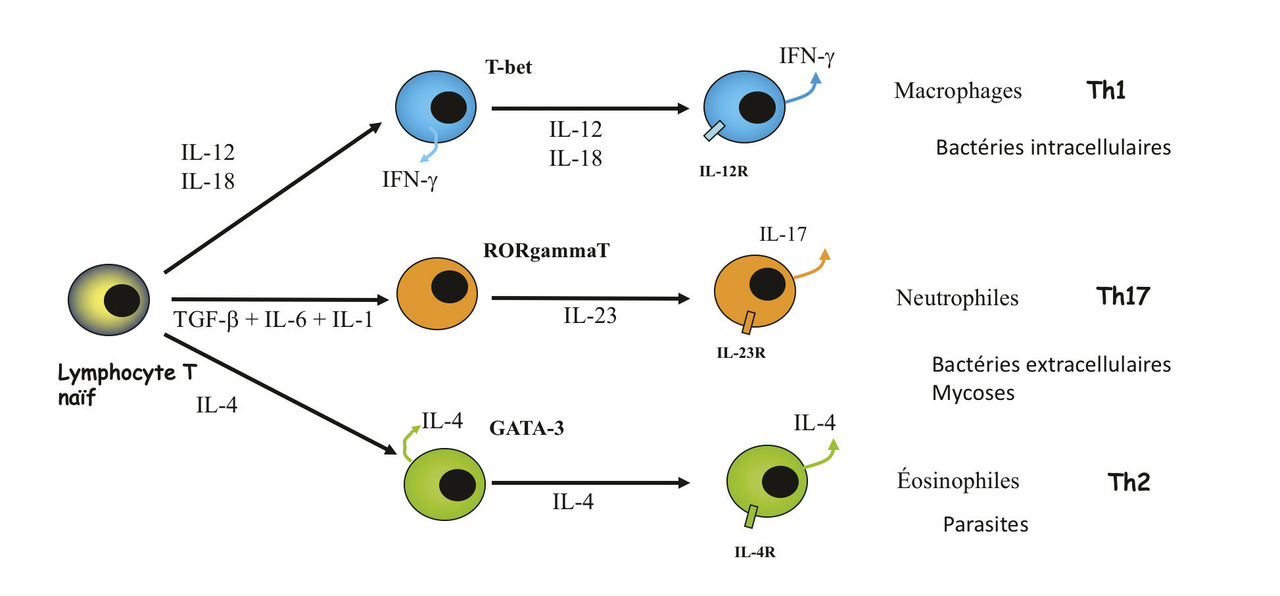
– d’un côté, les lymphocytes Th1 qui sont responsables de la défense vis-à-vis des infections à bactéries intracellulaires, dont le meilleur exemple est la tuberculose. Les lymphocytes Th1 produisent de l’interféron gamma (IFNγ), et les monocytes ont un rôle central dans cette défense. La protection efficace contre les infections opportunistes nécessite un fonctionnement correct des lymphocytes Th1 ;4
– de l’autre, les lymphocytes Th2 qui contrôlent les infections à parasites. Les lymphocytes Th2 produisent de l’interleukine 4 (IL-4), avec les éosinophiles pour cellules cibles.
Plus récemment ont été décrits les lymphocytes Th17 qui contrôlent les infections à bactéries extracellulaires et les mycoses.5 Ces lymphocytes Th17 produisent de l’IL-17, et les cellules critiques sont les poly- nucléaires neutrophiles. Ces lymphocytes sont critiques pour la protection vis-à-vis des mycoses et des bactéries extracellulaires. Les individus ayant un déficit de cette voie ont des infections sévères à Candida et à staphylocoques.6
Ainsi, il semble donc logique de suspecter des anomalies de la voie Th1 dans ces cas de réactivation de la tuberculose. De plus, des enfants porteurs d’un déficit de cette voie peuvent avoir une infection diffuse et mortelle après vaccination par le BCG.7
– d’un côté, les lymphocytes Th1 qui sont responsables de la défense vis-à-vis des infections à bactéries intracellulaires, dont le meilleur exemple est la tuberculose. Les lymphocytes Th1 produisent de l’interféron gamma (IFNγ), et les monocytes ont un rôle central dans cette défense. La protection efficace contre les infections opportunistes nécessite un fonctionnement correct des lymphocytes Th1 ;4
– de l’autre, les lymphocytes Th2 qui contrôlent les infections à parasites. Les lymphocytes Th2 produisent de l’interleukine 4 (IL-4), avec les éosinophiles pour cellules cibles.
Plus récemment ont été décrits les lymphocytes Th17 qui contrôlent les infections à bactéries extracellulaires et les mycoses.5 Ces lymphocytes Th17 produisent de l’IL-17, et les cellules critiques sont les poly- nucléaires neutrophiles. Ces lymphocytes sont critiques pour la protection vis-à-vis des mycoses et des bactéries extracellulaires. Les individus ayant un déficit de cette voie ont des infections sévères à Candida et à staphylocoques.6
Ainsi, il semble donc logique de suspecter des anomalies de la voie Th1 dans ces cas de réactivation de la tuberculose. De plus, des enfants porteurs d’un déficit de cette voie peuvent avoir une infection diffuse et mortelle après vaccination par le BCG.7
Déficit Th1 et inflammation chronique
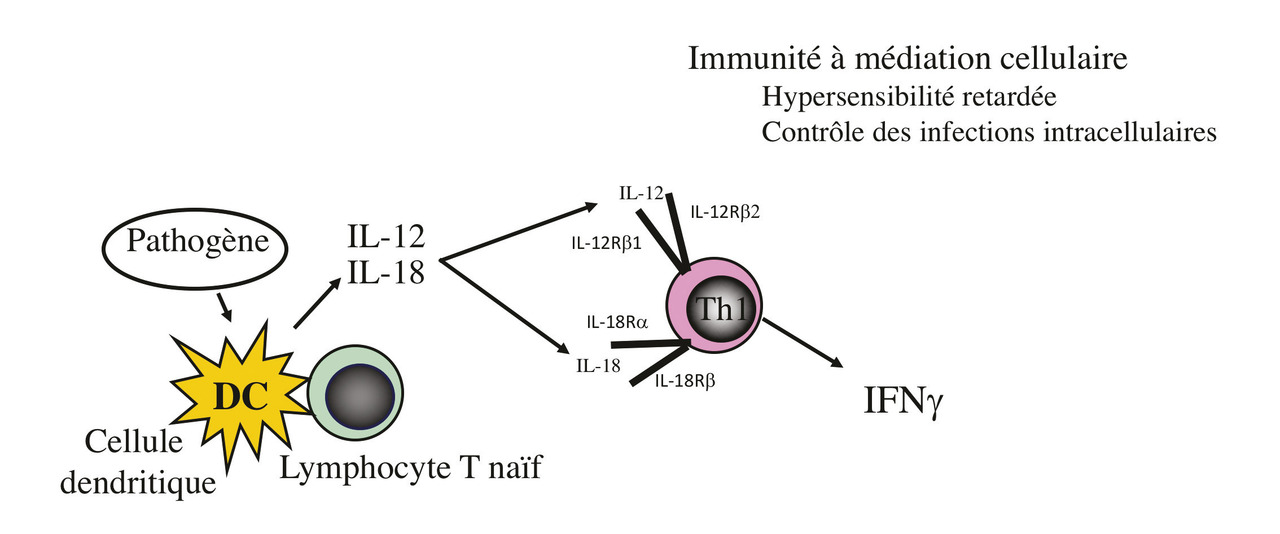
La production d’IFNγ par les lymphocytes Th1 et d’autres cellules est induite par l’action combinée de deux cytokines produites par les cellules dendritiques, l’IL-12 et l’IL-18 (fig. 1 et 2).8, 9 Ces deux cytokines agissent en synergie pour amplifier la production d’IFNγ. L’IL-12 agit sur les lymphocytes T par l’intermédiaire du récepteur à l’IL-12 formé de deux chaînes : IL-12Rß1 et IL-12Rß2. La chaîne IL-12Rß2, spécifique de l’IL-12, joue le rôle central dans la régulation de la production d’IFNγ.
Au cours des maladies inflammatoires chroniques, il existe un déficit de la voie Th1 avec un défaut de production d’IFNγ gamma. Ce déficit résulte d’un défaut d’expression du récepteur pour l’IL-12, spécifiquement de la chaîne IL-12Rß2. Cela induit un déficit immunitaire touchant l’immunité à médiation cellulaire. La fréquence accrue des infections opportunistes dont la tuberculose au cours des maladies inflammatoires chroniques en est une conséquence.
Le contrôle de l’inflammation par différents traitements, y compris par les inhibiteurs du TNF, est capable de corriger ce déficit immunitaire et de restaurer le défaut de production d’IFNγ en réponse à l’IL-12 et l’IL-18.10 Cela permet de conclure que ce déficit immunitaire est bien secondaire à l’inflammation.
Pour comprendre la réactivation de la tuberculose, il faut ajouter un élément central à la démonstration. Le TNF a une importance majeure dans la formation des ganglions et leur organisation, en particulier pour les centres germinatifs. Ainsi, chez un individu apparemment sain mais dont la tuberculose est latente, l’infection reste localisée aux granulomes dans les organes cibles : poumons, ganglions, moelle osseuse.11 Lors de l’inhibition du TNF, la structure du granulome est altérée et les bactéries toujours vivantes et jusque-là contenues sont libérées et diffusent rapidement. Cela rend compte du caractère diffus et grave de ces cas de tuberculose. Dans ces conditions, l’inhibition du TNF ajoute une anomalie supplémentaire au déficit des lymphocytes T dû à l’inflammation, ce qui accentue brutalement le déficit immunitaire global.10 Ce déficit lié à l’inflammation n’est que transitoire et régresse ensuite sous l’effet positif du traitement par anti-TNF sur l’inflammation. Contrastant avec cet effet indésirable grave sur les gra- nulomes liés à une tuberculose ancienne, le même mécanisme d’inhibition des interactions cellulaires dans les organes inflammatoires contribue à l’effet anti-inflammatoire bénéfique recherché.9
Au cours des maladies inflammatoires chroniques, il existe un déficit de la voie Th1 avec un défaut de production d’IFNγ gamma. Ce déficit résulte d’un défaut d’expression du récepteur pour l’IL-12, spécifiquement de la chaîne IL-12Rß2. Cela induit un déficit immunitaire touchant l’immunité à médiation cellulaire. La fréquence accrue des infections opportunistes dont la tuberculose au cours des maladies inflammatoires chroniques en est une conséquence.
Le contrôle de l’inflammation par différents traitements, y compris par les inhibiteurs du TNF, est capable de corriger ce déficit immunitaire et de restaurer le défaut de production d’IFNγ en réponse à l’IL-12 et l’IL-18.10 Cela permet de conclure que ce déficit immunitaire est bien secondaire à l’inflammation.
Pour comprendre la réactivation de la tuberculose, il faut ajouter un élément central à la démonstration. Le TNF a une importance majeure dans la formation des ganglions et leur organisation, en particulier pour les centres germinatifs. Ainsi, chez un individu apparemment sain mais dont la tuberculose est latente, l’infection reste localisée aux granulomes dans les organes cibles : poumons, ganglions, moelle osseuse.11 Lors de l’inhibition du TNF, la structure du granulome est altérée et les bactéries toujours vivantes et jusque-là contenues sont libérées et diffusent rapidement. Cela rend compte du caractère diffus et grave de ces cas de tuberculose. Dans ces conditions, l’inhibition du TNF ajoute une anomalie supplémentaire au déficit des lymphocytes T dû à l’inflammation, ce qui accentue brutalement le déficit immunitaire global.10 Ce déficit lié à l’inflammation n’est que transitoire et régresse ensuite sous l’effet positif du traitement par anti-TNF sur l’inflammation. Contrastant avec cet effet indésirable grave sur les gra- nulomes liés à une tuberculose ancienne, le même mécanisme d’inhibition des interactions cellulaires dans les organes inflammatoires contribue à l’effet anti-inflammatoire bénéfique recherché.9
Quelle prévention ?
La gravité de ces infections a justifié la mise en place de mesures de prévention qui ont été régulièrement actualisées.12, 13 Celles-ci comportent l’association de mesures cliniques, radiologiques et biologiques (tableau 1). Malgré une hétérogénéité vis-à-vis de la tuberculose, ces mesures doivent rester systématiques. Elles sont obligatoires avant la mise en place d’un traitement anti-TNF, comme défini dans l’autorisation de mise sur le marché de tous ces traitements. Elles associent des actions simples, d’interrogatoire sur les antécédents et des examens radio- logiques classiques.
Le test le plus ancien est l’intradermoréaction à la tuberculine. Elle a l’avantage d’être un test fonctionnel qui explore toutes les étapes de la réaction d’hypersensibilité retardée. L’injection sous-cutanée de la tuberculine entraîne localement une réaction visible et palpable, considérée positive à partir de 5 mm d’induration. Les inconvénients de la méthode sont connus au point que certains pays l’ont abandonnée. Dans nos populations, la vaccination antérieure par le BCG complique l’interprétation du test.
Les tests plus récents reposent sur le principe décrit plus haut. Un individu sensibilisé à un antigène de l’agent de la tuberculose mais aussi du BCG aura des lymphocytes T spécifiques de cet antigène, présents au site du granulome actif, mais aussi latent. De plus, ces lymphocytes T spécifiques circulent dans le sang et sont donc isolables par une simple prise de sang. Pour reproduire la réaction in vivo, les lymphocytes circulants sont mis en contact in vitro avec plusieurs antigènes de Mycobacterium tuber- culosis, différents de ceux présents dans le BCG. En effet, la question centrale est de faire la différence entre la signature immunologique de l’agent de la tuberculose de celle de la bactérie modifiée du BCG.
S’il existe des lymphocytes T spécifiques de Mycobacterium tuberculosis, ceux-ci vont produire de l’IFNγ qui est mesuré par différentes méthodes : dosage de l’IFNγ soluble par méthode ELISA ou quantification du nombre de cellules productrices par méthode ELISPOT. Des contrôles sont associés, en particulier une activation non spécifique pour vérifier la réactivité globale des lymphocytes, critique dans un contexte d’immunosuppression.
En pratique, la décision de mise en place d’un traitement antibiotique à doses préventives afin d’éviter la réactivation tuberculeuse doit tenir compte du contexte clinique et de l’interprétation des tests. En effet, les tests peuvent être faussement négatifs chez un malade immunodéprimé par la maladie et/ou le traitement. Le traitement par anti-TNF peut débuter après un mois d’antibiothérapie, qui est poursuivie 6 mois. Les modalités de traitement sont bien entendu différentes lorsqu’il s’agit d’une tuberculose active.
Les infections sous traitement anti-TNF ne se limitent pas à la tuberculose. Les mécanismes décrits ci-dessus augmentent le risque de toutes les infections opportunistes. Les plus classiques dans ce contexte sont résumées dans le tableau 2.14 Il y a manifestement des variations géographiques importantes. Ce contexte de déficit immunitaire d’origine mixte augmente aussi la gravité de toutes les infections courantes. Il est important de revoir l’état des vaccinations avant de débuter un traitement anti-TNF.
Le test le plus ancien est l’intradermoréaction à la tuberculine. Elle a l’avantage d’être un test fonctionnel qui explore toutes les étapes de la réaction d’hypersensibilité retardée. L’injection sous-cutanée de la tuberculine entraîne localement une réaction visible et palpable, considérée positive à partir de 5 mm d’induration. Les inconvénients de la méthode sont connus au point que certains pays l’ont abandonnée. Dans nos populations, la vaccination antérieure par le BCG complique l’interprétation du test.
Les tests plus récents reposent sur le principe décrit plus haut. Un individu sensibilisé à un antigène de l’agent de la tuberculose mais aussi du BCG aura des lymphocytes T spécifiques de cet antigène, présents au site du granulome actif, mais aussi latent. De plus, ces lymphocytes T spécifiques circulent dans le sang et sont donc isolables par une simple prise de sang. Pour reproduire la réaction in vivo, les lymphocytes circulants sont mis en contact in vitro avec plusieurs antigènes de Mycobacterium tuber- culosis, différents de ceux présents dans le BCG. En effet, la question centrale est de faire la différence entre la signature immunologique de l’agent de la tuberculose de celle de la bactérie modifiée du BCG.
S’il existe des lymphocytes T spécifiques de Mycobacterium tuberculosis, ceux-ci vont produire de l’IFNγ qui est mesuré par différentes méthodes : dosage de l’IFNγ soluble par méthode ELISA ou quantification du nombre de cellules productrices par méthode ELISPOT. Des contrôles sont associés, en particulier une activation non spécifique pour vérifier la réactivité globale des lymphocytes, critique dans un contexte d’immunosuppression.
En pratique, la décision de mise en place d’un traitement antibiotique à doses préventives afin d’éviter la réactivation tuberculeuse doit tenir compte du contexte clinique et de l’interprétation des tests. En effet, les tests peuvent être faussement négatifs chez un malade immunodéprimé par la maladie et/ou le traitement. Le traitement par anti-TNF peut débuter après un mois d’antibiothérapie, qui est poursuivie 6 mois. Les modalités de traitement sont bien entendu différentes lorsqu’il s’agit d’une tuberculose active.
Les infections sous traitement anti-TNF ne se limitent pas à la tuberculose. Les mécanismes décrits ci-dessus augmentent le risque de toutes les infections opportunistes. Les plus classiques dans ce contexte sont résumées dans le tableau 2.14 Il y a manifestement des variations géographiques importantes. Ce contexte de déficit immunitaire d’origine mixte augmente aussi la gravité de toutes les infections courantes. Il est important de revoir l’état des vaccinations avant de débuter un traitement anti-TNF.
DES PRÉCAUTIONS D’EMPLOI INDISPENSABLES
L’inhibition du TNF a été et reste un progrès majeur dans le traitement des maladies inflammatoires chroniques. Cependant, les précautions d’emploi désormais en place restent indispensables pour réduire le risque d’infections graves, en particulier de réactivation de la tuberculose. Cet effet indésirable est la conséquence des effets de toute inflammation sur le système immunitaire et du rôle spécifique du TNF sur la formation et le maintien du granulome protecteur.
Références
1. Maini RN, St Clair EW, Breedveld FC, et al. Infliximab (chimeric anti-tumour necrosis factor a monoclonal antibody) versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randomised phase III trial. Lancet 1999;354:1932-9.
2. Keane J, Gershon S, Wise RP, et al. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001;35:1098-104.
3. Toh ML, Miossec P. The role of T cells in rheumatoid arthritis: new subsets and new targets. Curr Opin Rheumatol 2007;19:284-8.
4. Miossec P, van den Berg W. Th1/Th2 cytokine balance in arthritis. Arthritis Rheum 1997;40:2105-15.
5. Miossec P, Korn T, Kuchroo VK. Interleukin-17 and type 17 helper T cells. N Engl J Med 2009;361:888-98.
6. Puel A, Cypowyj S, Bustamante J, et al. Chronic mucocutaneous candidiasis in humans with inborn errors of interleukin-17 immunity. Science 2011;332:65-8.
7. Boisson-Dupuis S, Bustamante J, El-Baghdadi J, et al. Inherited and acquired immunodeficiencies underlying tuberculosis in childhood. Immunol Rev 2015;264:103-20.
8. Cruz A, Khader SA, Torrado E, et al. Cutting edge: IFN-gamma regulates the induction and expansion of IL-17-producing CD4 T cells during mycobacterial infection. J Immunol 2006;177:1416-20.
9. Toh ML, Kawashima M, Hot A, Miossec P. Role of IL-17 in the Th1 systemic defects in rheumatoid arthritis through selective IL-12Rbeta2 inhibition. Ann Rheum Dis 2010;69:1562-7.
10. Kawashima M, Miossec P. Decreased response to IL-12 and IL-18 of peripheral blood cells in rheumatoid arthritis. Arthritis Res Ther 2004;6:R39-R45.
11. Bernut A, Nguyen-Chi M, Halloum I, Herrmann JL, Lutfalla G, Kremer L. Mycobacterium abscessus-induced granuloma formation is strictly dependent on TNF signaling and neutrophil trafficking. PLoS Pathog 2016;12:e1005986.
12. Salmon D. Recommendations about the prevention and management of tuberculosis in patients taking infliximab. Joint Bone Spine 2002;69:170-2.
13. Goeb V, Ardizzone M, Arnaud L, et al. Recommendations for using TNFalpha antagonists and French Clinical Practice Guidelines endorsed by the French National Authority for Health. Joint Bone Spine 2013;80:574-81.
14. Tubach F, Salmon-Ceron D, Ravaud P, Mariette X. The RATIO observatory: French registry of opportunistic infections, severe bacterial infections, and lymphomas complicating anti-TnFalpha therapy. Joint Bone Spine 2005;72:456-60.
2. Keane J, Gershon S, Wise RP, et al. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001;35:1098-104.
3. Toh ML, Miossec P. The role of T cells in rheumatoid arthritis: new subsets and new targets. Curr Opin Rheumatol 2007;19:284-8.
4. Miossec P, van den Berg W. Th1/Th2 cytokine balance in arthritis. Arthritis Rheum 1997;40:2105-15.
5. Miossec P, Korn T, Kuchroo VK. Interleukin-17 and type 17 helper T cells. N Engl J Med 2009;361:888-98.
6. Puel A, Cypowyj S, Bustamante J, et al. Chronic mucocutaneous candidiasis in humans with inborn errors of interleukin-17 immunity. Science 2011;332:65-8.
7. Boisson-Dupuis S, Bustamante J, El-Baghdadi J, et al. Inherited and acquired immunodeficiencies underlying tuberculosis in childhood. Immunol Rev 2015;264:103-20.
8. Cruz A, Khader SA, Torrado E, et al. Cutting edge: IFN-gamma regulates the induction and expansion of IL-17-producing CD4 T cells during mycobacterial infection. J Immunol 2006;177:1416-20.
9. Toh ML, Kawashima M, Hot A, Miossec P. Role of IL-17 in the Th1 systemic defects in rheumatoid arthritis through selective IL-12Rbeta2 inhibition. Ann Rheum Dis 2010;69:1562-7.
10. Kawashima M, Miossec P. Decreased response to IL-12 and IL-18 of peripheral blood cells in rheumatoid arthritis. Arthritis Res Ther 2004;6:R39-R45.
11. Bernut A, Nguyen-Chi M, Halloum I, Herrmann JL, Lutfalla G, Kremer L. Mycobacterium abscessus-induced granuloma formation is strictly dependent on TNF signaling and neutrophil trafficking. PLoS Pathog 2016;12:e1005986.
12. Salmon D. Recommendations about the prevention and management of tuberculosis in patients taking infliximab. Joint Bone Spine 2002;69:170-2.
13. Goeb V, Ardizzone M, Arnaud L, et al. Recommendations for using TNFalpha antagonists and French Clinical Practice Guidelines endorsed by the French National Authority for Health. Joint Bone Spine 2013;80:574-81.
14. Tubach F, Salmon-Ceron D, Ravaud P, Mariette X. The RATIO observatory: French registry of opportunistic infections, severe bacterial infections, and lymphomas complicating anti-TnFalpha therapy. Joint Bone Spine 2005;72:456-60.