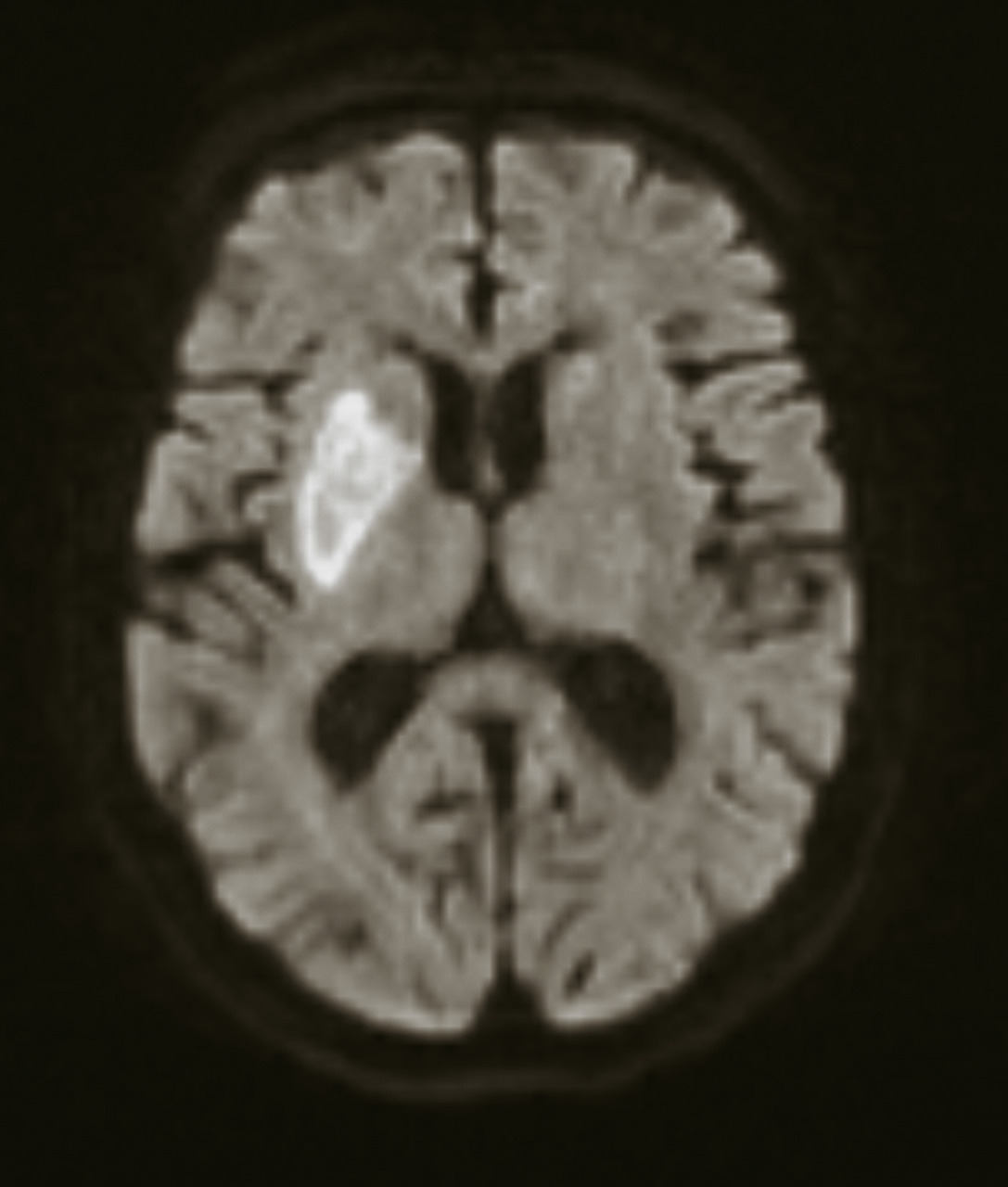
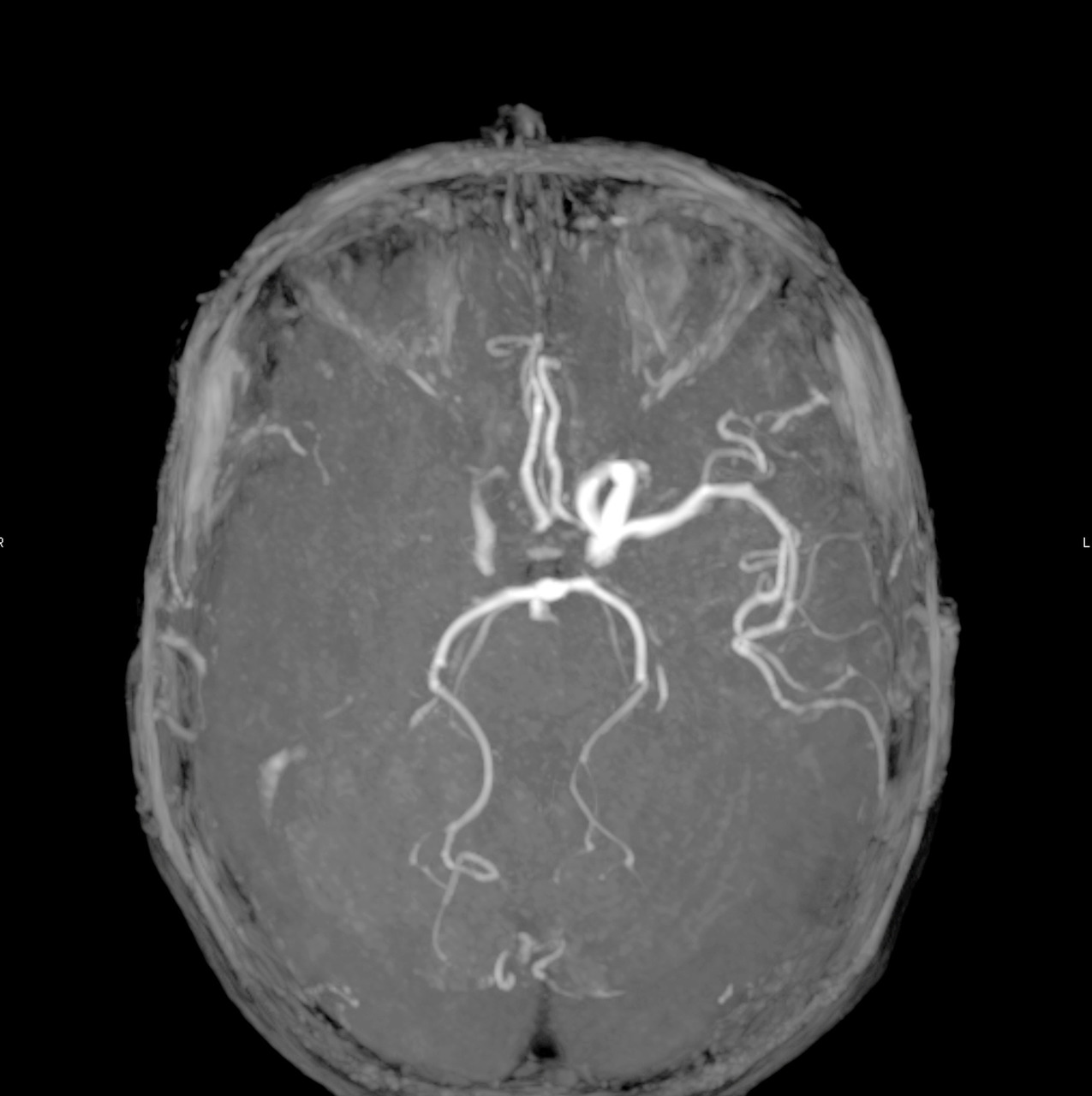
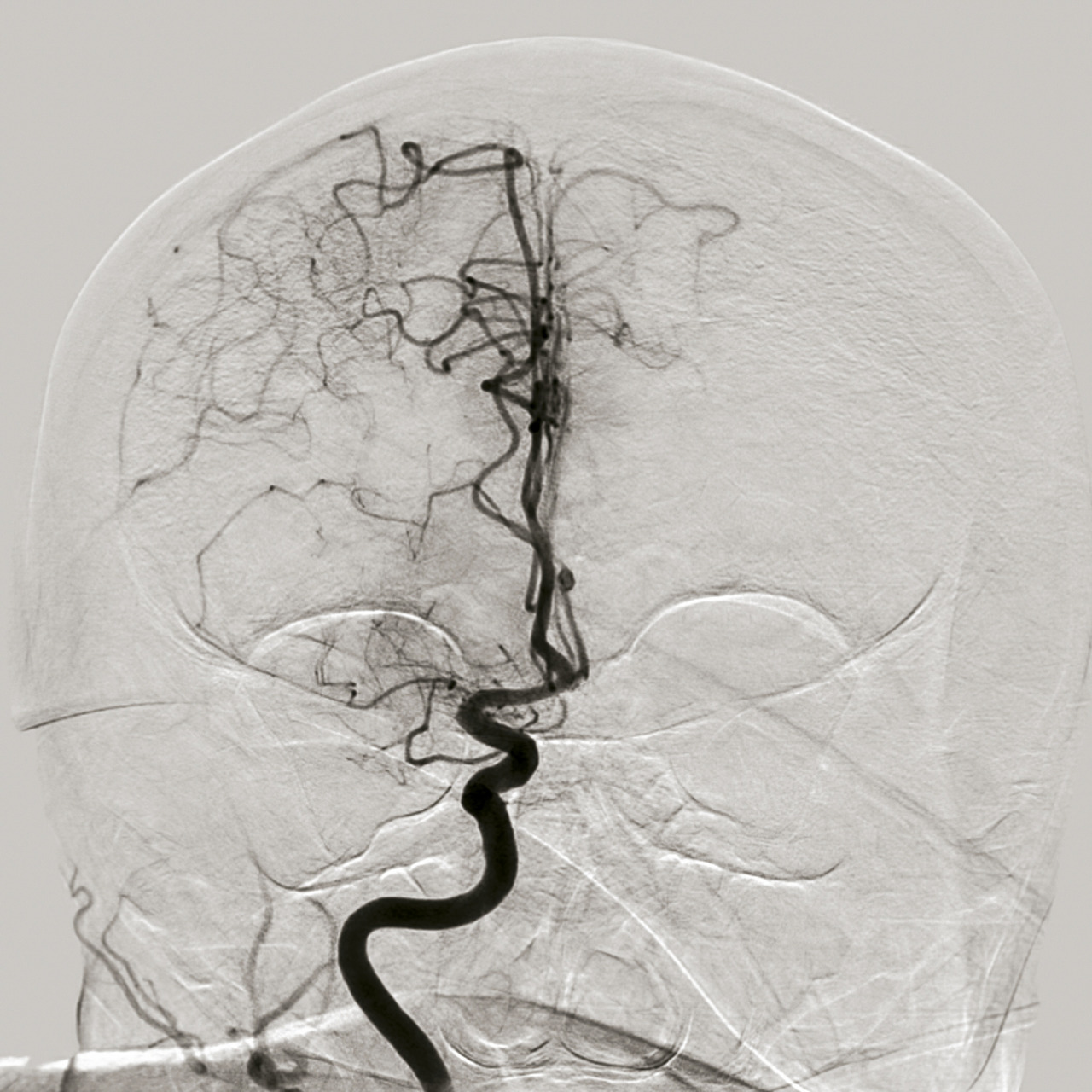
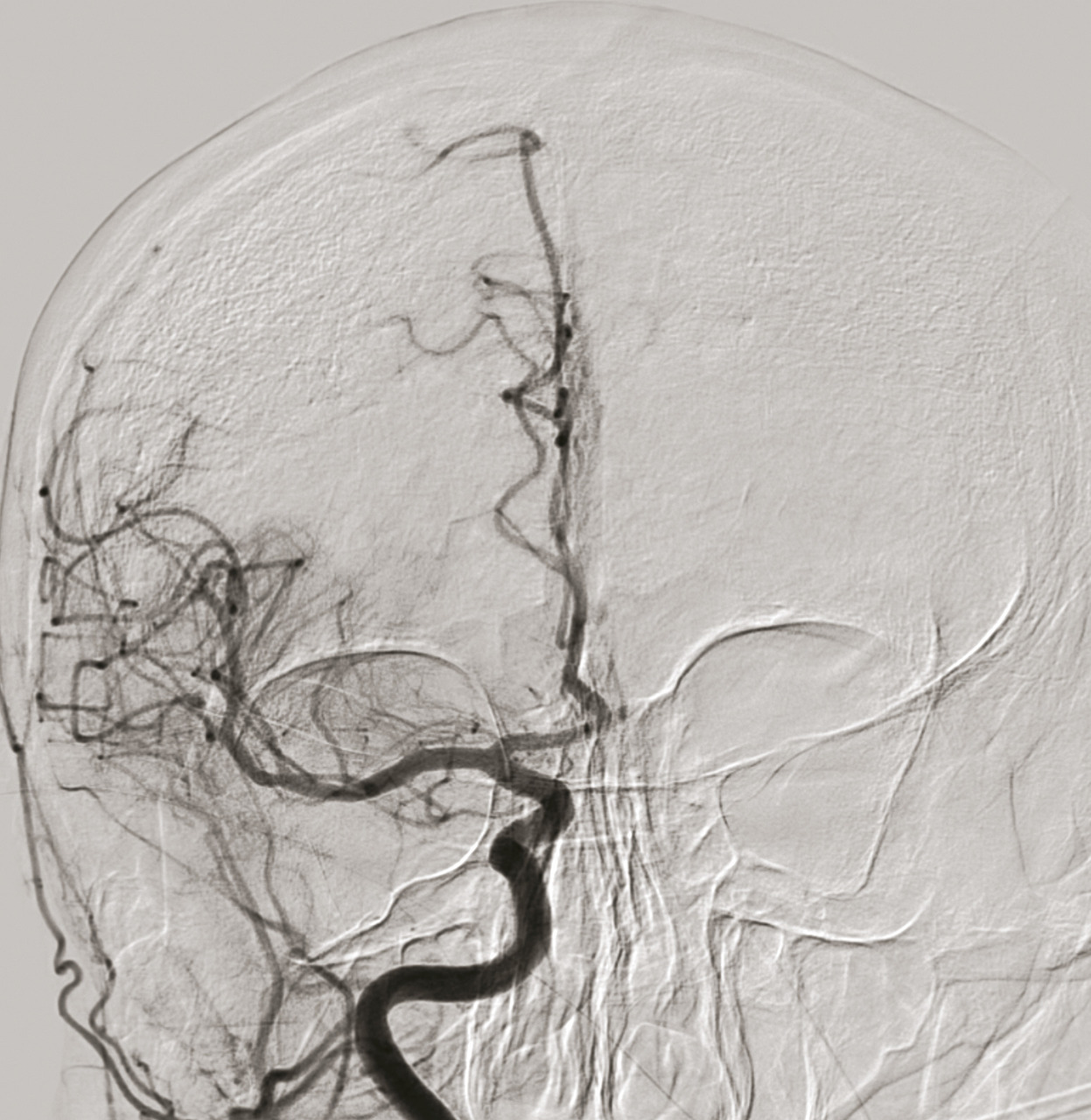
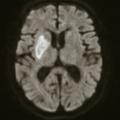
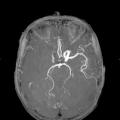
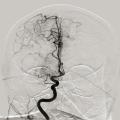
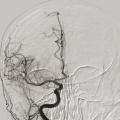
À la phase aiguë, la prise en charge thérapeutique de l’accident vasculaire cérébral (AVC) ischémique repose sur deux piliers : l’hospitalisation en unité neurovasculaire (UNV) et la recanalisation. Les stratégies de recanalisation se fondent sur deux approches, l’une pharmacologique (administration d’un fibrinolytique, c’est la thrombolyse intraveineuse [IV]) et l’autre mécanique (capture par voie endovasculaire du caillot, encore appelée thrombectomie mécanique). La stratégie de recanalisation retenue dépend de la présence d’une occlusion artérielle proximale. En l’absence de visualisation d’une occlusion artérielle proximale sur l’imagerie cérébrale, une approche pharmacologique seule est entreprise ; alors qu’en cas d’occlusion artérielle proximale documentée, les patients sont traités par une combinaison associant thrombolyse IV et thrombectomie mécanique.
Recanalisation, un objectif majeur
Elle est un facteur prédictif déterminant de l’autonomie fonctionnelle à 3 mois. En effet, chaque délai supplémentaire de 30 minutes pour rouvrir l’artère occluse est responsable d’une diminution de 20 % de patients guéris à 3 mois.1 La recanalisation correspond à la « réouverture » de l’artère occluse, mais la « réouverture » globale du lit vasculaire d’aval, capitale pour obtenir un bénéfice clinique, correspond à la reperfusion. Lorsque la recanalisation et la reperfusion sont obtenues, alors la revascularisation est atteinte.2 Cette sémantique est importante car une recanalisation complète peut n’être associée à aucun bénéfice clinique : si la reperfusion n’a pas été obtenue (en raison de l’embolisation distale du caillot), ou si elle a été futile (c’est-à-dire quand le parenchyme cérébral reperfusé n’est plus viable).
Fenêtre thérapeutique
Si l’hospitalisation en UNV permet de réduire la mortalité et le handicap de 20 %,3 quel que soit le délai de prise en charge, les fenêtres thérapeutiques recommandées sont de 4 h 30 pour la thrombolyse IV et de 6 heures pour la thrombectomie mécanique.4 La fenêtre thérapeutique pour la thrombectomie mécanique a été établi à 6 heures car la majorité des patients inclus dans les études montrant le bénéfice de la thrombectomie mécanique l’ont été dans cette tranche horaire. Il est intéressant de noter que l’évolution favorable des patients traités par thrombectomie mécanique diminue avec le temps, passant de 40 % pour les patients recanalisés entre 4 h 30 et 6 heures à moins de 20 % pour une recanalisation au-delà de 6 heures.5 Ces résultats confirment la nécessité de recanaliser le plus rapidement possible. La fenêtre thérapeutique de la thrombectomie mécanique a été récemment étendue à 24 heures pour des patients sélectionnés sur la base de critères d’imagerie stricts évaluant la pénombre.4 Ces dernières données suggèrent que nous allons progressivement évoluer vers une individualisation de la fenêtre thérapeutique sur la base de l’imagerie de perfusion, qui permet de préciser s’il existe encore du parenchyme cérébral à reperfuser dans de bonnes conditions.
Approche endovasculaire
En 2015, cinq essais thérapeutiques ont prouvé l’efficacité de la thrombectomie mécanique en association à la thrombolyse IV dans le traitement des AVC ischémiques avec occlusion des artères de gros calibre de la circulation antérieure (artères carotide interne et moyenne proximale,
Les patients les plus âgés (> 80 ans) sont ceux qui bénéficient le plus de la thrombectomie mécanique,6 et cela même pour des fenêtres thérapeutiques élargies jusqu’à 24 heures.4 L’âge ne peut donc être considéré comme une contre-indication à la thrombectomie mécanique. L’impact majeur de la thrombectomie mécanique a été démontré dans la circulation antérieure, mais pas pour la circulation postérieure (c’est-à-dire les occlusions du tronc basilaire). Même si les recommandations européennes précisent que la thrombectomie mécanique peut être envisagée dans cette situation clinique,4 le seul essai thérapeutique dédié aux patients avec une occlusion de la circulation postérieure et publié à ce jour est négatif, soulignant que l’effet de la thrombectomie mécanique sur les occlusions du tronc basilaire n’est pas le même que celui obtenu dans la circulation antérieure.8
Perspectives
Malgré la grande efficacité de la thrombectomie mécanique, plus de 50 % des patients traités n’ont pas d’autonomie fonctionnelle à 3 mois.6 Par ailleurs, de nombreuses questions restent débattues, comme la gestion de la pression artérielle périopératoire, la prise en charge des AVC ischémiques mineurs avec occlusion artérielle proximale ou a contrario ceux de gros volume. Plusieurs essais randomisés sont en cours pour essayer de répondre à ces questions. L’approche pharmacologique est susceptible d’évoluer également rapidement. Alors que l’altéplase est le thrombolytique de référence depuis 1995, des données comparant la ténectéplase à l’altéplase montrent des taux de recanalisation plus élevés et une probabilité d’autonomie fonctionnelle plus importante sous ténectéplase,9 plaçant cette dernière comme un sérieux candidat pour remplacer l’altéplase. L’analyse des caillots récupérés lors des procédures de thrombectomie mécanique a montré une architecture avec une coque constamment retrouvée, et qui confère une résistance à l’altéplase.10 Différentes cibles biologiques ont été identifiées au sein de cette coque comme les neutrophil extracellular traps (fragments d’ADN relargués par les neutrophiles), ouvrant ainsi de nouvelles pistes thérapeutiques avec la co-administration de DNAse, qui permet d’accélérer la lyse du caillot en présence du thrombolytique. La prise en charge de l’AVC ischémique vit actuellement plusieurs mutations rapprochées dans le temps, qui permettent de changer le pronostic des patients de manière spectaculaire.
1. Mazighi, M, Serfaty JM, Labreuche J, et al. Comparison of intravenous alteplase with a combined intravenous-endovascular approach in patients with stroke and confirmed arterial occlusion (RECANALISE study): a prospective cohort study. Lancet Neurol 2009;8:802-9.
2. Khatri, P, Neff J, Broderick J, Khoury J, Carrozzella J, Tomsick T. Revascularization end points in stroke interventional trials: recanalization versus reperfusion in IMS-I. Stroke 2005;36:2400-3.
3. Stroke Unit Trialists’ Collaboration. Organised inpatient (stroke unit) care for stroke. The Cochrane Database of Systematic Reviews 2013 Sept:CD000197.
4. Turc G, Bhogal P, Fischer U, et al. European Stroke Organisation (ESO) - European society for minimally invasive neurological therapy (esmint) guidelines on mechanical thrombectomy in acute ischaemic stroke endorsed by Stroke alliance for Europe (SAFE). Eur Stroke J 2019;4:6-12.
5. Prabhakaran S, Ruff I, Bernstein RA. Acute stroke intervention: a systematic review. JAMA 2015;313:1451-62.
6. Goyal M, Menon BK, van Zwam WH, et al. Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomised trials. Lancet 2016;387:1723-31.
7. Wardlaw J, Murray V, Berge E, del Zoppo G. Thrombolysis for acute ischaemic stroke. The Cochrane Database of Systematic Reviews 2014 Jul 29:CD000213
8. Liu X, Dai Q, Ye R, et al. Endovascular treatment versus standard medical treatment for vertebrobasilar artery occlusion (BEST): an open-label, randomised controlled trial. Lancet Neurol 2020;19:115-22.
9. Parsons M, Spratt N, Bivard A, et al. A randomized trial of tenecteplase versus alteplase for acute ischemic Stroke. N Engl J Med 2012;366:1099–107.
10. Di Meglio L, Desilles JP, Ollivier V, et al. Acute ischemic stroke thrombi have an outer shell that impairs fibrinolysis. Neurology 2019;93:e1686-e1698.