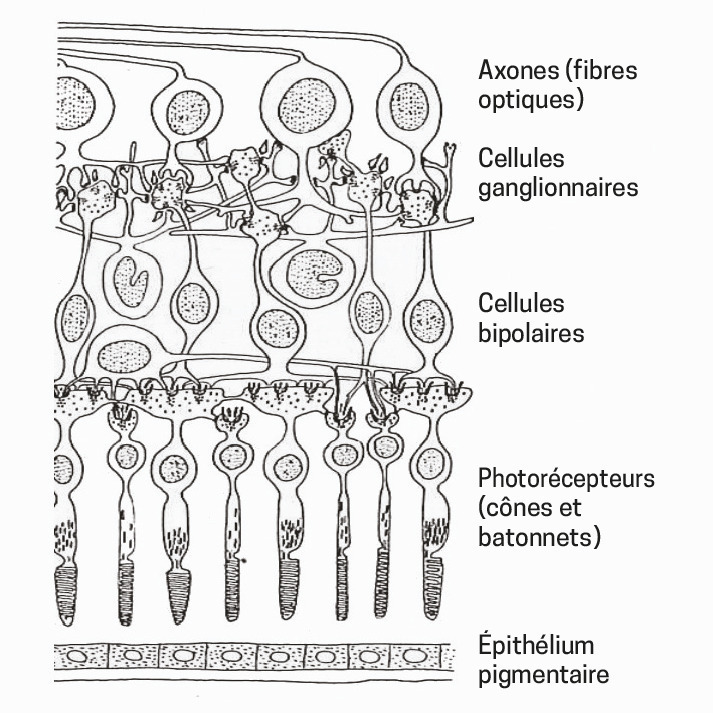
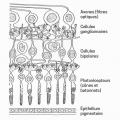
La rétine fonctionne en transformant les images lumineuses reçues à travers la pupille en signaux électriques envoyés au cortex occipital (fig. 1 ). Les photorécepteurs (cônes et bâtonnets) situés dans la partie la plus profonde, assurent la transduction du signal lumineux en signal bioélectrique, qui est transmis aux cellules ganglionnaires d’où partent les axones, qui convergent ensuite pour former le nerf optique.
La DMLA est caractérisée par une dégénérescence maculaire des photo- récepteurs en cônes se traduisant, classiquement à partir de 65 ans, par une perte de la vision centrale. Les formes néovasculaires sont traitées par un anti-VEGF en intravitréen mais, pour les atrophiques, il n’y a pas de thérapeutique efficace.
La rétinite pigmentaire (RP), chef de file des dystrophies héréditaires, touche en premier lieu la périphérie rétinienne et a ensuite une évolution centripète : perte du champ visuel périphérique, baisse de la sensibilité en milieu sombre, puis atteinte progressive de la vision centrale.
Pour pallier la dégénérescence des photorécepteurs, plusieurs axes de recherche se dessinent, à des stades d’avancement et d’évaluation différents.
La DMLA est caractérisée par une dégénérescence maculaire des photo- récepteurs en cônes se traduisant, classiquement à partir de 65 ans, par une perte de la vision centrale. Les formes néovasculaires sont traitées par un anti-VEGF en intravitréen mais, pour les atrophiques, il n’y a pas de thérapeutique efficace.
La rétinite pigmentaire (RP), chef de file des dystrophies héréditaires, touche en premier lieu la périphérie rétinienne et a ensuite une évolution centripète : perte du champ visuel périphérique, baisse de la sensibilité en milieu sombre, puis atteinte progressive de la vision centrale.
Pour pallier la dégénérescence des photorécepteurs, plusieurs axes de recherche se dessinent, à des stades d’avancement et d’évaluation différents.
Optogénétique
Elle vise à restaurer la capacité photo- transductionnelle dans une cellule défectueuse. Via un vecteur viral, on y transfère des gènes codant pour des protéines sensibles à la lumière, issues d’algues photosensibles. Les travaux de recherche sont limités aux modèles animaux (souris) et aux rétines post-mortem.
Un essai de phase I/II est en cours de recrutement dans la RP.
Un essai de phase I/II est en cours de recrutement dans la RP.
Thérapie cellulaire
L’objectif est de stabiliser le processus dégénératif de la maladie en reconstituant le pool de cellules neurosensorielles perdues. Les essais actuels utilisent des cellules pluripotentes « induites », obtenues en prélevant et « reprogrammant » des cellules différenciées adultes telles que les kératinocytes.
En 2014, un essai japonais a permis de stabiliser la DMLA d’une patiente, grâce à l’injection de cellules prélevées de son propre organisme. La tendance actuelle est de faire appel à des banques de cellules pluripotentes (dérivées de donneurs sains). Un essai de phase I au Japon, montre l’innocuité de cette technique.
En 2014, un essai japonais a permis de stabiliser la DMLA d’une patiente, grâce à l’injection de cellules prélevées de son propre organisme. La tendance actuelle est de faire appel à des banques de cellules pluripotentes (dérivées de donneurs sains). Un essai de phase I au Japon, montre l’innocuité de cette technique.
Deux types d’implants
C’est l’approche la plus développée et la mieux évaluée.
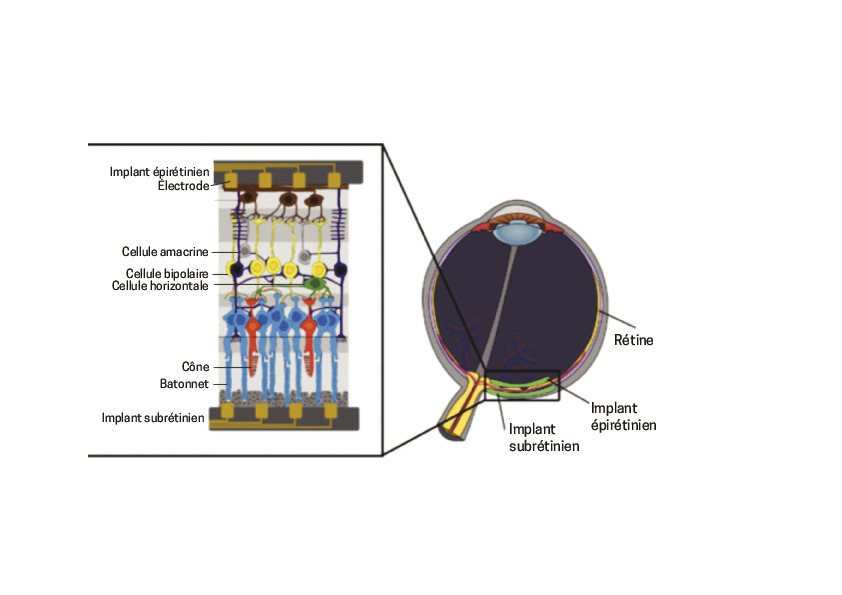
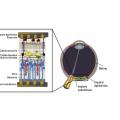
Deux grands abords permettent d’équiper la rétine d’un support artificiel. Les électrodes sont posées soit sur la rétine (épirétiniens), où elles stimulent directement les cellules ganglionnaires à travers les axones, soit plus profondément sous la rétine externe (implants sous-rétiniens ; la stimulation a lieu dans ce cas à travers la couche disparue des photorécepteurs dégénérés). La transmission de l’influx se fait via le nerf optique qui doit donc être intègre. De nombreuses équipes travaillent sur ces technologies (fig. 2 ).
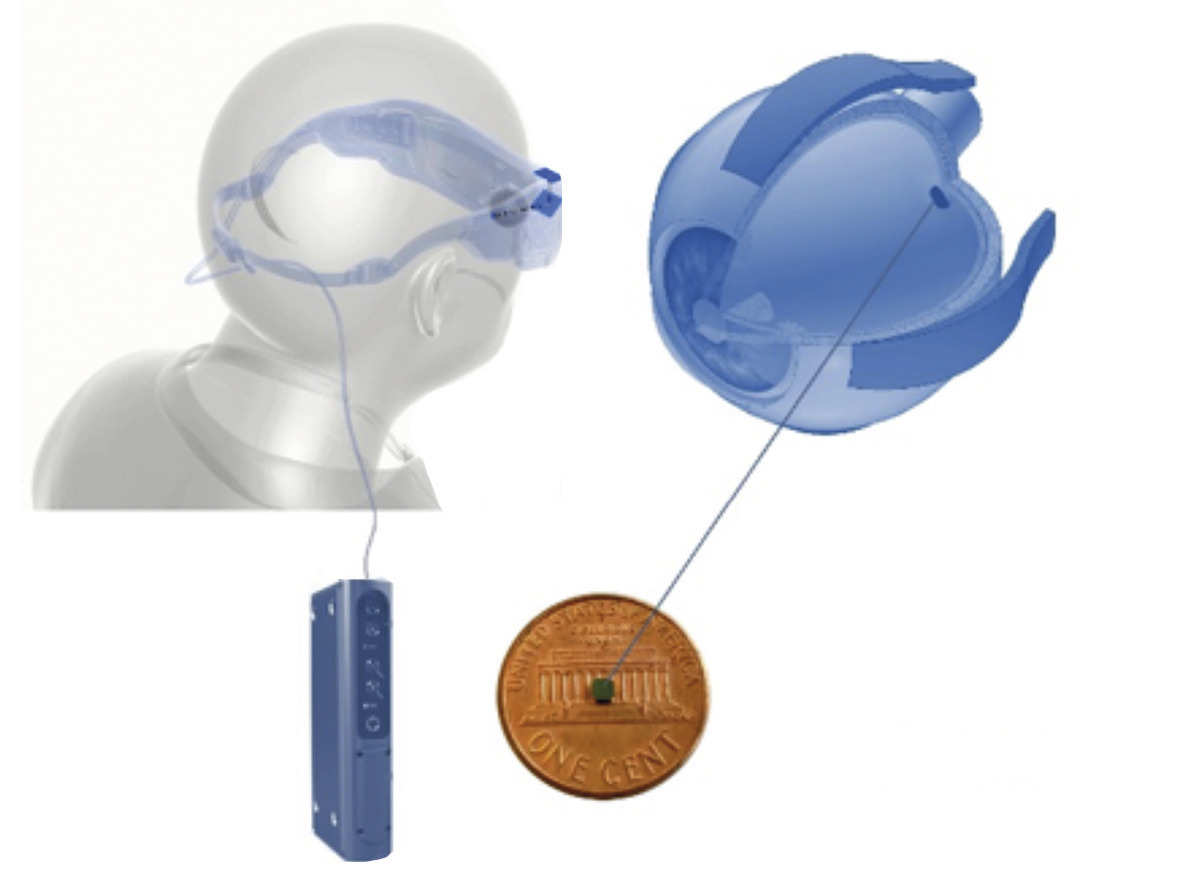
La société américaine SecondSight a développé Argus II. Cet implant épi- rétinien de 64 électrodes a été posé chez plus de 200 patients à travers le monde, dont une trentaine de personnes en France entre 2008 et 2016. Une caméra miniature intégrée à des lunettes capture l’image et la transmet par un câble à un micro-ordinateur porté à la ceinture. Ce dernier transforme le signal visuel en code de signaux électriques renvoyés par câble à la branche des lunettes d’où un transmetteur envoie sans fil le signal au faisceau d’électrodes localisées dans la partie oculaire du dispositif. En France, il peut être prescrit dans le cadre d’un forfait innovation.
Un autre implant épirétinien, IRIS II, à 150 électrodes, a été produit par une firme française, Pixium Vision. Il a des résultats comparables à ceux d’ARGUS II, mais son utilisation a été interrompue car la durée de vie de l’implant s’est avérée trop courte.
L’entreprise a récemment développé un dispositif : PRIMA. Son fonctionnement est très novateur, sans fil ni connexion. Une micropuce photovoltaïque, comportant plusieurs centaines de diodes, est posée en sous-rétinien par chirurgie peu invasive. Les lunettes capturent les images de l’environnement visuel du patient, qui sont ensuite converties en signal infrarouge (via un boîtier porté dans la poche), lui-même projeté sur la rétine du patient à partir d’un projecteur miniaturisé sur les lunettes. La puce fonctionne donc comme un panneau solaire et convertit le signal en stimulation électrique.
Les premières évaluations dans la DMLA sèche (5 implantations) sont satisfaisantes avec une restauration partielle de la vision centrale (fig. 3 ).
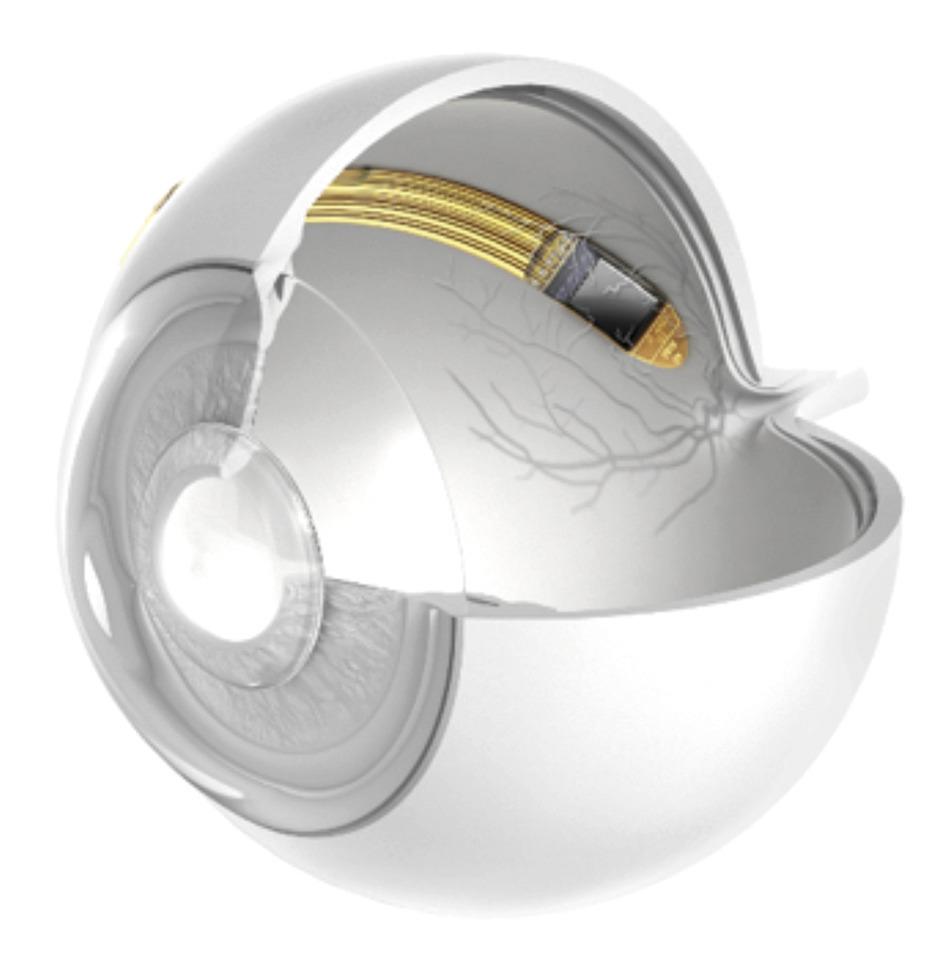
Enfin, Alpha IMS, implant sous-rétinien commercialisé par la firme allemande Retina, comporte 1 600 photodiodes et a comme avantage de fonctionner sans caméra vidéo externe ni traitement additionnel du signal. Il transforme directement les images rétiniennes en impulsions électriques (fig. 4 ).
En outre, la puce visuelle se déplace avec le mouvement de l’œil : la vision est donc plus « naturelle », car elle suit la direction du regard (dans les systèmes épirétiniens, le patient doit apprendre à tourner la tête pour voir ce qui se passe sur les côtés puisque c’est en fait la caméra qui voit pour lui). La pose chirurgicale est toutefois plus complexe. Cependant, Retina a récemment mis fin à ses activités.
Deux grands abords permettent d’équiper la rétine d’un support artificiel. Les électrodes sont posées soit sur la rétine (épirétiniens), où elles stimulent directement les cellules ganglionnaires à travers les axones, soit plus profondément sous la rétine externe (implants sous-rétiniens ; la stimulation a lieu dans ce cas à travers la couche disparue des photorécepteurs dégénérés). La transmission de l’influx se fait via le nerf optique qui doit donc être intègre. De nombreuses équipes travaillent sur ces technologies (
La société américaine SecondSight a développé Argus II. Cet implant épi- rétinien de 64 électrodes a été posé chez plus de 200 patients à travers le monde, dont une trentaine de personnes en France entre 2008 et 2016. Une caméra miniature intégrée à des lunettes capture l’image et la transmet par un câble à un micro-ordinateur porté à la ceinture. Ce dernier transforme le signal visuel en code de signaux électriques renvoyés par câble à la branche des lunettes d’où un transmetteur envoie sans fil le signal au faisceau d’électrodes localisées dans la partie oculaire du dispositif. En France, il peut être prescrit dans le cadre d’un forfait innovation.
Un autre implant épirétinien, IRIS II, à 150 électrodes, a été produit par une firme française, Pixium Vision. Il a des résultats comparables à ceux d’ARGUS II, mais son utilisation a été interrompue car la durée de vie de l’implant s’est avérée trop courte.
L’entreprise a récemment développé un dispositif : PRIMA. Son fonctionnement est très novateur, sans fil ni connexion. Une micropuce photovoltaïque, comportant plusieurs centaines de diodes, est posée en sous-rétinien par chirurgie peu invasive. Les lunettes capturent les images de l’environnement visuel du patient, qui sont ensuite converties en signal infrarouge (via un boîtier porté dans la poche), lui-même projeté sur la rétine du patient à partir d’un projecteur miniaturisé sur les lunettes. La puce fonctionne donc comme un panneau solaire et convertit le signal en stimulation électrique.
Les premières évaluations dans la DMLA sèche (5 implantations) sont satisfaisantes avec une restauration partielle de la vision centrale (
Enfin, Alpha IMS, implant sous-rétinien commercialisé par la firme allemande Retina, comporte 1 600 photodiodes et a comme avantage de fonctionner sans caméra vidéo externe ni traitement additionnel du signal. Il transforme directement les images rétiniennes en impulsions électriques (
En outre, la puce visuelle se déplace avec le mouvement de l’œil : la vision est donc plus « naturelle », car elle suit la direction du regard (dans les systèmes épirétiniens, le patient doit apprendre à tourner la tête pour voir ce qui se passe sur les côtés puisque c’est en fait la caméra qui voit pour lui). La pose chirurgicale est toutefois plus complexe. Cependant, Retina a récemment mis fin à ses activités.
Quelle efficacité ?
Selon l’intégrité rétinienne résiduelle et la réussite de l’implantation, les résultats sont variables et restent modestes dans l’absolu.
Par ailleurs, un long travail de rééducation est nécessaire. L’objectif est de reconstituer une « bibliothèque visuelle », en associant les nouveaux stimulus lumineux perçus aux souvenirs visuels du patient. Cela demande de nombreuses séances dans un centre spécialisé de réhabilitation visuelle, avec l’aide d’un orthoptiste et d’un ergothérapeute. Une motivation solide du patient est indispensable au succès de l’implantation.
Du fait du nombre limité d’électrodes, la performance visuelle est limitée et correspond à une image pixélisée en noir et blanc, floue et vacillante. Certains arrivent à distinguer des caractères de grande taille, d’autres sont capables de désigner des véhicules en mouvement ou encore de se servir de couverts posés sur une table. Mais pour les patients atteints d’une déficience visuelle importante, ces simples progrès ont un impact fonctionnel extrêmement important dans la vie courante.
Compte tenu du rapport bénéfice/risque encore modéré de ces systèmes innovants et de leurs coûts élevés, les indications sont restreintes aux patients atteints de cécité sévère, percevant tout au plus un signal lumineux.
PRIMA espère recevoir le marquage CE l’année prochaine.
Par ailleurs, un long travail de rééducation est nécessaire. L’objectif est de reconstituer une « bibliothèque visuelle », en associant les nouveaux stimulus lumineux perçus aux souvenirs visuels du patient. Cela demande de nombreuses séances dans un centre spécialisé de réhabilitation visuelle, avec l’aide d’un orthoptiste et d’un ergothérapeute. Une motivation solide du patient est indispensable au succès de l’implantation.
Du fait du nombre limité d’électrodes, la performance visuelle est limitée et correspond à une image pixélisée en noir et blanc, floue et vacillante. Certains arrivent à distinguer des caractères de grande taille, d’autres sont capables de désigner des véhicules en mouvement ou encore de se servir de couverts posés sur une table. Mais pour les patients atteints d’une déficience visuelle importante, ces simples progrès ont un impact fonctionnel extrêmement important dans la vie courante.
Compte tenu du rapport bénéfice/risque encore modéré de ces systèmes innovants et de leurs coûts élevés, les indications sont restreintes aux patients atteints de cécité sévère, percevant tout au plus un signal lumineux.
PRIMA espère recevoir le marquage CE l’année prochaine.
Pour en savoir plus
da Cruz L, Dorn JD, Humayun MS, et al. Five-Year Safety and Performance Results from the Argus II Retinal Prosthesis System Clinical Trial. Ophthalmology 2016;123:2248-54.
Edwards TL, Cottriall CL, Xue K, et al. Assessment of the Electronic Retinal Implant Alpha AMS in Restoring Vision to Blind Patients with End-Stage Retinitis Pigmentosa. Ophthalmology 2018;125:432-43.
Le Mer Y. Rétines artificielles. Rev Prat 2017;67:591-6.
Edwards TL, Cottriall CL, Xue K, et al. Assessment of the Electronic Retinal Implant Alpha AMS in Restoring Vision to Blind Patients with End-Stage Retinitis Pigmentosa. Ophthalmology 2018;125:432-43.
Le Mer Y. Rétines artificielles. Rev Prat 2017;67:591-6.