Toute fièvre associée à un rash et/ou à une escarre d’inoculation doit faire évoquer le diagnostic de rickettsiose et faire pratiquer, en plus de la sérologie, une PCR sur écouvillon d’escarre.
Les rickettsioses sont des zoonoses causées par bactéries intracellulaires strictes appartenant à l’ordre des Rickettsiales. Elles sont transmises par des arthropodes vecteurs. Actuellement, plusieurs groupes de maladies restent communément appelées rickettsioses. Les rickettsies du groupe « boutonneux » sont transmises principalement par les tiques ou les puces (Rickettsia felis) et celles du groupe « typhus » transmises par des puces ou des poux. Il faut ajouter à cela le typhus des broussailles, causé par Orientia tsutsugamushi, transmis par des arthropodes proches des aoûtats. Coxiella burnetii, l’agent de la fièvre Q, a longtemps été classée dans les rickettsies, mais les progrès de la phylogénétique ont montré que cette bactérie appartient à un autre groupe bactérien ;1 la fièvre Q ne sera donc pas traitée ici.1, 2 En France métropolitaine, ce sont essentiellement les rickettsioses transmises par les tiques qui sont diagnostiquées, mais les rickettsioses sont des causes fréquentes de fièvre au retour de voyage.3
Rickettsioses du groupe « boutonneux » transmises par les tiques en France
En France métropolitaine, les trois principales rickettsioses boutonneuses diagnostiquées sont :
– la fièvre boutonneuse méditerranéenne causée par R. conorii conorii ;
– le scalp eschar and neck lymphadenopathy (SENLAT) ou tick borne lymphadenitis (TIBOLA) ou dermacentor-borne necrosis erythema lymphadenopathy (DEBONEL) causés par R. slovaca et R. raoultii ;
– et le lymphangitis-associated rickettsiosis (LAR) causé par R. sibirica mongolitimonae (v . tableau ).
– la fièvre boutonneuse méditerranéenne causée par R. conorii conorii ;
– le scalp eschar and neck lymphadenopathy (SENLAT) ou tick borne lymphadenitis (TIBOLA) ou dermacentor-borne necrosis erythema lymphadenopathy (DEBONEL) causés par R. slovaca et R. raoultii ;
– et le lymphangitis-associated rickettsiosis (LAR) causé par R. sibirica mongolitimonae (
Fièvre boutonneuse méditerranéenne
La fièvre boutonneuse méditerranéenne, causée par R. conorii conorii, est transmise par la tique brune du chien Rhipicephalus sanguineus. La maladie est présente en région méditerranéenne (v . tableau ). Il s’agit de l’une des plus anciennes maladies liées aux tiques connues, puisque l’on retrouve des descriptions de la maladie dès 1910 en Tunisie,4 puis dans les années 1920 à Marseille.4 Si les tiques R. sanguineus sont actives entre mai et octobre dans le sud de la France, la maladie est principalement observée en été entre juin et août. Cette prédominance estivale est liée au fait que R. sanguineus est plus agressive à des températures élevées pour piquer des hôtes inhabituels, tels que l’homme.5 Les réservoirs animaux de R. conorii conorii sont mal connus. Le rôle des tiques comme réservoir est incertain car, si la répartition de R. sanguineus est très large en zone tempérée et tropicale, celle de la bactérie ne l’est pas. Le pourcentage de tiques porteuses dans la nature est, en règle générale, inférieur à 1 % mais peut varier d’un endroit à l’autre.
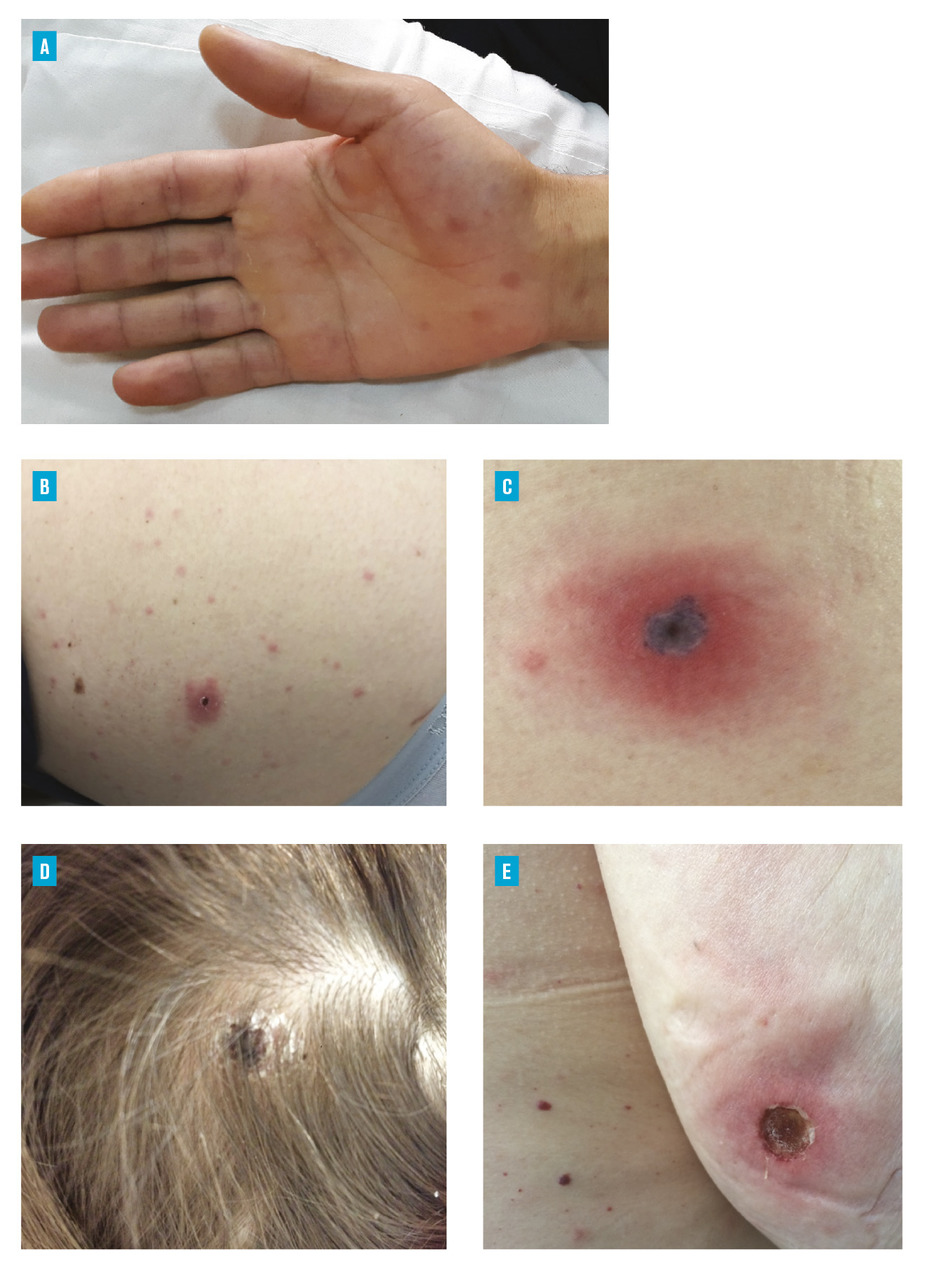
Après une piqûre infectante, la période d’incubation est d’environ une semaine. Les signes cliniques sont une éruption maculopapuleuse qui atteint les paumes et les plantes, ce qui, pour les maladies éruptives de l’adulte, est très évocateur (quand il ne s’agit pas d’une syphilis) (fig. 1A et B ), associée à une fièvre élevée à 39 ou 40 °C. Le signe pathognomonique de nombreuses rickettsioses du groupe boutonneux et que l’on retrouve dans la fièvre boutonneuse méditerranéenne est l’escarre d’inoculation (fig. 1 B et C ) au niveau du site de piqûre de tique. Il existe des formes sévères de fièvre boutonneuse méditerranéenne avec des tableaux neurologiques ou des défaillances multiviscérales ; dans ces cas, l’éruption peut être purpurique.6 La mortalité des patients hospitalisés dépasse 5 %. Ces formes sévères surviennent principalement chez les patients qui ont des comorbidités telles que le diabète, l’alcoolisme ou un déficit en glucose-6-phosphate déshydrogénase (G6PD), ou en cas d’antibiothérapie tardive ou inadaptée (les bêtalactamines sont inefficaces).
Après une piqûre infectante, la période d’incubation est d’environ une semaine. Les signes cliniques sont une éruption maculopapuleuse qui atteint les paumes et les plantes, ce qui, pour les maladies éruptives de l’adulte, est très évocateur (quand il ne s’agit pas d’une syphilis) (
SENLAT, TIBOLA ou DEBONEL
Cette maladie est due à R. slovaca et R. raoultii qui ont pour vecteurs des tiques du genre Dermacentor (D. marginatus dans le sud de la France et D. reticulatus, plus au nord). Les hôtes habituels de ces tiques adultes sont les sangliers, les moutons ou les chiens.7 Chez l’homme, elles ont la particularité de piquer préférentiellement au niveau du cuir chevelu. La maladie se voit partout en France, mais également dans les pays d’Europe centrale et jusqu’en Russie, correspondant à la répartition des tiques, qui semblent être des réservoirs. L’incidence de cette infection est plus importante au printemps et à l’automne, période d’activité des tiques vectrices.7
Après quelques jours d’incubation, on note l’apparition d’une escarre d’inoculation au niveau du cuir chevelu (fig. 1 D ), parfois d’une fébricule, des céphalées mais surtout des adénopathies cervicales, qui sont souvent le motif de consultation. La maladie est bénigne et sans complication rapportée à l’heure actuelle. Néanmoins, les adénopathies peuvent persister plusieurs mois et il peut exister une alopécie séquellaire au niveau de l’escarre d’inoculation.
Après quelques jours d’incubation, on note l’apparition d’une escarre d’inoculation au niveau du cuir chevelu (
LAR ou lymphangitis-associated rickettsiosis
Cette maladie est plus rarement rencontrée. Elle est causée par Rickettsia sibirica mongolitimonae,transmise principalement par des tiques du genre Hyalomma mais elle a également été détectée dans des tiques Rhipicephalus pusillus qui piquent habituellement les lapins ou aussi les chats dans le sud de la France.8 Comme pour les autres rickettsioses du groupe « boutonneux », on trouve une escarre d’inoculation, de la fièvre, des myalgies et une éruption maculopapuleuse pouvant toucher la paume des mains et la plante des pieds. Un signe caractéristique de cette rickettsiose (33 % des cas) est une traînée de lymphangite débutant au niveau de l’escarre d’inoculation jusqu’à un ganglion satellite à proximité souvent augmenté de volume9 (fig. 1 E ). Le pronostic est globalement beaucoup moins sévère que celui de la fièvre boutonneuse méditerranéenne, mais au moins un cas de sepsis et de coagulation intravasculaire disséminée a cependant été rapporté.10
Rickettsioses au retour de voyage
Fièvre à tiques africaine
La fièvre à tiques africaine causée par Rickettsia africae est transmise par des tiques du genre Amblyomma en Afrique subsaharienne. Les A. hebraeum sont particulièrement agressives dans le sud de l’Afrique (Afrique du Sud, Swaziland, Lesotho), qui sont des régions touristiques pour la pratique de safaris notamment.3 La fièvre à tiques africaine a également été rapportée chez des patients au retour des Antilles, où la tique A. variegatum avait été importée avec des zébus il y a plusieurs siècles.11-13 La maladie se manifeste par la présence d’une fièvre souvent modérée, associée à un ou plusieurs escarres d’inoculation et à un rash dans 50 % des cas.3 L’évolution est bénigne, avec un bon pronostic dans la majorité des cas, y compris sans traitement. Cette maladie est dans le top 3 des causes de fièvres documentées chez les voyageurs au retour d’Afrique subsaharienne.
Autres rickettsioses à tiques à travers le monde
Fièvre pourprée des montagnes Rocheuses
La fièvre pourprée des montagnes Rocheuses est causée par Rickettsia rickettsii3 et peut être transmise par plusieurs genre de tiques (Dermacentor, Rhipicephalus, Amblyomma). Elle a parfois été rapportée chez des voyageurs ayant pratiqué des activités en plein air de type randonnée ou camping, au retour des États-Unis.3 Le diagnostic est plus difficile à évoquer car il n’y a, la plupart du temps, pas d’escarre d’inoculation ni de rash. Les complications peuvent cependant être très sévère et ce diagnostic, une fois évoqué, doit donc faire débuter un traitement en urgence. Une coagulation intravasculaire disséminée, un syndrome de détresse respiratoire aiguë ou un syndrome de défaillance multiviscérale peuvent en effet survenir en l’absence de traitement.3 Contrairement à ce que son nom laisse suggérer, cette maladie n’est pas limitée géographiquement à la région des montagnes Rocheuses aux États-Unis, mais peut se rencontrer sur l’ensemble du continent américain.Typhus murin
Le typhus murin est causé par Rickettsia typhi et transmis par des puces de rat. Il est endémique en Asie du Sud-Est où il est responsable de jusqu’à 10 % des « fièvres d’origine indéterminées ».14 Le tableau clinique associant une fièvre, des céphalées et une éruption fugace est très inconstant (moins d’un tiers des cas). Le diagnostic est souvent tardif en raison d’aspects cliniques variables (respiratoires, digestifs, fièvre isolée) et est évoqué après élimination d’une autre cause de fièvre au retour de voyage comme les arborviroses (dengue, chikungunya ou zika), par exemple. En résumé, il faut y penser devant tout tableau fébrile au retour de voyage, et particulièrement quand des bêtalactamines ont été utilisées et ont été inefficaces. Le pronostic est généralement favorable.Typhus des broussailles
Le typhus des broussailles est causé par Orientia tsutsugamushi, transmise par des acariens proches des aoûtats en zone rurale en Asie et dans le pacifique. Les piqûres sont fréquentes, principalement dans les zones de broussailles aux alentours des rivières. Les paysans, les militaires ou les touristes « verts » sont particulièrement exposés. La maladie ressemble à une rickettsiose à tiques. Le tableau clinique associe une fièvre, des céphalées, une éruption maculopapuleuse, une escarre d’inoculation et parfois une polyadénopathie, et la maladie peut être sévère en l’absence de traitement, avec jusqu’à 30 % de mortalité.15Typhus épidémique
Le typhus épidémique est causé par Rickettsia prowazekii et est transmis par les poux de corps. C’est donc une maladie observée chez des patients vivant dans des conditions d’hygiène précaire. Cette maladie, qui a marqué l’histoire, a principalement été rapportée au xxe siècle dans des zones de guerre, en prison (Burundi) ou dans des camps de réfugiés. En France, la population porteuse de poux de corps est celle des sans domicile fixe qui seraient donc potentiellement vulnérables à cette maladie en cas d’introduction de la bactérie sur le territoire. Le tableau clinique associe une fièvre élevée à des myalgies, des céphalées, une éruption maculopapuleuse de manière inconstante et à une atteinte multiviscérale (digestive, pulmonaire, cardiaque, neurologique). La mortalité est de 30 %. Les survivants non traités lors de la primo-infection peuvent développer jusqu’à 40 ans plus tard une recrudescence fébrile appelée maladie de Brill-Zinsser ; cette forme de la maladie a été observée en France chez un patient originaire du Maroc.3Diagnostic des rickettsioses
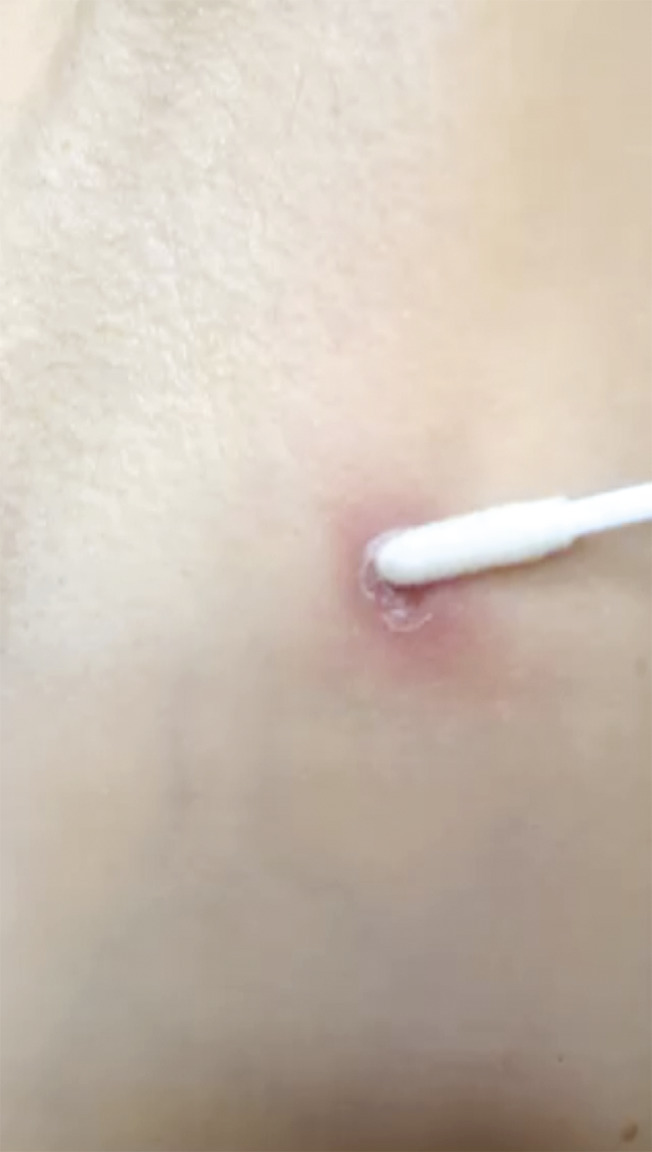
Les rickettsies sont des bactéries de culture fastidieuse, le diagnostic ne peut donc pas être fait sur des hémocultures standard. Cependant, l’avènement des techniques de biologie moléculaire telles que la polymerase chain reaction (PCR) a permis des avancées majeures en termes de diagnostic à la phase précoce de l’infection. Ainsi, la PCR sur un écouvillon d’escarre d’inoculation (fig. 2 ) est aujourd’hui un moyen de diagnostic peu invasif, simple et rapide, qui est réalisée au Centre national de référence (CNR) des rickettsies à l’Institut hospitalo-universitaire Méditerranée infection de Marseille et dont le résultat est rendu dans les 48 heures après réception du prélèvement*.
La sérologie, méthode de diagnostic indirecte, est également un outil important et a longtemps été le seul moyen disponible. Cependant, il est souvent nécessaire de répéter cette sérologie pour observer une séroconversion dans un délai de 15 jours après le début de l’infection, ce qui n’en fait pas un outil de diagnostic précoce. Les techniques de cultures sur cellules à partir de biopsies cutanées ou d’échantillons sanguins pour l’isolement des rickettsies sont uniquement réalisées dans des laboratoires spécialisés comme le CNR.
La sérologie, méthode de diagnostic indirecte, est également un outil important et a longtemps été le seul moyen disponible. Cependant, il est souvent nécessaire de répéter cette sérologie pour observer une séroconversion dans un délai de 15 jours après le début de l’infection, ce qui n’en fait pas un outil de diagnostic précoce. Les techniques de cultures sur cellules à partir de biopsies cutanées ou d’échantillons sanguins pour l’isolement des rickettsies sont uniquement réalisées dans des laboratoires spécialisés comme le CNR.
Traitement et prévention des rickettsioses
Certaines rickettsioses (fièvre boutonneuse méditerranéenne, fièvre pourprée des montagnes Rocheuses, typhus des broussailles ou typhus épidémique) peuvent être fatales en l’absence de traitement, et une antibiothérapie adaptée doit donc être débutée au plus vite dès le diagnostic suspecté. Le traitement de référence est la doxycycline à la dose de 200 mg/j pendant 7 jours pour les rickettsioses du groupe boutonneux et en dose unique (200 mg) pour les rickettsioses du groupe typhus. En cas d’allergie ou chez l’enfant de moins de 8 ans, les macrolides comme l’azithromycine sont une alternative dans les formes bénignes, mais l’utilisation de la doxycycline chez l’enfant n’est plus un problème et doit être utilisée dans les formes sévères.16, 17 Les bêtalactamines sont inefficaces sur les rickettsioses et ne doivent donc en aucun cas être utilisées dans ce cadre.
La prévention des rickettsioses transmises par les tiques repose sur la prévention des piqûres de tiques par l’utilisation notamment de répulsifs et de vêtements couvrants qui peuvent être imprégnés d’acaricides à base de perméthrine.18 Après une promenade en zone à risque de piqûre, il faut recommander au patient une auto-inspection cutanée minutieuse, à la recherche d’une tique attachée. Les tiques doivent être restées attachées au moins 24 heures pour avoir commencé à injecter de la salive et des rickettsies. C’est d’ailleurs le cas pour la plupart des maladies infectieuses transmises par les tiques. Si une tique est retirée immédiatement après la piqûre, la probabilité qu’elle ait transmis un agent infectieux est nulle. Ainsi, en cas de piqûre, il convient de retirer la tique à l’aide d’une pince à épiler ou d’un tire-tique et de désinfecter ensuite la zone lésée. La survenue d’une escarre, d’une fièvre, d’une adénopathie ou d’une éruption dans les jours qui suivent la piqûre doit amener le patient à consulter rapidement.18 Il n’y a pas d’indication à une antibioprophylaxie systématique en cas de piqûre.
La prévention des rickettsioses transmises par les tiques repose sur la prévention des piqûres de tiques par l’utilisation notamment de répulsifs et de vêtements couvrants qui peuvent être imprégnés d’acaricides à base de perméthrine.18 Après une promenade en zone à risque de piqûre, il faut recommander au patient une auto-inspection cutanée minutieuse, à la recherche d’une tique attachée. Les tiques doivent être restées attachées au moins 24 heures pour avoir commencé à injecter de la salive et des rickettsies. C’est d’ailleurs le cas pour la plupart des maladies infectieuses transmises par les tiques. Si une tique est retirée immédiatement après la piqûre, la probabilité qu’elle ait transmis un agent infectieux est nulle. Ainsi, en cas de piqûre, il convient de retirer la tique à l’aide d’une pince à épiler ou d’un tire-tique et de désinfecter ensuite la zone lésée. La survenue d’une escarre, d’une fièvre, d’une adénopathie ou d’une éruption dans les jours qui suivent la piqûre doit amener le patient à consulter rapidement.18 Il n’y a pas d’indication à une antibioprophylaxie systématique en cas de piqûre.
Un traitement à débuter sans délai
Les rickettsioses les plus fréquemment rencontrées en France sont la fièvre boutonneuse méditerranéenne sur le pourtour méditerranéen et le SENLAT ou TIBOLA. Devant un tableau fébrile associéà un rash et/ou à une escarre d’inoculation, le diagnostic de rickettsiose doit être évoqué. Dans ce cas, en plus de la sérologie, la PCR spécifique sur écouvillon d’escarre est un moyen de diagnostic rapide et non invasif. En cas de suspicion clinique, le traitement de référence est la doxycycline, qui doit être débutée sans délai.
Références
1. Eldin C, Mélenotte C, Mediannikov O, et al. From Q Fever to Coxiella burnetii infection:a paradigm change. Clin Microbiol Rev 2017;30:115-90.
2. Million M, Lepidi H, Raoult D. Fièvre Q: actualités diagnostiques et thérapeutiques. Med Mal Infect 2009;39:82-94.
3. Delord M, Socolovschi C, Parola P. Rickettsioses and Q fever in travelers (2004-2013). Travel Med Infect Dis 2014;12:443-58.
4. Rovery C, Brouqui P, Raoult D. Questions on mediterranean spotted fever a century after its discovery. Emerg Infect Dis 2008;14:1360-7.
5. Parola P, Socolovschi C, Jeanjean L, et al. Warmer weather linked to tick attack and emergence of severe rickettsioses. PLoS Negl Trop Dis 2008;2:e338.
6. Bouchaib H, Eldin C, Laroche M, Raoult D, Parola P. Tick- and flea-borne rickettsioses in Tizi-Ouzou, Algeria: implications for travel medicine. Travel Med Infect Dis 2018;26:51-7.
7. Dubourg G, Socolovschi C, Del Giudice P, Fournier PE, Raoult D. Scalp eschar and neck lymphadenopathy after tick bite: an emerging syndrome with multiple causes. Eur J Clin Microbiol Infect Dis 2014;33:1449-56.
8. Edouard S, Parola P, Socolovschi C, Davoust B, La Scola B, Raoult D. Clustered cases of Rickettsia sibirica mongolitimonae infection, France. Emerg Infect Dis 2013;19:337-8.
9. Nouchi A, Monsel G, Jaspard M, Jannic A, Angelakis E, Caumes E. Rickettsia sibirica mongolitimonae infection in a woman travelling from Cameroon: a case report and review of the literature. J Travel Med [Internet] 2018 Jan 1;25(1). http://bit.ly/2Opls1o
10. Gaillard E, Socolovschi C, Fourcade C, Lavigne JP, Raoult D, Sotto A. Sepsis sévère avec coagulation intravasculaire disséminée au cours d’une infection a Rickettsia sibirica mongolitimonae. Med Mal Infect 2015;45:57-9.
11. Kelly P, Lucas H, Beati L, Yowell C, Mahan S, Dame J. Rickettsia africae in Amblyomma variegatum and domestic ruminants on eight Caribbean islands. J Parasitol 2010;96:1086-8.
12. Parola P, Jourdan J, Raoult D. Tick-borne infection caused by Rickettsia africae in the West Indies. N Engl J Med 1998;338:1391.
13. Parola P, Vestris G, Martinez D, Brochier B, Roux V, Raoult D. Tick-borne rickettiosis in Guadeloupe, the French West Indies: isolation of Rickettsia africae from Amblyomma variegatum ticks and serosurvey in humans, cattle, and goats. Am J Trop Med Hyg 1999;60:888-93.
14. Le-Viet N, Le VN, Chung H, et al. Prospective case-control analysis of the aetiologies of acute undifferentiated fever in Vietnam. Emerg Microbes Infect 2019;8:339-52.
15. Le Viet N, Laroche M, Thi Pham HL, et al. Use of eschar swabbing for the molecular diagnosis and genotyping of Orientia tsutsugamushi causing scrub typhus in Quang Nam province, Vietnam. PLoS Negl Trop Dis 2017;11:e0005397.
16. Gaillard T, Briolant S, Madamet M, Pradines B. The end of a dogma: the safety of doxycycline use in young children for malaria treatment. Malar J 2017;16:148.
17. Todd SR, Dahlgren FS, Traeger MS, et al. No visible dental staining in children treated with doxycycline for suspected Rocky Mountain Spotted Fever. J Pediatr 2015;166:1246-51.
18. Gocko X, Lenormand C, Lemogne C, et al. Lyme borreliosis and other tick-borne diseases. Guidelines from the French scientific societies. Med Mal Infect 2019;49:296-317.
2. Million M, Lepidi H, Raoult D. Fièvre Q: actualités diagnostiques et thérapeutiques. Med Mal Infect 2009;39:82-94.
3. Delord M, Socolovschi C, Parola P. Rickettsioses and Q fever in travelers (2004-2013). Travel Med Infect Dis 2014;12:443-58.
4. Rovery C, Brouqui P, Raoult D. Questions on mediterranean spotted fever a century after its discovery. Emerg Infect Dis 2008;14:1360-7.
5. Parola P, Socolovschi C, Jeanjean L, et al. Warmer weather linked to tick attack and emergence of severe rickettsioses. PLoS Negl Trop Dis 2008;2:e338.
6. Bouchaib H, Eldin C, Laroche M, Raoult D, Parola P. Tick- and flea-borne rickettsioses in Tizi-Ouzou, Algeria: implications for travel medicine. Travel Med Infect Dis 2018;26:51-7.
7. Dubourg G, Socolovschi C, Del Giudice P, Fournier PE, Raoult D. Scalp eschar and neck lymphadenopathy after tick bite: an emerging syndrome with multiple causes. Eur J Clin Microbiol Infect Dis 2014;33:1449-56.
8. Edouard S, Parola P, Socolovschi C, Davoust B, La Scola B, Raoult D. Clustered cases of Rickettsia sibirica mongolitimonae infection, France. Emerg Infect Dis 2013;19:337-8.
9. Nouchi A, Monsel G, Jaspard M, Jannic A, Angelakis E, Caumes E. Rickettsia sibirica mongolitimonae infection in a woman travelling from Cameroon: a case report and review of the literature. J Travel Med [Internet] 2018 Jan 1;25(1). http://bit.ly/2Opls1o
10. Gaillard E, Socolovschi C, Fourcade C, Lavigne JP, Raoult D, Sotto A. Sepsis sévère avec coagulation intravasculaire disséminée au cours d’une infection a Rickettsia sibirica mongolitimonae. Med Mal Infect 2015;45:57-9.
11. Kelly P, Lucas H, Beati L, Yowell C, Mahan S, Dame J. Rickettsia africae in Amblyomma variegatum and domestic ruminants on eight Caribbean islands. J Parasitol 2010;96:1086-8.
12. Parola P, Jourdan J, Raoult D. Tick-borne infection caused by Rickettsia africae in the West Indies. N Engl J Med 1998;338:1391.
13. Parola P, Vestris G, Martinez D, Brochier B, Roux V, Raoult D. Tick-borne rickettiosis in Guadeloupe, the French West Indies: isolation of Rickettsia africae from Amblyomma variegatum ticks and serosurvey in humans, cattle, and goats. Am J Trop Med Hyg 1999;60:888-93.
14. Le-Viet N, Le VN, Chung H, et al. Prospective case-control analysis of the aetiologies of acute undifferentiated fever in Vietnam. Emerg Microbes Infect 2019;8:339-52.
15. Le Viet N, Laroche M, Thi Pham HL, et al. Use of eschar swabbing for the molecular diagnosis and genotyping of Orientia tsutsugamushi causing scrub typhus in Quang Nam province, Vietnam. PLoS Negl Trop Dis 2017;11:e0005397.
16. Gaillard T, Briolant S, Madamet M, Pradines B. The end of a dogma: the safety of doxycycline use in young children for malaria treatment. Malar J 2017;16:148.
17. Todd SR, Dahlgren FS, Traeger MS, et al. No visible dental staining in children treated with doxycycline for suspected Rocky Mountain Spotted Fever. J Pediatr 2015;166:1246-51.
18. Gocko X, Lenormand C, Lemogne C, et al. Lyme borreliosis and other tick-borne diseases. Guidelines from the French scientific societies. Med Mal Infect 2019;49:296-317.