Des études précédentes menées par la Cnam puis Épiphare avaient montré que l’utilisation prolongée et à dose élevée de trois progestatifs – l’acétate de cyprotérone (≥ 25 mg/jour) (Androcur), de chlormadinone (2 - 10 mg/jour) (Lutéran) et de nomégestrol (3,75 - 5 mg/jour) (Lutényl) – augmente significativement le risque de méningiome. Ces résultats ont donné lieu à des recommandations d’utilisation et de surveillance par imagerie cérébrale chez les personnes utilisant ces médicaments.
Au-delà de ces 3 progestatifs oraux, il était nécessaire de savoir s’il existait un risque similaire avec d’autres progestatifs. Épiphare, en association avec l’AP-HP, a ainsi conduit une vaste étude visant à évaluer le risque de méningiome intracrânien opéré chez les femmes lié à l’utilisation d’une liste élargie de progestatifs. Les résultats sont désormais publiés dans le BMJ . Au total, 18 061 femmes âgées de 45 à 74 ans (en moyenne 58 ans) et opérées d’un méningiome entre 2009 et 2018 en France ont été incluses dans l’étude, appariées avec 90 305 femmes témoins. Les résultats montrent que :
- l’utilisation prolongée (un an ou plus) de médrogestone (Colprone) est associée à un risque 3,5 fois plus élevé de méningiome nécessitant une intervention chirurgicale par rapport aux témoins ;
- l’utilisation prolongée de l’acétate de médroxyprogestérone injectable (Depo Provera) est associée à un risque multiplié par 5,6. Le risque est multiplié par 2 lors des expositions prolongées à la promégestone (Surgestone), qui n’est plus commercialisée depuis 2020 en France ;
- l’étude n’a pas montré de risque de méningiome pour une utilisation de moins d’un an de ces trois progestatifs et en l’absence d’exposition préalable aux trois progestatifs cyprotérone, nomégestrol et chlormadinone ;
- les expositions à la progestérone per os , intravaginale ou percutanée (Utrogestan et génériques) et à la dydrogestérone (Duphaston) n’ont pas été associées significativement à un sur-risque de chirurgie de méningiome intracrânien. Les résultats pour les DIU au lévonorgestrel (stérilets hormonaux Mirena, Donasert, Kyleena et Jaydess) sont très rassurants et en faveur de l’absence de risque de méningiome ;
- aucun enseignement n’a pu être tiré concernant le diénogest (Visanne et génériques) ou l’hydroxyprogestérone, les données étant insuffisantes.
L’ANSM s’est prononcée en faveur du maintien de ses premières recommandations, en y ajoutant des précisions sur les changements de progestatifs (schémas explicatifs en figures 1 et 2).
Recos d’utilisation pour les personnes traitées
Médrogestone (Colprone)
Elle ne doit pas être utilisée en première intention dans les indications suivantes :
- ménopause, cycle artificiel en association avec un œstrogène ;
- irrégularités du cycle ;
- syndrome prémenstruel (dysménorrhées essentielles) ;
- douleur mammaire (mastodynie) non sévère.
Sa prescription peut rester justifiée en première intention pour les indications suivantes :
- saignements liés au fibrome ;
- endométriose ;
- douleur mammaire (mastodynie) sévère.
Acétate de médroxyprogestérone (Depo Provera)
Sa prescription peut rester justifiée dans certains cas très particuliers, tels que non-respect de l’observance, intolérance à l’implant sous-cutané ou au DIU.
Recos de suivi par imagerie
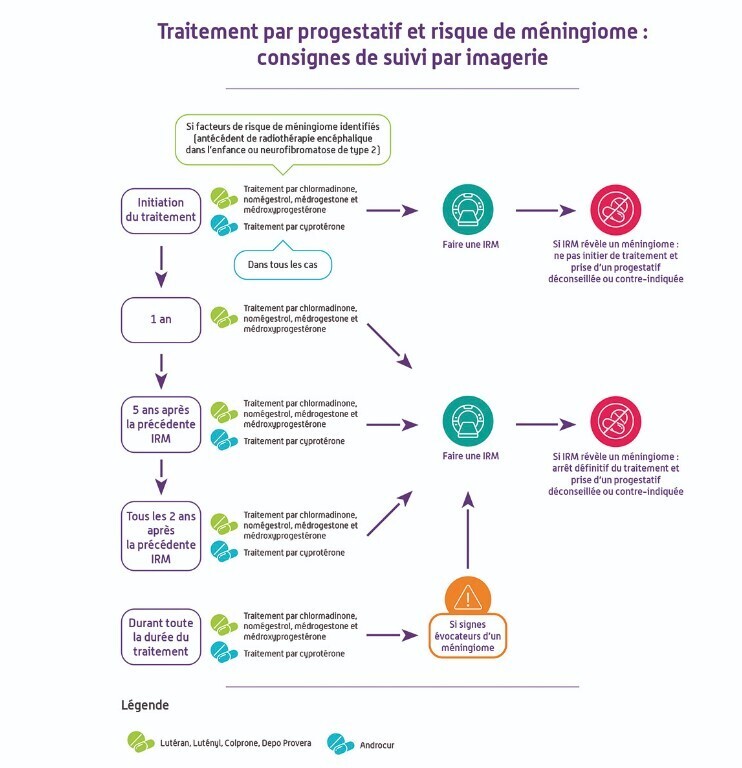
Pour la médrogestone et l’acétate de médroxyprogestérone, une surveillance par imagerie cérébrale est désormais recommandée selon les mêmes modalités que pour l’acétate de chlormadinone (Lutéran et génériques) ou de nomégestrol (Lutényl et génériques).
Un examen par IRM doit être également réalisé quel que soit l’âge de la patiente :
- à tout moment, pendant ou après le traitement, en cas de signes évocateurs de méningiomes ;
- à l’instauration d’un traitement progestatif par l’un des 5 progestatifs à risque (acétate de cyprotérone, acétate de chlormadinone, acétate de nomégestrol, médrogestone, acétate de médroxyprogestérone) ou par un progestatif avec un risque de méningiome non connu à ce jour (diénogest, drospirénone et désogestrel) si la patiente a été traitée plus d’un an par médrogestone ou médroxyprogestérone.
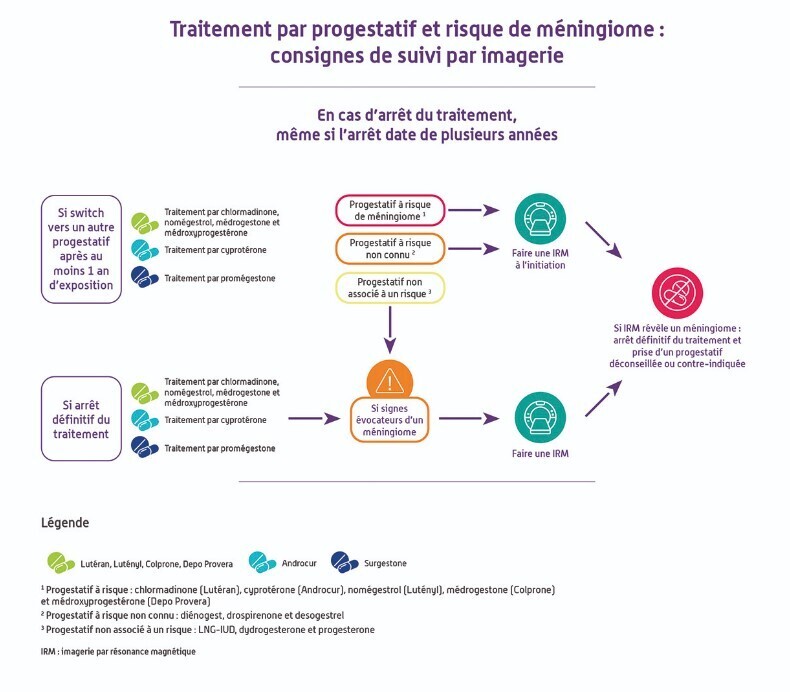
Pour le surgestone (promégestone), progestatif qui n’est plus commercialisé depuis 2020, les recos de suivi par imagerie pour les patientes qui ont été traitées sont les suivantes :
- si la patiente a été traitée plus d’un an et qu’elle a ensuite été traitée par un des cinq progestatifs à risque (acétate de cyprotérone, acétate de chlormadinone, acétate de nomégestrol, médrogestone, acétate de médroxyprogestérone) ou par un progestatif avec un risque de méningiome non connu à ce jour (diénogest, drospirénone et désogestrel), une IRM cérébrale doit être réalisée ;
- si la patiente a des signes évocateurs d’un méningiome, même à distance de l’arrêt de son traitement par promégestone, une IRM cérébrale doit être réalisée.
Recos générales et changement de traitement entre progestatifs
- En cas d’antécédent de méningiome ou de méningiome existant, ces progestatifs (acétate de cyprotérone, acétate de chlormadinone, acétate de nomégestrol, médrogestone, acétate de médroxyprogestérone) sont contre-indiqués. Pour les autres progestatifs (seuls, en association dans un contraceptif ou un THS de la ménopause), il est recommandé de ne pas les utiliser. Dans des situations exceptionnelles, la prescription est possible après évaluation en réunion de concertation pluridisciplinaire.
- La prescription d’un nouveau progestatif en relais d’un traitement antérieur par acétate de cyprotérone, acétate de chlormadinone, acétate de nomégestrol, médrogestone, médroxyprogestérone ou promégestone n’exclut pas le risque de méningiome, sans que l’on puisse actuellement le déterminer. En cas d’utilisation supérieure à un an d’un de ces progestatifs et de changement de traitement vers un progestatif à risque ou vers un progestatif avec un risque de méningiome non connu à ce jour, une IRM cérébrale doit être réalisée à l’instauration du nouveau traitement progestatif.
- En cas de changement de traitement pour un progestatif non associé à un risque de méningiome (DIU au lévonorgestrel, progestérone par voie orale, vaginale ou cutanée, dydrogestérone), une IRM doit être réalisée si des signes évocateurs d’un méningiome apparaissent.
- Le traitement doit toujours être prescrit à la dose minimale efficace et pendant une durée d’utilisation la plus courte possible.
- L’intérêt de poursuivre le traitement doit être réévalué chaque année, notamment aux alentours de la ménopause, car le risque de méningiome augmente fortement avec l’âge.
- Une IRM cérébrale doit être réalisée en cas de signes évocateurs d’un méningiome.
Mesures de réduction du risque et actions à venir
- Renforcement des conditions de prescription et de délivrance de la médrogestone (Colprone) et la médroxyprogestérone (Depo Provera) avec mise en place d’une attestation annuelle d’information dès lors que le traitement est poursuivi au-delà d’un an et remise d’une fiche d’information patiente par le prescripteur (quelle que soit la durée du traitement).
- Envoi de courriers nominatifs aux patientes et aux prescripteurs ayant respectivement eu une délivrance ou prescrit de la médrogestone (Colprone) et de la médroxyprogestérone (Depo Provera) dans les 24 derniers mois.
Épiphare. Progestatifs et risque de méningiome intracrânien. 28 mars 2024.
Roland N, Neumann A, Hoisnard L, et al. Use of progestogens and the risk of intracranial meningioma: national case-control study. BMJ 2024;384:e078078.