Une sécurité renforcée, mais des risques subsistent et d’autres émergent.
La transfusion est une thérapeutique adjuvante destinée à pallier un déficit acquis ou constitutionnel, qualitatif ou quantitatif, d’un composant du sang : érythrocytes, plaquettes, granulocytes, facteurs de coagulation ou protéines plasmatiques. Les 3 millions de produits sanguins labiles (PSL) transfusés chaque année sont issus d’environ 3 millions de dons de volontaires non rémunérés. Les 530 000 receveurs sont souvent âgés (médiane à 69 ans),1 principalement suivis pour des pathologies chroniques (hématologie, cancérologie). Chaque don fait l’objet d’une qualification biologique : groupages sanguins, dépistage sérologique et/ou génomique d’agents infectieux. Les PSL sont délivrés sur ordonnance médicale ; chaque indication est pesée par le prescripteur en termes de bénéfice-risque des effets indésirables, parfois graves, chez le receveur. La transfusion est réalisée à l’hôpital mais ces complications doivent être connues des médecins de ville pour une prise en charge adaptée.
Principaux risques
La transmission d’agents infectieux ou une incompatibilité immunologique chez les patients transfusés sont inhérentes à l’origine humaine des PSL. En France, entre 2000 et 2010, 4 à 6 accidents mortels annuels lui ont été imputés. Dans l’analyse des données d’hémovigilance de l’Agence nationale de santé du médicament et des produits de santé (Ansm), 47 % étaient consécutifs à un œdème aigu du poumon, 18 % à une incompatibilité immune (ABO pour la moitié) et 9 % à une infection bactérienne.2
Près de 8 000 effets indésirables sont déclarés chaque année (0,24/100 PSL).2 Il s’agit le plus souvent d’événements mineurs spontanément résolutifs, comme les épisodes de frissons et/ou d’hyperthermie ou allergiques lesquels peuvent néanmoins annoncer une réaction plus grave. Plus rarement, les accidents transfusionnels sont retardés : à plusieurs jours (hémolyse par réactivation d’un allo-anticorps [Ac] anti-érythrocytaire), voire à plusieurs semaines ou mois comme lors d’une transmission d’agent pathogène.
Depuis 1998, tous les produits sanguins sont systématiquement « déleucocytés ». Cette réduction leucocytaire (en dessous de 106 globules blancs/unité) diminue significativement les réactions fébriles non hémolytiques (RFNH), la contamination du receveur par certains agents infectieux (cytomégalovirus – CMV –, HTLV-I/II, bactéries, nouveau variant de la maladie de Creutzfeldt-Jacob – nvCJD) ainsi que l’allo-immunisation HLA (Human Leucocyte Antigen).
Près de 8 000 effets indésirables sont déclarés chaque année (0,24/100 PSL).2 Il s’agit le plus souvent d’événements mineurs spontanément résolutifs, comme les épisodes de frissons et/ou d’hyperthermie ou allergiques lesquels peuvent néanmoins annoncer une réaction plus grave. Plus rarement, les accidents transfusionnels sont retardés : à plusieurs jours (hémolyse par réactivation d’un allo-anticorps [Ac] anti-érythrocytaire), voire à plusieurs semaines ou mois comme lors d’une transmission d’agent pathogène.
Depuis 1998, tous les produits sanguins sont systématiquement « déleucocytés ». Cette réduction leucocytaire (en dessous de 106 globules blancs/unité) diminue significativement les réactions fébriles non hémolytiques (RFNH), la contamination du receveur par certains agents infectieux (cytomégalovirus – CMV –, HTLV-I/II, bactéries, nouveau variant de la maladie de Creutzfeldt-Jacob – nvCJD) ainsi que l’allo-immunisation HLA (Human Leucocyte Antigen).
Transmission de pathogènes
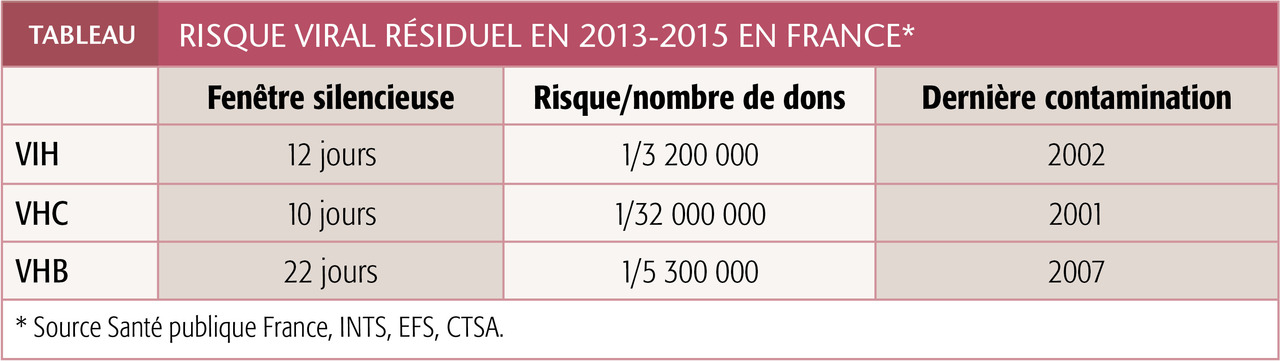
La sélection clinique des candidats au don de sang, les dépistages sérologiques et/ou génomiques d’agents infectieux dans chaque PSL et les méthodes d’atténuation des pathogènes ont rendu le risque de contamination extrêmement faible (tableau), notamment par les virus « majeurs », hépatites B et C, VIH dont les sérologies en pré- et post-transfusionnel ne sont, de ce fait, plus recommandées.
La modification des écosystèmes, la mondialisation des échanges économiques et l’explosion des voyages intercontinentaux favorisent la dissémination de nouveaux risques infectieux. C’est le cas du virus West Nile devenu endémique en 2002 aux États-Unis, de celui de la dengue, du chikungunya à la Réunion en 2005 et aux Antilles en 2012, enfin du Zika en 2014. Celui de l’hépatite E est un risque émergent dans les pays développés même si sa circulation en France est certainement ancienne : séroprévalence de 22,5 % (IgG VHE) variant selon les régions.3 La gravité de cette infection tient à la survenue (parfois rapide) d’une hépatite chronique, pouvant évoluer vers une cirrhose chez des receveurs immunodéprimés. La recherche d’ARN viral confirme le diagnostic (22 cas post-transfusionnels déclarés entre 2006 et 2015).
La prescription de PSL « CMV négatif » n’est plus indiquée, en raison de la sécurité apportée par la déleucocytation, quelle que soit la situation clinique du patient (y compris la grossesse).
Le paludisme post-transfusionnel reste redoutable bien qu’exceptionnel. Trois cas à Plasmodium falciparum ont été déclarés en France depuis 2000 (le dernier en 2012), le plus souvent mortels. On l’évoque devant une fièvre, une hémolyse, des signes neurologiques et une altération de l’état général, survenant 1 à 3 semaines après la transfusion d’un concentré de globules rouges (CGR), plus rarement d’un concentré de plaquettes (CP).
Les infections bactériennes transmises par transfusion (IBTT) peuvent être mortelles. Elles sont plus fréquentes avec les CP (80 % des IBTT) qu’avec les CGR. Le risque bactérien des concentrés plaquettaires peut être réduit par détection bactériologique ou atténuation physicochimique des pathogènes mais à ce jour ces méthodes ne sont pas applicables aux CGR.
Enfin, 4 cas britanniques probables de transmission du nvCJD ont été déclarés et associés à la transfusion, avant 2000, de sang non déleucocyté.
La modification des écosystèmes, la mondialisation des échanges économiques et l’explosion des voyages intercontinentaux favorisent la dissémination de nouveaux risques infectieux. C’est le cas du virus West Nile devenu endémique en 2002 aux États-Unis, de celui de la dengue, du chikungunya à la Réunion en 2005 et aux Antilles en 2012, enfin du Zika en 2014. Celui de l’hépatite E est un risque émergent dans les pays développés même si sa circulation en France est certainement ancienne : séroprévalence de 22,5 % (IgG VHE) variant selon les régions.3 La gravité de cette infection tient à la survenue (parfois rapide) d’une hépatite chronique, pouvant évoluer vers une cirrhose chez des receveurs immunodéprimés. La recherche d’ARN viral confirme le diagnostic (22 cas post-transfusionnels déclarés entre 2006 et 2015).
La prescription de PSL « CMV négatif » n’est plus indiquée, en raison de la sécurité apportée par la déleucocytation, quelle que soit la situation clinique du patient (y compris la grossesse).
Le paludisme post-transfusionnel reste redoutable bien qu’exceptionnel. Trois cas à Plasmodium falciparum ont été déclarés en France depuis 2000 (le dernier en 2012), le plus souvent mortels. On l’évoque devant une fièvre, une hémolyse, des signes neurologiques et une altération de l’état général, survenant 1 à 3 semaines après la transfusion d’un concentré de globules rouges (CGR), plus rarement d’un concentré de plaquettes (CP).
Les infections bactériennes transmises par transfusion (IBTT) peuvent être mortelles. Elles sont plus fréquentes avec les CP (80 % des IBTT) qu’avec les CGR. Le risque bactérien des concentrés plaquettaires peut être réduit par détection bactériologique ou atténuation physicochimique des pathogènes mais à ce jour ces méthodes ne sont pas applicables aux CGR.
Enfin, 4 cas britanniques probables de transmission du nvCJD ont été déclarés et associés à la transfusion, avant 2000, de sang non déleucocyté.
Incompatibilité érythrocytaire
Du fait du polymorphisme antigénique de la population humaine, toute transfusion d’un PSL contenant des globules rouges expose au risque d’allo-immunisation. La recherche d’agglutinines irrégulières (RAI) 15 à 21 jours après l’administration est le seul examen recommandé pour dépister un anticorps, quelquefois transitoire mais réactivable lors de transfusions ultérieures. Le nombre d’accidents par incompatibi- lité ABO a nettement régressé en France (21 cas en 2000 contre 4 en 2014 avec les CGR). Le tableau classique d’hémolyse aiguë avec douleurs lombaires, hémoglobinurie, collapsus cardiovasculaire peut manquer, l’incompatibilité immune s’exprimant seulement par un syndrome frissons-hyperthermie ou une inefficacité transfusionnelle immédiate ou retardée. Il faut alors rechercher un accident lié à ABO (vérification de l’identité du receveur, comparaison des documents transfusionnels et du CGR), effectuer un contrôle biologique des groupes sanguins, et chercher des anticorps circulants ou fixés aux hématies du patient.
Réactions pulmonaires
L’œdème post-transfusionnel peut être hémodynamique par surcharge volémique (Transfusion Associated Circulating Overload, TACO) ou lésionnel par altération de la membrane alvéolocapillaire (Transfusion Related Acuted Lung Injury, TRALI).
Le TRALI survient dans les 6 heures suivant la transfusion. Il associe fièvre, tachypnée et hypoxémie, le plus souvent chez des patients ayant des facteurs de risque : sepsis, chirurgie cardiaque avec circulation extracorporelle, état de choc. Une de ses causes est l’activation des polynucléaires du receveur par des anticorps anti-HLA (voire HNA, Human Neutrophil Antigen) du produit sanguin. Une sélection drastique des donneurs de plasma et de plaquettes (exclusion des femmes non nullipares porteuses d’Ac anti-HLA) a réduit significativement son incidence (68 déclarations en 2010, 20 en 2015).2
Quant au TACO, il survient essentiellement chez des patients âgés et peut être précédé d’une HTA isolée lors de transfusions antérieures. Il est plus fréquent avec les CGR, surtout s’ils sont transfusés rapidement à des sujets ayant une dysfonction cardiaque.
Le TRALI survient dans les 6 heures suivant la transfusion. Il associe fièvre, tachypnée et hypoxémie, le plus souvent chez des patients ayant des facteurs de risque : sepsis, chirurgie cardiaque avec circulation extracorporelle, état de choc. Une de ses causes est l’activation des polynucléaires du receveur par des anticorps anti-HLA (voire HNA, Human Neutrophil Antigen) du produit sanguin. Une sélection drastique des donneurs de plasma et de plaquettes (exclusion des femmes non nullipares porteuses d’Ac anti-HLA) a réduit significativement son incidence (68 déclarations en 2010, 20 en 2015).2
Quant au TACO, il survient essentiellement chez des patients âgés et peut être précédé d’une HTA isolée lors de transfusions antérieures. Il est plus fréquent avec les CGR, surtout s’ils sont transfusés rapidement à des sujets ayant une dysfonction cardiaque.
RFNH et réactions « allergiques »
Les réactions fébriles non hémolytiques (RFNH), de faible fréquence (0,05/100 PSL), sont caractérisées par un décalage ther- mique supérieur ou égal à 1 °C, associé ou non à des frissons. Ce sont, avec les réactions « allergiques » (0,03/100 PSL),2 les plus fréquentes réactions immédiates. Elles sont volontiers modérées (érythème, urticaire), parfois plus sévères (broncho-spasme, angiœdème), rarement graves (choc anaphylactique).
Autres risques
Le purpura post-transfusionnel est dû à une allo-immunisation antiplaquettaire, avec thrombopénie le plus souvent profonde (< 10 G/L) par destruction des plaquettes du patient 8 à 10 jours après la transfusion.
La réaction du greffon contre l’hôte, est une complication grave, liée à la présence de lymphocytes viables dans le produit sanguin cellulaire transfusé. Elle concerne surtout des patients immunodéprimés : déficits constitutionnels ou acquis (greffes de cellules souches hématopoïétiques, traitement oncologique par analogues puriniques) ou certaines situations exceptionnelles de don intrafamilial.
L’hémosidérose post-transfusionnelle est une complication métabolique insidieuse car longtemps négligée. Elle survient lors de transfusions itératives (chaque CGR apporte 200 mg de fer), et justifie une surveillance chez toute personne ayant reçu plus de 20 CGR, associée à un traitement chélateur si la ferritinémie est supérieure à 1 000 ng/mL.
La réaction du greffon contre l’hôte, est une complication grave, liée à la présence de lymphocytes viables dans le produit sanguin cellulaire transfusé. Elle concerne surtout des patients immunodéprimés : déficits constitutionnels ou acquis (greffes de cellules souches hématopoïétiques, traitement oncologique par analogues puriniques) ou certaines situations exceptionnelles de don intrafamilial.
L’hémosidérose post-transfusionnelle est une complication métabolique insidieuse car longtemps négligée. Elle survient lors de transfusions itératives (chaque CGR apporte 200 mg de fer), et justifie une surveillance chez toute personne ayant reçu plus de 20 CGR, associée à un traitement chélateur si la ferritinémie est supérieure à 1 000 ng/mL.
Encadre
Surveillance immédiate et à distance
Signes d’appel au cours/décours immédiat d’une transfusion
• Fièvre ou frissons
• Hyper-/hypotension artérielle
• Dyspnée/détresse respiratoire
• Manifestations allergiques (urticaire, érythème, toux, bronchospasme)
• Hémolyse (urines foncées)
Surveillance à distance de la transfusion
• RAI post-transfusionnelle
• Ferritinémie
références
1. Fillet AM, Desmarets M, Assari S, et al. Blood products use in France : a nationwide cross-sectional survey. Transfusion 2016;56:3033-41.
2. Ansm. Rapport d’activité hémovigilance 2015. Septembre 2016.
3. Gallian P, Piquet Y, Assal A, et al. Virus de l’hépatite E, implications en transfusion sanguine. Transfusion clinique et biologique 2014;21;17-7
2. Ansm. Rapport d’activité hémovigilance 2015. Septembre 2016.
3. Gallian P, Piquet Y, Assal A, et al. Virus de l’hépatite E, implications en transfusion sanguine. Transfusion clinique et biologique 2014;21;17-7

 Encadrés
Encadrés