Diagnostiquer une sclérose en plaques.
Argumenter l'attitude thérapeutique et planifier le suivi du patient.
Décrire les principes de la prise en charge au long cours.
Épidémiologie et physiopathologie
Terrain
Causes
Facteurs endogènes
La sclérose en plaques n’est pas une maladie héréditaire, mais fait intervenir un terrain de susceptibilité génétique. Chez les jumeaux monozygotes, il existe un taux de concordance maximale de 25 %. La prévalence de la sclérose en plaques est de 0,1 %, de 2,75 % lorsqu’un des parents est atteint et de 4 % lorsqu’un frère ou une sœur est touché(e). Les formes familiales représentent 10 % des cas de sclérose en plaques. La sclérose en plaques est une maladie faisant intervenir plus de 200 gènes dont la majorité est impliquée dans la réponse immunitaire.Facteurs exogènes
Comme le prouve le modèle des migrations, l’environnement semble intervenir sur le risque de sclérose en plaques. Ainsi, les personnes migrant avant l’âge de 15 ans d’une zone de forte prévalence vers une zone de faible prévalence ont un risque peu important de déclarer une sclérose en plaques et, inversement, ce n’est pas le cas si la migration se fait à l’âge adulte. Plusieurs facteurs environnementaux sont incriminés dans le risque de sclérose en plaques. Si l’implication du virus Epstein-Barr et du tabac est certaine, celle de la carence en vitamine D par le biais du manque d’ensoleillement et de l’obésité infantile est fortement suspectée.Physiopathologie
Des clones de lymphocytes T et B sont activés dans la circulation sanguine, puis traversent la barrière hémato-encéphalique qui isole le système nerveux central. Une fois dans le cerveau, des cellules immuno-actives, des cytokines pro-inflammatoires et des anticorps sont libérés et vont concourir à l’attaque de la myéline. La sclérose en plaques est donc une maladie inflammatoire, auto-immune, démyélinisante du système nerveux central. Par l’atteinte de la myéline, le passage de l’influx nerveux est touché, entraînant des signes cliniques. Les mécanismes de remyélinisation permettent, au début, une récupération neurologique. Une souffrance de l’axone semble coexister avec l’atteinte myélinique. Les mécanismes de démyélinisation-remyélinisation coexistent dans la sclérose en plaques.
Histoire naturelle et signes cliniques
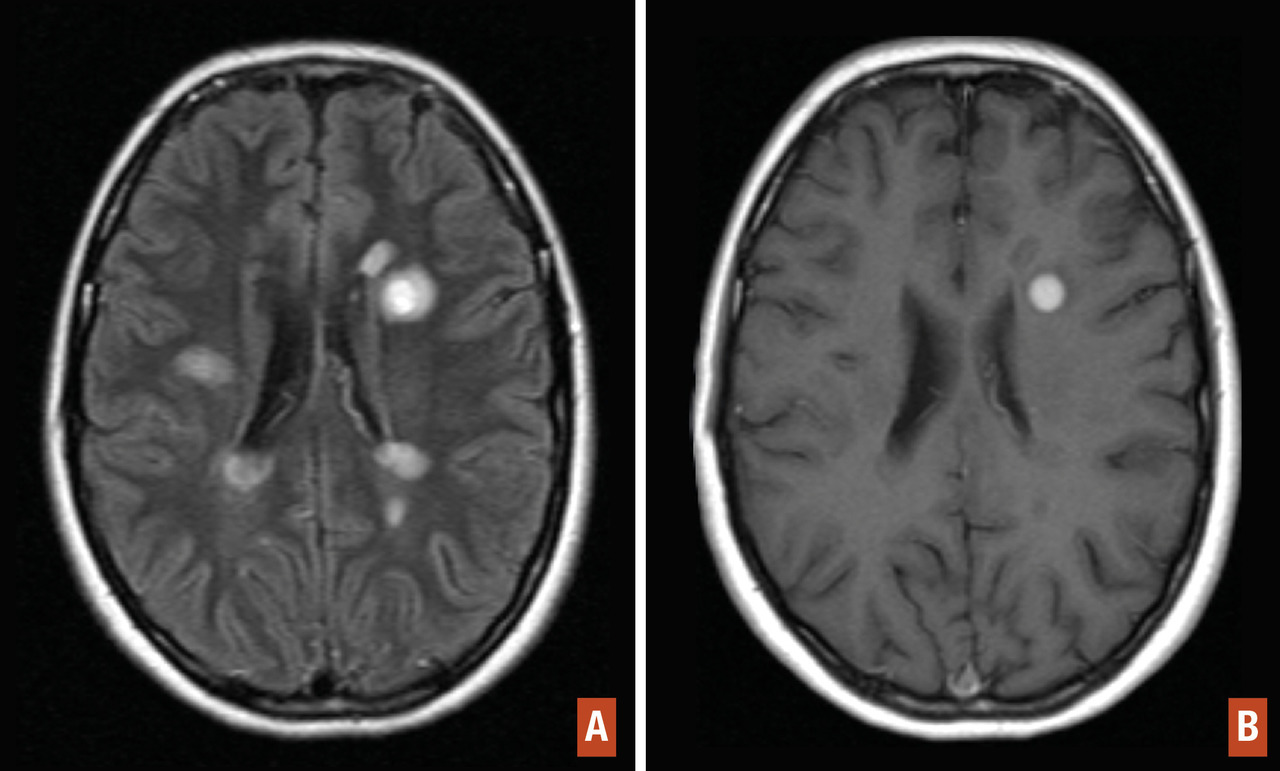
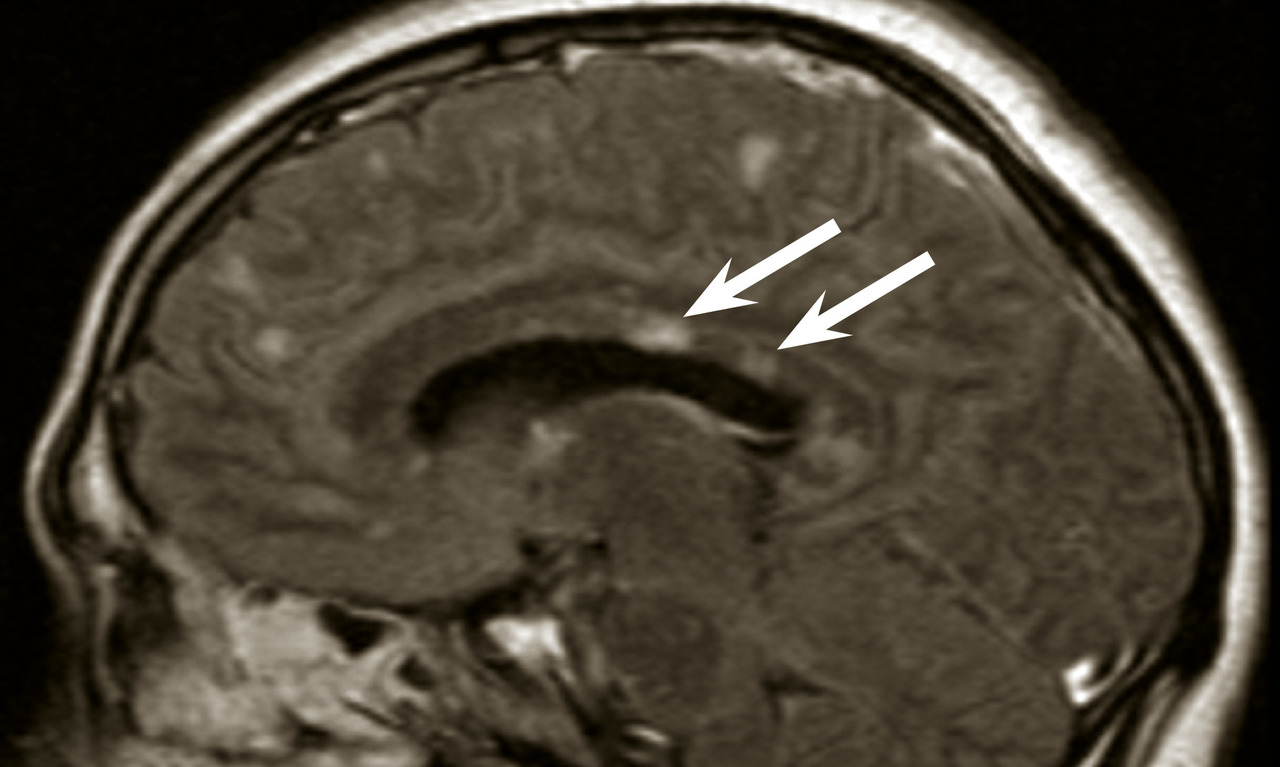
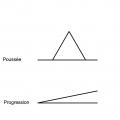
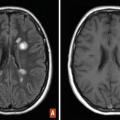
Phase de début (fig. 2 et 3)
Signes sensitifs
La sclérose en plaques débute par des signes sensitifs dans 45 % des cas. Ils sont souvent subjectifs, de distribution ne correspondant pas toujours à un dermatome. Ils peuvent être en ceinture ou en bande autour d’un ou de deux membres, de l’abdomen, parfois une zone de sensation anormale en « patch » est décrite. Les signes sensitifs sont soit négatifs à type d’hypo- ou d’anesthésie, soit positifs (brûlures, paresthésies, dysesthésies, engourdissements, ruissellement…). Il existe un signe sensitif quasiment pathognomonique : le signe de Lhermitte (sensation de décharge électrique descendant le long du rachis et des membres lors de la flexion de la tête) témoignant d’une atteinte cordonale postérieure médullaire. L’examinateur peut observer une atteinte de la voie lemniscale (sensibilité fine épicritique et proprioceptive) et/ou extralemniscale (sensibilité thermo-algique et tact grossier).Des douleurs existent aussi dans la sclérose en plaques. Il peut s’agir de brûlures, de décharges… Ces douleurs peuvent être permanentes ou paroxystiques telles que dans la névralgie du trijumeau. Les douleurs peuvent également être à type de contractures secondaires à la spasticité.
Signes moteurs
Ils inaugurent la sclérose en plaques dans 30 % des cas. Parfois, ils se manifestent seulement à l’effort. Ils se manifestent par une lourdeur, une faiblesse des membres. Les membres inférieurs sont plus souvent atteints et plus précocement que les membres supérieurs avec souvent un déficit asymétrique. Le malade n’arrive plus à courir et observe une réduction de son périmètre de marche. L’examen clinique peut révéler un déficit moteur, mais il peut se limiter à des anomalies de réflexes ostéotendineux vifs, diffusants et polycinétiques. Une trépidation épileptoïde des pieds est souvent présente, de même qu’un signe de Babinski qui peut être la seule manifestation de l’atteinte pyramidale.La spasticité des membres inférieurs est fréquente, elle aide les patients parétiques à marcher en fauchant mais elle est aussi à l’origine de gêne et d’inconfort avec parfois des spasmes invalidants.
Signes visuels
La névrite optique rétrobulbaire (NORB) est une manifestation fréquente dans la sclérose en plaques comme première poussée (25 % des cas). Elle se traduit par une baisse d’acuité visuelle s’installant sur quelques heures ou quelques jours, unilatérale à type de voile, accompagnée de douleurs périorbitaires aggravées par les mouvements oculaires.L’examinateur trouve une baisse d’acuité visuelle d’importance variable avec parfois un scotome central ou paracentral, une altération de la vision des couleurs avec une dyschromatopsie d’axe vert-rouge. L’examen ophtalmologique est le plus souvent normal. Au fond d’œil, la papille est le plus souvent normale, cependant un œdème papillaire est présent dans 10 % des cas.
Le phénomène de Marcus-Gunn (dilatation paradoxale de la pupille du côté atteint lors de l’éclairage alterné de chaque œil) témoigne d’un déficit du réflexe pupillaire afférent homolatéral, il signe une souffrance du nerf optique.
Troubles de l’équilibre, de la coordination, vertiges
L’ataxie peut être cérébelleuse (dysmétrie, hypermétrie, adiadococinésie, asynergie, tremblement d’intention, dysarthrie, hypotonie avec réflexes ostéotendineux pendulaires), proprioceptive (signe de Romberg, atteinte de la sensibilité profonde) ou vestibulaire (signe de Romberg, déviation des index, nystagmus).Extrémité céphalique
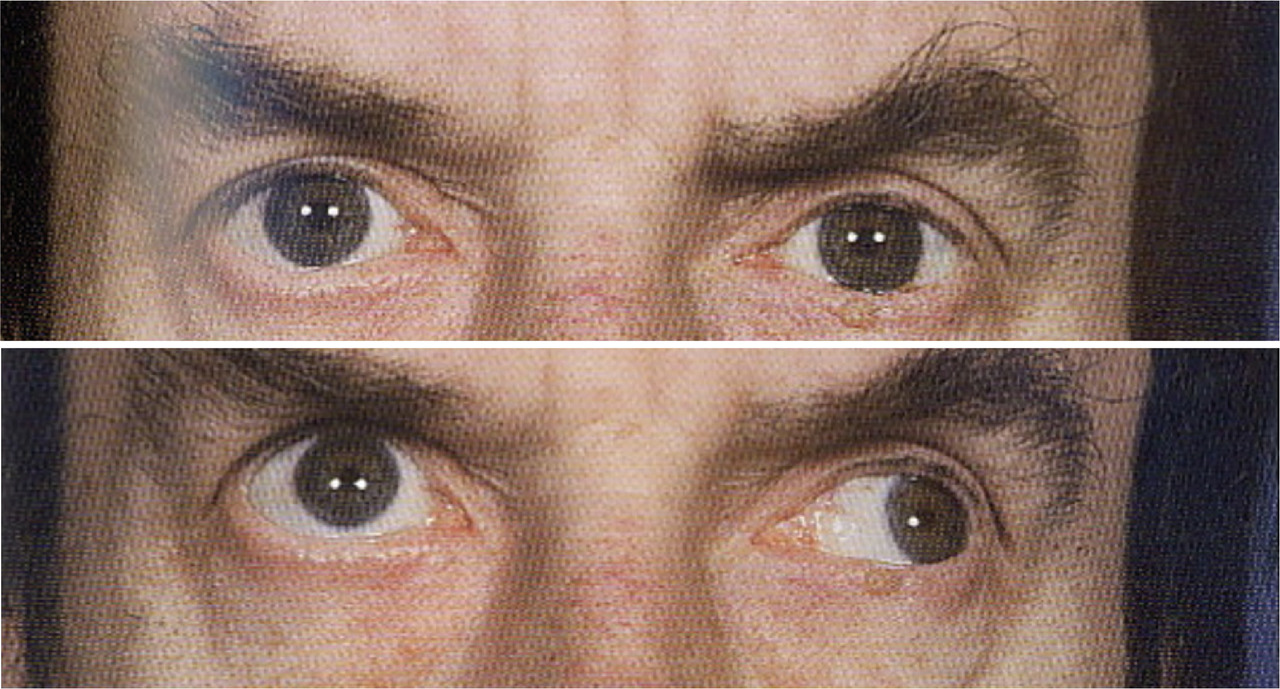
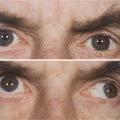
Les troubles oculomoteurs sont possibles. Un nystagmus le plus souvent horizontal est retrouvé, il peut être moins fréquemment rotatoire, battant vers le haut ou le bas. La plupart du temps, ce nystagmus est asymptomatique, mais il peut occasionner un inconfort visuel, une oscillopsie.L’ophtalmoplégie internucléaire (
Des anomalies de la mobilité extrinsèque sont possibles, avec des paralysies d’abduction.
La dysarthrie est fréquente dans la sclérose en plaques. Elle est d’origine diverse : cérébelleuse, pseudobulbaire (bigéniculée), mixte.
Des névralgies du trijumeau peuvent survenir au cours de la sclérose en plaques. Elles sont parfois révélatrices (5 %). Elles ressemblent à une névralgie essentielle, tout au moins au début, sauf par son âge de survenue, plus jeune, et son caractère bilatéral dans 14 % des cas.
La paralysie faciale d’expression périphérique est inaugurale dans 5 % des cas.
Les troubles de la déglutition (fausses routes, dysphagie) sont rarement inauguraux.
Troubles vésicosphinctériens et sexuels
Les troubles mictionnels urinaires inaugurent la maladie chez seulement 6 % des patients, mais ils surviennent chez 78 % des patients au cours de l’évolution de la maladie. Les patients rapportent des pollakiuries, des mictions impérieuses (urgenturies), des incontinences, des dysuries, des mictions incomplètes témoignant de l’existence d’un résidu post-mictionnel. La constipation est fréquente. Des impériosités ou incontinences fécales peuvent être rapportées, rarement inaugurales.Les troubles sexuels chez l’homme se traduisent par des dysfonctions érectiles et d’éjaculation. Chez la femme, il s’agit de perte de la libido, diminution de la lubrification vaginale, insensibilité locale.
Autres symptômes
Fatigue
Troubles cognitifs et psychiatriques
La dépression et l’anxiété concernent de 27 à 54 % des patients. Un syndrome frontal caractérisé par un état permanent d’optimisme, de satisfaction malgré un handicap peut être observé dans les formes évoluées.
Symptômes durant moins de 24 heures
Ces symptômes ne correspondent pas à une poussée.Phénomène d’Uhthoff
Manifestations paroxystiques
Ces différents symptômes inauguraux peuvent être isolés (mono-symptôme 60 %) ou s’associer (pluri-symptômes). Ils peuvent s’accumuler avec le temps. La récupération après une poussée peut être complète (deux tiers en début de maladie) ou partielle avec séquelles, qu’elle soit traitée ou pas. En moyenne, les patients ont une poussée tous les 18 mois au début, puis cette fréquence diminue.
Phase d’état
Évolution et pronostic
Des facteurs prédictifs cliniques de bon pronostic ont été mis en évidence parmi lesquels : un âge de début précoce, le fait d’être une femme, un début rémittent, un début par une NORB, un délai entre les deux premières poussées supérieur à 2 ans.
Grâce à l’élaboration de courbes de survie, des médianes de délais d’atteinte de niveaux de handicap évalués par l’échelle EDSS (expanded disability status scale) ont été établies. Cinquante pour cent des patients atteindront l’EDSS 4 (limitation du périmètre de marche) au bout de 8 ans ; l’EDSS 6 (recours à une canne) après 20 ans d’évolution ; et l’EDSS 7 (fauteuil roulant) après 30 ans.
Cas particuliers
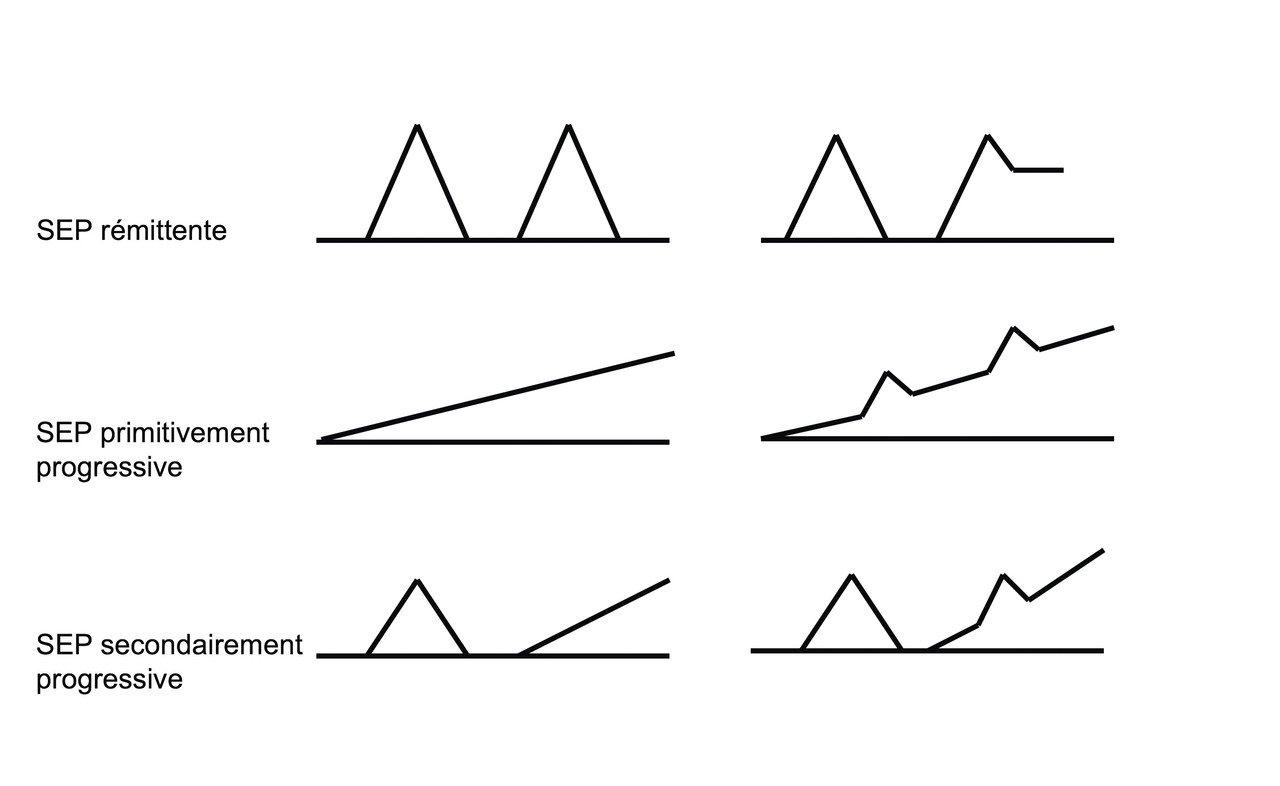
Formes progressives d’emblée (15 %)
Ces formes touchent autant les hommes que les femmes, débutent à un âge plus avancé (en moyenne 40 ans), avec un handicap qui survient plus vite. Les formes d’emblée progressives sont habituellement caractérisées par une atteinte médullaire progressive (réduction du périmètre de marche, troubles vésico-sphinctériens). Ces formes peuvent être avec ou sans poussées surajoutées. La progression se définit cliniquement sur une évaluation au moins annuelle.Formes dites « bénignes »
Certaines formes de sclérose en plaques sont dites « bénignes » à moyen terme. Il s’agit de patients encore ambulatoires après 10 ans d’évolution, sachant que 50 % des patients perdent leur statut de forme bénigne tous les 10 ans suivants.Syndrome clinique isolé
Un syndrome clinique isolé (ou première poussée) correspond à un premier événement inflammatoire démyélinisant ne répondant pas aux critères diagnostiques de dissémination dans le temps et/ou dans l’espace (v. chapitre Diagnostic).Syndrome radiologiquement isolé
Le syndrome radiologiquement isolé correspond à la découverte d’anomalies à l’imagerie par résonance magnétique (IRM) suggestives d’une sclérose en plaques chez un patient sans symptôme ni signe neurologique évocateur. La présence de lésions médullaires, l’âge jeune, le sexe masculin, la présence de bandes oligoclonales dans le liquide céphalorachidien sont des facteurs prédictifs de conversion clinique vers une sclérose en plaques qui survient dans un tiers des cas à 5 ans.Diagnostic
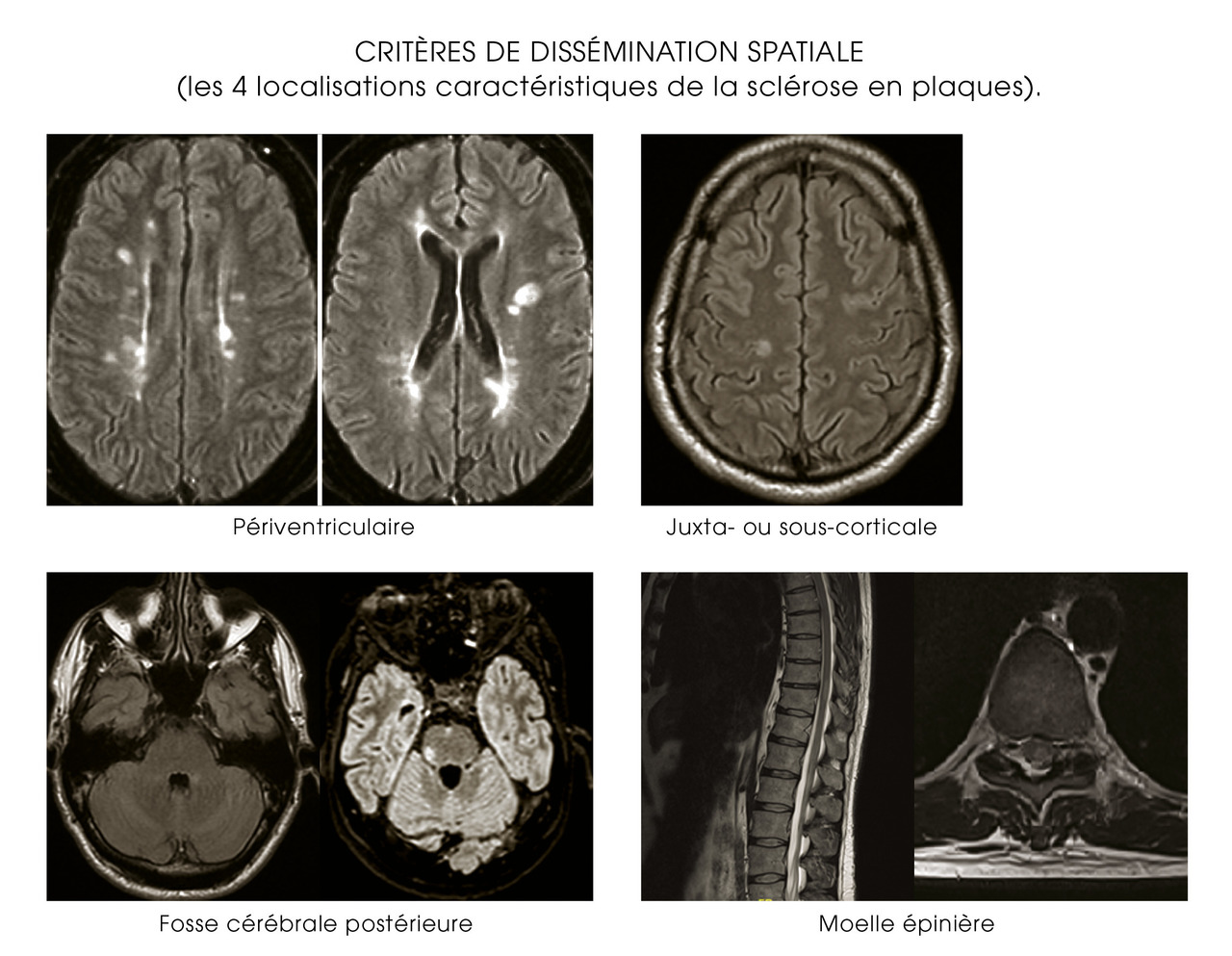
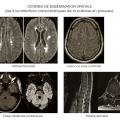
La dissémination spatiale des lésions est prouvée par la mise en évidence d’une atteinte de plusieurs zones du système nerveux central, soit à l’anamnèse ou à l’examen clinique, soit à l’IRM.
La dissémination temporelle des lésions se définit comme la succession d’épisodes neurologiques au sein du système nerveux central dans le temps, elle peut être démontrée à l’interrogatoire, à l’examen clinique ou grâce à l’IRM par la mise en évidence de façon contemporaine de lésions se rehaussant par le gadolinium (signant une souffrance du système nerveux central récente) et d’autres pas. La survenue d’une nouvelle lésion IRM sur un nouvel examen permet d’obtenir aussi ce critère de dissémination temporelle. Enfin, plusieurs études ont montré que chez un patient avec premier épisode démyélinisant, la présence de bandes oligoclonales dans la ponction lombaire était un facteur prédictif indépendant de survenue de deuxième épisode démyélinisant. Ainsi, la ponction lombaire peut suppléer l’absence de critère de dissémination temporelle si elle révèle des bandes oligoclonales pour établir le diagnostic positif.
Cette quête de la dissémination spatiale et temporelle est clinique mais aussi obtenue avec l’IRM. Le diagnostic de sclérose en plaques peut donc être établi devant la survenue de deux poussées mais, en cas de poussée unique, le critère de dissémination temporo-spatiale peut être obtenu par l’IRM.
Critères de McDonald (2017)
La dissémination temporelle est prouvée par l’apparition d’une lésion en T2 quel que soit le délai par rapport à l’IRM initiale ou par la présence sur l’IRM initiale à la fois de lésions se rehaussant par le gadolinium (signant une lésion récente) et de lésions ne se rehaussant pas (
Si ces critères de dissémination temporelle et spatiale ne sont pas respectés, il sera nécessaire d’attendre la survenue d’une deuxième poussée clinique ou la dissémination temporo-spatiale à l’IRM pour affirmer le diagnostic de sclérose en plaques.
Les critères diagnostiques des formes d’emblée progressives de sclérose en plaques imposent une année de progression de la maladie et 2 des 3 critères suivants : preuve d’une dissémination spatiale encéphalique : au moins une lésion en T2 dans au moins une zone caractéristique (périventriculaire, juxtacorticale, infratentorielle) et/ou de dissémination spatiale dans la moelle épinière : au moins deux lésions en T2 dans la moelle épinière et/ou un liquide cérébrospinal (LCS) positif (bandes oligoclonales ou indice d’IgG élevé).
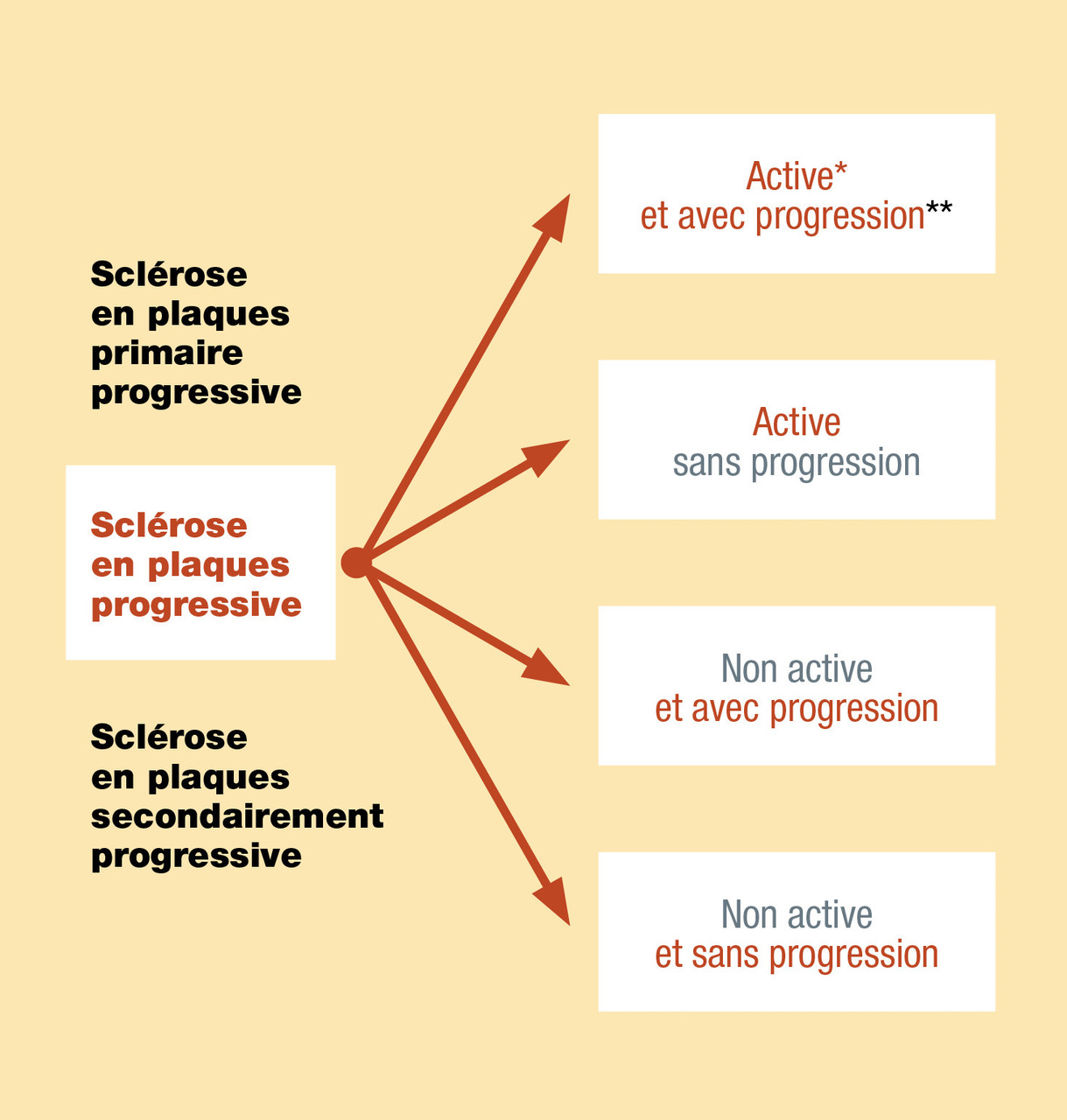
Il convient de préciser pour les patients atteints de sclérose en plaques progressive, qu’elle soit primaire progressive ou qu’elle soit secondairement progressive, la notion d’activité (clinique et/ou radiologique) et de progression (
Examens complémentaires
Bilan biologique
Il n’existe aucun test biologique spécifique pour le diagnostic de sclérose en plaques. Il n’y a pas de syndrome inflammatoire dans le sang dans la sclérose en plaques. Un bilan biologique sanguin minimal est réalisé afin d’écarter les diagnostics différentiels : numération formule sanguine, plaquettes, recherche d’un syndrome inflammatoire biologique. En fonction de ce dernier, des sérologies pourront être demandées (sérologie de Lyme, sérologie du VIH et syphilis…) ou des maladies auto-immunes à tropisme neurologique seront recherchées (lupus, syndrome de Gougerot-Sjögren…).Analyse du liquide cérébrospinal par ponction lombaire
Elle n’est pas obligatoire pour le diagnostic, elle est maintenant surtout utile pour éliminer les diagnostics différentiels de la sclérose en plaques. Elle est rarement normale. Dans un tiers des cas, la cytologie révèle une pléiocytose supérieure à 5 éléments blancs par mm3, mais inférieure à 50 éléments, constituée de lymphocytes ou de lymphoplasmocytes activés. L’analyse du liquide peut permettre de démontrer le caractère inflammatoire du système nerveux central. Une hyperprotéinorachie inférieure à 1 g/L est retrouvée dans 25 % des cas. Une sécrétion intrathécale d’IgG peut être démontrée quantitativement par l’indice de Link (> 0,70) [rapport des IgG liquide cérébrospinal/sang sur rapport albumine sang/liquide cérébrospinal]. Cette sécrétion intrathécale d’IgG est répartie en bandes oligoclonales mise en évidence par immunofixation ou iso-électrofocalisation du liquide cérébrospinal (90 % des scléroses en plaques). Leur présence peut permettre d’aider au diagnostic positif dans les situations de syndrome clinique isolé lorsque la dissémination temporelle n’est pas acquise. La mise en évidence de bandes oligoclonales est utile aussi pour le diagnostic des formes progressives.Potentiels évoqués
Les potentiels évoqués visuels, sensitifs, moteurs, auditifs n’ont plus lieu d’être dans le diagnostic de la sclérose en plaques.Diagnostics différentiels
Si certains signes sont typiques de la sclérose en plaques (ophtalmoplégie internucléaire, signe de Lhermitte, névrite optique), d’autres doivent être considérés comme des « drapeaux rouges » et faire envisager d’autres diagnostics (hémianopsie latérale homonyme, disparition des réflexes ostéotendineux, céphalées, aphasie, surdité, syndrome extrapyramidal, cécité bilatérale) [
La survenue de névrites optiques récupérant mal ou d’emblée bilatérales et/ou la survenue de tableau médullaire avec à l’IRM médullaire un hypersignal dépassant 3 corps vertébraux de hauteur et transverse doivent faire rechercher une neuro-optico-myélite (à anticorps anti-AqP4 ou anticorps anti-MOG).
Enfin, la présence d’un syndrome inflammatoire biologique doit orienter vers d’autres pathologies (lupus, sarcoïdose, maladie de Behçet, syndrome de Gougerot-Sjögren, vascularite cérébrale).
Les diagnostics différentiels des formes progressives correspondant à des myélopathies chroniques comprennent notamment les processus médullaires compressifs dont les myélopathies cervico-arthrosiques, et la maladie de Biermer.
Principes thérapeutiques
Traitement des poussées
Le traitement des poussées est habituellement bien toléré, avec parfois survenue de bouffées de chaleur, d’excitation psychomotrice, d’insomnie, de dysgueusie, d’asthénie, de troubles métaboliques (hyperglycémie, hypokaliémie). Afin de prévenir les complications graves (psychose aiguë, saignement digestif, arythmie, choc anaphylactique, septicémie), les premières perfusions sont réalisées le plus souvent en milieu hospitalier sur deux à trois heures avec régime désodé et pauvre en glucides ; les perfusions suivantes peuvent se faire à domicile. Avant la cure, toute infection évolutive doit être écartée. Un bilan ionique (kaliémie, glycémie), un électrocardiogramme, une numération formule sanguine avec protéine C réactive doivent être réalisés.
Traitement de fond
Dès la première poussée clinique avec preuve d’une dissémination spatiale et temporelle, des traitements immunomodulateurs peuvent être prescrits. Ces traitements comprennent les interférons bêta (IFN) : Avonex 30 µg (IFN bêta-1a) une injection par semaine en intramusculaire ; Plegridy 125 µg (IFN bêta-1a) une injection sous-cutanée tous les 14 jours ; Betaferon 8 MUI (IFN bêta-1b) une injection sous-cutanée un jour sur deux ; Extavia (IFN bêta-1b) une injection sous-cutanée un jour sur deux ; Rebif 22 ou 44 µg (IFN bêta-1a) une injection sous-cutanée trois fois par semaine, et l’acétate de glatiramère (Copaxone 20 mg une injection sous-cutanée par jour ou Copaxone 40 mg trois fois par semaine en sous-cutané).
Les IFN bêta peuvent occasionner des irritations et parfois des nécroses cutanées, des syndromes pseudogrippaux à leur initiation, prévenus par la prise de paracétamol et/ou d’anti-inflammatoires non stéroïdiens (AINS) avant leur administration et par une titration (augmentation progressive de la dose). Les IFN peuvent induire rarement des anémies, des leucopénies et/ou thrombopénies, des dysthyroïdies, des augmentations des enzymes hépatiques, le plus souvent transitoires et non sévères. Ces effets secondaires potentiels imposent une surveillance biologique (numération formule sanguine, plaquettes, transaminases). Ces effets secondaires tendent à diminuer avec le temps.
L’acétate de glatiramère ne nécessite aucune surveillance biologique, il peut induire des épisodes d’oppression thoracique bénins chez moins de 3 % des patients, sa tolérance aux sites d’injection n’est pas toujours bonne, avec la survenue d’induration. En termes d’efficacité, ces traitements immunomodulateurs réduisent la fréquence des poussées en moyenne de 30 à 40 % avec une efficacité limitée sur la progression du handicap. Une grossesse peut être débutée sous immunomodulateur.
Deux traitements oraux immunosuppresseurs ont eu une autorisation de mise sur le marché en 2014 : le diméthylfumarate (Tecfidera) et tériflunomide (Aubagio).
Le diméthylfumarate a une action anti-inflammatoire et antioxydante. La prise se fait en deux fois par jour à 240 mg. Il peut occasionner des troubles digestifs, des flushs, des cytolyses hépatiques, et surtout des lymphopénies. Quelques cas de leuco-encéphalopathie multifocale progressive ont été rapportés chez des patients avec lymphopénie profonde. Le diméthylfumarate doit être stoppé un cycle avant l’arrêt de la contraception orale en cas de désir de grossesse. Le diméthylfumarate réduit en moyenne de 49 % le risque de poussée.
Le tériflunomide inhibe la réplication des lymphocytes. Le tériflunomide 14 mg se prend une fois par jour. Il peut provoquer de la diarrhée, une diminution de la densité capillaire lors de l’instauration, des cytolyses hépatiques nécessitant une surveillance biologique régulière. Il peut favoriser les infections virales et bactériennes. Il est contre-indiqué en cas de désir de grossesse et nécessite, compte tenu de sa demi-vie très longue, une procédure d’élimination avant de pouvoir envisager une grossesse. Le tériflunomide réduit de 30 % en moyenne la fréquence des poussées.
Après échec de ces traitements de première ligne ou lors de forme de sclérose en plaques d’emblée sévère, un traitement immunosuppresseur peut être indiqué.
L’ocrélizumab (Ocrevus) est un anticorps anti-CD20 humanisé qui détruit les lymphocytes B, il s’administre en perfusions semestrielles. Il réduit de 45 % la fréquence des poussées par rapport à l’interféron pris comme traitement de référence. Ocrevus augmente le risque d’infections virales et bactériennes. L’ocrélizumab est indiqué pour les formes actives de sclérose en plaques récurrentes en termes de poussées ou d’IRM.
Le natalizumab (Tysabri), anticorps monoclonal humanisé, bloque l’entrée des lymphocytes activés dans le système nerveux central. Tysabri s’administre en perfusion mensuelle et expose à des risques de leuco-encéphalopathie multifocale progressive temps-dépendant chez les patients ayant une sérologie virus JC positive surtout s’ils ont reçu des immunosuppresseurs avant.
Le fingolimod (Gilenya) séquestre les lymphocytes dans les organes lymphoïdes périphériques. Gilenya est un traitement per os (1 gélule de 0,5 mg quotidienne) qui nécessite une surveillance cardiaque à son introduction du fait d’un risque de bradycardie et de bloc auriculoventriculaire, une surveillance biologique compte tenu de la lymphopénie induite et ophtalmologique du fait d’un risque d’œdème maculaire les premiers mois. Un risque d’infection virale sévère existe.
Tysabri réduit la fréquence des poussées de 68 % à 3 ans et le risque de progression du handicap de 42 % à 2 ans. Gilenya réduit de 50 % le risque de poussée et celui du handicap de façon significative.
La mitoxantrone (anthracycline) est réservée aux formes agressives de sclérose en plaques définies soit par la survenue de 2 poussées avec séquelles et/ou la progression du handicap au cours des 12 derniers mois avec une IRM active. Elle s’administre en perfusion mensuelle pendant six mois compte tenu de la toxicité cardiaque cumulée. La mitoxantrone comporte également un risque de leucémie (2 cas pour 1 000). Du fait de ses effets secondaires, elle nécessite une surveillance cardiaque par échographie (avant traitement, à trois et six mois, puis annuelle pendant 5 ans) ainsi qu’une surveillance de la numération formule sanguine mensuelle pendant six mois, puis trimestrielle pendant 5 ans.
Concernant les formes progressives de sclérose en plaques, de l’interféron bêta-1b (Betaferon) peut être prescrit en cas de poussées surajoutées, sinon des immunosuppresseurs (mycophénolate de mofétil, cyclophosphamide, méthotrexate…) sont parfois utilisés sans preuve certaine d’efficacité.
Traitements symptomatiques
La rééducation doit être pluridisciplinaire, adaptée à chaque patient afin de ne pas le fatiguer. Son objectif est triple : préserver l’indépendance de la marche, la verticalisation et les activités quotidiennes, prévenir et traiter certaines complications (spasticité, troubles vésico-sphinctériens, escarres), adapter l’environnement du patient par un ergothérapeute et une assistante sociale. Des appareillages orthopédiques (attelles, canne…) peuvent être proposés. La cryothérapie (bain en eau froide, vêtements réfrigérants) peut améliorer les symptômes.
Prise en charge de la spasticité
Avant d’avoir recours à des traitements, il est important d’écarter toute épine irritative (fécalome, infection urinaire, escarre, ongle incarné, plaie…). Les traitements utilisés sont le baclofène (Lioresal), le dantrolène (Dantrium), les benzodiazépines (clonazépam [Rivotril], diazépam [Valium], tétrazépam [Myolastan]). Les spasmes moteurs douloureux peuvent être atténués par l’utilisation d’antiépileptiques. Le recours à des injections de toxine botulique peut être utile pour des spasticités localisées. Enfin, l’implantation de pompes à baclofène intrathécale ou la réalisation de neurotomie peuvent être envisagées pour les spasticités sévères et rebelles aux précédents traitements.Suivi psychiatrique et/ou psychologique
Ce suivi peut être utile après l’annonce du diagnostic, en cas de dépression et d’anxiété.Prise en charge des troubles vésicosphinctériens
L’hyperactivité vésicale source d’impériosités mictionnelles, de fuites, de pollakiurie nécessite d’éliminer l’existence d’épines irritatives. La prescription d’anticholinergiques (oxybutynine [Ditropan, Driptane], de trospium [Ceris]) peut l’améliorer. Ces traitements nécessitent une surveillance du résidu post-mictionnel. L’injection de toxine botulique dans le détrusor peut également être envisagée chez les patients avec autosondages pour éviter les fuites.La dysurie et la rétention urinaire secondaires à l’hypertonie du sphincter lisse de l’urètre peuvent être améliorées par les alphabloquants (alfuzosine [Xatral], tamsulosine [Omix, Josir]) et les percussions sus-pubiennes. Le recours à des autosondages, voire à des dérivations urinaires (exemple : Bricker), peut s’avérer nécessaire.
Les infections urinaires doivent être traitées si elles sont symptomatiques.
La constipation est fréquente et doit être prévenue par l’utilisation de laxatifs et de mesures diététiques.
L’incontinence anale peut être améliorée par une évacuation rectale quotidienne (lavements, suppositoires de type Eductyl).
Les troubles génitaux chez l’homme à type de troubles de l’érection sont améliorés par la prescription de traitements per os (sildénafil [Viagra], vardénafil [Levitra], tadalafil [Cialis]) ou intracaverneux. Chez la femme, les traitements ont pour but de diminuer les douleurs, les troubles de la sensibilité, la sécheresse vaginale.
Prise en charge symptomatique de la fatigue
Il s’agit d’un symptôme très fréquent. Ses causes sont multiples. Les traitements proposés sont l’amantadine (Mantadix) ou les antidépresseurs en cas de troubles dépressifs associés, sans preuve significative d’efficacité.Prise en charge des douleurs et manifestations paroxystiques
Les manifestations paroxystiques douloureuses (signe de Lhermitte, névralgie du trijumeau, crises motrices paroxystiques) sont améliorées par les antiépileptiques (carbamazépine, gabapentine, clonazépam). Les névralgies du trijumeau rebelles aux traitements médicamenteux peuvent nécessiter une thermocoagulation du ganglion de Gasser. Les dysesthésies et paresthésies peuvent être atténuées par la gabapentine, le clonazépam, les antidépresseurs tricycliques.Prise en charge des troubles cognitifs
Il n’existe pas de traitement spécifique des troubles cognitifs. Les traitements visant à améliorer les symptômes pouvant influer sur la mémoire (asthénie, troubles de l’humeur, anxiété, dette de sommeil) sont parfois prescrits. Des séances de rééducation cognitive peuvent être proposées.Autres
La sclérose en plaques est une pathologie du système nerveux central prise en charge à 100 % (affection de longue durée : ALD 25) pour laquelle des réseaux de prise en charge médico-sociaux, des centres de ressources et de compétences existent ainsi que des associations de malades.POINTS FORTS À RETENIR
La sclérose en plaques (SEP) touche 1 Français sur 1 000, 3 femmes pour 1 homme, avec un début entre 20 et 40 ans.
C’est une maladie auto-immune inflammatoire démyélinisante du système nerveux central.
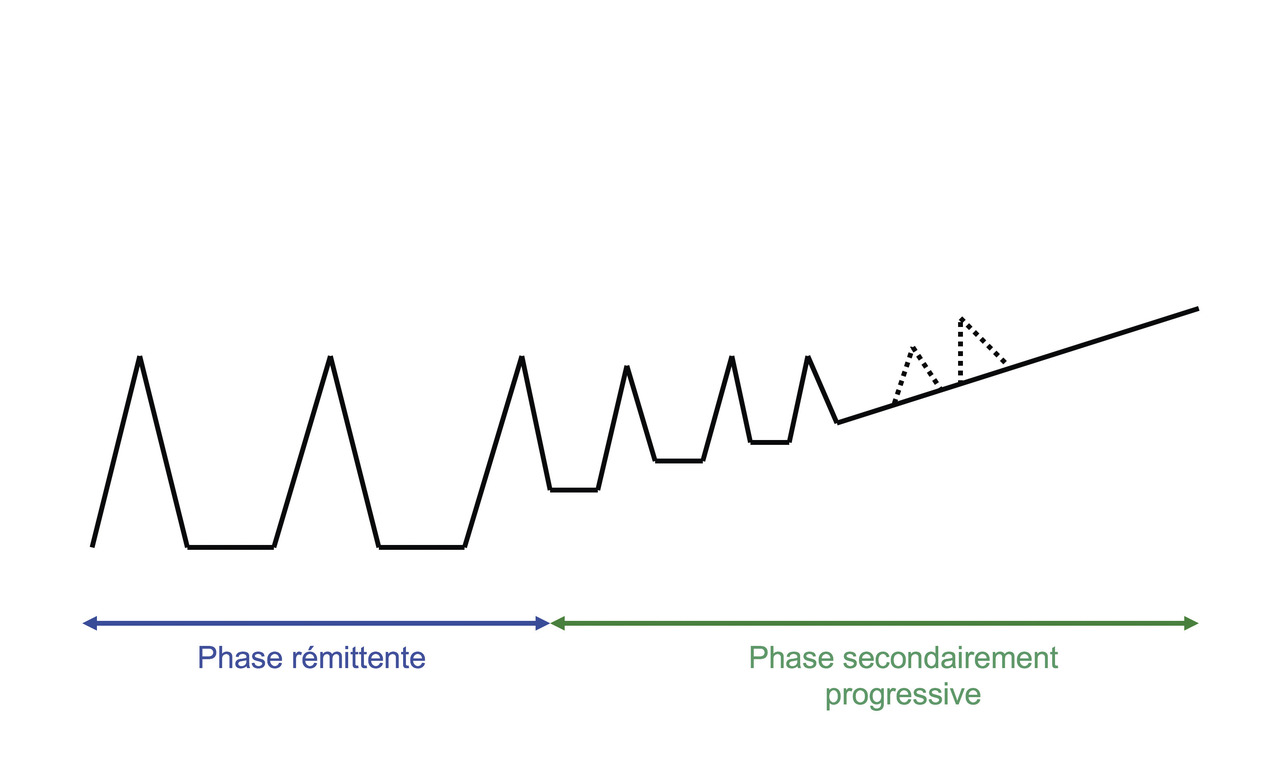
Elle débute par des « poussées » soit visuelles, motrices, sensitives dans 85 % des cas. Elle devient secondaire progressive une fois sur deux après 15 ans.
La sclérose en plaques est progressive d’emblée dans 15 % des cas, surtout si après 40 ans.
Le diagnostic de sclérose en plaques est fondé sur une dissémination dans l’espace et dans le temps de l’atteinte du système nerveux central par la clinique et/ou l’imagerie par résonance magnétique.
La prise en charge thérapeutique comprend le traitement de la poussée (corticoïdes), de fond pour réduire la fréquence des poussées et atténuer la progression du handicap et symptomatique (lutte contre la spasticité, la fatigue, les troubles urinaires, la dépression).
Ce qu’il faut savoir
1 La prédominance féminine.
2 La névrite optique rétrobulbaire comme présentation clinique révélatrice.
3 Le risque de handicap à long terme.
4 La notion de dissémination « temporo-spatiale » du processus lésionnel clinique ou IRM au sein du système nerveux central.
5 Les résultats de l’analyse du liquide céphalorachidien.
6 Les définitions de poussées, formes rémittentes et progressives, primaires ou secondaires.
7 Les principes de disséminations spatiale (localisation) et temporelle (prise du gadolinium, renouvellement de l’IRM, bandes oligoclonales à la ponction lombaire).
8 Le traitement des poussées avec les glucocorticoïdes.
9 Les principes thérapeutiques de fond : immunomodulateurs (interférons, acétate de glatiramère) versus immunosuppresseurs.
⑩ L’importance des traitements symptomatiques (contre la spasticité, la dépression, les troubles génito-sphinctériens).
Sclérose en plaques
La sclérose en plaques est la question phare des dossiers de neurologie car elle fait appel aux connaissances sémiologiques, au raisonnement diagnostique et à une prise en charge très standardisée. De plus, cette maladie handicapante ouvre sur les difficultés médico-sociales du handicap.
Une jeune femme bijoutière fait une névrite optique isolée avec séquelle à l’imagerie par résonance magnétique (IRM) encéphalique avec un seul hypersignal T2 FLAIR du corps calleux. Puis, deux ans après, un syndrome de Brown-Séquard TH5 gauche ; l’IRM répond aux critères de dissémination temporo-spatiale de McDonald.
Les questions s’orienteront vers la démarche diagnostique, la stratégie thérapeutique (traitement de première ligne) et l’aptitude à son travail.
Un patient de 30 ans présente une paraparésie progressive sur quelques jours avec impossibilité de tenir debout, des troubles sensitifs, sans atteinte des membres supérieurs ni de l’extrémité céphalique. L’examen clinique révèle des troubles sphinctériens, une ophtalmoplégie internucléaire et une baisse d’acuité visuelle de l’œil droit existant depuis 3 ans.
Des questions portant sur les causes de paraplégie du sujet jeune seront posées : syndrome de Guillain-Barré, compression médullaire, syndrome de la queue de cheval. Puis la démarche diagnostique vers la sclérose en plaques sera précisée. Enfin, les principes thérapeutiques de fond et symptomatiques seront demandés, en particulier les principes de prise en charge en rééducation.

 Encadrés
Encadrés