En dépit de mécanismes auto-immuns incontestés impliqués dans la physiopathologie de la maladie, la sclérose en plaques est de plus en plus considérée comme une pathologie neurodégénérative.
Sur le plan clinique, la composante auto-immune se traduit par la survenue de poussées. Sur le plan paraclinique, il s’agit de l’apparition de nouvelles lésions de la substance blanche en imagerie par résonance magnétique (IRM) conventionnelle. Un contrôle optimal de cette composante auto-immune ne prévient cependant pas totalement l’apparition d’une phase progressive lente de la maladie, et certaines formes progressives sont quasiment exemptes de poussées cliniques.
Mécanismes de neurodégénérescence : quatre cibles pour limiter la progression
Les mécanismes physiopathologiques responsables de la progression sont dorénavant mieux connus ; leur exploration a principalement reposé sur des investigations pathologiques post-mortem, sur des études en imagerie avancée et, à un moindre degré, sur l’extrapolation de résultats expérimentaux obtenus dans des modèles animaux. Quatre catégories de mécanismes sont ainsi actuellement incriminées dans la progression de la sclérose en plaques.
Atteinte diffuse, débordant des plaques de la substance blanche
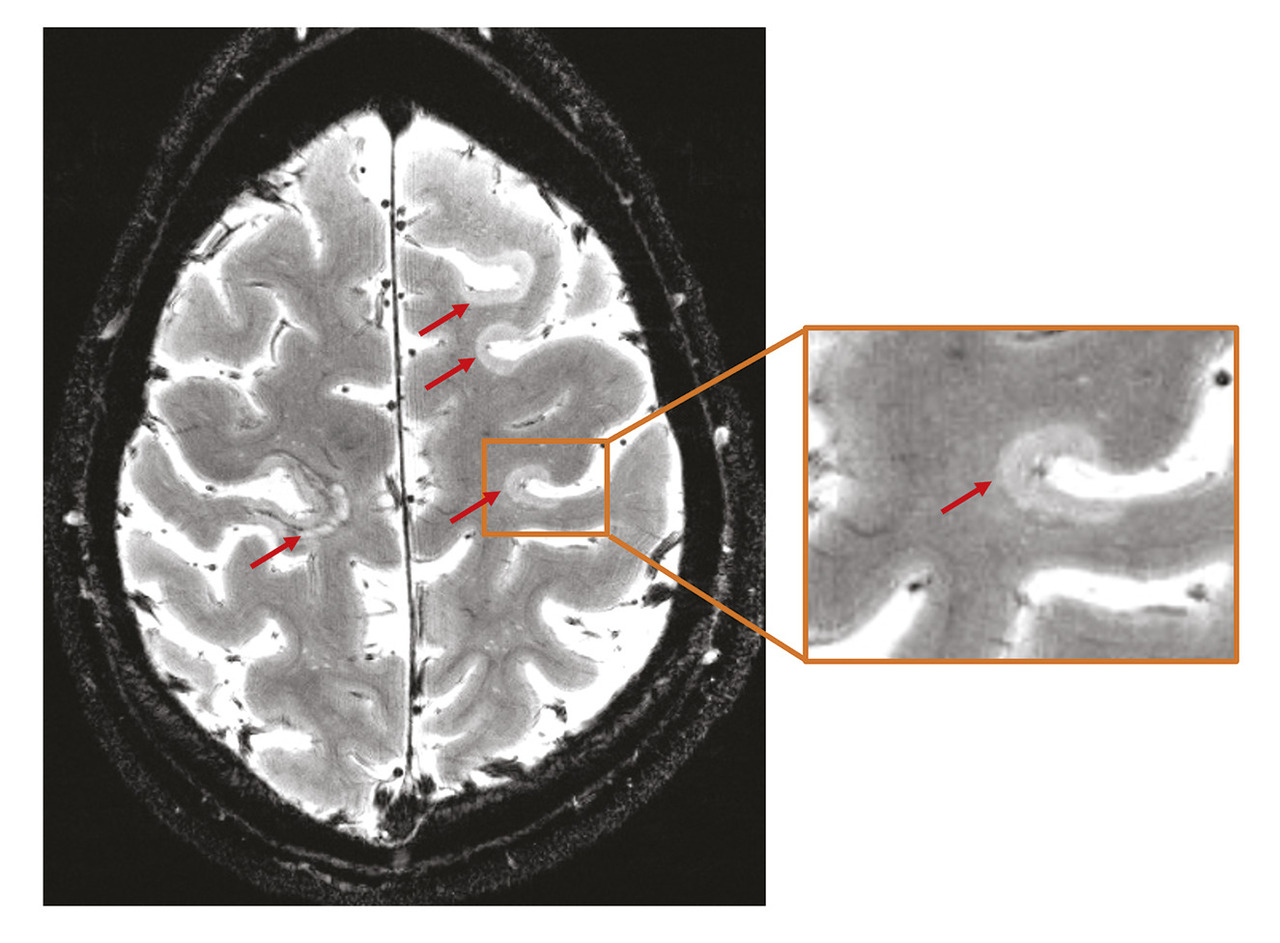
Au-delà de la substance blanche, il a dorénavant été largement démontré que la substance grise, en particulier le cortex, est aussi le siège de lésions démyélinisantes, parfois très étendues. Celles-ci peuvent se situer à la jonction de la substance blanche et du cortex, être focales dans le cortex ou étendues dans les couches corticales superficielles, en contact avec les espaces méningés. Impliquées dans l’apparition de troubles cognitifs et la progression du handicap, ces lésions sont très mal visualisées en IRM clinique de routine, mais peuvent être détectées en IRM à haut champ (IRM 7 Tesla*) [
Une inflammation extracérébrale méningée a aussi été mise en évidence dans les formes progressives, parfois organisée en formations lymphoïdes tertiaires (« follicules lymphoïdes ») où prédominent des lymphocyte B. Cette inflammation méningée est associée à une mort neuronale des couches externes du cortex ; les patients présentant des follicules lymphoïdes méningés ont une forme plus sévère de la maladie et un âge de décès plus précoce.
Composante neuro-inflammatoire persistante dans les lésions et au-delà
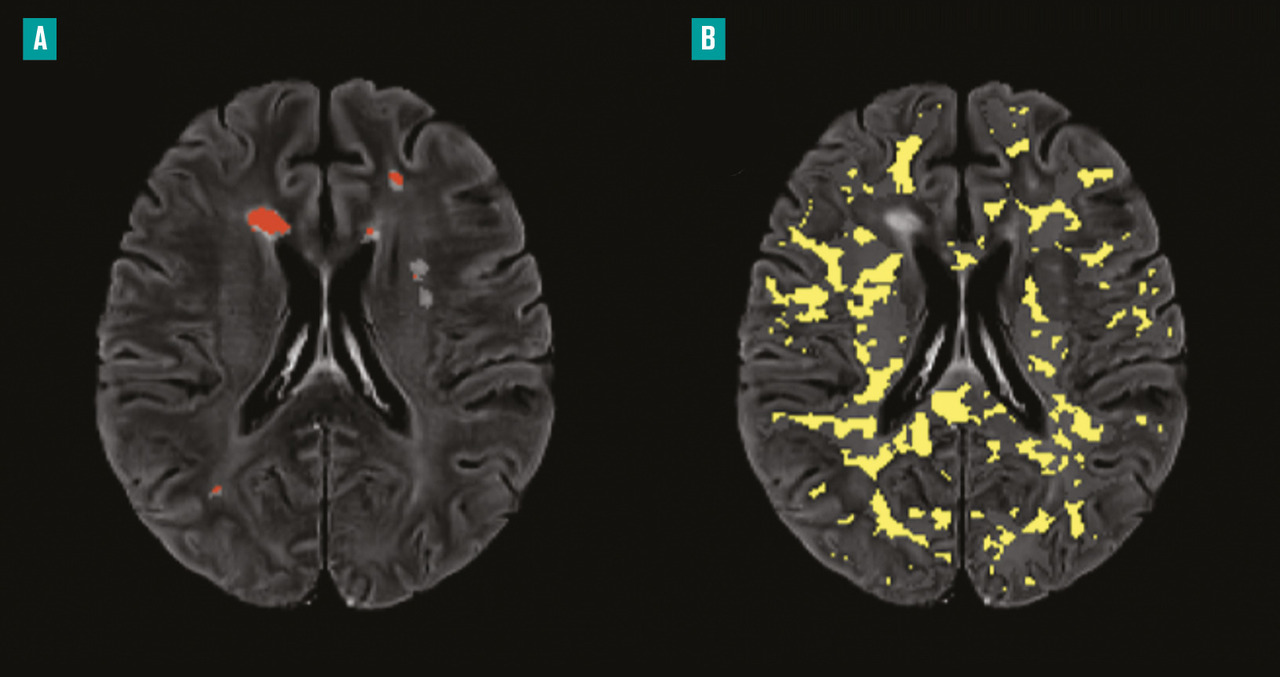
Il est aujourd’hui bien établi que certaines lésions de sclérose en plaques ont une évolution très chronique (sur plusieurs années), avec persistance d’une composante inflammatoire impliquant les cellules immunitaires innées du système nerveux central (les cellules microgliales). Ces lésions chroniques actives (aussi appelées smouldering, ou dites « en expansion lente ») sont souvent caractérisées par une accumulation de microglies activées chargées en fer à leur périphérie, responsable d’une démyélinisation et d’une dégénérescence axonale lente. Leur nombre est associé à une évolution clinique péjorative, et à une plus grande probabilité de développer une forme progressive.
Insuffisance de remyélinisation contribuant à la vulnérabilité de l’axone
La réparation myélinique est un processus régénératif efficace du système nerveux central adulte ; il permet de restaurer les gaines de myéline détruites (remyélinisation). Ce processus se rapproche de la myélinisation adaptative de l’adulte par ses mécanismes ; il permet d’adapter le niveau de myélinisation des axones à leur demande fonctionnelle. Dans les modèles animaux, cette remyélinisation est très efficace, le plus souvent complète, et implique majoritairement des cellules spécialisées (précurseurs d’oligodendrocytes). La réparation myélinique est indispensable à la restauration d’une vitesse de conduction rapide de l’influx nerveux car elle permet une conduction saltatoire rapide des axones, d’un nœud de Ranvier au suivant. Elle permet par ailleurs de protéger le neurone et son axone des agressions extérieures (rôle neuroprotecteur) et de supplémenter les neurones en métabolites énergétiques (rôle métabolique).
Dans la sclérose en plaques, la remyélinisation est le plus souvent insuffisante ou inefficace : seules 20 % des lésions y sont correctement réparées.1 Les raisons biologiques de cette défaillance sont imparfaitement connues : un environnement pro-inflammatoire exerçant un effet inhibiteur sur la différenciation des cellules remyélinisantes est vraisemblablement impliqué,2 ainsi qu’un déficit des signaux axonaux nécessaires à la réparation, non libérés par l’axone démyélinisé et non actifs électriquement.3 Cette insuffisance de remyélinisation tient un rôle-clé dans la neurodégénérescence au cours de la maladie.
Des processus neuronaux intrinsèques de dégénérescence
Plusieurs mécanismes intrinsèquement neuronaux contribuent également à la composante dégénérative de la maladie : désorganisation des microdomaines des membranes axonales (nœuds de Ranvier, canaux ioniques) conduisant à une accumulation de calcium intracellulaire, dérégulation énergétique avec déficit de support trophique glial, atteinte mitochondriale, stress oxydatif avec accumulation de radicaux libres, mécanismes excito-toxiques liés à l’excès de glutamate.
Les thérapeutiques de demain auront pour but de cibler ces mécanismes de neurodégénérescence et justifieront la mise en place de biomarqueurs, en particulier d’imagerie, capables de mesurer ces processus pathologiques en temps réel et in vivo dans les essais cliniques.4
Méthodes d’imagerie pour évaluer ces mécanismes
Une étape nécessaire pour le développement de nouveaux traitements ciblant l’intégrité myélinique et neuronale sera donc la validation de nouveaux biomarqueurs d’imagerie évaluant la remyélinisation au sein des lésions de la substance blanche, l’inflammation chronique, et l’atteinte neuronale.
IRM et TEP combinées pour évaluer la remyélinisation ?
Diverses approches par IRM ont été proposées pour la quantification de la myéline in vivo : imagerie par transfert d’aimantation, imagerie de la fraction aqueuse de myéline, cartographie quantitative de la susceptibilité et méthodes fondées sur l’IRM de diffusion.5 Toutes ces techniques ont montré une corrélation comparable avec le contenu histologique en myéline, même si de grandes variations ont été observées selon les études. Il est à noter que les biais potentiellement induits par d’autres composants pathologiques (en particulier, la neuro-inflammation) n’ont pas été rapportés. Au total, et malgré une spécificité imparfaite pour la myéline, les études utilisant ces métriques IRM chez les patients atteints d’une sclérose en plaques ont révélé des changements séquentiels au sein des lésions actives reflétant la démyélinisation, puis une remyélinisation se faisant en parallèle de la résolution de l’inflammation.6
Notre équipe a initié des études cliniques utilisant la tomographie par émission de positons (TEP) pour mesurer les changements de contenu myélinique dans les lésions cérébrales des patients, reflétant les processus dynamiques de démyélinisation et de remyélinisation. À cette fin, des radiotraceurs appartenant aux classes chimiques des dérivés du stilbène et du benzothiazole ont été repositionnés pour l’imagerie myélinique en TEP.7, 8 Une étude longitudinale a ainsi évalué des patients atteints d’une forme active de SEP à l’aide d’une TEP dynamique au 11C-PiB (traceur amyloïde ayant un lien spécifique avec la myéline) ; elle a démontré que les profils individuels de remyélinisation étaient très hétérogènes selon les patients et les lésions, et significativement corrélés à l’atrophie cérébrale et au handicap neurologique.8, 9 Devant ces résultats encourageants, une approche multimodale, combinant les mesures d’IRM sensibles à la myéline et la TEP aux traceurs la ciblant, semble être la plus prometteuse pour évaluer l’efficacité des nouveaux traitements remyélinisants dans le contexte de futurs essais cliniques.
Mesurer l’inflammation chronique : trois techniques d’imagerie novatrices
Plusieurs approches d’imagerie ont été proposées pour mesurer in vivo différents aspects de l’inflammation chronique chez les patients atteints de sclérose en plaques.
IRM post-contraste T2-FLAIR
L’IRM post-contraste T2-FLAIR a montré un rehaussement de contraste focal dans le compartiment leptoméningé, correspondant à la localisation d’infiltrats lymphocytaires et mononucléaires identifiés en neuropathologie. Ces rehaussements sont retrouvés avec une fréquence plus élevée chez les patients atteints de SEP secondairement progressive par rapport à ceux ayant une forme rémittente ; ils sont corrélés à l’épaisseur corticale locale.10 Cependant, la spécificité de ces rehaussements de contraste focaux dans le compartiment leptoméningé pour la SEP reste à démontrer.
IRM fondée sur la susceptibilité magnétique
L’IRM fondée sur la susceptibilité magnétique permet, quant à elle, de détecter des lésions avec un noyau démyélinisé et un anneau périphérique de contraste différent, traduisant l’accumulation de fer par des macrophages et/ou des cellules microgliales. Ces constats sont compatibles avec les lésions au stade actif chronique.11 Ces lésions entourées par un anneau paramagnétique ont été retrouvées surtout chez les patients atteints de formes progressives et particulièrement sévères de la maladie.12, 13 Cependant, les résultats obtenus à partir d’études IRM fondées sur la susceptibilité magnétique doivent être interprétés avec prudence en raison du manque relatif de spécificité de cette technique pour la microglie et les macrophages.
Performances prometteuses de la TEP aux traceurs TSPO
La TEP peut être utilisée avec des traceurs ciblant la protéine translocatrice TSPO, marqueur de la membrane mitochondriale externe dont l’expression est associée à la densité de macrophages et de microglies activés dans la SEP.14 Une augmentation de l’expression de la TSPO est observée à l’intérieur des lésions, dans les zones périlésionnelles et dans les matières blanche et grise d’apparence normale chez les patients atteints de SEP, par rapport aux témoins sains, à toutes les phases de la maladie.15 De plus, la TEP aux traceurs TSPO permet de mesurer l’activation des cellules immunitaires innées au niveau de la substance blanche d’apparence normale (
Améliorer les techniques pour détecter l’atteinte neuronale à ses phases précoces
Les techniques IRM les plus utilisées pour mesurer l’atteinte neuronale sont certainement celles visant la mesure des volumes cérébral (global mais aussi de la substance grise corticale et profonde, d’une part, et de la substance blanche, d’autre part) et médullaire. Les corrélations sont claires entre les mesures d’atrophie et le handicap clinique ; la valeur pronostique de ces métriques d’imagerie est forte sur l’évolution clinique. Les mesures IRM de l’atrophie ont donc été proposées comme approche complémentaire à l’évaluation des lésions, pour faciliter la prédiction des résultats cliniques et pour évaluer les réponses aux différents traitements de fond lors des essais cliniques.18 La limite la plus importante de ces mesures d’atrophie est qu’elles n’évaluent que l’étape finale de l’atteinte neuronale, c’est-à-dire la perte de tissu cérébral.
D’autres techniques d’imagerie visant l’atteinte neuronale dans ses phases plus précoces pourraient être utilisées dans les essais cliniques pour évaluer l’efficacité de nouveaux traitements neuroprotecteurs. Plusieurs techniques d’imagerie IRM ont ainsi été proposées, avec une grande variabilité de sensibilité et de spécificité : mesure du N-acétyl-aspartate en spectroscopie, imagerie de diffusion avancée et IRM au sodium.19 La TEP avec des radiotraceurs ciblant les neurones pourrait aussi contribuer au développement de nouveaux biomarqueurs de l’intégrité neuronale ; une étude TEP utilisant le flumazénil comme radiotraceur neuronal, a montré une réduction significative de ce traceur (reflétant une atteinte neuronale précoce) dans la substance grise superficielle et profonde des patients progressifs et rémittents ; ces constats étaient significativement corrélés aux performances cognitives.20 Grâce au développement de nouveaux traceurs ciblant les mitochondries et les vésicules synaptiques, la TEP pourra également être utilisée prochainement pour évaluer les changements métaboliques et structurels constituant les premiers signes d’atteinte neuro-axonale dans la SEP.21
Perspectives et essais thérapeutiques pour le futur proche
En dehors des traitements symptomatiques (douleurs, spasticité…), les traitements spécifiques actuellement disponibles (immunomodulateurs ou immunosuppresseurs) ciblent les mécanismes inflammatoires aigus de la sclérose en plaques. Il est désormais bien établi que dans les formes rémittentes, un traitement précoce et adapté à l’activité de la maladie diminue le risque d’apparition d’un handicap neurologique à long terme. Il existe cependant d’importants besoins thérapeutiques, actuellement non couverts, pour prévenir les séquelles neurologiques liées à l’accumulation des poussées, et surtout l’aggravation lente et insidieuse du handicap dans les formes progressives.
Grâce à une meilleure connaissance des mécanismes responsables de l’apparition d’un handicap irréversible, il est possible d’envisager plusieurs leviers pour favoriser la préservation de l’intégrité neuronale et myélinique : remyélinisation, neuroprotection, prise en charge de l’inflammation chronique. D’autres stratégies fondées sur l’immunotolérance pourraient également apporter un bénéfice en prévention de la SEP, ou comme traitement chez les patients ayant déjà débuté la maladie.
Remyélinisation : différentes voies thérapeutiques possibles
Diverses molécules, la stimulation neuronale et la greffe de cellules souches ont été étudiées dans la remyélinisation. Certains résultats sont prometteurs.
Voie pharmacologique : poursuivre la recherche
Concernant la remyélinisation, plusieurs essais cliniques ont évalué des molécules candidates identifiées par différentes méthodes de screening : l’opicinumab inhibe la protéine membranaire Lingo-1 exprimée sur les précurseurs d’oligodendrocytes (cellules en charge de la remyélinisation), favorisant leur maturation. Trois études de phase II ont été menées, dans la SEP rémittente ou chez les patients avec neuropathie optique chronique, mais leurs résultats ont été négatifs.22
Deux autres voies pharmacologiques ont été évaluées lors d’essais cliniques :
– la clémastine, antihistaminique utilisé de façon courante dans plusieurs pays, a des propriétés d’inhibition des récepteurs muscariniques, favorisant la maturation des oligodendrocytes. Un premier essai clinique réalisé par l’équipe de San Francisco a montré une amélioration de la latence de l’onde P100 lors de l’enregistrement des potentiels évoqués visuels chez des patients avec névrite optique chronique.23 Un nouvel essai avec la clémastine est en cours chez les patients présentant une névrite optique aiguë ;
– plus récemment, un essai clinique a évalué l’efficacité sur la remyélinisation du bexarotène, un agoniste des récepteurs gamma de l’acide rétinoïque dont l’activation est associée in vitro à la maturation des précurseurs d’oligodendrocytes. Dans cette étude, l’effet sur la remyélinisation était évalué en IRM (ratio du transfert d’aimantation ou MTR) au sein des lésions de démyélinisation. Le traitement n’a pas été efficace sur ce critère d’imagerie et a occasionné des effets indésirables thyroïdiens.24 Cependant, il a été observé une amélioration des latences de l’onde P100 au cours du suivi sur un sous-groupe de patients, suggérant un potentiel effet sur la conduction nerveuse. Bien que ce produit ne puisse pas être utilisé dans le futur en raison de ses effets indésirables, ces résultats encouragent le développement de nouvelles molécules ciblant la voie de l’acide rétinoïque.
Des données attendues en 2024 pour la stimulation neuronale
Au-delà des voies pharmacologiques identifiées pour la remyélinisation, il a été démontré que l’activité électrique neuronale est indispensable pour favoriser la remyélinisation.3 Or, même lorsque l’axone reste fonctionnel, l’activité électrique des neurones est diminuée lors d’un épisode aigu de démyélinisation. Nous avons donc mis en place une étude évaluant l’efficacité sur la remyélinisation de la stimulation neuronale effectuée à l’aide d’un stimulateur adapté pour le nerf optique (à travers l’orbite). Les résultats de cette étude, menée chez des patients ayant présenté un épisode aigu de névrite optique, devraient être connus d’ici à 2024.
Remyélinisation exogène : ne pas se limiter au nerf optique
Les stratégies de remyélinisation exogène, par transplantation de cellules souches, encore expérimentales dans des modèles précliniques, se heurtent à plusieurs difficultés : quelle lignée de cellules souches utiliser (par exemple progéniteur d’oligodendrocyte, ou cellules souches pluripotentes induites) ? Quel accès au site lésionnel est-il possible ?
La plupart des études ciblent le nerf optique, qui est atteint chez 50 % des patients environ, de façon aiguë ou chronique. L’évaluation de la conduction du signal nerveux à travers les voies optiques est accessible grâce aux potentiels évoqués visuels ; la neurodégénérescence des fibres du nerf optique peut être quantifiée grâce à la tomographie par cohérence optique (OCT). Cependant, la démyélinisation et remyélinisation du nerf optique au cours de la SEP ne reflète que partiellement le degré de myélinisation sur l’ensemble du système nerveux. Il semble important de travailler désormais sur des schémas d’essais cliniques évaluant le potentiel de réparation tissulaire dans d’autres compartiments (par exemple, la moelle épinière ou le cervelet, dont les études histologiques ont montré une moindre remyélinisation).
Études de phase III attendues pour le repositionnement de molécules en neuroprotection
La neuroprotection est en partie liée à la remyélinisation. Cependant, plusieurs études, dont les résultats ont malheureusement été négatifs, ont évalué le repositionnement de molécules ayant des propriétés de neuroprotection dans les modèles précliniques : la lamotrigine, le riluzole, l’amiloride et la fluoxétine. Ces trois dernières molécules ont en outre été évaluées lors d’une étude de phase II incluant 445 patients.25 L’ibudilast, molécule agissant comme inhibiteur du monoxyde d’azote (NO) et ayant des effets neuroprotecteurs, a montré une efficacité pour diminuer la perte de volume cérébral chez des patients avec une SEP secondairement progressive lors d’une étude de phase II,26 mais pour le moment, il n’y a pas encore d’étude de phase III dans la SEP.
Des molécules à l’essai contre la neuro-inflammation dans les formes progressives
La neuro-inflammation (notamment médiée par la microglie) est un mécanisme difficile à évaluer spécifiquement. Elle n’est donc quasiment jamais étudiée lors des essais cliniques pour le moment. Cependant, le développement de l’imagerie en TEP devrait permettre d’évaluer les effets sur la neuro-inflammation des thérapeutiques déjà disponibles, au-delà de la visualisation simple des lésions et de la rupture de la barrière hémato-encéphalique.
En 2021, plusieurs essais cliniques de phase III ont débuté avec une nouvelle classe de molécules pouvant potentiellement agir sur les cellules immunitaires résidentes du système nerveux : les inhibiteurs de tyrosine kinase de Bruton (BTKi). Ces molécules agissent sur une kinase qui régule des voies de signalisation au niveau des lymphocytes B, mais aussi des macrophages, diminuant le relargage de cytokine pro-inflammatoires, et modifiant la polarisation des macrophages vers un profil prorégénératif plutôt que pro-inflammatoire. Elles sont capables de franchir la barrière hémato-encéphalique et pourraient donc agir directement sur les cellules microgliales ou sur l’inflammation méningée. Leur efficacité chez les patients avec SEP rémittente a été démontrée lors de deux études de phase II (évobrutinib et tolébrutinib), diminuant significativement le risque de poussées. Des études de phase III ont débuté dans les formes primaires progressives et secondairement progressives. Elles seront déterminantes pour évaluer si l’effet sur les cellules microgliales ou l’inflammation méningée pourrait être bénéfique sur le ralentissement de la progression du handicap neurologique, qui s’accumule indépendamment des poussées. Leurs résultats pourraient être connus en 2025, les inclusions étant toujours en cours.
Des lendemains prometteurs
Les progrès en imagerie ont permis de mieux comprendre les mécanismes physiopathologiques en cause dans la sclérose en plaques, d’affiner et d’avancer le diagnostic à des stades de plus en plus précoces. De ces avancées dans la compréhension de la maladie découlent l’émergence de nouvelles voies thérapeutiques la possibilité d’en surveiller les effets, dans une dynamique translationnelle où recherche fondamentale et cliniciens se retrouvent. Il reste cependant à optimiser la méthodologie et à définir des critères d’évaluation pertinents pour une synergie efficace.
* NDLR : l’IRM 7 Tesla est une technique d’imagerie avancée dont la résolution spatiale améliorée permet d’étudier des structures de petite taille jusque-là inaccessibles et dont la meilleure résolution spectrale permet de quantifier de nouveaux métabolites. En mode fonctionnel, sa puissance accrue permet une intégration globale des multiples connexions temporospatiales sous-tendant l’activité cérébrale. Elle permet enfin de mesurer l’efficacité d’un traitement pharmacologique, favorisant ainsi des activités de recherche médicale translationnelle (à l’interface entre recherches fondamentale et clinique).
1. Patrikios P, Stadelmann C, Kutzelnigg A, RauchschkanH, Schmiddbauern M, Larsen H, et al. Remyelination is extensive in a subset of multiple sclerosis patients. Brain 2006;129:3165-72.
2. Hess K, Starost L, Kieran NW, Thomas C, Vinecenten MCJ, Antel J, et al. Lesion stage-dependent causes for impaired remyelination in MS. Acta Neuropathol 2020;140:359-75.
3. Lubetzki C, Zalc B, Williams A, Stadelmann C, Stankoff B. Remyelination in multiple sclerosis: from basic science to clinical translation. Lancet Neurol 2020;19:678-88.
4. Dangond F, Donnelly A, Hohlfeld R, Hohfeld,R, Lubetzki C, Kohlhaas S, Leocani L, et al. Facing the urgency of therapies for progressive MS - a Progressive MS Alliance proposal. Nat Rev Neurol 2021;17:185-92.
5. Lazari A, Lipp I. Can MRI measure myelin? Systematic review, qualitative assessment, and meta-analysis of studies validating microstructural imaging with myelin histology. Neuroimage 2021;230:117744.
6. Chen JT, Collins DL, Atkins HL, Freedman MS, Arnold DL;Canadian MSBMTSG. Magnetization transfer ratio evolution with demyelination and remyelination in multiple sclerosis lesions. Ann Neurol 2008;63:254-62.
7. Stankoff B, Freeman L, Aigrot MS, Aigrot MS, Chardain A, Dollé F, et al. Imaging central nervous system myelin by positron emission tomography in multiple sclerosis using [methyl-(1)(1)C]-2-(4’-methylaminophenyl)- 6-hydroxybenzothiazole. Ann Neurol 2011;69:673-80.
8. Bodini B, Veronese M, Garcia-Lorenzo D, Battaglini M, Poirion E, Chardain A, et al. Dynamic Imaging of Individual Remyelination Profiles in Multiple Sclerosis. Ann Neurol 2016;79:726-38.
9. Ricigliano VAG, Tonietto M, Hamzaoui M, Colombi A, Matteo T, Hazaoui M, et al. Spontaneous remyelination in lesions protects the integrity of surrounding tissues over time in multiple sclerosis. Eur J Neurol 2022.
10. Zurawski J, Tauhid S, Chu R, Khalid F, Healy BC, Weiner HL, et al. 7T MRI cerebral leptomeningeal enhancement is common in relapsing-remitting multiple sclerosis and is associated with cortical and thalamic lesions. Mult Scler 2020;26:177-87.
11. Dal-Bianco A, Grabner G, Kronnerwetter C, Weber M, Höftberger R, Berger T, et al. Slow expansion of multiple sclerosis iron rim lesions: pathology and 7 T magnetic resonance imaging. Acta Neuropathol 2017;133:25-42.
12. Absinta M, Sati P, Fechner A, Schindler MK, Nair G, Reich DS. Identification of Chronic Active multiple sclerosis lesions on 3T MRI. AJNR Am J Neuroradiol 2018;39:1233-8.
13. Absinta M, Sati P, Masuzzo F, air G, Sethi V, Kolb H, et al. Association of Chronic Active Multiple Sclerosis Lesions With Disability In Vivo. JAMA Neurol 2019;76:1474-83.
14. Nutma E, Stephenson JA, Gorter RP, de Bruin J, Boucherie DM, Donat CK, et al. A quantitative neuropathological assessment of translocator protein expression in multiple sclerosis. Brain 2019;142:3440-55.
15. Bodini B, Poirion E, Tonietto M, Benoit C, Palladino R, Maillart E, et al. Individual mapping of innate immune cell activation is a candidate marker of patient-specific trajectories of worsening disability in multiple sclerosis. J Nucl Med 2020;61:1043-9.
16. Sucksdorff M, Matilainen M, Tuisku J, Polvinen E, Vuorimaa A, Rokka J, et al. Brain TSPO-PET predicts later disease progression independent of relapses in multiple sclerosis. Brain 2020;143:3318-30.
17. Datta G, Colasanti A, Kalk N, Owen D, Scott G, Rabiner EA, et al. (11)C-PBR28 and (18)F-PBR111 Detect White Matter Inflammatory Heterogeneity in Multiple Sclerosis. J Nucl Med 2017;58:1477-82.
18. Sastre-Garriga J, Pareto D, Battaglini M, Rocca MA, Cicarelli O, Enzingzer C, et al.; MAGNIMS consensus recommendations on t he use of brain and spinal cord atrophy measures in clinical practice. Nat Rev Neurol 2020;16:171-82.
19. Oh J, Ontaneda D, Azevedo C, Klawiter EC, Absinrta M, Arnold DL, et al. Imaging outcome measures of neuroprotection and repair in MS: A consensus statement from NAIMS. Neurology 2019;92:519-33.
20. Freeman L, Garcia-Lorenzo D, Bottin L, Leroy C, Louarpe C, Bodini B, et al. The neuronal component of gray matter damage in multiple sclerosis: A [(11) C]flumazenil positron emission tomography study. Ann Neurol 2015;78:554-67.
21. Bodini B, Tonietto M, Airas L, Stankoff B. Positron emission tomography in multiple sclerosis - straight to the target. Nat Rev Neurol 2021;17:663-75.
22. Cadavid D, Mellion M, Hupperts R, Edwards KR, Calabresi PA, DruloviÉ J, et al. Safety and efficacy of opicinumab in patients with relapsing multiple sclerosis (SYNERGY): a randomised, placebo-controlled, phase 2 trial. Lancet Neurol 2019;18:845-56.
23. Green AJ, Gelfand JM, Cree BA, Bevan C, Boscardin W, Mei F, et al. Clemastine fumarate as a remyelinating therapy for multiple sclerosis (ReBUILD): a randomised, controlled, double-blind, crossover trial. Lancet 2017;390:2481-9.
24. Brown JWL, Cunniffe NG, Prados F, Kanber B, Jones JL, Needham E, et al. Safety and efficacy of bexarotene in patients with relapsing-remitting multiple sclerosis (CCMR One): a randomised, double-blind, placebo-controlled, parallel-group, phase 2a study. Lancet Neurol 2021;20:709-20.
25. Chataway J, De Angelis F, Connick P, et al. Efficacy of three neuroprotective drugs in secondary progressive multiple sclerosis (MS-SMART): a phase 2b, multiarm, double-blind, randomised placebo-controlled trial. Lancet Neurol 2020;19:214-25.
26. Fox RJ, Coffey CS, Conwit R, Cudkoxicz ME, Gleason T, Goodman A, et al. Phase 2 Trial of Ibudilast in Progressive Multiple Sclerosis. N Engl J Med 2018;379:846-55.