En mars, Catherine Hill et ses collaborateurs ont écrit pour nous une synthèse des résultats cliniques des différents vaccins contre le Covid. Compte tenu des nouvelles données disponibles – effets indésirables, efficacité contre les variants circulants, effet sur la transmission du virus par les personnes vaccinées –, ils nous livrent une nouvelle analyse à la fois complète et synthétique. Un document indispensable à avoir sous la main pour répondre aux questions de vos patients !
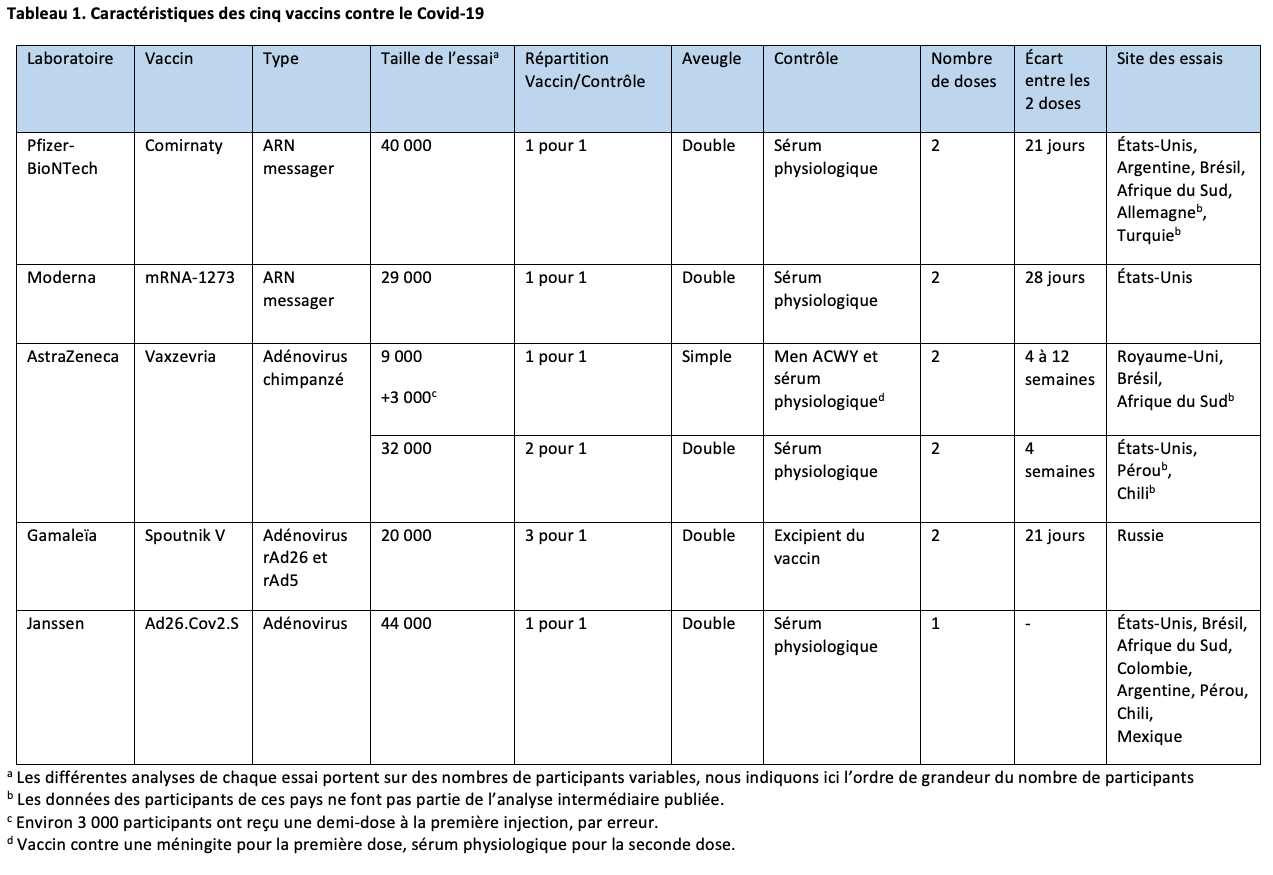
À ce jour, cinq vaccins ont été autorisés sur le territoire européen : les vaccins à ARN messager Comirnaty de Pfizer-BioNTech1 et mRNA1273 de Moderna2 et les vaccins à adénovirus Vaxzevria (ancien nom : ChAdOx1nCov-19) d’AstraZeneca,3 Ad26.COV2.S de Janssen4 et enfin Spoutnik V de Gamaleïa5 qui n’est pas autorisé en France.
Un résumé rapide des résultats des essais de phase III de ces premiers vaccins a été publié en mars dans La Revue du Praticien.6 Dans ce papier, nous allons dans un premier temps réactualiser les résultats de l’essai d’AstraZeneca et étudier le risque de thrombose associé à ce vaccin. Puis nous présenterons les différents variants du SARS-CoV-2, les résultats sur l’efficacité des vaccins contre ces variants et les données disponibles sur la réduction de la transmission du virus par les personnes vaccinées.
Attention ! L’efficacité d’un vaccin dépend du critère de jugement. Les essais sur ces vaccins ont en général pris comme critère principal le diagnostic de Covid-19 symptomatique confirmé par un test PCR. Si on prend en compte un critère différent, par exemple un Covid grave, c’est-à-dire nécessitant au moins une ventilation, on n’obtient pas la même mesure de l’efficacité.
Efficacité du vaccin d’AstraZeneca
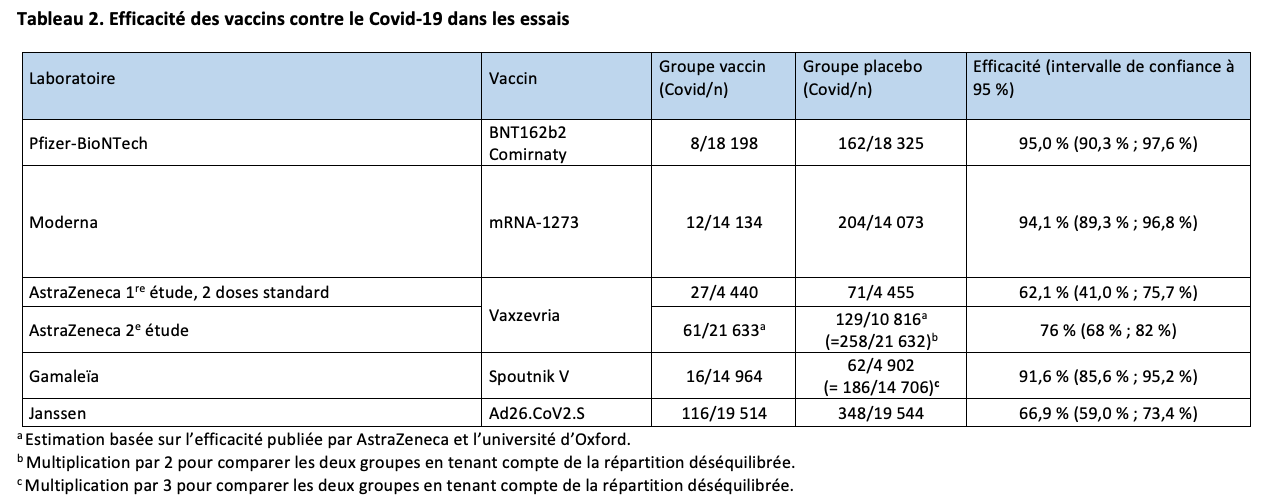
Un premier essai clinique, décrit dans notre premier article, a été conduit au Royaume-Uni, au Brésil et en Afrique du Sud. Des problèmes de dosage du produit actif ont conduit à administrer à une partie des participants une 1re dose qui était la moitié de la dose prévue. L’analyse des résultats montre une efficacité du vaccin de 62,1 % (intervalle de confiance [IC] à 95 % : 41,0 % ; 75,7 %) dans la population qui a reçu les deux doses standard.
Depuis, un 2e essai a été réalisé aux États-Unis, au Pérou et au Chili.7 Ses caractéristiques sont résumées dans les tableaux 1 et 2. Deux fois plus de participants ont reçu le vaccin par rapport au sérum physiologique. Comme dans le 1er essai, l’efficacité du vaccin a été évaluée en comptant le nombre de cas de Covid-19 symptomatiques survenant au-delà de 15 jours après la 2e dose et confirmés par un test PCR positif : avec ce critère, l’efficacité s’élève à 76 % (IC à 95 % : 68 % ; 82 %). Le vaccin protège à 100 % des cas graves de Covid-19 (8 cas dans le groupe placebo et 0 cas dans le groupe vacciné). Les résultats étaient comparables dans les différentes classes d’âge et 20 % des participants avaient 65 ans ou plus.
La synthèse des résultats des deux essais (avec les deux doses standard pour le 1er) donne une estimation globale de l’efficacité sur le risque de Covid-19 symptomatique de 69,0 % (IC à 95 % : 55,4 % ; 82,7 %).
Dans les deux études, aucun évènement grave n’a été rapporté et identifié comme lié au vaccin.
Surveillance post-AMM du vaccin d’AstraZeneca
Les syndromes pseudo grippaux ont été les premiers effets indésirables graves signalés au début de la campagne vaccinale, et ils sont fréquents. En cas de fièvre et/ou de douleurs, l’ANSM conseille de privilégier l’utilisation du paracétamol à la dose la plus faible et le moins longtemps possible.
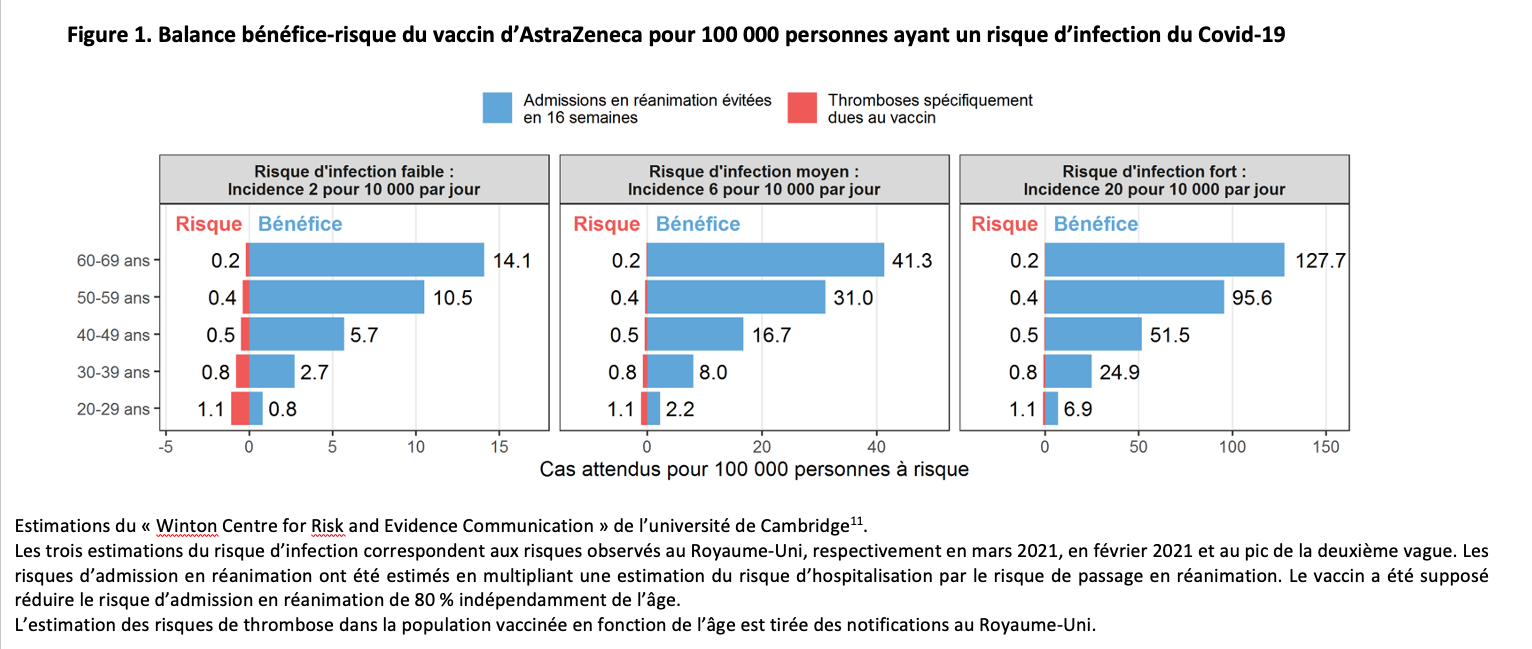
À la suite de la vaccination à grande échelle par le vaccin d’AstraZeneca en Europe, des cas de thromboses ont été rapportés chez des personnes récemment vaccinées. Ces thromboses sont particulières par leur siège, cérébral ou abdominal, et par leur association à des signes de coagulation intravasculaire disséminée, et en particulier à une thrombopénie. L’Agence européenne a compté 62 cas de thrombose veineuse cérébrale et 24 cas de thrombose veineuse splanchnique ayant conduit à 18 décès, observés jusqu’au 22 mars 2021, date où 25 millions de personnes avaient reçu au moins une dose de vaccin. Ces cas ont été signalés par les systèmes de surveillance de la Communauté européenne et du Royaume-Uni.8L’Agence européenne du médicament (EMA) estime la fréquence de signalement de ces thromboses à 1 pour 100 000, et a conclu que ces risques rares devaient être mentionnés sur la liste des effets secondaires du vaccin d’AstraZeneca. Ces effets semblent apparaître au plus tard 2 semaines après la vaccination.9,10
Le « Winton Centre for Risk and Evidence Communication » de l’université de Cambridge a estimé la balance bénéfice-risque en fonction de l’âge des personnes vaccinées et du risque d’infection11 (fig. 1). Cette balance est bien meilleure si le risque d’infection est élevé et si les personnes vaccinées sont âgées. Elle est mauvaise dans la population de 20 à 29 ans et varie, selon le risque d’infection, de 0,8 à 6,9 admissions en réanimation évitées par le vaccin pour 1,1 thrombose causée par le vaccin. Au contraire, la balance bénéfice-risque est bonne dans les autres classes d’âge et d’autant meilleure que la population est plus âgée.
En France, la HAS a recommandé de n’utiliser ce vaccin que chez les personnes de 55 ans ou plus. Les plus jeunes ayant déjà reçu une dose du vaccin d’AstraZeneca reçoivent une seconde dose d’un vaccin à ARN messager (Pfizer-BioNTech ou Moderna).12 Cette utilisation successive de deux vaccins différents n’a pas encore été évaluée.
Il est à noter que le vaccin de Janssen, basé sur la même technologie d’adénovirus inactivé que celui d’AstraZeneca, pourrait lui aussi provoquer de rares événements thrombotiques (8 cas de thrombose cérébrale ont été signalés, parmi plus de 7 millions de personnes vaccinées). Après une étude de pharmacovigilance, l’EMA a conclu qu’il existe un lien entre la formation de caillots de sang et ce vaccin. Elle considère que ces effets sont rares, que le rapport bénéfice-risque reste positif et recommande de continuer à l’utiliser.13
Surveillance post-AMM du vaccin de Pfizer-BioNTech
Dans notre premier article, nous avions mentionné l’observation de plusieurs cas de paralysie faciale après vaccination par le vaccin Comirnaty de Pfizer-BioNTech. Une étude récente, utilisant la base de données de pharmacovigilance de l’OMS, a comparé la proportion des paralysies faciales parmi les effets indésirables notifiés avec les vaccins à ARN à la proportion observée avec les vaccins contre d’autres virus.14 À la date du 9 mars 2021, on a dénombré 844 paralysies faciales (749 cas avec le vaccin de Pfizer-BioNTech et 95 avec celui de Moderna) parmi 133 883 effets indésirables relevés pour les vaccins à ARN messager (0,6 %), à comparer à 5 734 paralysies faciales notifiées pour 1 265 182 effets indésirables notifiés pour les vaccins contre d’autres virus (0,5 %). L’étude conclut donc qu’il n’existe pas de signal indiquant un risque augmenté de paralysie faciale avec ces deux vaccins à ARN.
De très rares cas de myocardites et de péricardites ont été signalés après vaccination contre le Covid-19, la plupart survenant chez des jeunes adultes après la deuxième dose de vaccin de Pfizer ou de Moderna.15 Ces effets indésirables doivent être signalés de façon à prendre le problème en charge rapidement en cas de douleur thoracique, ou essoufflement, ou sensation de battements de cœur rapides, de palpitations.
Les variants du Covid-19
Un virus se multiplie dans l’organisme qu’il infecte et cette prolifération peut s’accompagner de modifications génétiques, appelées mutations, donnant naissance à de nouveaux variants. Les variants sont répertoriés par l’OMS, les Centers for Disease Control (CDC) des États-Unis et l’European Center for Disease Control (ECDC).16-18 Ces organismes les classent en fonction de leur niveau de dangerosité globale en :
– variant à suivre (« variant of interest », VOI) : si les mutations modifient la transmission, le diagnostic et les traitements ou si une infection par une souche antérieure n’est pas protectrice ;
– variant préoccupant (« variant of concern », VOC) : si on observe une transmissibilité accrue, une maladie plus grave, un échec de certains tests diagnostiques, ou une diminution de l’efficacité des traitements ou des vaccins ;
– variant de haute conséquence (« variant of high consequence »), en cas de véritable échappement au diagnostic, au traitement ou au vaccin.
Pour l’instant, aucun variant n’est considéré comme « de haute conséquence » dans le monde, mais quatre variants sont considérés comme préoccupants selon l’OMS et l’ECDC :
– le variant alpha (anglais, B.1.1.7, 501Y.V1) a été découvert en septembre 2020 ; il est entre 43 % et 90 % plus contagieux que les souches préexistantes au Royaume-Uni ;19,20
– le variant bêta (sud-africain, B.1.351, 501Y.V2), identifié en octobre 2020, a été estimé comme étant 50 % plus transmissible que les souches préexistantes en Afrique du Sud ;21
– le variant gamma (brésilien, P.1, 501Y.V3), détecté pour la 1re fois en décembre 2020, est entre 40 % et 120 % plus transmissible que les souches préexistantes au Brésil,22 il est génétiquement proche du variant bêta ;
– le variant delta (indien, B.1.617.2), découvert en octobre 2020 en Inde, semblerait être plus contagieux que la souche originelle.
Le classement en variant préoccupant dépend de la prévalence locale du variant et peut donc différer selon la région. Par exemple, les CDC des États-Unis considèrent comme préoccupant le variant californien, pour l’instant absent en France, tandis que Santé publique France considère comme préoccupant un variant breton B.1.1.7 + E484K/Q, sur lequel nous n’avons que très peu d’information.
Ces variants ont des mutations au niveau de la protéine Spike, qui permet au virus de pénétrer dans les cellules humaines (via le récepteur ACE2) et qui représente la principale cible pour notre système immunitaire.23
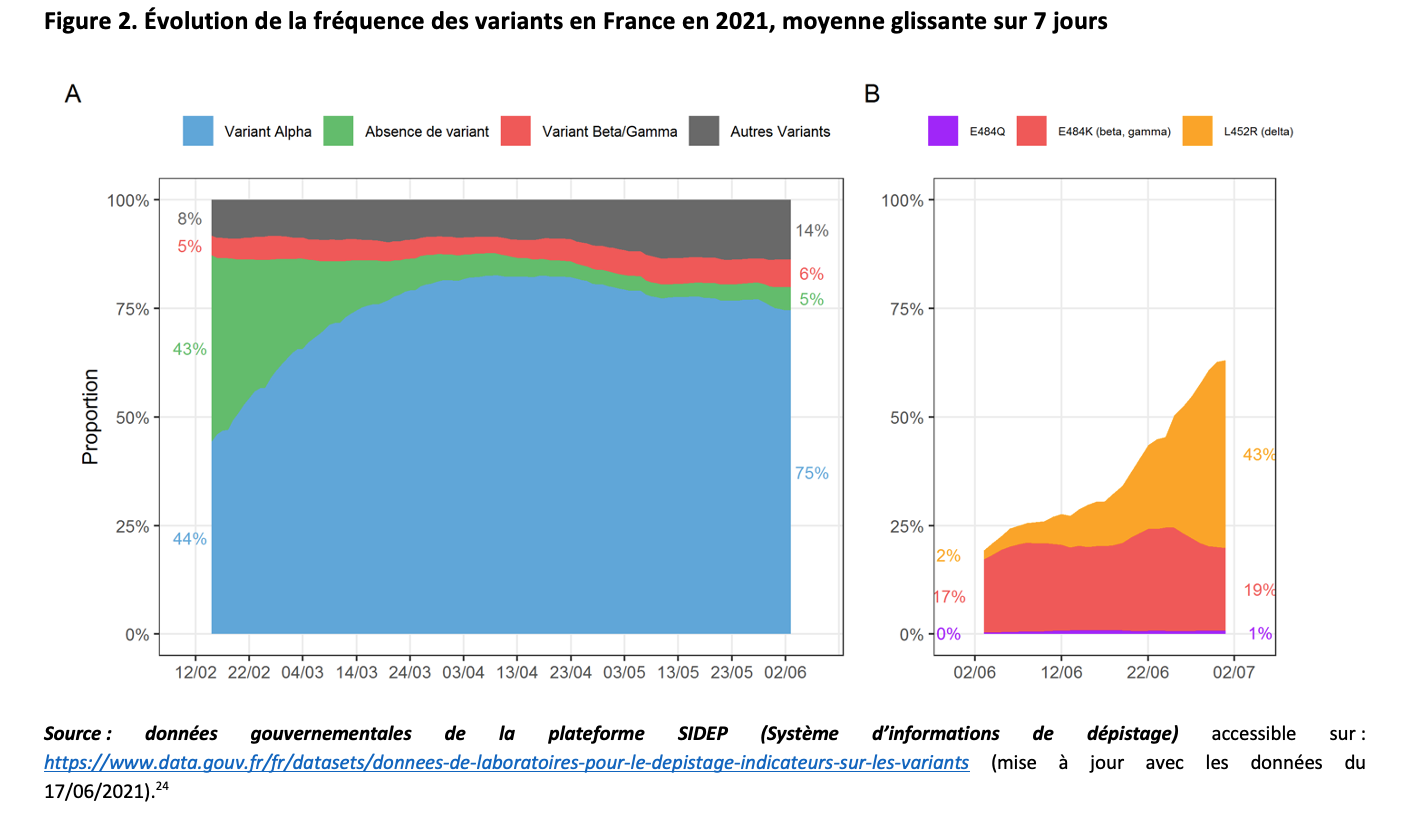
Pour surveiller la fréquence des variants en France, on dispose de deux sources :
– Les tests PCR de criblage, qui permettent de suspecter la présence de certains variants. Ces PCR de criblage ont été utilisées pour 51 % à 60 % des tests PCR positifs réalisés entre le 15 février et le 26 mai 2021. Cette proportion a diminué ensuite pour atteindre 28 % des tests PCR positifs réalisés entre le 31 mai et le 6 juin 2021.
– Le séquençage complet d’un petit nombre de prélèvements positifs réalisés un jour donné dans des laboratoires ayant choisi de participer aux « enquêtes Flash » de Santé publique France.
La figure 2A montre l’évolution de la fréquence des variants en France selon les tests PCR de criblage jusqu’au 6 juin (moyenne glissante sur 7 jours).24 Cette dernière semaine, la répartition des prélèvements positifs étudiés était la suivante : 75 % de variant alpha, 6 % de variants bêta + gamma, 14 % de variant indéterminé, 5 % de souche originelle. La figure 2B montre l’évolution de la fréquence des variants depuis le 3 juin avec le nouveau système de criblage qui identifie seulement trois mutations et montre 43,2 % de variant delta, 19,1 % de variants bêta + gamma, et 0,8 % de variant 20I/484K.
La dernière enquête Flash (#12), réalisée le 22 juin 2021, a porté sur 595 prélèvements25 et montré 48 % de variant alpha, 30,5 % de variant delta, 5,6 % de variant bêta, 3,6 % de variant breton 20I/484K et 0,4 % de variant gamma.
Efficacité des vaccins contre les variants
On dispose de peu de données sur l’efficacité des vaccins contre les variants in vitro ou in vivo.
In vitro, certaines études traitent de l’immunité à long terme liée aux lymphocytes26 mais la plupart porte sur des essais de neutralisation par les anticorps.27-29 Ces essais consistent à exposer du sérum de patient (sain, malade, guéri, vacciné…) aux différents variants, et à déduire (à partir de la réaction observée) la concentration en anticorps, spécifiques ou non contre chaque variant.
In vivo, des essais cliniques ont évalué l’efficacité des vaccins dans des populations particulièrement exposées à certains variants. Dans un essai au Royaume-Uni, le vaccin d’AstraZeneca avait une efficacité conservée contre le variant alpha, malgré une activité neutralisante réduite.30 En revanche, un essai sur 2 000 patients en Afrique du Sud montrait une efficacité de seulement 10,4 % (IC à 95 % : -76,8 % ; 54,8 %) de ce même vaccin contre le variant bêta.31
Une étude cas-témoin en Israël32 a comparé la distribution des variants alpha, bêta et virus sauvage chez des personnes contaminées après vaccination avec le vaccin de Pfizer-BioNTech et chez des personnes non vaccinées. Cette étude repose sur l’hypothèse que si un variant résiste à un vaccin, sa proportion sera plus élevée chez les sujets vaccinés que chez les non-vaccinés. Les résultats montrent plus de variant bêta – mais pas plus de variant alpha – chez les personnes vaccinées que chez les non vaccinées, ce qui est en phase avec les études de neutralisation29 montrant une réduction des anticorps pour le variant bêta mais pas pour alpha. Ces conclusions reposent cependant sur peu de cas.
Une étude cas-témoin au Qatar réalisée sur 265 410 participants a estimé que le vaccin de Pfizer-BioNTech avait une efficacité de 89,5 % (IC à 95 % : 85,9 % ; 92,3 %) contre le variant alpha et de 75,0 % (IC à 95 % : 70,5 % ; 78,9 %) contre le bêta.31
En résumé, l’efficacité des vaccins ne semble pas diminuée vis-à-vis du variant alpha, mais les autres variants pourraient être plus résistants. Les variants bêta et gamma se distinguent du variant alpha par deux mutations supplémentaires qui pourraient expliquer cette résistance accrue.20
Les premières études évaluant l’efficacité des vaccins contre le variant delta montrent une efficacité un peu diminuée mais qui reste largement suffisante.Les contaminations par ce variant surviennent essentiellement dans les populations non vaccinées et dans une moindre mesure chez les personnes n’ayant reçu qu’une première dose de vaccin.
Réduction de la transmission du virus par les personnes vaccinées
La transmission du virus par des individus infectés asymptomatiques contribue de manière significative à la pandémie en cours. On estime que plus de la moitié des transmissions se font à partir d'individus sans symptômes soit parce qu’ils ne seront jamais symptomatiques soit parce qu’ils sont présymptomatiques. C’est l’une des raisons pour lesquelles un dépistage massif (par exemple en utilisant des tests PCR sur prélèvements salivaires) serait nécessaire pour identifier et isoler les personnes asymptomatiques.
Les essais ont montré que les vaccins contre le Covid-19 protégeaient les personnes vaccinées d’une infection symptomatique. Depuis, la comparaison des risques d'infection par le SARS-CoV-2 aux États-Unis chez des personnes ayant reçu au moins une dose du vaccin de Pfizer-BioNTech et chez des personnes non vaccinées a montré une réduction du risque d’infection asymptomatique de 79 % (IC à 95 % : 63 % ; 88 %) plus de 10 jours après la vaccination.34,35 Pfizer a depuis confirmé ces résultats : d’après les données israéliennes, le vaccin aurait une efficacité de 94 % 2 semaines après la 2e dose.32Si les vaccins protègent efficacement des infections aussi bien symptomatiques qu’asymptomatiques, on peut supposer qu'ils réduisent aussi efficacement le risque de transmission du virus.
Études en cours et questions en suspens
Les laboratoires Pfizer-BioNTech, Moderna et Janssen ont commencé des essais cliniques sur des enfants âgés de 6 ans à 17 ans.36-38 L’université d’Oxford, qui avait débuté un essai du vaccin d’AstraZeneca sur les 6-17 ans, l’a suspendu à la suite des thromboses observées chez les adultes.39 Les résultats de l’essai de Pfizer-BioNTech ont conduit la Food and Drug Administration et l’EMA à autoriser la vaccination chez les 12-15 ans. Pfizer a annoncé que le vaccin, qui devait au départ être conservé entre -80 °C et -60 °C, pouvait être stocké pendant deux semaines entre -25 °C et -15 °C,40 ce qui facilite son utilisation.
En France, les effets de la vaccination commencent à être observés. Au 16 juin 2021, 87,9 % des résidents des Ehpad avaient reçu au moins une dose de vaccin, et 81,2 % les deux doses.41La mortalité de ces résidents a considérablement diminué passant de 200 décès par jour en novembre 2020 à 1 décès/j en juin 2021. En dehors des Ehpad, la mortalité diminue, mais on observe encore une cinquantaine de décès par jour en juin 2021.42
Il manque toutefois encore beaucoup d’information pour pouvoir conclure sur l’efficacité des vaccins sur tous les variants. De plus, tant qu’il y aura des personnes non vaccinées, le virus trouvera un hôte à infecter et continuera de muter. Une raison de plus pour renforcer la campagne de vaccination !
Nusaïbah Ibrahimi, Dan Chaltiel, Catherine Hill
Institut Gustave-Roussy, service de biostatistiques et d’épidémiologie.
Les auteurs déclarent n’avoir aucun lien d’intérêts.
1. Polack FP, Thomas SJ, Kitchin N, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med 2020;383(27):2603-15.
2. Baden LR, Sahly HME, Essink B, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med 2021;384(5):403-16.
3. Voysey M, Clemens SAC, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. The Lancet 2021;397(10269):99-111.
4. Janssen COVID-19 Vaccine EUA Fact Sheet for Healthcare Providers. FDA 23 avril 2021.
5. Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia.The Lancet 2021;397(10275):671-81.
6. Ibrahimi N, Chaltiel D, Hill C. Vaccins contre la Covid-19 disponibles en Europe.Rev Prat 2021;71(3):239-44.
7. Kemp A. AZD1222 US Phase III primary analysis confirms safety and efficacy. AstraZeneca 25 mars 2021.
8. AstraZeneca’s COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low platelets. European Medicines Agency 7 avril 2021.
9. Schultz NH, Sørvoll IH, Michelsen AE, et al. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. N Engl J Med 2021;384(22):2124-30.
10. Greinacher A, Thiele T, Warkentin TE, et al. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med 2021;384(22);2092-2101.
11. Communicating the potential benefits and harms of the Astra-Zeneca COVID-19 vaccine. University of Cambridge 7 avril 2021.
12. Covid-19 : quelle stratégie vaccinale pour les moins de 55 ans ayant déjà reçu une dose d’AstraZeneca ? Haute autorité de Santé 9 avril 2021.
13. COVID-19 Vaccine Janssen: assessment of very rare cases unusual blood clots with low platelets continues. European Medicines Agency 14 avril 2021.
14. Renoud L, Khouri C, Revol B, et al. Association of Facial Paralysis With mRNA COVID-19 Vaccines: A Disproportionality Analysis Using the World Health Organization Pharmacovigilance Database.JAMA Intern Med 2021;e212219.
15. Santé Canada met à jour les étiquettes des vaccins contre la COVID 19 de Pfizer BioNTech et de Moderna pour y inclure des renseignements sur la myocardite et la péricardite. Gouvernement du Canada 30 juin 2021.
16. Analyse de risque liée aux variants émergents de SARS-CoV-2 réalisée conjointement par le CNR des virus des infections respiratoires et Santé publique France. Santé publique France 21 avril 2021.
17. SARS-CoV-2 Variant Classifications and Definitions.CDC 6 juillet 2021.
18. SARS-CoV-2 variants of concern as of 1 July 2021.European Centre for Disease Prevention and Control 2 juillet 2021.
19. Davies NG, Abbott S, Barnard RC, et al. Estimated transmissibility and impact of SARS-CoV-2 lineage B.1.1.7 in England. medRxiv 5 mars 2021.
20. Karim SSA, de Oliveira T. New SARS-CoV-2 Variants – Clinical, Public Health, and Vaccine Implications. N Engl J Med 2021;384(19):1866-8.
21. Pearson CAB, Russel TW, Davies N, et al. Estimates of severity and transmissibility of novel SARS-CoV-2 variant 501Y.V2 in South Africa.CMMID Repository 11 janvier 2021.
22. Faria NR, Mellan TA, Whittaker C, et al. Genomics and epidemiology of the P.1 SARS-CoV-2 lineage in Manaus, Brazil.Science 2021;372(6544):815-21.
23. Korsia-Meffre S. Covid-19 : mutations, variants, lignées, N501Y, E484K… de quoi parle-t-on ? Vidal 18 février 2021.
24. Données de laboratoires pour le dépistage : indicateurs sur les variants (SI-DEP) (mise à jour avec les données du 17/06/2021).
25. COVID-19 : point épidémiologique du 10 juin 2021. Santé publique France 10 juin 2021.
26. Peng H, Yang LT, Wang LY, et al. Long-lived memory T lymphocyte responses against SARS coronavirus nucleocapsid protein in SARS-recovered patients.Virology 2006;351(2):466-75.
27. Betton M, Livrozet M, Planas D, et al. Sera neutralizing activities against SARS-CoV-2 and multiple variants six month after hospitalization for COVID-19.Clin Infect Dis 2021;ciab308.
28. Luchsinger LL, Ransegnola BP, Jin DK, et al. Serological Assays Estimate Highly Variable SARS-CoV-2 Neutralizing Antibody Activity in Recovered COVID-19 Patients. J Clin Microbiol 2020;58(12):e02005-20.
29. Liu Y, Liu J, Xia H, et al. Neutralizing Activity of BNT162b2-Elicited Serum. N Engl J Med 2021;384(15):1466-8.
30. Emary KRW, Golubchik T, Aley PK, et al. Efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine against SARS-CoV-2 variant of concern 202012/01 (B.1.1.7): an exploratory analysis of a randomised controlled trial. The Lancet 2021;397(10282):1351-62.
31. Madhi SA, Baillie V, Cutland CL, et al. Efficacy of the ChAdOx1 nCoV-19 Covid-19 Vaccine against the B.1.351 Variant.N Engl J Med 2021;384(20):1885-98.
32. Kustin T, Harel N, Finkel U, et al. Evidence for increased breakthrough rates of SARS-CoV-2 variants of concern in BNT162b2-mRNA-vaccinated individuals. Nat Med 14 juin 2021.
33. Abu-Raddad LJ, Chemaitelly H, Butt AA. Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants. N Engl J Med 2021;NEJMc2104974.
34. Real-World Evidence Confirms High Effectiveness of Pfizer-BioNTech COVID-19 Vaccine and Profound Public Health Impact of Vaccination One Year After Pandemic Declared. BusinessWire 11 mars 2021.
35. Tande AJ, Pollock BD, Shah ND, et al. Impact of the COVID-19 Vaccine on Asymptomatic Infection Among Patients Undergoing Pre-Procedural COVID-19 Molecular Screening. Clin Infect Dis 2021;ciab229.
36. Pfizer-BioNTech Announce Positive Topline Results of Pivotal COVID-19 Vaccine Study in Adolescents.BusinessWire 31 mars 2021.
37. Moderna Announces First Participants Dosed in Phase 2/3 Study of COVID-19 Vaccine Candidate in Pediatric Population. Moderna 16 mars 2021.
38. Johnson & Johnson Expands Phase 2a Clinical Trial of COVID-19 Vaccine Candidate to Include Adolescents. Johnson & Johnson 2 avril 2021.
39. Oxford University suspends AstraZeneca vaccine trial on children. Euronews 6 avril 2021.
40. Coronavirus (COVID-19) Update: FDA Allows More Flexible Storage, Transportation Conditions for Pfizer-BioNTech COVID-19 Vaccine. FDA News Release 25 février 2021.
41. Géodes : Géo données en santé publique. Santé publique France 6 juillet 2021. 42. Tableau de bord COVID-19. Santé publique France 18 juin 2021.


