Des troubles fréquents mais négligés en dépit de moyens thérapeutiques efficaces.
Les pathologies neurodégénératives dues à l’accumulation neuronale anormale d’une protéine naturelle, l’alpha-synucléine, sont la maladie de Parkinson (MP), l’atrophie multisystématisée (AMS) et la démence à corps de Lewy (DCL). De nombreux troubles du sommeil sont souvent au premier plan dans ces maladies : insomnie, syndrome d’apnées du sommeil (SAS), syndrome des jambes sans repos (SJSR), trouble du comportement en sommeil paradoxal (TCSP), hypersomnolence diurne d’origine centrale, altération du rythme circadien.
De plus, les douleurs nocturnes et le handicap moteur inhérents aux pathologies favorisent la fragmentation du sommeil. Les troubles de l’humeur, les épisodes dépressifs ou anxieux (comorbidités fréquentes) peuvent induire ou aggraver une insomnie.
Enfin, les médicaments d’action centrale interfèrent souvent avec l’organisation veille/sommeil.
Maladie de Parkinson
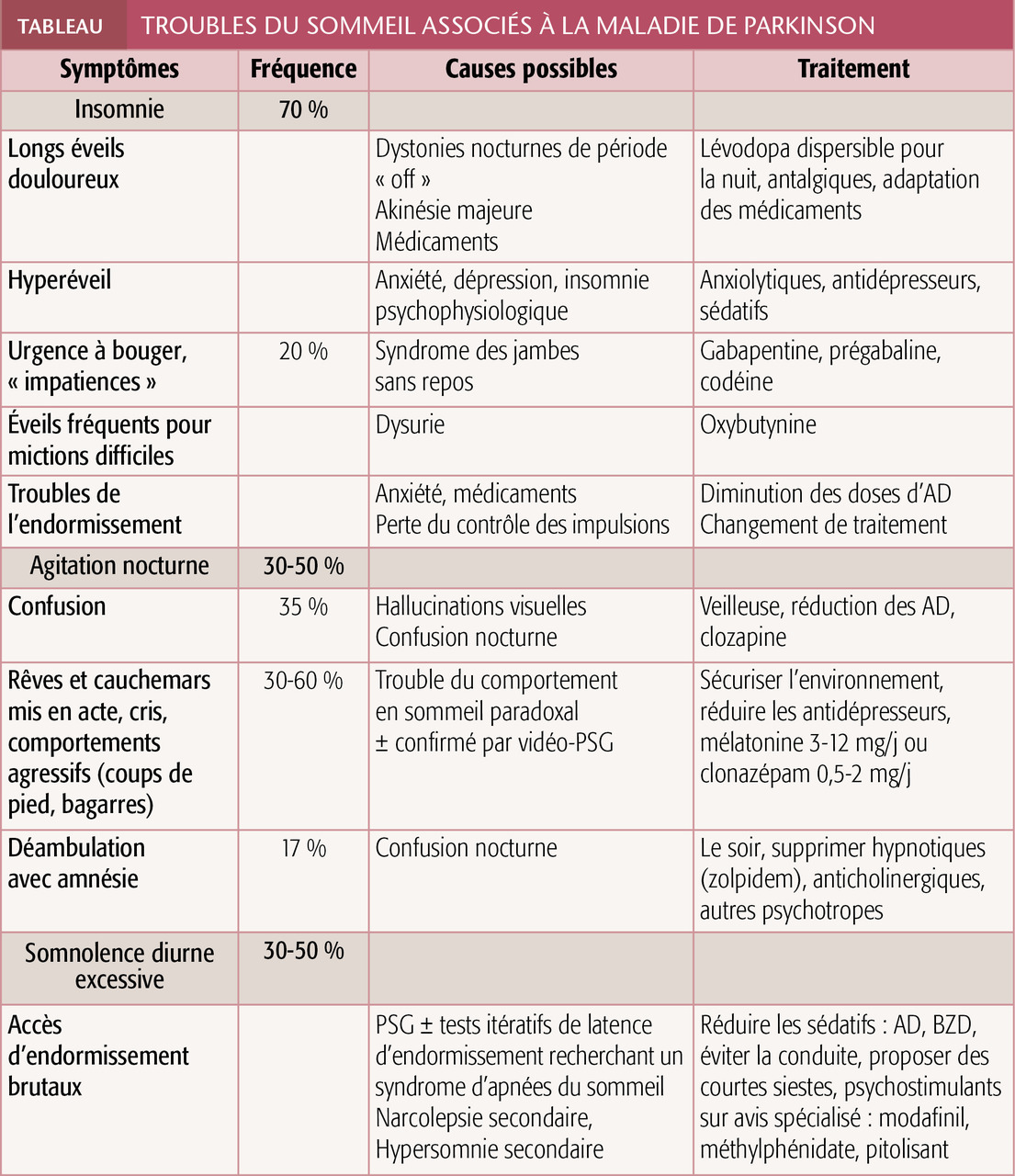
Quasiment tous les troubles du sommeil de la classification internationale (ICSD-3)2 se manifestent chez ces patients, presque toujours touchés (95 %), et sont à l’origine d’un handicap fonctionnel important.3 Les symptômes nocturnes et diurnes diffèrent par leurs mécanismes, donc par leurs traitements (tableau).
L’anamnèse détaillée implique le conjoint si possible. L’enregistrement polysomnographique (PSG) peut être utile surtout s’il y a somnolence ou agitation nocturne, beaucoup moins en cas d’insomnie.
Insomnie
Une majorité de parkinsoniens
(37 à 81 %) s’en plaint, soit une prévalence 3 fois supérieure à celle de la population du même âge. Le trouble est d’autant plus fréquent que la maladie est avancée.
Les difficultés d’endormissement
(20-30 %) sont fréquemment associées à une anxiété et aggravées par la prise de L-dopa, sélégiline ou amantadine, ou encore secondaires à un SJSR. Elles peuvent être exacerbées par un effet indésirable, rare mais classique, des agonistes dopaminergiques (AD) : le trouble du contrôle des impulsions (jeu pathologique, achat compulsif et hypersexualité nocturne).
Un défaut de maintien du sommeil (longs éveils nocturnes) ou un réveil précoce
sont encore plus fréquents (60 % des patients) et liés à plusieurs phénomènes : symptômes moteurs dus à des doses médicamenteuses souvent plus faibles (dystonies nocturnes de « off », akinésie majeure, tremblement), dysurie dysautonomique, dépression, coucher trop précoce, douleurs nocturnes.
La prise en charge peut faire appel à la TCC.
Les hypnotiques (particulièrement : zopiclone, zolpidem), utiles ponctuellement, ne sont pas recommandés au long cours. L’adaptation posologique nocturne du traitement dopaminergique peut se révéler bénéfique dans certains cas. La dysurie peut être minimisée par la prise d’oxybutinine (Ditropan, 2,5-5 mg) au coucher.
Comorbidité nocturne
Un ronflement, des éveils répétés pour uriner,
des sueurs nocturnes, des céphalées matinales, une hypersalivation la nuit ou une sensation de bouche sèche, justifient de rechercher et éventuellement traiter, un SAS. La ventilation à pression positive continue (PPC) n’est indiquée que dans les formes sévères. Bénéfique contre la somnolence diurne et la nycturie, elle peut aggraver l’insomnie.
Le besoin impératif d’agiter les jambes
dès que le patient s’allonge évoque un SJSR : 15 à 20 % des parkinsoniens sont concernés, soit 2 fois la prévalence en population générale. Recrudescence vespérale et nocturne des symptômes et un soulagement par le mouvement sont les critères qui distinguent les impatiences du SJSR du besoin urgent de bouger en période « off » ou d’autres diagnostics. Une carence martiale est à rechercher ; la supplémentation orale s’impose si le taux de ferritine plasmatique est < 50-75 μg/L. La vidéo-PSG n’apporte généralement pas d’aide au diagnostic qui est essentiellement clinique. Elle peut toutefois mettre en évidence la motricité nocturne, des mouvements périodiques des membres (associés dans 80 % des cas au SJSR) ainsi que de longs éveils fragmentant le sommeil. Les AD pris le soir ou, en cas d’échec, la prégabaline, la gabapentine et éventuellement les opioïdes sont des options médicamenteuses.
Trouble du comportement en sommeil paradoxal
Il est présent dans 60 % des cas
au cours d’une MP (80 à 100 % des patients avec AMS ou DCL). Cette agitation nocturne survient parfois avant les symptômes moteurs diurnes de la maladie, les précédant de plusieurs années chez un tiers des patients (appelés TCSP idiopathique en l’absence de comorbidités ou symptômes associés). Bien qu’un antidépresseur, notamment sérotoninergique, puisse provoquer un TCSP, celui-ci est généralement dû à la neurodégénérescence des noyaux du tronc cérébral (qui contrôlent l’atonie physiologique en SP).
Des mouvements complexes souvent violents
(combats, cris) survenant en fin de nuit ou au petit matin correspondent à la mise en acte d’un rêve ou d’un cauchemar ; ils doivent faire évoquer le diagnostic. À noter que certains micro-éveils ou éveils de fin d’apnées peuvent mimer le trouble.
Utile, la vidéo-PSG
prouve l’absence d’atonie du SP, les mouvements plus ou moins complexes et souvent agressifs (coups de pieds, injures) et les comportements élaborés, en phase avec le rêve rapporté ensuite par le patient.
Les déambulations nocturnes,
plus rares, orientent plutôt vers une confusion nocturne, généralement iatrogène. La réduction des molécules potentiellement responsables doit être envisagée : Z-drugs, benzodiazépines (BZD), anticholinergiques, AD et anticholinestérasiques notamment.
La mélatonine à forte dose
(3-12 mg/j) et le clonazépam à faible dose (0,5-2 mg) sont indiqués, sans haut niveau de preuve. Le clonazépam pouvant aggraver un SAS, il faut l’avoir écarté préalablement. L’aménagement de la chambre à coucher est important pour limiter le risque de blessures.
Somnolence diurne excessive
Affectant 20 à 50 % des parkinsoniens,
la somnolence est souvent liée à la sévérité de la maladie. Chez 1 à 14 % des patients, des endormissements brutaux peuvent se produire sans prodromes et en situation active ; ils exposent aux accidents de la voie publique lorsque le patient est au volant.
Plusieurs causes sont à évoquer :
AD, BZD ou autres psychotropes, baisse d’amplitude des rythmes circadiens (mélatonine, température), SAS, fragmentation excessive du sommeil nocturne. Elles justifient un suivi clinique régulier lorsqu’on introduit ou modifie les doses.
Cette somnolence rend nécessaire
la suspension provisoire de la conduite automobile, en attendant l’adaptation thérapeutique. Si le problème persiste, il faut demander un bilan étiologique : une PSG, suivie de tests itératifs de latence d’endormissement.
Un traitement stimulant l’éveil
peut être envisagé par un spécialiste du sommeil : modafinil, méthylphénidate, voire pitolisant (Wakix). Son rapport bénéfice-risque doit être bien évalué, surtout chez des patients âgés en raison des comorbidités et des facteurs de risque cardiovasculaires.
Atrophie multisystématisée
Chez ces patients,
le sommeil est encore plus perturbé que lors d’une MP. Il ne faut pas hésiter à demander une vidéo-PSG pour documenter une fragmentation du sommeil (majeure), un TCSP ou un SAS.
Cette maladie rare et grave
associe des troubles parkinsoniens, cérébelleux et dysautonomiques. L’atteinte de la commande bulbaire du larynx, associée à une dystonie des cordes vocales, peut engendrer un spasme laryngé avec détresse respiratoire. C’est une urgence médicale qui se signale par un stridor nocturne. Les patients respirent bruyamment en dormant. Ce bruit d’origine laryngé plus aigu que le ronflement impose la mise en place immédiate d’une PPC nocturne, voire, après discussion avec les ORL, une cordotomie ou une trachéotomie dans certains cas.
Démence à corps de Lewy
Près de 70 % des patients
ont des troubles du sommeil. En particulier, un TCSP est quasi constant et permet la distinction avec la MA.
Il peut exister des états confusionnels
nocturnes prolongés, sans sommeil sur le plan électrophysiologique, correspondant à un
. Les éveils sont alors associés à des hallucinations nocturnes ou une agitation anxieuse.
La PSG montre un tracé EEG
très ralenti et un sommeil paradoxal quasi constamment dépourvu d’atonie musculaire.
La mélatonine à forte dose
peut réduire l’agitation nocturne. Surtout, elle n’expose pas aux effets adverses des BZD ou des antidépresseurs.
1. Albers JA, Chand P, Anch AM. Multifactorial sleep disturbance in Parkinson’s disease. Sleep Med 2017;35:41-8.
2. American Academy of Sleep Medicine. ICSD-3: International Classification of Sleep Disorders, 3rd ed. 2014.
3. Swick TJ. Parkinson’s disease and sleep/wake disturbances. Parkinson Dis 2012;2012:205471.
4. Dauvilliers Y. Insomnia in patients with neuro- degenerative conditions. Sleep Med 2007;8 (suppl 4):S27-34.