Connaître les principales hypothèses diagnostiques et les examens complémentaires pertinents.
Généralités
Épidémiologie
Historique
Apport du diagnostic prénatal
Transition du fœtus au nouveau-né
Examen clinique cardiovasculaire de l’enfant
Âge
Interrogatoire des parents
Marqueurs de risque de cardiopathie congénitale
Les antécédents familiaux de cardiopathie congénitale sont recherchés. L’incidence de cardiopathie congénitale est plus élevée lorsqu’un parent au premier degré est atteint. Des antécédents familiaux de mort subite sont recherchés. Le déroulement de la grossesse est analysé. D’éventuels médicaments ou toxiques pris durant la grossesse sont notés. Le syndrome d’alcoolisme fœtal est associé à un risque accru de communication interatriale, communication interventriculaire et tétralogie de Fallot. Le diabète gestationnel, des infections maternelles durant la grossesse comme la rubéole, la fécondation in vitro notamment exposent aussi à un risque plus élevé de malformation cardiaque congénitale.Limitation fonctionnelle
Chez le nourrisson, la difficulté à téter est la première limitation fonctionnelle. Elle est évaluée par l’apparition de sueurs et la nécessité de fractionner les repas. Les tétées « plaisir » deviennent longues et laborieuses. Chez l’enfant, l’intolérance se porte sur l’activité sportive.Cassure pondérale
Les difficultés à la tétée, très caractéristiques des shunts gauche-droite, entraînent une inflexion de la courbe de poids. Un retard de croissance staturo-pondérale peut avoir une origine diverse (génétique, endocrinienne, digestive…).Douleur thoracique, syncope, palpitations
La douleur thoracique est un symptôme souvent décrit par les enfants. Contrairement à l’adulte, l’étiologie cardiovasculaire est rare (moins de 1 %). La syncope, le plus souvent d’origine vasovagale, est très fréquente chez l’enfant. La survenue de symptômes à l’effort doit alerter et peut faire découvrir un obstacle sur la voie gauche (sténose valvulaire aortique, sous- ou supravalvulaire aortique, cardiomyopathie hypertrophique obstructive), une anomalie coronarienne (anomalie d’implantation ou de trajet, anévrisme coronarien séquellaire d’une maladie de Kawasaki) ou un trouble du rythme héréditaire (syndrome du QT long, syndrome du QT court, tachycardie ventriculaire catécholergique, syndrome de Brugada…), associés à un risque de mort subite de l’enfant.Examen physique
Recherche d'une dysmorphie
Une dysmorphie faciale, une anomalie des extrémités, une anomalie des organes génitaux externes, etc. peuvent orienter vers un syndrome génétique. L’anomalie chromosomique la plus fréquente associée à des cardiopathies congénitales est la trisomie 21. Dans 1 cas sur 2 environ, les enfants ayant une trisomie 21 ont une cardiopathie congénitale, et la moitié d’entre elles sont un canal atrioventriculaire. La délétion du chromosome 22q11 (syndrome de Di George) est souvent associée à une cardiopathie congénitale, notamment la tétralogie de Fallot. Le syndrome de Marfan, de morphotype caractérisé par les critères de Gand, est lié à une mutation génétique d’un gène de l’élastine, dont le risque est la dissection aortique. Le syndrome de Turner est associé à un risque accru de coarctation aortique. D’autres syndromes moins fréquents comme les syndromes de Williams-Beuren, CHARGE, Alagille, Holt-Oram, Noonan, Ellis-van Creveld, Costello… sont associés à des cardiopathies congénitales variées.Inspection
Dans les shunts gauche-droite, la fréquence respiratoire peut être accélérée et, plus tard, le thorax déformé (par la dilatation du ventricule gauche), bombant en « tonneau ». Dans les shunts droite-gauche, une cyanose des téguments et des muqueuses apparaît lorsque le taux d’hémoglobine réduite est supérieur à 5 g/100 mL de sang capillaire moyen. La cyanose dans les cardiopathies congénitales est dite réfractaire, car non sensible à l’oxygène (Palpation des pouls
La palpation des pouls fémoraux et axillaires est systématique. Elle permet d’apprécier leur fréquence et leur régularité. Des pouls mal perçus aux quatre membres suggèrent une insuffisance circulatoire d’origine ou non cardiogénique. Des pouls mieux perçus en axillaire qu’en fémoral suggèrent une coarctation aortique, qui est confirmée par un gradient tensionnel systolique supérieur à 20 mmHg.Pression artérielle
La pression artérielle est mesurée avec un brassard adapté et comparée aux abaques pour l’âge. Une élévation de la pression artérielle de l’enfant est le plus souvent d’origine néphrologique, mais doit faire rechercher une coarctation aortique.Souffle cardiaque
L’examen à la recherche d’un souffle cardiaque débute par la palpation du thorax avec la paume de la main pour localiser la pointe du cœur et rechercher un éventuel frémissement. L’auscultation se fait à différents foyers : parasternal gauche, parasternal droit, sous-xiphoïdien, à l’apex en sous-claviculaire sur le bord gauche du sternum et dans le dos. Le premier temps de l’auscultation consiste à identifier les bruits physiologiques du cœur. Le B1 correspond à la fermeture des valves tricuspide et mitrale. Le B2 correspond à la fermeture des valves aortique et pulmonaire. L’auscultation doit être suffisamment longue pour les bruits du cœur afin de les différencier des bruits respiratoires. Physiologiquement, on perçoit le plus souvent chez l’enfant un dédoublement uniquement inspiratoire du B2 lié à la fermeture retardée de la valve pulmonaire secondaire à l’augmentation du retour veineux cave par la dépression thoracique. Des bruits surajoutés B3 et B4 signent un galop et sont audibles dans une myocardiopathie dilatée hypokinétique.
Lorsqu’un souffle est identifié, les éléments suivants doivent être décrits :
- le timing au sein du cycle cardiaque (systolique ou/et diastolique, au début, au milieu ou à la fin de la période (proto-, méso-, télé- respectivement) ;
- la localisation (le foyer où le souffle est le mieux perçu) ;
- le timbre (aigu, grave, doux, râpeux, aspiratif, humide, sec, rude) ;
- l’intensité (cotée de 1 à 6 [1 : souffle difficilement audible ; 2 : souffle léger mais entendu immédiatement ; 3 : souffle très distinct sur une faible surface ; 4 : souffle très distinct sur une large surface ; 5 : souffle frémissant ; 6 : souffle entendu avec le stéthoscope décollé de la poitrine]) ;
- l’irradiation (espace de diffusion où le souffle est étendu) ;
- les signes associés (clicks valvulaires, dédoublement constant du B2…).
Caractéristiques d’un souffle innocent
Certaines caractéristiques stétho-acoustiques alertent sur le risque de cardiopathies sous-jacentes. Ces anomalies doivent servir de drapeaux rouges, conduisant à un examen plus approfondi spécialisé. Un souffle holosystolique (odds ratio [OR] = 54) évoque ainsi une communication interventriculaire ou une insuffisance mitrale. Un souffle frémissant et une tonalité râpeuse sont en défaveur d’un souffle innocent (OR = 4,8 et OR = 2,4 respectivement). Un dédoublement fixe et constant du B2 évoque une communication interauriculaire (OR = 4,1). Un souffle d’intensité maximale au bord gauche du thorax oriente vers une coarctation (OR = 4,2). Un click systolique est évocateur d’un obstacle valvulaire (OR = 8,3). Un souffle diastolique n’est jamais fonctionnel.
Quelques souffles innocents ont été décrits.
Un souffle apexien, doux, musical, vibratoire et positionnel (disparaissant à l’orthostatisme) est parfois perçu entre 2 ans et l’adolescence (souffle de Still). Il serait lié aux vibrations du flux sanguin éjecté dans la chambre de chasse du ventricule gauche. C’est un des souffles innocents les plus fréquents.
Un souffle pulmonaire au bord gauche du sternum, systolique, aigu, doux, positionnel (diminuant à l’orthostatisme), sans click, avec irradiation dans le dos et en axillaire est lié au flux normal à travers la voie de sortie du ventricule droit.
Un souffle bénin de sténose pulmonaire périphérique du nouveau-né est un souffle innocent créé par la disparité de calibre entre le tronc artériel pulmonaire et les branches pulmonaires à cet âge. Durant la vie fœtale, 90 % du flux dans l’artère pulmonaire est dirigé vers le canal artériel. Les branches pulmonaires du nouveau-né sont de ce fait physiologiquement moins larges et naissent avec un angle plus aigu qu’observé chez l’enfant. Ces particularités anatomiques peuvent générer un souffle fonctionnel systolique au bord gauche du sternum irradiant dans le dos.
Un souffle fonctionnel mammaire est entendu sur la paroi thoracique (antérieur, aigu, doux, parfois prolongé en diastole, bilatéral) et correspondrait au flux sanguin à travers les artères mammaires internes.
Un souffle innocent haut situé avec irradiation dans les carotides et dans les creux sus-claviculaires est lié au flux systémique normal à travers la crosse aortique.
Un souffle innocent veineux continu est de tonalité grave, bilatéral, positionnel, augmentant en diastole et disparaissant lors de la rotation de la nuque, entendu entre 3 et 8 ans.
Examens complémentaires et avis spécialisé
Cardiopathies congénitales les plus fréquentes
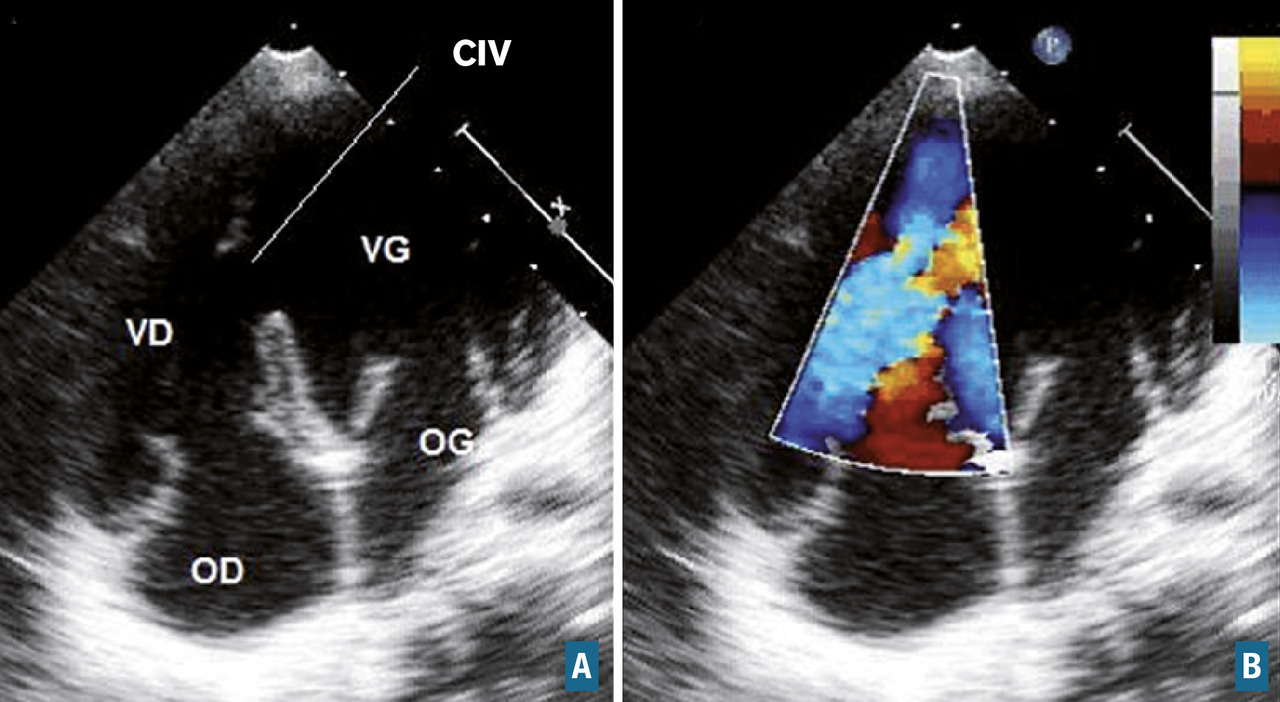
Communications interventriculaires
En cas de communication interventriculaire de petite taille, l’enfant est asymptomatique. Le souffle cardiaque de communication interventriculaire est intense, du fait de pressions artérielles pulmonaires basses et ainsi d’un gradient transventriculaire gauche-droit important.
En cas de large communication interventriculaire, le souffle cardiaque s’associe à partir de la fin du premier mois de vie à des signes de shunt gauche-droite avec hyperdébit pulmonaire : dyspnée d’effort, polypnée, signes de lutte respiratoire, asthénie, sueurs aux tétées, difficultés aux tétées, stagnation ou cassure staturo-pondérale, bronchites à répétition. Le bruit B1 est fort à la pointe. Plus la communication interventriculaire est large, plus les pressions artérielles pulmonaires sont élevées, et plus le souffle de communication interventriculaire devient faible. En cas d’hypertension pulmonaire, on entend un claquement du bruit B2 au foyer pulmonaire.
L’évolution naturelle d’une communication interventriculaire large est le syndrome d’Eisenmenger, pouvant apparaître à partir de 6-9 mois de vie. Il correspond à l’augmentation des résistances vasculaires pulmonaires, en réponse à l’hyperdébit pulmonaire prolongé. L’examen clinique est faussement rassurant : il n’y a plus ou peu de souffle cardiaque et les signes de shunt gauche-droite disparaissent. Les cavités gauches ne sont plus dilatées. Il existe une hypertension pulmonaire fixée, avec un shunt interventriculaire bidirectionnel, contre-indiquant la fermeture chirurgicale de la communication interventriculaire.
On distingue quatre types de communication interventriculaire en fonction de leur localisation dans le septum interventriculaire : périmembraneuse, infundibulaire, d’admission, et trabéculée ou musculaire. L’échocardiographie affirme le diagnostic, précise la taille et le type de communication interventriculaire, évalue son retentissement (surcharge volumétrique avec dilatation du tronc de l’artère pulmonaire, de l’oreillette gauche et du ventriculaire gauche, hypertension pulmonaire), recherche des complications (insuffisance valvulaire aortique par prolapsus d’une sigmoïde aortique dans la communication interventriculaire) et des lésions associées. La radiographie pulmonaire montre, en cas de shunt gauche-droite significatif, une cardiomégalie et une vascularisation pulmonaire accentuée.
Le risque commun à toutes les communications interventriculaires, quelle que soit leur taille, est l’endocardite d’Osler.
Les communications interventriculaires périmembraneuses et trabéculées se ferment le plus souvent spontanément. La fermeture chirurgicale n’est indiquée qu’en cas de communication interventriculaire large ou compliquée (fuite aortique).
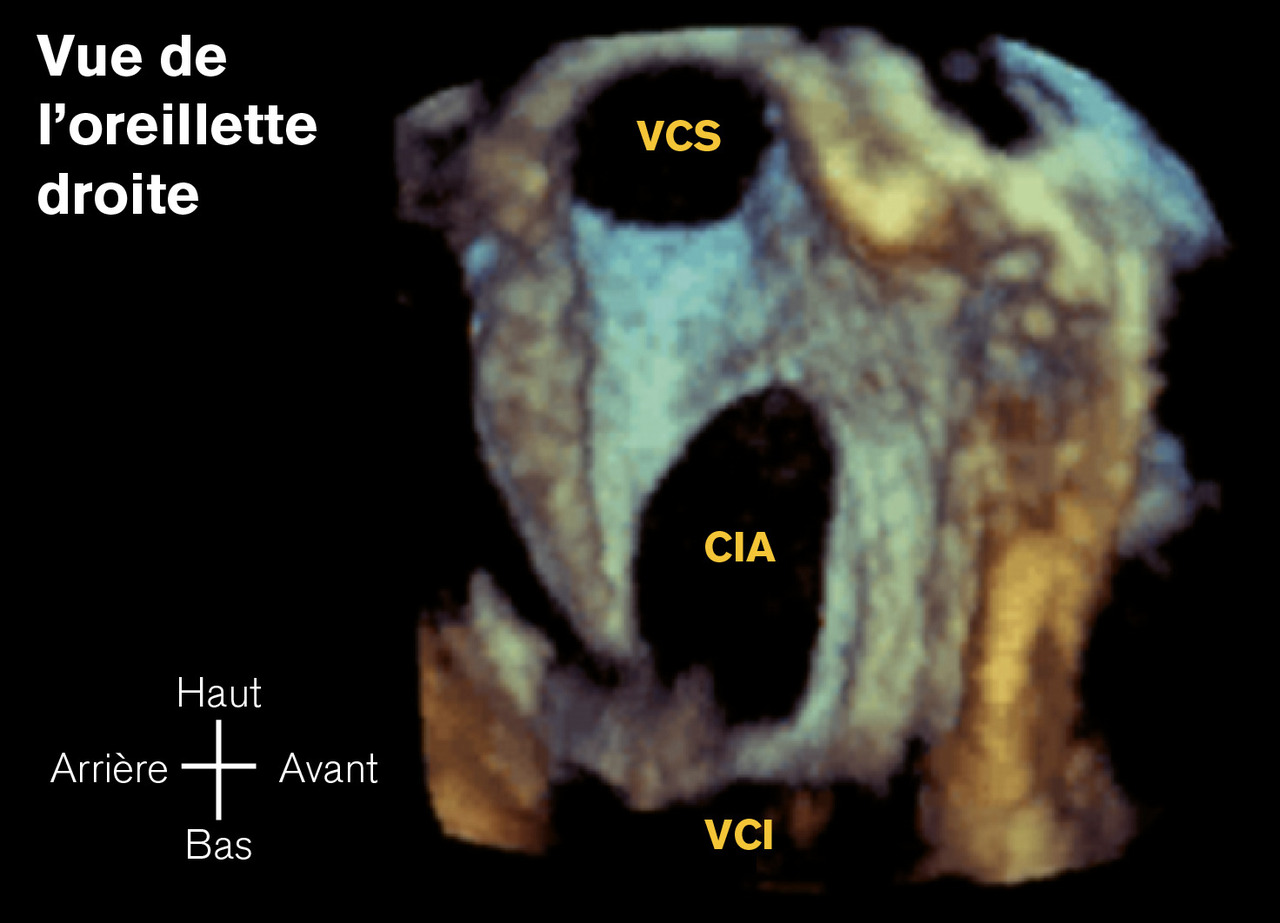
Communications interauriculaires
Dans la majorité des cas, l’enfant est asymptomatique. L’examen clinique ne relève qu’un souffle cardiaque isolé. Quand le shunt auriculaire gauche-droite est important (communication interauriculaire large), il apparaît des signes de shunt gauche-droite. On distingue trois types de communication interauriculaire : ostium secondum (les plus fréquentes), ostium primum et sinus venosus.
L’échocardiographie affirme le diagnostic, précise la taille et le type de communication interauriculaire, évalue son retentissement (surcharge volumétrique avec dilatation du tronc de l’artère pulmonaire, de l’oreillette droite et du ventricule droit ; parfois hypertension pulmonaire de débit), recherche des lésions associées et, en cas de communication interauriculaire ostium secondum, étudie son éligibilité à la fermeture par cathétérisme interventionnel (longueur et épaisseur des berges).
Les complications tardives (après 30 ans) sont l’insuffisance cardiaque droite, les troubles du rythme auriculaire et l’hypertension pulmonaire fixée (rare). En cas de retentissement (clinique ou échographique), une communication interauriculaire ostium secondum doit être fermée. Ceci peut se faire par voie percutanée (cathétérisme interventionnel) à partir de 5 ans et si les berges sont suffisantes. Sinon, la fermeture est chirurgicale, sous circulation extracorporelle. La communication interauriculaire sinus venosus et les communications interauriculaires ostium primum nécessitent toujours une fermeture chirurgicale.
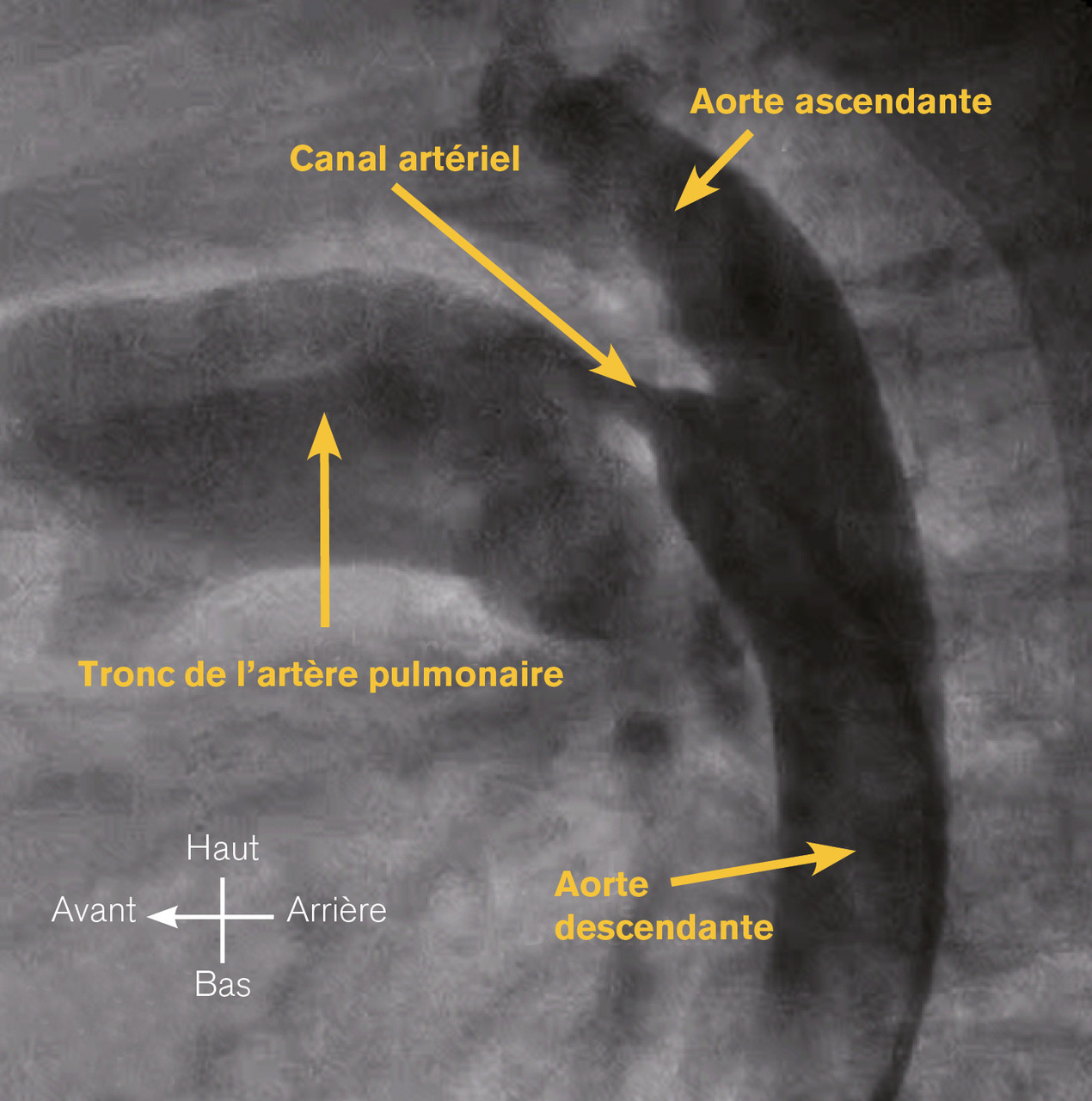
Canal artériel persistant
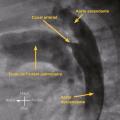
Le canal artériel est dit persistant (CAP) chez un nouveau-né à terme lorsqu’il reste perméable au-delà du premier mois de vie. Le diagnostic anténatal est impossible puisque le canal artériel est physiologiquement ouvert chez le fœtus. La persistance du canal artériel provoque un shunt artériel gauche-droite qui surcharge les poumons et les cavités gauches (
En cas de persistance de petite taille, l’enfant est asymptomatique. En cas de persistance large, le shunt gauche-droite est significatif et entraîne un B1 fort à la pointe et des signes de shunt gauche-droite. Les pouls fémoraux et huméraux sont amples, du fait d’un vol systémique diastolique par le canal artériel entraînant une baisse de la pression artérielle diastolique et ainsi une augmentation de la pression pulsée (différence entre les pressions artérielles systolique et diastolique). En cas d’hypertension pulmonaire, il existe un claquement du bruit B2 au foyer pulmonaire.
L’échocardiographie affirme le diagnostic, précise la taille et la forme du canal artériel, évalue son retentissement (surcharge volumétrique avec dilatation du tronc de l’artère pulmonaire, de l’oreillette gauche et du ventriculaire gauche, hypertension pulmonaire), recherche des lésions associées. La radiographie pulmonaire montre, en cas de shunt gauche-droite significatif, une cardiomégalie et une vascularisation pulmonaire accentuée.
La fermeture est indiquée en cas de large canal artériel avec shunt gauche-droite significatif (dilatation des cavités gauches) ou en cas de canal artériel sans shunt significatif mais avec un souffle cardiaque, en prévention de l’endocardite d’Osler. La fermeture est percutanée, par cathétérisme interventionnel (la chirurgie n’étant réservée qu’aux très gros canaux d’enfants de petit poids).
Coarctation de l’aorte
Si elle est serrée et de constitution brutale, elle peut entraîner chez le nouveau-né vers 1 semaine de vie une insuffisance cardiaque, puis rapidement un choc cardiogénique par défaillance du ventricule gauche. L’ouverture du canal artériel par administration de prostaglandines peut améliorer la situation en attendant la correction chirurgicale (résection de la zone sténosée et plastie aortique). En cas de coarctation moins serrée ou plus progressive, la révélation est plus tardive, par une hypertension artérielle des membres supérieurs.
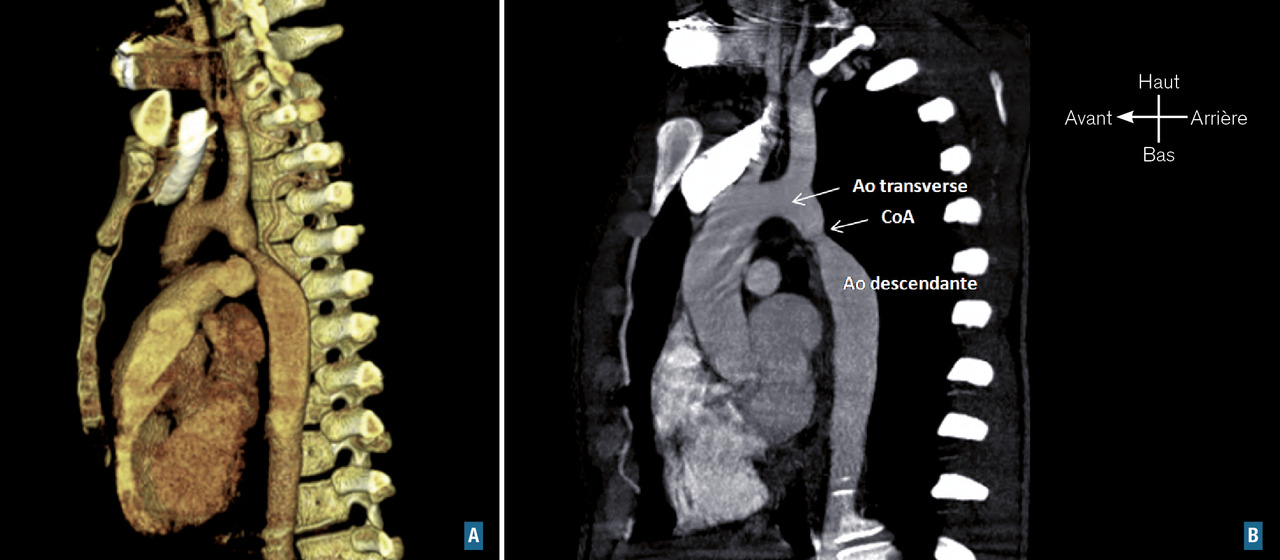
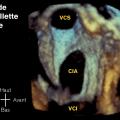
Le diagnostic de coarctation est clinique : diminution (ou abolition) des pouls fémoraux et gradient tensionnel entre les membres supérieurs et inférieurs. Il est confirmé par l’échocardiographie, qui recherche des lésions associées dont la plus fréquente est la bicuspidie aortique. Le scanner permet de préciser l’étendue de la zone coarctée.
Tétralogie de Fallot
Sténose valvulaire pulmonaire
Transposition des gros vaisseaux
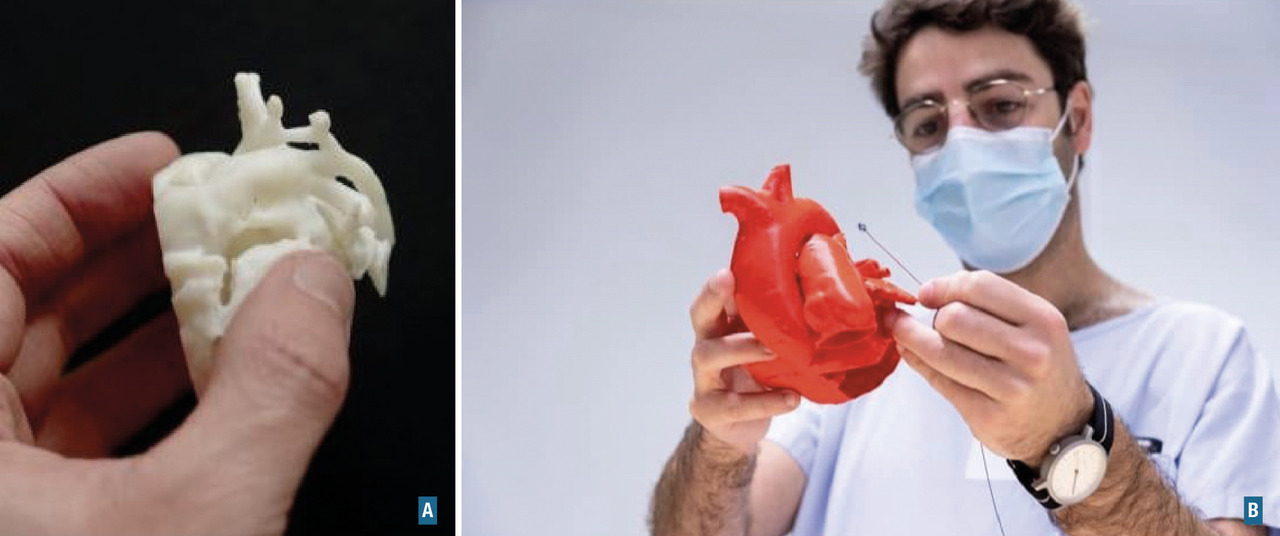
Perspectives : la 3D comme outil de communication et d’enseignement
POINTS FORTS À RETENIR
Le souffle innocent est de loin le plus fréquent chez l’enfant. Une auscultation caractéristique et un examen clinique normal justifient l’absence d’examen complémentaire.
Les cardiopathies sont les plus fréquentes des malformations de l’enfant. Les plus graves d’entre elles peuvent être dépistées chez le fœtus par échographie morphologique.
Les cardiopathies congénitales peuvent être mineures (sans retentissement clinique et hémodynamique) et se corriger spontanément dans le temps.
L’échocardiographie est l’examen de choix pour évaluer des cardiopathies congénitales qui peuvent associer plusieurs malformations (shunt, obstacle de la voie gauche ou droite).
Les cardiopathies congénitales avec retentissement clinique ou hémodynamique sont pour la plupart accessibles à un traitement chirurgical ou percutané.
Toute cardiopathie congénitale a potentiellement un risque oslérien (sauf les communications inter-auriculaires).

 Encadrés
Encadrés