Les souffles cardiaques sont très fréquents chez l’enfant (50 % des nouveau-nés et un tiers des nourrissons et enfants). Ils sont le motif de consultation spécialisée de loin le plus courant.
La plupart sont fonctionnels, « anorganiques » ou « innocents » sans aucun substrat anatomique puisque les malformations cardiaques congénitales concernent environ 1 % des patients. En outre, les anomalies cardiaques acquises sont devenues exceptionnelles dans les pays industrialisés depuis la disparition du rhumatisme articulaire aigu.
L’objectif est donc de distinguer un symptôme fonctionnel, bénin, d’un souffle témoignant d’une cardiopathie relevant d’une prise en charge spécifique.
L’auscultation n’est pas toujours facile chez le petit enfant, car le cœur est rapide, volontiers irrégulier et l’arythmie sinusale respiratoire physiologique (accélération de la fréquence cardiaque à l’inspiration et ralentissement lors de l’expiration) peut être très marquée. De plus, l’auscultation est souvent gênée par les cris, les pleurs et l’agitation. Un dédoublement du deuxième bruit (B2) le long du bord sternal gauche, variable avec la respiration, est courant et physiologique. Un troisième bruit est entendu chez 50 % des enfants.
La plupart sont fonctionnels, « anorganiques » ou « innocents » sans aucun substrat anatomique puisque les malformations cardiaques congénitales concernent environ 1 % des patients. En outre, les anomalies cardiaques acquises sont devenues exceptionnelles dans les pays industrialisés depuis la disparition du rhumatisme articulaire aigu.
L’objectif est donc de distinguer un symptôme fonctionnel, bénin, d’un souffle témoignant d’une cardiopathie relevant d’une prise en charge spécifique.
L’auscultation n’est pas toujours facile chez le petit enfant,
Conduite à tenir
Il faut préciser le temps du souffle (systolique, diastolique, systolodiastolique ou continu) ; son timbre ; son intensité et son caractère frémissant ou non ; son foyer ; ses irradiations et les modifications éventuelles des bruits du cœur. Ces caractéristiques orientent déjà assez facilement le diagnostic.
Un souffle innocent est :1
– inconstant, mieux entendu si fièvre, effort, anémie, hyperthyroïdie (augmentation du débit cardiaque) ;
– isolé ou asymptomatique ;
– systolique, bref (mésosystolique : au milieu de la systole) ;
– avec bruits du cœur normaux ;
– de timbre musical ou vibratoire, piaulant ;
– d’intensité modérée non frémissant (< 3/6) ;
– très peu irradiant ;
– variable selon la position de l’enfant, le moment de l’examen, le cycle respiratoire et les consultations.
La disparition du souffle en position debout après 2 minutes de calme (par baisse du débit cardiaque), signe simple et fiable, oriente vers un souffle anorganique
Le souffle fonctionnel est le bruit normal du flux sanguin lors de l’éjection du sang. On l’entend car la distance du cœur au stéthoscope est plus faible et que les cavités cardiaques sont de plus petite taille. Cela explique sa disparition à l’âge adulte. Avant 3 mois, il peut être lié à une accélération du flux sur les branches pulmonaires en raison de la différence de calibre entre le tronc et les branches pulmonaires à cet âge.
Un souffle innocent est :1
– inconstant, mieux entendu si fièvre, effort, anémie, hyperthyroïdie (augmentation du débit cardiaque) ;
– isolé ou asymptomatique ;
– systolique, bref (mésosystolique : au milieu de la systole) ;
– avec bruits du cœur normaux ;
– de timbre musical ou vibratoire, piaulant ;
– d’intensité modérée non frémissant (< 3/6) ;
– très peu irradiant ;
– variable selon la position de l’enfant, le moment de l’examen, le cycle respiratoire et les consultations.
La disparition du souffle en position debout après 2 minutes de calme (par baisse du débit cardiaque), signe simple et fiable, oriente vers un souffle anorganique
Le souffle fonctionnel est le bruit normal du flux sanguin lors de l’éjection du sang. On l’entend car la distance du cœur au stéthoscope est plus faible et que les cavités cardiaques sont de plus petite taille. Cela explique sa disparition à l’âge adulte. Avant 3 mois, il peut être lié à une accélération du flux sur les branches pulmonaires en raison de la différence de calibre entre le tronc et les branches pulmonaires à cet âge.
Un souffle organique ?
Outre l’analyse du souffle, l’interrogatoire et l’examen physique recherchent des antécédents familiaux, des signes ou des symptômes orientant vers une cause organique.
Chez le nouveau-né, il peut s’agir d’une cyanose (mesure de la saturation au moindre doute à l’oxymètre de pouls ; cyanose visible si < 80 % [normale > 96 %]), de difficultés alimentaires ou d’une hépatomégalie (signes d’insuffisance cardiaque).
Chez le nourrisson : difficultés alimentaires (la tétée doit être fractionnée), retard staturopondéral, polypnée, infections pulmonaires à répétition.
Chez l’enfant plus grand : mêmes symptômes que précédemment (mais plus rares) ou dyspnée d’effort, fatigabilité, et moins souvent syncope ou douleur thoracique d’effort.
Un contexte particulier peut faire suspecter une atteinte cardiaque :
– syndrome polymalformatif (dysmorphie faciale, anomalies des extrémités, organes génitaux externes, trisomie 21, syndrome de DiGeorge) : une échographie cardiaque systématique est indiquée, qu’il y ait ou non des symptômes, et qu’il y ait ou non un souffle ;
– maladie génétique familiale pouvant toucher le cœur ou les gros vaisseaux, comme le syndrome de Marfan (mutation génétique d’un gène de l’élastine à risque de dissection aortique).
La probabilité de diagnostiquer une cardiopathie est plus fréquente avant 3 mois de vie.
L’échocardiographie transthoracique est l’examen clé du diagnostic en cas de doute. Sa qualité est constamment bonne chez l’enfant, mais sa réalisation est parfois rendue difficile par l’agitation. Elle nécessite un matériel adapté et un opérateur rodé à la cardiologie pédiatrique.
Chez le nouveau-né, il peut s’agir d’une cyanose (mesure de la saturation au moindre doute à l’oxymètre de pouls ; cyanose visible si < 80 % [normale > 96 %]), de difficultés alimentaires ou d’une hépatomégalie (signes d’insuffisance cardiaque).
Chez le nourrisson : difficultés alimentaires (la tétée doit être fractionnée), retard staturopondéral, polypnée, infections pulmonaires à répétition.
Chez l’enfant plus grand : mêmes symptômes que précédemment (mais plus rares) ou dyspnée d’effort, fatigabilité, et moins souvent syncope ou douleur thoracique d’effort.
Un contexte particulier peut faire suspecter une atteinte cardiaque :
– syndrome polymalformatif (dysmorphie faciale, anomalies des extrémités, organes génitaux externes, trisomie 21, syndrome de DiGeorge) : une échographie cardiaque systématique est indiquée, qu’il y ait ou non des symptômes, et qu’il y ait ou non un souffle ;
– maladie génétique familiale pouvant toucher le cœur ou les gros vaisseaux, comme le syndrome de Marfan (mutation génétique d’un gène de l’élastine à risque de dissection aortique).
La probabilité de diagnostiquer une cardiopathie est plus fréquente avant 3 mois de vie.
L’échocardiographie transthoracique est l’examen clé du diagnostic en cas de doute. Sa qualité est constamment bonne chez l’enfant, mais sa réalisation est parfois rendue difficile par l’agitation. Elle nécessite un matériel adapté et un opérateur rodé à la cardiologie pédiatrique.
Conseils aux parents
En cas de souffle fonctionnel : aucune thérapeutique, surveillance ou restriction d’activité ne sont justifiées ; ces enfants peuvent mener une vie strictement normale, puisqu’ils ne sont pas malades. Tous les sports sont autorisés, y compris en compétition.
Il est inutile et même nuisible de revoir l’enfant en consultation de cardiopédiatrie. La conclusion doit être ferme et précise dès le premier examen, afin de rassurer la famille et le patient, souvent inquiets du « souffle au cœur ». Les adjectifs bénins ou innocents ainsi que le terme bruits normal du cœur (traduction du terme anglais murmur) rassurent les parents.
Il est inutile et même nuisible de revoir l’enfant en consultation de cardiopédiatrie. La conclusion doit être ferme et précise dès le premier examen, afin de rassurer la famille et le patient, souvent inquiets du « souffle au cœur ». Les adjectifs bénins ou innocents ainsi que le terme bruits normal du cœur (traduction du terme anglais murmur) rassurent les parents.
Communication interventriculaire
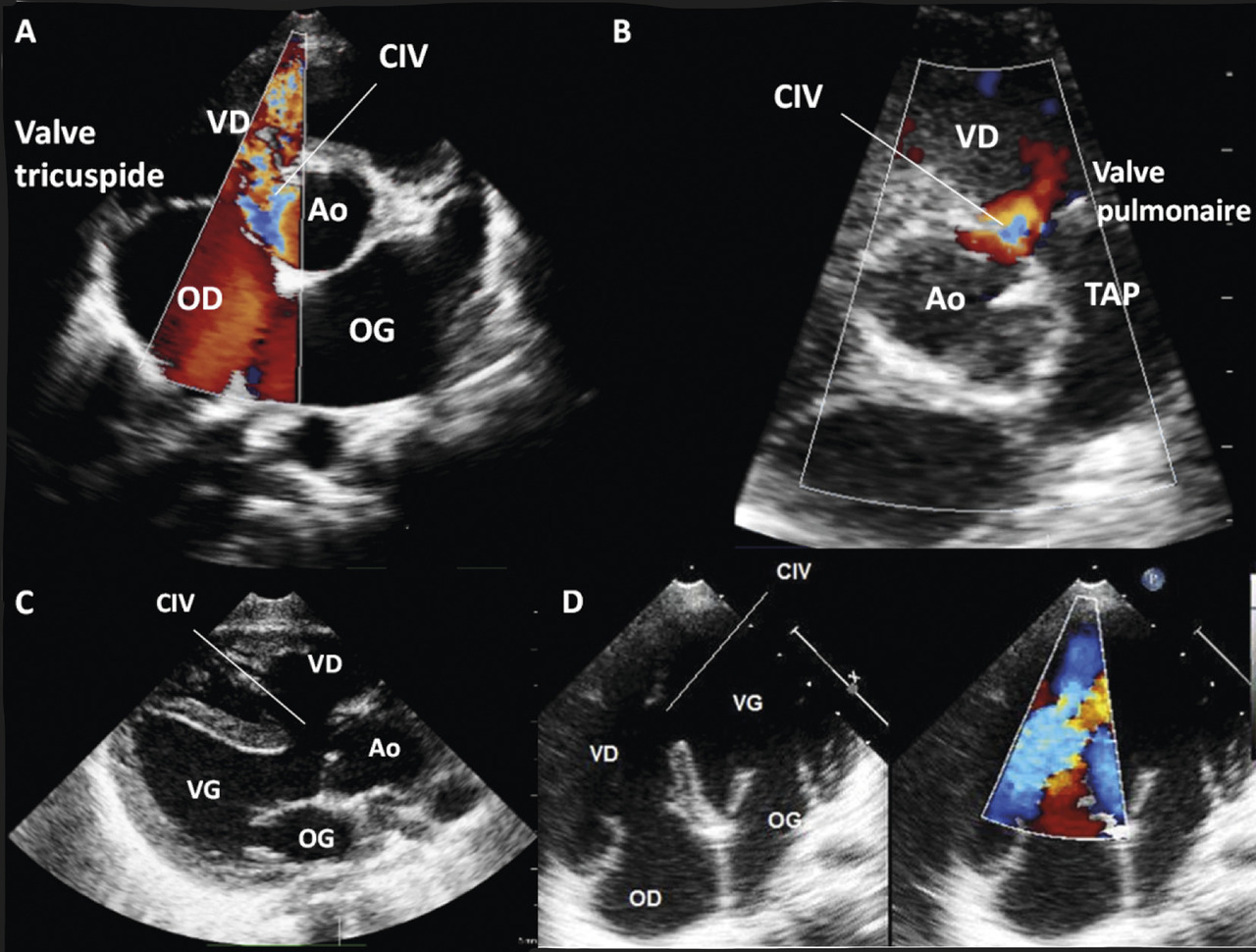
La communication interventriculaire (CIV) est la cardiopathie la plus fréquente chez le nourrisson (25 % des cardiopathies congénitales). La prévalence diminue ensuite puisque plus de la moitié des CIV se ferment spontanément pendant l’enfance. Une large CIV peut être diag- nostiquée en anténatal à l’échographie fœtale.
Le souffle est holosystolique, maximal en parasternal gauche, irradiant en rayon de roue et d’autant plus intense que la communication est petite et donc bien tolérée.
La CIV entraîne un shunt gauche-droite qui surcharge la circulation pulmonaire en fonction de sa taille et du rapport entre les résistances pulmonaires et systémiques. La CIV dilate les cavités gauches puisque le shunt se fait majoritairement en systole (valve aortique et pulmonaire ouvertes) et donc augmente le débit pulmonaire puis le retour veineux pulmonaire à l’oreillette gauche et au ventricule gauche.
L’enfant devient symptomatique vers un mois de vie, lorsque les résistances pulmonaires diminuent, entraînant des signes d’insuffisance cardiaque néonatale (difficultés d’alimentation, retard de croissance, polypnée).
Sans correction, en cas de large CIV (souffle peu intense, voire inexistant car absence de gradient entre ventricule gauche et ventricule droit), des lésions vascu- laires pulmonaires irréversibles peuvent aboutir à un syndrome d’Eisenmenger à 6-9 mois de vie (hypertension artérielle pulmonaire fixée avec shunt droite-gauche, claquement du B2 au foyer pulmonaire).
Une CIV de type 1, ou maladie de Roger, est une petite CIV responsable d’un souffle intense frémissant sans hypertension pulmonaire et sans hyperdébit pulmonaire significatif.
On classe également les CIV selon leur anatomie et leur localisation au sein du septum interventriculaire (figure ).
La CIV musculaire (dite aussi trabéculée) est la forme la plus fréquente chez le nourrisson, elle est souvent petite et parfois multiple (swiss cheese septum).
La CIV membraneuse ou périmembraneuse est la plus courante chez le grand enfant et l’adulte. Cette dernière se situe dans la région d’éjection du ventricule gauche, sous la valve aortique.
D’autres localisations existent : admission, éjection…
Selon sa position, une CIV peut entraîner des complications telle une insuffisance aortique.
Le diagnostic est confirmé à l’échocardiographie, qui précise sa localisation et aussi quantifie le shunt, évalue les pressions pulmonaires et le retentissement.2
Le souffle est holosystolique, maximal en parasternal gauche, irradiant en rayon de roue et d’autant plus intense que la communication est petite et donc bien tolérée.
La CIV entraîne un shunt gauche-droite qui surcharge la circulation pulmonaire en fonction de sa taille et du rapport entre les résistances pulmonaires et systémiques. La CIV dilate les cavités gauches puisque le shunt se fait majoritairement en systole (valve aortique et pulmonaire ouvertes) et donc augmente le débit pulmonaire puis le retour veineux pulmonaire à l’oreillette gauche et au ventricule gauche.
L’enfant devient symptomatique vers un mois de vie, lorsque les résistances pulmonaires diminuent, entraînant des signes d’insuffisance cardiaque néonatale (difficultés d’alimentation, retard de croissance, polypnée).
Sans correction, en cas de large CIV (souffle peu intense, voire inexistant car absence de gradient entre ventricule gauche et ventricule droit), des lésions vascu- laires pulmonaires irréversibles peuvent aboutir à un syndrome d’Eisenmenger à 6-9 mois de vie (hypertension artérielle pulmonaire fixée avec shunt droite-gauche, claquement du B2 au foyer pulmonaire).
Une CIV de type 1, ou maladie de Roger, est une petite CIV responsable d’un souffle intense frémissant sans hypertension pulmonaire et sans hyperdébit pulmonaire significatif.
On classe également les CIV selon leur anatomie et leur localisation au sein du septum interventriculaire (
La CIV musculaire (dite aussi trabéculée) est la forme la plus fréquente chez le nourrisson, elle est souvent petite et parfois multiple (swiss cheese septum).
La CIV membraneuse ou périmembraneuse est la plus courante chez le grand enfant et l’adulte. Cette dernière se situe dans la région d’éjection du ventricule gauche, sous la valve aortique.
D’autres localisations existent : admission, éjection…
Selon sa position, une CIV peut entraîner des complications telle une insuffisance aortique.
Le diagnostic est confirmé à l’échocardiographie, qui précise sa localisation et aussi quantifie le shunt, évalue les pressions pulmonaires et le retentissement.2
Prise en charge
En cas de maladie de Roger, la prévention médicamenteuse de l’endocardite infectieuse n’est plus recommandée. Il faut insister sur une bonne hygiène bucco-dentaire et cutanée. Aucune restriction physique n’est recommandée et un suivi tous les 3 à 5 ans est nécessaire.
Une large CIV symptomatique requiert un suivi et une prise en charge spécifique. Le traitement médical en cas de CIV avec hyperdébit pulmonaire symptomatique (insuffisance cardiaque) comprend des diurétiques, un inhibiteur de l’enzyme de conversion, une transfusion (si Hb < 15 g/dL) pour diminuer les effets du shunt, un enrichissement alimentaire, et la prévention de la bronchiolite à VRS (immunothérapie).
Les indications à la fermeture chirurgicale ou interventionnelle varient selon le retentissement et l’âge de l’enfant.3 Le choix du mode de fermeture (chirurgie ou cathétérisme) dépend de l’anatomie de la CIV.
Une fois fermée et même en l’absence de lésion résiduelle, un suivi (à vie par un cardiologue) est recommandé mais l’enfant puis l’adulte aura une vie normale sans restriction.
Une CIV du nourrisson qui se ferme spontanément ne requiert aucun suivi.
Une large CIV symptomatique requiert un suivi et une prise en charge spécifique. Le traitement médical en cas de CIV avec hyperdébit pulmonaire symptomatique (insuffisance cardiaque) comprend des diurétiques, un inhibiteur de l’enzyme de conversion, une transfusion (si Hb < 15 g/dL) pour diminuer les effets du shunt, un enrichissement alimentaire, et la prévention de la bronchiolite à VRS (immunothérapie).
Les indications à la fermeture chirurgicale ou interventionnelle varient selon le retentissement et l’âge de l’enfant.3 Le choix du mode de fermeture (chirurgie ou cathétérisme) dépend de l’anatomie de la CIV.
Une fois fermée et même en l’absence de lésion résiduelle, un suivi (à vie par un cardiologue) est recommandé mais l’enfant puis l’adulte aura une vie normale sans restriction.
Une CIV du nourrisson qui se ferme spontanément ne requiert aucun suivi.
Références
1. McCrindle BW, Shaffer KM, Kan JS, et al. Cardinal clinical signs in the differentiation of heart murmurs in children. Arch Pediatr Adolesc Med 1996;150:169-74.
2. Hadeed K, Hascoet S, Amadieu R, et al. Assessment of Ventricular Septal Defect Size and Morphology by Three-Dimensional Transthoracic Echocardiography. J Am Soc Echocardiogr 2016; 29:777-85.
3. Hadeed K, Hascoët S, Karsenty C, et al. Usefulness of echocardiographic-fluoroscopic fusion imaging in children with congenital heart disease. Arch Cardiovasc Dis 2018;111:399-410.
2. Hadeed K, Hascoet S, Amadieu R, et al. Assessment of Ventricular Septal Defect Size and Morphology by Three-Dimensional Transthoracic Echocardiography. J Am Soc Echocardiogr 2016; 29:777-85.
3. Hadeed K, Hascoët S, Karsenty C, et al. Usefulness of echocardiographic-fluoroscopic fusion imaging in children with congenital heart disease. Arch Cardiovasc Dis 2018;111:399-410.