Elle est le plus souvent secondaire à une atteinte dégénérative de la valve qui se calcifie (maladie de Mönckeberg).
D’autres étiologies sont possibles chez le sujet âgé :
– bicuspidie (congénitale, dès la naissance, 2 feuillets valvulaires au lieu de 3), qui peut évoluer tardivement soit vers une sténose aortique pure, soit vers une maladie aortique associant également une insuffisance de la valve ;
– antécédent lointain de radiothérapie thoracique (lymphome de Hodgkin, cancer du sein) ;
– maladie rhumatismale post-streptococcique (aujourd’hui anecdotique dans les pays à hauts revenus).
La sténose aortique dégénérative est caractérisée par la formation de calcifications sur le versant aortique des sigmoïdes. Ce processus était supposé être lié uniquement au stress mécanique répété infligé à ces valvules à chaque systole, ajouté à une dégénérescence tissulaire due au vieillissement. Toutefois, les facteurs de risque cardiovasculaires classiques – hypercholestérolémie, tabagisme, diabète et HTA – seraient impliqués dans la physiopathologie, ce qui est en faveur d’un mécanisme proche de celui de l’athérosclérose, conduisant à la sclérose, puis au rétrécissement valvulaire aortique.
Cette sténose est responsable d’un obstacle à l’éjection du ventricule gauche avec augmentation de la post-charge ventriculaire gauche. L’hypertrophie concentrique de ce dernier, initialement compensatrice, évolue spontanément vers une dysfonction systolique et une insuffisance cardiaque congestive.
Signes cliniques
Des symptômes d’effort sont évocateurs : dyspnée – parfois décrite comme une simple fatigue –, angor, syncope, lipothymie ; cependant, ils ne sont pas spécifiques et peuvent être dus à d’autres pathologies associées (maladie coronaire, pulmonaire, troubles du rythme cardiaque ou de la conduction). Ils doivent conduire à des explorations spécialisées. À l’inverse, une limitation fonctionnelle liée à l’âge et/ou aux comorbidités peut rendre difficile l’interprétation d’éventuels signes survenant à l’effort. Ainsi, il n’est pas rare que des patients soient diagnostiqués lors d’un épisode d’insuffisance cardiaque aiguë (œdème aigu pulmonaire, anasarque avec souvent passage en fibrillation auriculaire), pourtant tardif dans l’histoire naturelle de la maladie, ou lors d'un BAV syncopal ou non.
étape importante : l’évaluation des comorbidités, de l’état physiologique et de la fragilité de la personne âgée conditionne la prise en charge.
À l’auscultation cardiaque, le souffle est systolique, éjectionnel, entendu surtout au foyer aortique (2e espace intercostal droit) en position penchée en avant (zone de projection de l’aorte), mais également à tous les foyers, en écharpe. Le timbre du rétrécissement aortique est rude, râpeux. Son irradiation bilatérale aux vaisseaux du cou en l’absence de sténose carotidienne est caractéristique.
L’abolition du B2 (bruit de fermeture des sigmoïdes aortiques) est un signe spécifique mais peu sensible. Le retard du maximum d’intensité du souffle aortique dans la systole traduit classiquement la gravité. L’intensité n’est pas corrélée à la sévérité de la sténose. Un rétrécissement modéré peut s’accompagner d’un souffle important, surtout en situation d’hyper- débit cardiaque (anémie, hyperthyroïdie).
À l’inverse, lorsque la sténose est évoluée, s’y associe une baisse du débit cardiaque et transvalvulaire, et par conséquent de l’intensité du souffle. À noter qu’on peut retrouver un souffle diastolique en cas d’insuffisance aortique concomitante, la restriction du mouvement valvulaire lié aux calcifications étant à la fois systolique et diastolique.
Bilan complémentaire
La radiographie thoracique peut mettre en évidence des calcifications valvulaires, des signes d’insuffisance cardiaque gauche, une aorte « porcelaine » (lésions athéromateuses étendues, friables).
La concentration plasmatique du BNP (ou NT-pro-BNP) est plus élevée en cas de symptômes mais elle est variable chez les patients âgés, parfois normale malgré une authentique sténose serrée ; son niveau dépend des comorbidités (âge, HTA, fibrillation atriale associée, insuffisance rénale, hypertension pulmonaire…). Rappelons que sa concentration tend à diminuer chez les sujets obèses.
Échocardiographie
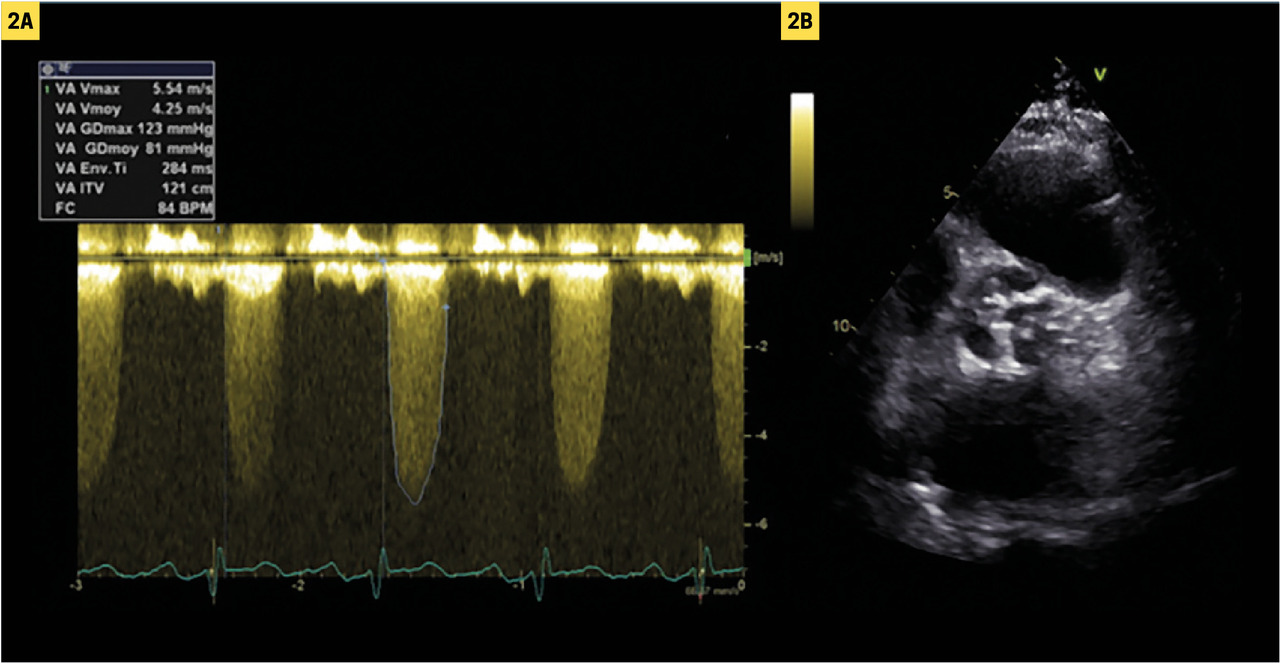
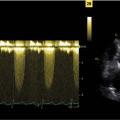
L’écho-doppler cardiaque apprécie la sévérité de la sténose et évalue la fonction ventriculaire gauche, le débit cardiaque, la FEVG (normale si > 50 %). On recherche une éventuelle hypertrophie, une dilatation de l’aorte ascendante et d’autres valvulopathies.
Pour simplifier, la sténose est considérée comme serrée si la vitesse maximale du flux transaortique en doppler continu (Vmax) est supérieure à 4 m/s ou si le gradient moyen de pression transaortique est supérieur à 40 mmHg (
En revanche, chez les sujets dont le débit est soit trop élevé (anémie ou fistule artério-veineuse chez un patient hémodialysé par exemple), soit trop bas (altération de la fonction systolique du VG), vitesses et gradients transvalvulaires peuvent être respectivement sur- ou sous-estimés. La mesure de la surface fonctionnelle valvulaire (équation de continuité) en écho-doppler cardiaque est alors utile : si elle est > 1 cm² chez un patient dont le débit cardiaque est normal ou élevé, on peut considérer qu’il s’agit d’une sténose modérée (serrée si < 1 cm2). à l’inverse, en cas de débit bas ou normal, si la surface est ≤ 1 cm2 malgré des gradients et des vitesses transvalvulaires n’atteignant pas les seuils de sévérité (en pratique 20 % des patients avec sténose serrée sur le critère de surface), d’autres examens sont souvent nécessaires pour affirmer la gravité (échocardiographie sous faibles doses de dobutamine, mesure du score calcique valvulaire par scanner, cathétérisme cardiaque). Cette évaluation complexe est réalisée dans un centre expert en valvulopathies (Heart Valve Center), selon les recommandations européennes.3
L’examen échocardiographique conclut parfois à une sténose aortique modérée associée à une autre maladie cardiaque nécessitant une prise en charge spécifique indépendante (cardiopathie ischémique, insuffisance cardiaque à fraction d’éjection préservée, conséquence d’une HTA au long cours, amylose cardiaque...).
Stratégie thérapeutique
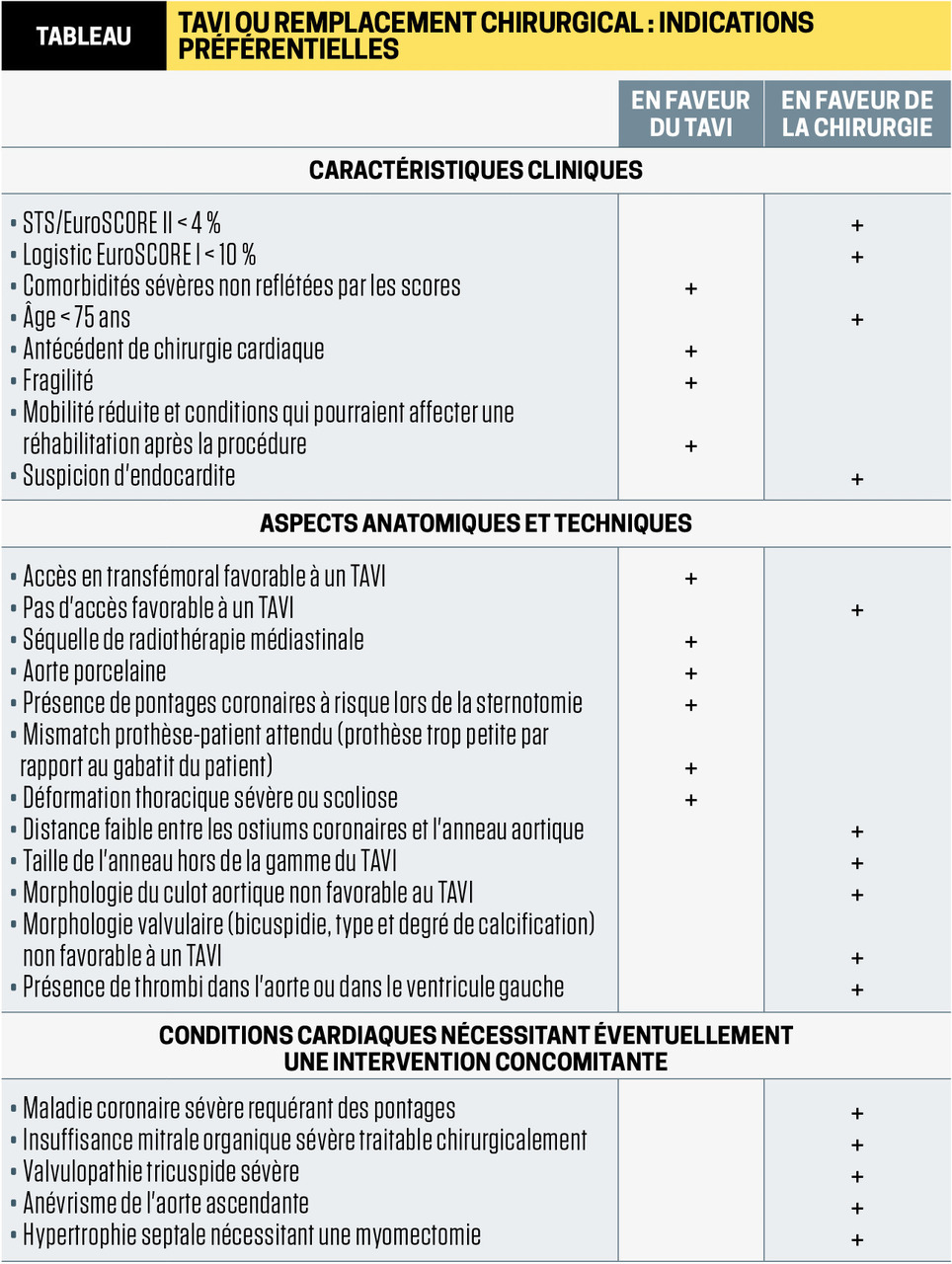
Selon les recommandations actuelles, la chirurgie est en règle réalisée chez les patients à faible risque opératoire, en cas de sténose aortique sévère symptomatique, ou avec dysfonction systolique du ventricule gauche (FEVG < 50 %).2 Si le rétrécissement est très serré (Vmax > 5,5 m/s), elle peut être discutée d’emblée même en l’absence de symptômes.
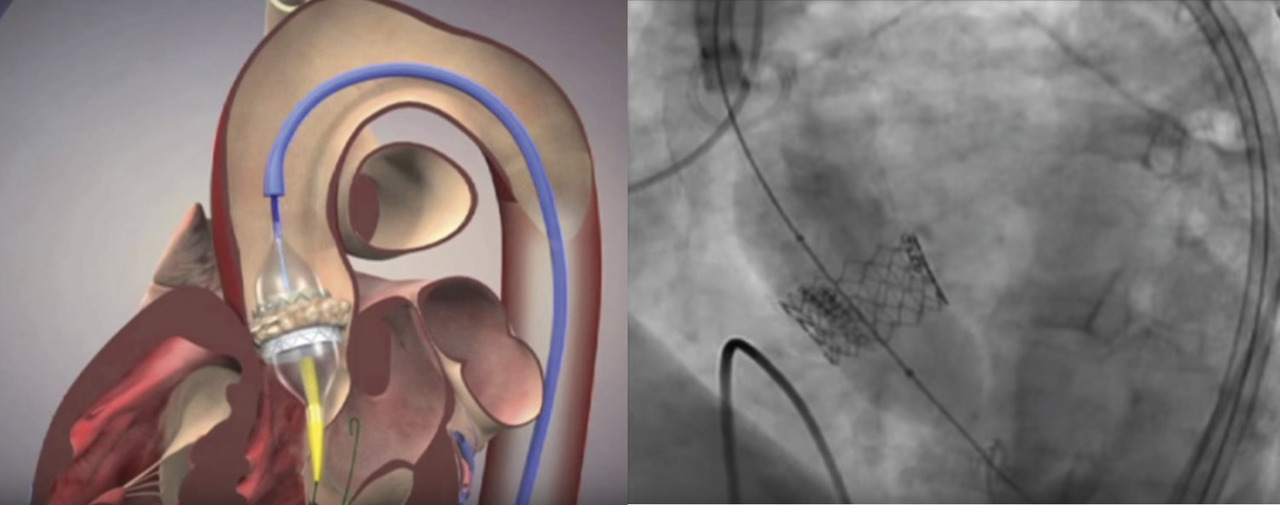
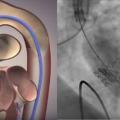
Chez les plus de 75-80 ans et les sujets ayant un thorax « hostile » en raison d’un antécédent de radiothérapie ou de chirurgie cardiaque, ou dont le risque opératoire (EuroSCORE II ou score STS) est intermédiaire ou élevé, l’implantation d’une bioprothèse par voie percutanée (TransArterial Valve Implantation, TAVI) est désormais préférée (
Même si cette procédure est moins lourde par rapport à une thoracotomie sous CEC, elle est accompagnée d’une morbidité non négligeable : risque d’AVC embolique, nécessité d’implantation de stimulateurs cardiaques après la procédure, hémopéricarde, complications vasculaires, rénales, endocardite sur prothèse, complications des angioplasties coronaires réalisées avant le TAVI… à noter que l'éradication des foyers infectieux extracardiaques s’impose de la même façon qu’avant remplacement chirurgical. De plus, le recul sur la durabilité de ces prothèses montées sur un stent est encore limité (5 ans au maximum, études menées chez des sujets très âgés à haut risque et taux de mortalité élevé) pour généraliser leur implantation chez des sujets à faible risque dont l’espérance de vie est élevée.
Par ailleurs, il faut éviter un TAVI inutile chez des personnes âgées ayant des troubles cognitifs ou une limitation fonctionnelle majeure (marche absente ou très réduite en déambulateur, absence de vie sociale) et lorsque l’espérance de vie est < 1 an en raison de comorbidités importantes conditionnant le pronostic. Dans ces cas, un traitement médical focalisé sur les symptômes doit être proposé, en vue d’améliorer la qualité et non l’espérance de vie.
La décision est prise au cas par cas par l’équipe multi- disciplinaire au sein du centre expert (Heart Team) qui prend en compte les comorbidités, le risque chirurgical, la balance bénéfices/risques.
Chez le patient ayant une sténose aortique sévère asymptomatique ou avec des symptômes équivoques à l’interrogatoire, et dont l’état général est compatible avec la chirurgie, il est recommandé de réaliser un test d’effort sur tapis roulant dans un centre des valvulopathies (contre-indiqué en cas de rétrécissement serré avec des symptômes évidents dès l’interrogatoire).
Si ce test est interrompu pour dyspnée à faible charge, ou s’il existe une chute tensionnelle à l’effort, le patient est considéré comme « faux asymptomatique », et le remplacement valvulaire aortique chirurgical peut être proposé.
En l’absence d’anomalie, il peut être suivi tous les 6 mois en attendant la survenue de symptômes spontanés. Cela impose un temps essentiel d’éducation thérapeutique, qui implique le patient, le médecin traitant, le cardiologue de proximité et le centre expert au sein d’un réseau de soins « maladie valvulaire ».9
Ainsi, une étude observationnelle récente a montré que les symptômes de la sténose aortique sont mal connus des patients, malgré une information initiale, mais aussi des médecins traitants,10 alors qu’il s’agit d’un prérequis à la surveillance ambulatoire de ces malades en toute sécurité.
Le centre expert doit être disponible pour les réévaluer plus tôt que prévu, à leur demande ou à celle du médecin traitant, grâce par exemple à une ligne directe dédiée, impliquant des infirmières spécialisées, comme cela a été mis en place dans notre centre (Groupement des hôpitaux de l’Institut catholique de Lille, hôpital Saint-Philibert). Le sport de compétition (rarement pratiqué dans la population gériatrique…) est contre-indiqué.
En cas de sténose aortique modérée (surface valvulaire fonctionnelle > 1 et < 1,5 cm²), un suivi annuel est préconisé, sa progression étant très variable d’un patient à l’autre.
Surveillance
L’optimisation du traitement antihypertenseur est souvent nécessaire (réduction importante de la post-charge). Le suivi est ensuite organisé de façon annuelle ou plus tôt en cas de réapparition de symptômes.
Retenons que l’implantation d’un substitut valvulaire, quelle que soit sa modalité (percutanée ou chirurgicale) est également associée à un risque inhérent à la prothèse (thrombose sur prothèse), hémorragique (anticoagulants ou antiagrégants plaquettaires), infectieux (endocardite sur prothèse) et à long terme (nécessité potentielle de réintervenir lors de la dégénérescence inéluctable de la bioprothèse).
Les patients opérés, comme ceux atteints de valvulopathie, sont aussi à haut risque d’endocardite infectieuse et doivent bénéficier d’un suivi dentaire tous les 6 mois et d’une antibioprophylaxie en cas de soins.
La mortalité d’une sténose aortique serrée asymptomatique est inférieure à 1 %. En cas de symptômes, la survie médiane est de 4,5 ans si douleurs thoraciques, 2,6 ans si malaises, 1 an si insuffisance cardiaque. La mortalité est de 3-4 % dans les 3 premiers mois suivant l’apparition de symptômes. La survie est globalement de 20 % à 3 ans si la dyspnée est NYHA III ou IV. Le risque chirurgical global est de 1 à 5 % (3 à 10 % chez les patients de plus de 80 ans). Il peut dépasser 10 % lors de pontage cororaire associé. Le pronostic peut être dégradé en raison de maladies concomitantes et d’autres cardiopathies. En cas de dysfonction VG, les risques à la fois évolutifs et de la chirurgie sont nettement supérieurs. Une dysfonction VG peut être la conséquence d’une sténose aortique très vieillie (avec ou sans récupération fonctionnelle possible) associée souvent à une autre étiologie telle qu’une cardiopathie ischémique.
Que dire au patient ?
La maladie valvulaire est liée à la formation de calcifications qui entraînent un obstacle à l’éjection du cœur. Chez le patient très âgé peu symptomatique,en raison d’une limitation fonctionnelle ou de comorbidités, le bénéfice du remplacement valvulaire sur les symptômes est peu probable ; l’objectif est de préserver la qualité de vie. En cas de sténose aortique « silencieuse » sans critère d’intervention immédiate, il faut consulter si des symptômes surviennent à l’effort (dyspnée, angor, lipothymies, syncopes). Si sténose modérée, un suivi cardiologique annuel est nécessaire. Une surveillance dentaire tous les 6 mois est indispensable, afin d’éviter une infection valvulaire (endocardite) dont le pronostic est catastrophique.
2. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017;38:2739-91.
3. Chambers JB, Prendergast B, Iung B, et al. Standards defining a ‘Heart Valve Centre’: ESC Working Group on Valvular Heart Disease and European Association for Cardiothoracic Surgery Viewpoint. Eur Heart J 2017;38:2177-83.
4. Cribier A, Eltchaninoff H, Bash A, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation 2002;106:3006-8.
5. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med 2016;374:1609-20.
6. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med 2010;363:1597-607.
7. Reardon MJ, Van Mieghem NM, Popma JJ, et al.; SURTAVI Investigators. Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med 2017;376:1321-31.
8. Smith CR, Leon MB, Mack MJ, et al.; PARTNER Trial Investigators. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med 2011;364:2187-98.
9. Marechaux S, Ennezat PV, Guerbaai RA, et al. Dedicated heart valve networks for improving the outcome of patients with valvular heart disease? Arch Cardiovasc Dis 2018;111:465-9.
10. Guerbaii RA, Fustier G, Ennezat PV, et al. Asymptomatic aortic stenosis: An assessment of patients’ and of their general practitioners’ knowledge, after an indexed specialized assessment in community practice. PloS One 2017;12:e0178932.

 Encadrés
Encadrés