La stratégie diagnostique des lésions intra-utérines est une question qui se pose très fréquemment en consultation de gynécologie. De nombreuses patientes consultent pour un bilan de métrorragies ou pour l’exploration d’une image intra-utérine découverte fortuitement à l’échographie, et il est essentiel d’adopter une démarche rigoureuse afin de ne pas méconnaître un cancer de l’endomètre ou, à l’inverse, ne pas imposer des examens complémentaires parfois douloureux et pas toujours nécessaires.
Le cancer de l’endomètre survient le plus souvent chez des femmes ménopausées ; les saignements sont le premier signe clinique dans la très grande majorité des cas. À l’inverse, bien qu’il soit beaucoup plus rare dans ce contexte, le cancer de l’endomètre peut être découvert lors du bilan de saignements utérins anormaux chez des patientes non ménopausées.
Le bilan histologique et d’imagerie à réaliser pour un cancer de l’endomètre a été précisé par des recommandations européennes dont la dernière mise à jour date de 2021.1
Saignements utérins anormaux : d’abord l’échographie
Les saignements génitaux sont l’un des motifs de consultation les plus fréquents en gynécologie. La première étape de la démarche diagnostique est l’interrogatoire, à la recherche de facteurs de risque de cancer de l’endomètre, puis l’examen clinique, avec notamment un examen vulvaire et au spéculum. Cet examen confirme l’origine utérine du saignement et permet d’éliminer une cause vulvaire, vaginale ou cervicale.
Femmes non ménopausées
Les saignements sont anormaux par leur mode de survenue (métrorragies, saignements provoqués) ou par leur durée ou leur abondance (ménorragies). Le prélèvement histologique est effectué soit de façon systématique devant un épaississement de l’endomètre, soit en cas d’image échographique suspecte.
Femmes ménopausées
Tout saignement, même minime, doit être considéré comme anormal et conduire à la réalisation d’un bilan ; les saignements post-ménopausiques sont en effet le premier signe clinique de cancer de l’endomètre dans plus de 90 % des cas.2
Le premier examen complémentaire à prescrire est une échographie pelvienne, réalisée si possible par voie vaginale et par un opérateur entraîné (une échographie « de débrouillage » aux urgences ou au cabinet par un opérateur non spécialisé en échographie gynécologique n’est pas suffisante pour éliminer un cancer de l’endomètre et arrêter là les explorations).
L’échographie permet d’examiner l’utérus et de mesurer l’épaisseur de l’endomètre. Elle recherche un épaississement ou une irrégularité de l’endomètre qui fait suspecter un processus endocavitaire (polype, cancer). L’échographie permet également d’explorer la structure du myomètre (fibrome, adénomyose) et les annexes à la recherche d’un kyste.
Lors d’un épisode unique de saignement utérin anormal et lorsque l’échographie estime l’épaisseur de l’endomètre inférieure ou égale à 4 mm, il est possible de surseoir à une exploration utérine complémentaire.3
En cas de saignements utérins anormaux récidivants ou lorsque l’épaisseur de l’endomètre est supérieure à 4 mm chez une femme ménopausée, des explorations utérines complémentaires (hystéroscopie et histologie) sont recommandées.3
Hystéroscopie diagnostique, un examen de consultation
L’hystéroscopie diagnostique est une exploration visuelle de la cavité endométriale à l’aide d’un endoscope. L’examen permet de préciser l’origine du saignement en visualisant un polype, un épaississement de l’endomètre, un processus endocavitaire suspect de cancer ou une atrophie endométriale.
Il s’agit d’un examen réalisé en consultation. La technique recommandée en première intention pour une hystéroscopie diagnostique est la vaginoscopie (grade A) avec un hystéroscope rigide (grade C), de diamètre inférieur ou égal à 3,5 mm (grade A), avec une distension au sérum physiologique (grade C) à température ambiante (accord d’experts), sans aucune anesthésie et sans aucune préparation médicamenteuse (grade B), au début de la phase folliculaire (après la fin des règles chez les patientes non ménopausées) [accord d’experts].4
Certains hystéroscopes sont équipés d’un canal opérateur et permettent la réalisation d’une biopsie dirigée sur le processus endocavitaire suspect. Le plus souvent, si une biopsie est indiquée, elle est exécutée à l’issue de l’examen avec une pipelle de Cornier ou, dans un second temps, par une hystéroscopie opératoire sous anesthésie.
Modalités du prélèvement histologique
Le prélèvement histologique est une étape essentielle de l’exploration des lésions intra-utérines. Il peut être réalisé en consultation par une biopsie d’endomètre (biopsie à la pipelle de Cornier ou à la canule de Novack) ; cette biopsie est faite « à l’aveugle », sans certitude quant au prélèvement de la zone suspecte. La pipelle est introduite dans la cavité endométriale, une dépression est réalisée et le prélèvement effectué avec des petits mouvements de va-et-vient en faisant tourner la pipelle pour essayer de prélever toutes les faces et de maximiser les chances d’obtenir le diagnostic. Cet examen est parfois douloureux, et sa mauvaise tolérance peut nécessiter d’arrêter la procédure. Il est parfois difficile d’accéder à la cavité endométriale en raison d’une sténose du col (patientes ménopausées) ou de la position utérine.
La biopsie d’endomètre a plus de chance d’être productive et donc pertinente en cas d’épaississement endométrial ou de lésion endométriale suspecte de cancer. En cas d’atrophie endométriale ou de lésion endocavitaire focale (polype, myome), la biopsie est le plus souvent négative et donc non contributive.
Si la biopsie d’endomètre permet le diagnostic de cancer de l’endomètre, il n’est pas nécessaire de proposer systématiquement un complément de biopsie par hystéroscopie opératoire sous anesthésie car, même s’il existe environ 20 % de discordances entre l’appréciation préopératoire du type histopathologique et du grade et le diagnostic définitif sur pièce opératoire, le prélèvement en hystéroscopie opératoire n’améliore pas cette discordance.5
En cas de biopsie d’endomètre non contributive ou négative et d’échographie ou d’hystéroscopie diagnostique évocatrice d’une lésion endo-utérine, les explorations doivent être poursuivies. Une biopsie par hystéroscopie opératoire sous anesthésie ou un curetage permettent alors de faire le diagnostic histologique.
Identification du type histologique et des marqueurs moléculaires
Le diagnostic de cancer de l’endomètre est porté par l’analyse anatomopathologique de la biopsie d’endomètre. Cette analyse est un temps essentiel de la prise en charge car elle détermine en partie le pronostic et guide les traitements. Les dernières recommandations européennes concernant la prise en charge des patientes présentant un cancer de l’endomètre publiées en 2021 ont précisé les éléments indispensables pour le diagnostic histologique.1 L’analyse de la biopsie identifie le type histologique : ces types sont maintenant regroupés en endométrioïde ou non endométrioïde (séreux, cellules claires, carcinosarcomes) ; le grade est désormais qualifié de bas ou de haut.
Il est recommandé de réaliser une analyse complémentaire associant des marqueurs immunohistochimiques (p53, MLH1, PMS2, MSH6 et MSH2) et un test moléculaire (analyse de mutation du domaine exonucléase de POLE [polymerase epsilon]). Cette classification moléculaire est particulièrement encouragée pour les tumeurs de haut grade. L’analyse des mutations de POLE peut être omise dans les cas de tumeurs à faible risque et risque intermédiaire avec un bas grade histologique.
Une partie de ces analyses a pour objectif d’évoquer un syndrome de Lynch ou un cancer colorectal héréditaire sans polypose syndrome (HNPCC) qui est une maladie génétique responsable d’une augmentation du risque de développer certains cancers, principalement colorectaux et gynécologiques. Une consultation d’oncogénétique est proposée selon les résultats.
L’IRM pour explorer l’extension
Une fois le diagnostic histologique établi, le bilan d’imagerie permet de déterminer l’extension locale et à distance du cancer. Examen indispensable au bilan du cancer de l’endomètre, l’imagerie par résonance magnétique (IRM) abdominopelvienne inclut les aires ganglionnaires aortiques (
La recherche de métastases extrapelviennes par un autre examen complémentaire est nécessaire en cas de cancer à « haut risque ». Celui-ci est déterminé par l’analyse histologique et moléculaire et par l’IRM : en cas d’extension locorégionale, de suspicion d’atteinte annexielle ou ganglionnaire. Pour cela, un TEP-scan est réalisé en première intention ou, à défaut, un scanner thoraco-abdomino-pelvien.
Échographie pelvienne et biopsie de l’endomètre indispensables au diagnostic
Le bilan des lésions endo-utérines doit donc répondre à une démarche rigoureuse afin de ne pas méconnaître un cancer de l’endomètre ou, à l’inverse, de ne pas réaliser trop d’examens complémentaires parfois invasifs, douloureux et coûteux.
L’échographie pelvienne et la biopsie d’endomètre ont une place très importante dans la stratégie diagnostique. En cas de découverte d’un cancer de l’endomètre, l’examen clé est l’IRM lombopelvienne.
Éléments d’interprétation de l’IRM lombopelvienne
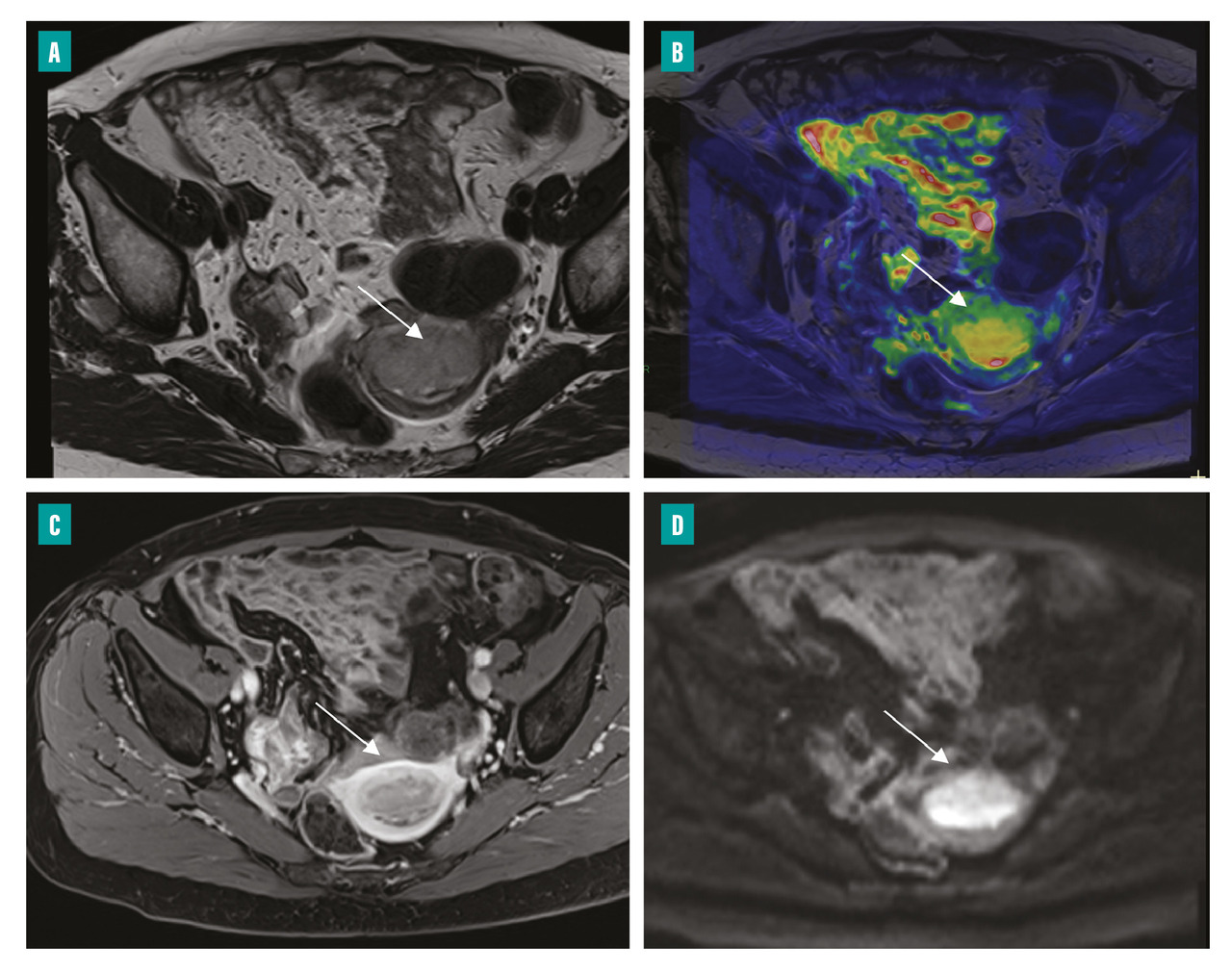
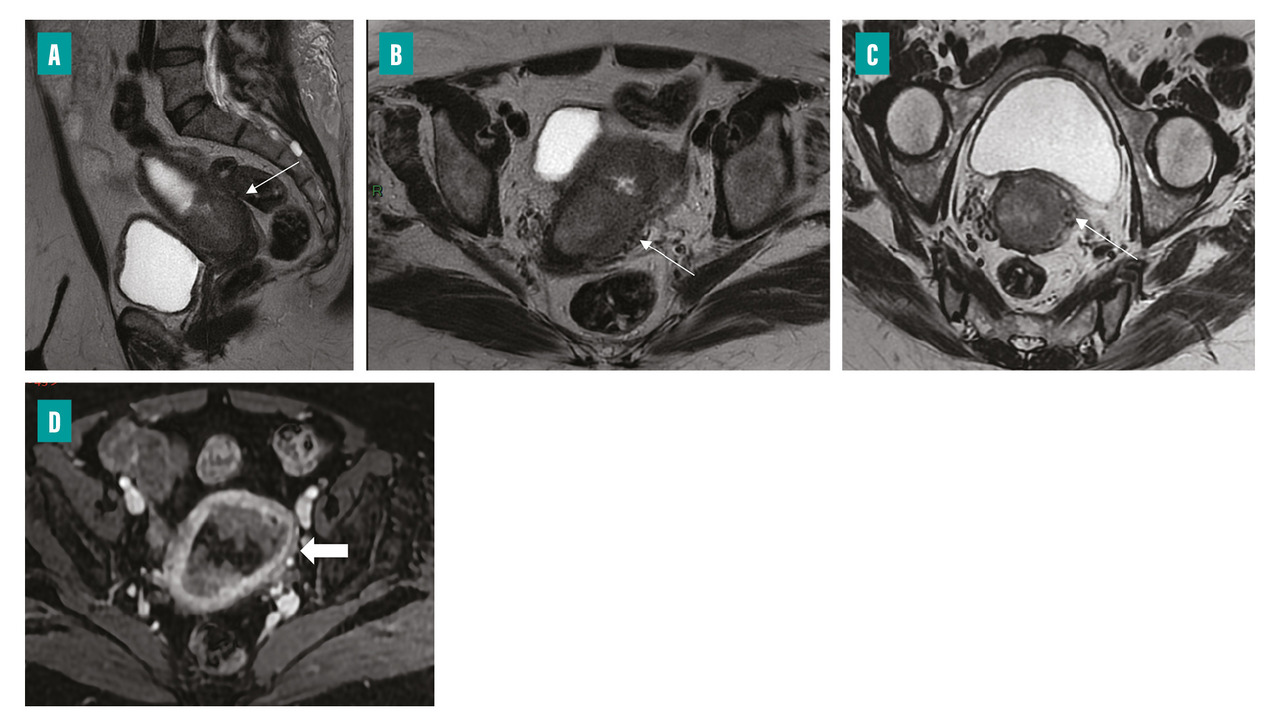
Le bilan d’extension locorégional préopératoire repose sur l’imagerie par résonance magnétique (IRM) pelvienne qui permet de mieux stratifier les patientes selon leur risque. Le protocole d’examen comporte des séquences axiales et sagittales T2, des séquences T1 après injection, dynamiques ou uniphasiques à 2 minutes 30 (temps auquel la différence de contraste entre le myomètre et le cancer de l’endomètre est maximale), et des séquences de diffusion (fig. 1). Ces dernières améliorent les performances de l’IRM dans l’évaluation de l’atteinte myométriale. À ces séquences centrées sur le pelvis s’ajoute une séquence lombopelvienne remontant jusqu’au plan de la veine rénale afin de juger d’une éventuelle extension ganglionnaire lombo-aortique. Le cancer endométrial est en signal T2 intermédiaire (l’endomètre normal étant en hypersignal T2), avec une prise de contraste inférieure à celle du myomètre et un hypersignal de diffusion avec chute de l’ADC (coefficient de diffusion apparent).
Le compte-rendu précise l’élément-clé qu’est le degré d’envahissement myométrial et/ou du stroma cervical, difficile à évaluer cliniquement. L’infiltration myométriale en IRM s’observe principalement sur les séquences pondérées T2, par interruption de la zone jonctionnelle qui est hypo-intense. Après la ménopause, le myomètre s’atrophie et la zone jonctionnelle s’amincit, rendant parfois l’invasion myométriale difficile à estimer. En cas d’infiltration du stroma cervical, il existe une interruption de l’anneau fibreux du col de l’utérus (à l’état normal en hyposignal T2 franc). Cette dernière est visualisée de façon optimale dans un plan T2 perpendiculaire au col (fig. 2).
Certains éléments peuvent par ailleurs orienter vers le type histologique ; ainsi, un aspect plus hétérogène sur les différentes séquences et un petit axe supérieur à 24 mm plaide en faveur d’un cancer de sous-type non endométrioïde.6
L’IRM occupe donc une place déterminante et permet d’anticiper la nécessité d’une exploration ganglionnaire, le risque d’atteinte ganglionnaire augmentant avec la profondeur de l’extension au niveau du myomètre et avec le type histologique.
1. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Concin N, Matias-Guiu X, Vergote I, Cibula D, Mirza MR, Marnitz S, et al. Int J Gynecol Cancer 2021;31(1):12-39.
2. Judd HL, Mebane-Sims I, Legault C, Wasilauskas C, Johnson S, Merino M, et al. The Postmenopausal Estrogen/Progestin Interventions (PEPI) Trial. Effects of hormone replacement therapy on endometrial histology in postmenopausal women. JAMA 1996;275(5):370-5.
3. Hamdaoui N, Boubli L. La gestion des effets secondaires sous traitement hormonal de la ménopause : saignements utérins anormaux. RPC Les femmes ménopausées du CNGOF et du GEMVi. Practice Guideline. Gynecol Obstet Fertil Senol. 2021;49(5):474-84.
4. Deffieux X, Gauthier T, Ménager N, Legendre G, Agostini A, Pierre F. Prevention of the complications related to hysteroscopy: guidelines for clinical practice. J Gynecol Obstet Biol Reprod (Paris) 2013;42(8):1032-49.
5. Phelippeau J, Canlorbe G, Bendifallah S, Naoura I, Lefevre M, Ballester M, Daraï E. Preoperative diagnosis of tumor grade and type in endometrial cancer by pipelle sampling and hysteroscopy: results of a french study. Surg Oncol 2016; 25:370-7.
6. Lavaud P , Fedida B , Canlorbe G, Bendifallah S, Daraï E, Thomassin-Naggara I. Preoperative MR imaging for ESMO-ESGO-ESTRO classification of endometrial cancer. Diagn Interv Imaging 2018;99(6):387-96.
Dans cet article
- Saignements utérins anormaux : d’abord l’échographie
- Hystéroscopie diagnostique, un examen de consultation
- Modalités du prélèvement histologique
- Identification du type histologique et des marqueurs moléculaires
- L’IRM pour explorer l’extension
- Échographie pelvienne et biopsie de l’endomètre indispensables au diagnostic

 Encadrés
Encadrés