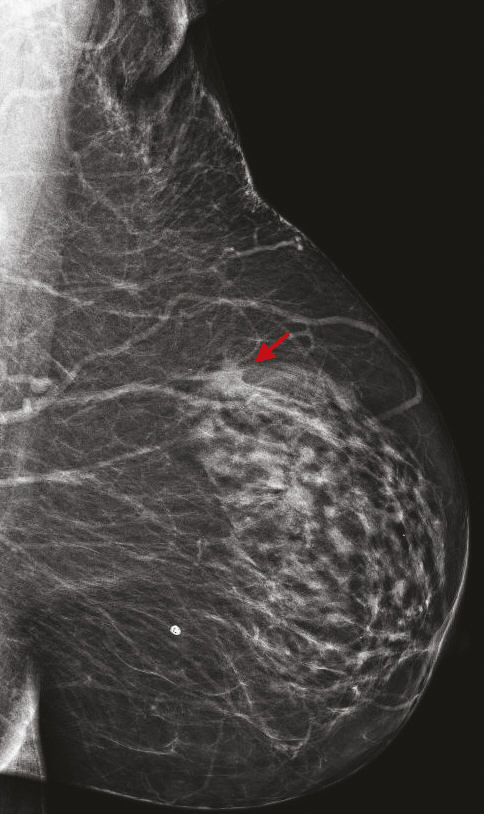
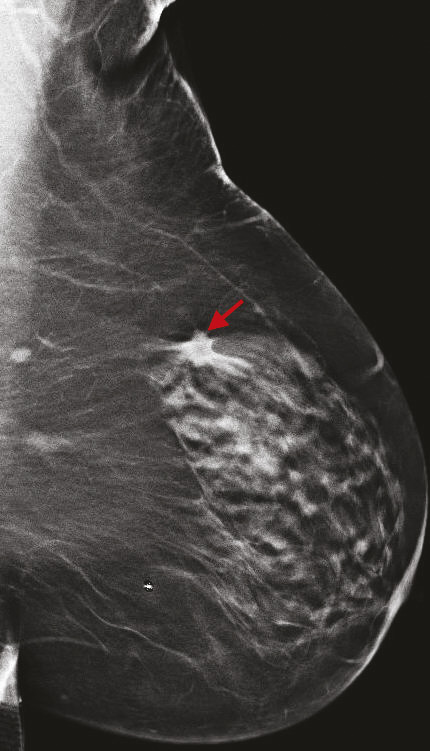
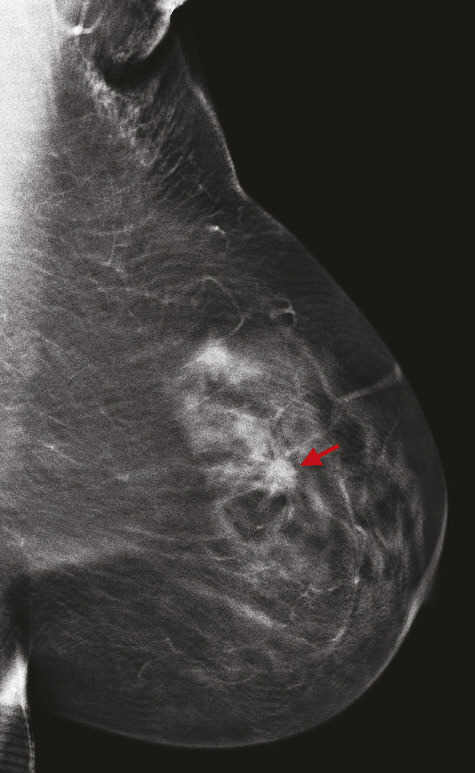
Avec 58 459 nouveaux cas diagnostiqués de cancer du sein et 12 146 décès en 2018,1 le cancer du sein demeure le cancer le plus fréquent et une des premières causes de décès par cancer en France chez la femme. Une diminution de la mortalité a été constamment observée entre 1990 et 2018 et peut être liée d’une part aux progrès des thérapeutiques du cancer du sein, et d’autre part à un diagnostic plus précoce lié au dépistage par imagerie. Les programmes nationaux de dépistage organisé du cancer du sein ont été fondés sur les résultats de grands essais randomisés publiés au cours des dernières années, l’âge restant le principal critère de sélection de la population de femmes à inviter au dépistage, cet âge pouvant varier entre les pays, à partir de 40-50 ans, et jusqu’à 69-74 ans. Selon les pays, le rythme des mammographies de dépistage varie également, de tous les ans (aux États-Unis) à tous les 3 ans (au Royaume-Uni). Plusieurs larges essais randomisés contrôlés et méta-analyses ont ainsi évalué l’apport du dépistage organisé dans la réduction de la mortalité par cancer du sein, avec une réduction estimée de la mortalité de 12 à 58 %,2, 3 et une moyenne estimée à 21 %. Nous ferons ici le point sur l’apport de l’imagerie dans le dépistage du cancer du sein, pour les femmes sans facteurs de risque mais aussi pour les femmes à risque identifié.
Efficacité du dépistage organisé du cancer du sein
Onze grands essais randomisés (New York Health Insurance Plan [HIP], Malmö I and II, Comté de Suède 2 [Kopparberg et Östergötland], Canada I et II, Stockholm, Göteborg, UK Age Trial, et Edinburgh) ainsi que plusieurs revues systématiques de la littérature ont évalué l’apport du dépistage organisé dans la réduction de la mortalité par cancer du sein4, 5 et ont montré l’efficacité du dépistage du cancer du sein par la mammographie, par une réduction de 20 % en moyenne. L’évaluation par un panel d’experts anglais indépendant en 2013 a estimé que le dépistage par mammographie à partir de 50 ans permettrait d’éviter un décès par cancer du sein pour environ 250 femmes invitées.4 Une méta-analyse récente3 incluant 36 études de cohorte, 17 études cas-contrôle et 7 essais randomisés a montré que la mortalité par cancer du sein pouvait même diminuer encore plus que précédemment, allant jusqu’à 58 % dans certains pays d’Europe de l’Ouest.3 L’important, toutefois, pour arriver à ces résultats est la participation des femmes aux programmes proposés ; cependant, les taux de participation ne sont pas toujours optimaux, comme en France où ils ont atteint un seuil inférieur à 50 % (49,9 %) en 2017, avec une hétérogénéité selon les départements (de 32 à 68 %).6
Modalités du dépistage du cancer du sein en France
Dépistage organisé
En France, le programme de dépistage du cancer du sein a été établi en 1994 en se fondant sur les recommandations européennes avec des programmes pilotes dans quelques régions françaises, puis a été généralisé à l’ensemble du territoire français en 2004 lors du 1er Plan cancer. L’objectif était d’obtenir une baisse de la mortalité par cancer du sein par une participation des femmes suffisante au dépistage, tout en générant le moins possible de cas faux positifs. Le dépistage organisé cible les femmes de 50 à 74 ans, qui reçoivent tous les 2 ans une invitation à participer au dépistage, avec une mammographie gratuite. Ce dépistage comprend : un examen clinique mammaire par le radiologue présent sur place et une mammographie bilatérale avec deux incidences (incidences de face et oblique externe) interprétée par un radiologue accrédité selon la classification Breast Imaging-Reporting And Data System (Bi-RADS) établie par l’American College of Radiology (ACR). Une deuxième lecture par un autre radiologue accrédité est organisée si la première lecture de la mammographie ne révèle pas d’anomalie, le but de cette deuxième lecture étant d’augmenter la sensibilité du programme de dépistage, et de réduire les faux négatifs estimés entre 5 et 15 %.6 Une échographie mammaire complémentaire peut être proposée si nécessaire, en cas de densité mammaire élevée par exemple (seins de densité C et D selon l’échelle de densité de l’ACR). Il faut signaler toutefois que l’échographie n’est pas considérée comme un examen de dépistage d’emblée, car il n’y a pas de contrôle qualité des échographes ; de plus, il est difficile de vérifier si l’examen a été complet car les images fournies ne sont qu’un extrait de l’examen. Il existe des systèmes d’échographie automatisée du sein, utilisant une large sonde manipulée par un technicien, avec la possibilité d’enregistrer un examen en entier avec plusieurs incidences par sein, et des reconstructions multiplanaires, mais ces systèmes se développent peu en France où l’échographie mammaire est faite par les radiologues et non pas par les manipulateurs. Par ailleurs, l’échographie n’est pas gratuite, contrairement à la mammographie réalisée dans le cadre du dépistage organisé, mais remboursée au tarif réglementé.
En cas de mammographie anormale en première lecture, un bilan de diagnostic immédiat (agrandissements, échographie mammaire) peut être proposé par le radiologue sur place afin de classer rapidement une image suspecte/bénigne ou au contraire d’orienter rapidement la femme vers les structures de prise en charge adéquates. Depuis 2008, la mammographie numérique a été introduite en France de manière croissante dans le cadre du dépistage organisé. Plusieurs études randomisées ont comparé l’apport de la mammographie numérique en comparaison à la mammographie analogique.7 La mammographie numérique plein champ améliore la lecture en présence de seins denses en comparaison à la mammographie analogique, notamment chez les femmes de moins de 50 ans pré- ou périménopausées, et ces études ont également montré des taux de détection plus élevés d’anomalies, notamment de microcalcifications et de carcinomes au stade précoce (principalement in situ, également de petite taille pT1a).7 Les radiologues sont maintenant équipés à plus de 95 % en France avec des systèmes de mammographie numérique et, depuis septembre 2019, l’utilisation de la mammographie analogique en dépistage organisé n’est plus autorisée.
En cas de mammographie anormale en première lecture, un bilan de diagnostic immédiat (agrandissements, échographie mammaire) peut être proposé par le radiologue sur place afin de classer rapidement une image suspecte/bénigne ou au contraire d’orienter rapidement la femme vers les structures de prise en charge adéquates. Depuis 2008, la mammographie numérique a été introduite en France de manière croissante dans le cadre du dépistage organisé. Plusieurs études randomisées ont comparé l’apport de la mammographie numérique en comparaison à la mammographie analogique.7 La mammographie numérique plein champ améliore la lecture en présence de seins denses en comparaison à la mammographie analogique, notamment chez les femmes de moins de 50 ans pré- ou périménopausées, et ces études ont également montré des taux de détection plus élevés d’anomalies, notamment de microcalcifications et de carcinomes au stade précoce (principalement in situ, également de petite taille pT1a).7 Les radiologues sont maintenant équipés à plus de 95 % en France avec des systèmes de mammographie numérique et, depuis septembre 2019, l’utilisation de la mammographie analogique en dépistage organisé n’est plus autorisée.
Dépistage individuel
En France, la particularité est qu’il coexiste un dépistage organisé et un dépistage individuel. Le dépistage individuel consiste en la réalisation d’une mammographie de dépistage pour une femme asymptomatique et volontaire de moins de 50 ans ou de plus de 74 ans. Les radiologues sont les mêmes en dépistage organisé et individuel, avec les mêmes prérequis de formation, de lecture de mammographies (avec un seuil minimal > 500/an pour un radiologue premier lecteur, et > 2 000/an pour un second lecteur), de matériel de mammographie qui doit être contrôlé tous les 6 mois par un organisme indépendant, et avec des contrôles qualité quotidiens réalisés par les manipulateurs. La grande différence est qu’il n’y a pas de double lecture des clichés normaux par un second lecteur, et donc un risque de faux négatifs en cas de lésion subtile, d’inattention du radiologue ou de lecture difficile dans un sein dense. Il n’y a pas non plus de pilotage ou d’enregistrement des résultats, et cette activité est donc plus difficile à analyser. Le taux de participation en dépistage individuel en France est estimé à 10 % (source www.has-sante.fr).
Tomosynthèse et dépistage
La tomosynthèse est une technique de mammographie développée depuis plus de 15 ans qui consiste non plus à acquérir deux images fixes du sein, mais un volume d’images, par un déplacement du tube de rayons X sur une angulation définie. Ainsi, le nombre d’images varie selon l’épaisseur du sein. L’avantage de cette technique est de s’affranchir d’une partie des effets masquants du tissu mammaire sur d’éventuelles lésions, et de mieux définir les contours des lésions bénignes et des cancers.
Cette technique permet d’augmenter le taux de détection des cancers, principalement invasifs, en particulier dans les seins denses de type C. Une récente étude prospective italienne a montré que la tomosynthèse mammaire deux incidences (face, oblique), associée à la vue synthétique (image 2D reconstruite à partir du volume 3D), permettait d’augmenter significativement le taux de cancers.8 Dans cette étude, 16 666 femmes asymptomatiques âgées de 50 à 69 ans ont été dépistées dans le programme de dépistage de Vérone avec une tomosynthèse deux incidences, comportant une analyse complémentaire de la vue synthétique. Les résultats ont été comparés à ceux de la précédente cohorte de dépistage de 2014, où les mammographies avaient été acquises uniquement en 2D (14 443 femmes).9 Le programme avec tomosynthèse et vue synthétique a permis une augmentation de détection de cancers invasifs significatifs par rapport au programme de dépistage 2D, avec un taux de détection de 9,30 versus 5,41 cancers pour 1 000 femmes. Ce qui est intéressant est que les cancers dépistés étaient plus souvent des cancers invasifs de stade 1 (72,3 % avec la tomosynthèse vs 50 % avec la mammographie 2D), avec moins de cancers in situ (9 % avec la tomosynthèse vs 26,9 % avec la mammographie 2D). Le taux de rappel était similaire entre les deux techniques (4 % pour la tomosynthèse vs 4,2 % pour la mammographie 2D). Ces résultats sont en accord avec les principales études prospectives et rétrospectives comparant l’apport de la tomosynthèse par rapport à la mammographie 2D.10 11
Une grande étude américaine (étude T-MIST) financée par le National Health Institute et contrôlée par l’American College of Radiology Imaging Network (ACRIN) et l’Eastern Cooperative Oncology Group (ECOG) a débuté en juillet 2017, et se terminera en 2025.12 Dans cet essai prospectif randomisé de phase III, tous les systèmes de mammographie commercialement disponibles et agréés par la Food and Drug Administration (FDA) pourront être utilisés ; 165 000 femmes asymptomatiques âgées de 45 à 74 ans seront incluses dans l’étude. Elles seront randomisées dans deux bras, soit tomosynthèse seule, soit mammographie 2D seule, avec une mammographie (annuelle en l’absence de ménopause, ou tous les deux chez les femmes ménopausées) pendant 5 ans. Le but de cette étude est notamment d’évaluer le nombre de cancers invasifs détectés dans chaque bras.
Il est probable qu’à l’issue de cette étude, si les résultats sont en faveur de la tomosynthèse, cela favorisera le passage au dépistage par tomosynthèse dans tous les pays qui pratiquent le dépistage, comme cela a été le cas avec l’étude DMIST en 2005, dont les résultats ont été en faveur de la mammographie numérique par rapport à la mammographie analogique, notamment dans les seins denses.7
Actuellement en France, la tomosynthèse n’est pas autorisée en dépistage organisé. Les radiologues peuvent l’utiliser en dépistage individuel ou en cas de symptôme, ou en seconde intention pour caractériser une image ambiguë. Cette technique est en cours d’évaluation par la Haute Autorité de santé (HAS).
Cette technique permet d’augmenter le taux de détection des cancers, principalement invasifs, en particulier dans les seins denses de type C. Une récente étude prospective italienne a montré que la tomosynthèse mammaire deux incidences (face, oblique), associée à la vue synthétique (image 2D reconstruite à partir du volume 3D), permettait d’augmenter significativement le taux de cancers.8 Dans cette étude, 16 666 femmes asymptomatiques âgées de 50 à 69 ans ont été dépistées dans le programme de dépistage de Vérone avec une tomosynthèse deux incidences, comportant une analyse complémentaire de la vue synthétique. Les résultats ont été comparés à ceux de la précédente cohorte de dépistage de 2014, où les mammographies avaient été acquises uniquement en 2D (14 443 femmes).9 Le programme avec tomosynthèse et vue synthétique a permis une augmentation de détection de cancers invasifs significatifs par rapport au programme de dépistage 2D, avec un taux de détection de 9,30 versus 5,41 cancers pour 1 000 femmes. Ce qui est intéressant est que les cancers dépistés étaient plus souvent des cancers invasifs de stade 1 (72,3 % avec la tomosynthèse vs 50 % avec la mammographie 2D), avec moins de cancers in situ (9 % avec la tomosynthèse vs 26,9 % avec la mammographie 2D). Le taux de rappel était similaire entre les deux techniques (4 % pour la tomosynthèse vs 4,2 % pour la mammographie 2D). Ces résultats sont en accord avec les principales études prospectives et rétrospectives comparant l’apport de la tomosynthèse par rapport à la mammographie 2D.10 11
Une grande étude américaine (étude T-MIST) financée par le National Health Institute et contrôlée par l’American College of Radiology Imaging Network (ACRIN) et l’Eastern Cooperative Oncology Group (ECOG) a débuté en juillet 2017, et se terminera en 2025.12 Dans cet essai prospectif randomisé de phase III, tous les systèmes de mammographie commercialement disponibles et agréés par la Food and Drug Administration (FDA) pourront être utilisés ; 165 000 femmes asymptomatiques âgées de 45 à 74 ans seront incluses dans l’étude. Elles seront randomisées dans deux bras, soit tomosynthèse seule, soit mammographie 2D seule, avec une mammographie (annuelle en l’absence de ménopause, ou tous les deux chez les femmes ménopausées) pendant 5 ans. Le but de cette étude est notamment d’évaluer le nombre de cancers invasifs détectés dans chaque bras.
Il est probable qu’à l’issue de cette étude, si les résultats sont en faveur de la tomosynthèse, cela favorisera le passage au dépistage par tomosynthèse dans tous les pays qui pratiquent le dépistage, comme cela a été le cas avec l’étude DMIST en 2005, dont les résultats ont été en faveur de la mammographie numérique par rapport à la mammographie analogique, notamment dans les seins denses.7
Actuellement en France, la tomosynthèse n’est pas autorisée en dépistage organisé. Les radiologues peuvent l’utiliser en dépistage individuel ou en cas de symptôme, ou en seconde intention pour caractériser une image ambiguë. Cette technique est en cours d’évaluation par la Haute Autorité de santé (HAS).
Dépistage des femmes à très haut risque de cancer du sein
L’évaluation du risque de cancer du sein nécessite une consultation oncogénétique en cas de suspicion de prédisposition génétique, à évaluer par le score d’Eisinger (tableau ), pour adresser les patientes en consultation d’oncogénétique. Le groupe de femmes à risque concerne les femmes ayant une prédisposition génétique liée aux altérations délétères des gènes BRCA1 et BRCA2 ou d’autres gènes plus rares dont certains peuvent être syndromiques (Li-Fraumeni, Cowden, Peutz-Jeghers), les femmes ayant une histoire familiale significative sans altération génétique délétère identifiée, et les femmes ayant un antécédent d’irradiation thoracique avant l’âge de 30 ans, notamment pour la maladie de Hodgkin. Les référentiels « Femmes à risque » (FAR) régulièrement mis à jour établissent les modalités de prise en charge et de surveillance particulières à ce groupe de patientes à risque très élevé de cancer du sein, avec un examen clinique annuel, et à partir de 30 ans un suivi par imagerie par résonance magnétique (IRM) mammaire annuelle avec ou sans échographie mammaire, la mammographie annuelle n’étant introduite qu’après l’âge de 30 ans afin de limiter les irradiations répétées.
Dépistage des femmes à haut risque et risque intermédiaire
Pour le « haut risque » familial, la HAS préconise une mammographie associée à une échographie annuelle entre 40 et 50 ans, puis tous les 2 ans dans le dépistage organisé des cancers du sein à partir de 50 ans. Cependant, des surveillances par IRM peuvent être proposées au cas par cas.13 Les autres situations à « haut risque » regroupent des situations très différentes pour lesquelles la HAS a préconisé des modalités spécifiques de surveillance. Les femmes qui ont un antécédent personnel de cancer du sein (invasif ou canalaire in situ) doivent bénéficier d’une mammographie annuelle à vie et sortent du dépistage organisé ; celles ayant un antécédent de lésion histologique à risque, une mammographie annuelle pendant 10 ans avant de reprendre une surveillance biennale soit dans le cadre du dépistage organisé si elles sont dans la tranche d’âge, soit dans le dépistage individuel si elles ont moins de 50 ans. Enfin, pour les femmes qui ont un score d’Eisinger de 1 ou 2 (à risque intermédiaire), la définition du risque est relativement floue, et son évaluation doit être faite par les médecins référents ou le radiologue. Les modalités de surveillance (âge de début, rythme du dépistage) de ce groupe très important en volume devaient être mieux définies pour éviter une multiplication des examens inutiles.
Conclusion
Le dépistage du cancer du sein repose essentiellement sur l’imagerie et la mammographie. Cette technique a beaucoup évolué grâce à la mammographie numérique qui permet l’accès à de nouvelles applications comme la tomosynthèse. L’IRM est réservée pour le dépistage des femmes à très haut risque. Il est important que les prescripteurs en connaissent les avantages et les limites, ainsi que les enjeux.
Références
1. Defossez G, Le Guyader-Peyrou S, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 2010 et 2018. Étude à partir des registres du cancer du réseau Francim. Saint-Maurice: Santé publique France, 2019:371. https://bit.ly/3202yEh
2. Moss SM, Wale C, Smith R, Evans A, Cuckle H, Duffy SW. Effect of mammographic screening from age 40 years on breast cancer mortality in the UK Age trial at 17 years’ follow-up: a randomised controlled trial. Lancet Oncol 2015;16:1123-32.
3. Zielonke N, Gini A, Jansen EEL, et al. Evidence for reducing cancer-specific mortality due to screening for breast cancer in Europe: a systematic review. Eur J Cancer 2020;127:191-206.
4. Marmot MG, Altman DG, Cameron DA, Dewar JA, Thompson SG, Wilcox M. The benefits and harms of breast cancer screening: an independent review. Br J Cancer 2013;108:2205-40.
5. Nystrom L, Bjurstam N, Jonsson H, Zackrisson S, Frisell J. Reduced breast cancer mortality after 20+ years of follow-up in the Swedish randomized controlled mammography trials in Malmo, Stockholm, and Goteborg. J Med Screen 2017;24:34-42.
6. Ceugnart L, Rocourt N, Ben Haj-Amor M, et al. Dépistage organisé du cancer du sein : point de vue du radiologue. Bull Cancer 2019;106:684-92.
7. Pisano ED, Gatsonis C, Hendrick E, et al. Diagnostic performance of digital versus film mammography for breast-cancer screening. N Engl J Med 2005;353:1773-83.
8. Caumo F, Romanucci G, Hunter K, et al. Comparison of breast cancers detected in the Verona screening program following transition to digital breast tomosynthesis screening with cancers detected at digital mammography screening. Breast Cancer Res Treat 2018;170:391-7.
9. Bernardi D, Caumo F, Macaskill P, et al. Effect of integrating 3D-mammography (digital breast tomosynthesis) with 2D-mammography on radiologists’ true-positive and false-positive detection in a population breast screening trial. Eur J Cancer 2014;50:1232-8.
10. Skaane P, Bandos AI, Gullien R, et al. Comparison of digital mammography alone and digital mammography plus tomosynthesis in a population-based screening program. Radiology 2013;267:47-56.
11. Skaane P, Sebuodegard S, Bandos AI, et al. Performance of breast cancer screening using digital breast tomosynthesis: results from the prospective population-based Oslo Tomosynthesis Screening Trial. Breast Cancer Res Treat 2018;169:489-96.
12. Pisano ED. Is tomosynthesis the future of breast cancer screening? Radiology 2018;287:47-8.
13. Ceugnart L, Tardivon A. Programme de dépistage organisé du cancer du sein : adaptation au risque élevé. Imagerie de la Femme 2016;26:116-20.
2. Moss SM, Wale C, Smith R, Evans A, Cuckle H, Duffy SW. Effect of mammographic screening from age 40 years on breast cancer mortality in the UK Age trial at 17 years’ follow-up: a randomised controlled trial. Lancet Oncol 2015;16:1123-32.
3. Zielonke N, Gini A, Jansen EEL, et al. Evidence for reducing cancer-specific mortality due to screening for breast cancer in Europe: a systematic review. Eur J Cancer 2020;127:191-206.
4. Marmot MG, Altman DG, Cameron DA, Dewar JA, Thompson SG, Wilcox M. The benefits and harms of breast cancer screening: an independent review. Br J Cancer 2013;108:2205-40.
5. Nystrom L, Bjurstam N, Jonsson H, Zackrisson S, Frisell J. Reduced breast cancer mortality after 20+ years of follow-up in the Swedish randomized controlled mammography trials in Malmo, Stockholm, and Goteborg. J Med Screen 2017;24:34-42.
6. Ceugnart L, Rocourt N, Ben Haj-Amor M, et al. Dépistage organisé du cancer du sein : point de vue du radiologue. Bull Cancer 2019;106:684-92.
7. Pisano ED, Gatsonis C, Hendrick E, et al. Diagnostic performance of digital versus film mammography for breast-cancer screening. N Engl J Med 2005;353:1773-83.
8. Caumo F, Romanucci G, Hunter K, et al. Comparison of breast cancers detected in the Verona screening program following transition to digital breast tomosynthesis screening with cancers detected at digital mammography screening. Breast Cancer Res Treat 2018;170:391-7.
9. Bernardi D, Caumo F, Macaskill P, et al. Effect of integrating 3D-mammography (digital breast tomosynthesis) with 2D-mammography on radiologists’ true-positive and false-positive detection in a population breast screening trial. Eur J Cancer 2014;50:1232-8.
10. Skaane P, Bandos AI, Gullien R, et al. Comparison of digital mammography alone and digital mammography plus tomosynthesis in a population-based screening program. Radiology 2013;267:47-56.
11. Skaane P, Sebuodegard S, Bandos AI, et al. Performance of breast cancer screening using digital breast tomosynthesis: results from the prospective population-based Oslo Tomosynthesis Screening Trial. Breast Cancer Res Treat 2018;169:489-96.
12. Pisano ED. Is tomosynthesis the future of breast cancer screening? Radiology 2018;287:47-8.
13. Ceugnart L, Tardivon A. Programme de dépistage organisé du cancer du sein : adaptation au risque élevé. Imagerie de la Femme 2016;26:116-20.