Ces dernières années, la prise en charge de la sclérose en plaques (SEP) a évolué, tant sur le plan diagnostique que thérapeutique. Le diagnostic peut maintenant être posé et annoncé très tôt, parfois même dès les premiers symptômes. L’arsenal thérapeutique s’est considérablement enrichi, et les stratégies de traitement, mises en place précocement et ajustées dès le début aux risques évolutifs de la maladie, sont régulièrement adaptées et réévaluées. Le handicap des patients est ainsi limité.
Du fait du caractère chronique de la maladie, il est capital d’établir d’emblée un lien de confiance fort afin de maintenir une alliance thérapeutique avec l’ensemble des professionnels de santé qui accompagnent le patient sur le long terme ; une coordination de tous les acteurs du soin est nécessaire tout au long du parcours.
La place de la médecine générale est particulière : les patients atteints de SEP sont peu nombreux au sein d’une patientèle de médecine générale, mais les sollicitations la concernant sont nombreuses – première poussée, soutien psychologique, questions sur la maladie et ses traitements, gestion médico-sociale… Ces aspects, allant du diagnostic au parcours de soins, sont ici abordés autour de trois moments clés : suspicion diagnostique, confirmation diagnostique et prise en charge thérapeutique au long cours.
Suspicion diagnostique
Ce qui n’a pas changé : les signes évocateurs de la maladie
S’il existe un débat autour des prodromes insidieux de la SEP (asthénie, syndrome dépressif, douleurs), 85 % des patients entrent dans la maladie par une poussée, correspondant le plus souvent à l’une des quatre situations cliniques dites typiques : névrite optique, atteinte du tronc cérébral/cervelet, atteinte médullaire (généralement partielle) ou atteinte focale hémisphérique (hémiparésie, hémiparesthésie, par exemple) [tableau].
Cette poussée est la traduction clinique d’une atteinte inflammatoire subaiguë du système nerveux central : l’atteinte neurologique s’accentue en quelques jours à quelques semaines, avant d’atteindre un plateau, puis de régresser plus ou moins complètement en quelques semaines à quelques mois. Les premiers épisodes peuvent ne durer que quelques jours. Les patients concernés ont le plus souvent entre 20 et 40 ans, et sont majoritairement des femmes (65 %).
Un autre mode possible de révélation de la maladie est la majoration insidieuse d’une gêne neurologique (souvent la marche et l’équilibre) au fil des mois ou des années ; les patients sont alors souvent plus âgés (autour de 50 ans) et le sex ratio est équilibré.1,2
Ce qui a changé : la place de l’IRM
L’IRM, dont le rôle incontournable dans le diagnostic a émergé, doit être réalisée dans un contexte clinique donné : atteinte aiguë ou subaiguë du système nerveux central ou l’une des quatre situations cliniques typiques évoquées. Les patients doivent être rapidement orientés vers un radiologue puis un neurologue. Il est fréquent que le compte -rendu radiologique soit transmis plus rapidement que l’obtention d’une consultation spécialisée, devançant l’annonce du diagnostic, qui n’avait donc pas encore été évoqué clairement en consultation. Cela peut fragiliser le lien soignants-soigné et rendre plus délicate la suite de la prise en charge. Il existe donc un enjeu diagnostique mais aussi de communication lors de l’orientation du patient vers une filière de soin plus adaptée.
Rôle du médecin généraliste à cette étape : participer à l’annonce
Il convient d’évoquer la possibilité d’une maladie inflammatoire, et donc d’une SEP, assez tôt avec le patient si la situation est typique. Cela permet d’exposer les enjeux de ce premier bilan d’imagerie : confirmer l’origine lésionnelle de ses troubles, éviter que la « consultation internet » à la suite de la lecture du compte rendu de l’IRM ne donne le diagnostic plus rapidement que le médecin traitant lui-même.
Il est nécessaire ensuite d’adresser le patient à un neurologue spécialisé dans la prise en charge des patients atteints de SEP. Cette orientation précoce permet de mettre en place les stratégies thérapeutiques les plus adaptées, et surtout d’avoir accès aux autres soignants experts, médicaux et paramédicaux, pour une prise en charge optimale du patient, tout au long du parcours de soins (psychologue, infirmier spécialisé, éducation thérapeutique...).
Certains drapeaux rouges peuvent être identifiés à cette étape et amener à une hospitalisation rapide en neurologie pour un bilan en urgence ou semi-urgence : atteinte subaiguë, atteinte très sévère (névrite optique rétrobulbaire bilatérale, myélite sévère) [tableau], atteinte systémique, confusion, somnolence, par exemple.
Confirmation diagnostique
Ce qui n’a pas changé : écarter les diagnostics différentiels
Le diagnostic de SEP repose toujours sur deux éléments : mettre en évidence une dissémination spatiale et temporelle de lésions touchant le système nerveux central et écarter les diagnostics différentiels toujours plus nombreux mais restant rares. L’évolution récente porte sur la rapidité avec laquelle le diagnostic peut être posé et sur les aspects pronostiques du premier bilan.
Ce qui a changé : quelques données pronostiques dès le diagnostic
Autrefois purement cliniques, les critères de dissémination spatiale et temporelle reposent aujourd’hui également sur les données de l’IRM et de la ponction lombaire : ce sont les critères de McDonald initialement publiés en 2001 et révisés trois fois jusqu’à leur dernière version de 2017.3 Une actualisation semble prévue dans le courant de l’année 2024. Pour les appliquer, il faut tenir compte de la clinique initiale – qui doit être typique – et savoir lire les clichés IRM – ce qui demande une expertise particulière. Il existe des « drapeaux rouges » cliniques et d'imagerie faisant rechercher des diagnostics alternatifs. Une grande prudence est donc requise pour ne pas appliquer ces critères de manière inadaptée et risquer de traiter un patient de manière inappropriée.
Du fait de la place centrale de l’IRM, il a été important d’établir des recommandations qualitatives quant aux séquences à réaliser, disponibles sur le site de l’Observatoire français de la sclérose en plaques (https ://www.ofsep.org/fr/), accompagnées d’une grille de lecture précise pour retenir ces critères IRM diagnostiques.
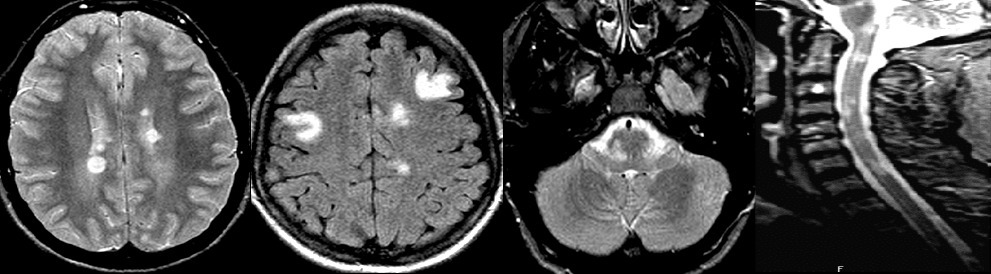
La dissémination spatiale est actuellement retenue s’il y a au moins une lésion IRM pondérée en T2/FLAIR dans au moins deux des quatre régions caractéristiques de la SEP (périventriculaire, corticale, sous-tentorielle, médullaire) [figure].
La présence de lésion(s) prenant le produit de contraste alors que d’autres ne le prennent pas, la présence d’une synthèse intrathécale d’immunoglobulines G, l’apparition de nouvelles lésions au cours du suivi IRM sont autant de critères faisant retenir la dissémination temporelle.
La place de la ponction lombaire reste très importante, notamment lors d’un premier épisode. C’est un argument quasiment incontournable pour les diagnostics différentiels : une protéinorachie supérieure à 1 g/L ou la présence de plus de 50 éléments blancs/mm3 doivent faire rechercher d’autres diagnostics. La ponction lombaire constitue aussi un argument pour le diagnostic positif de SEP. Une synthèse intrathécale d’immunoglobulines (bandes oligoclonales, taux d’IgG, indice de chaînes légères kappa) est présente chez 85 à 95 % des patients avec une SEP (sans en être spécifique). Elle permet de remplir le critère de dissémination temporelle de la maladie dès le premier bilan et représente un facteur de risque péjoratif.
Outre le diagnostic positif, cette première étape clinique, radiologique et biologique permet aussi d’avoir une idée pronostique et ainsi d’envisager d’emblée la stratégie thérapeutique à mettre en place.
L’accompagnement au moment de l’annonce de la maladie est un moment clé. S’il n’existe pas de recommandations spécifiques structurées pour cette annonce, il existe de plus en plus de dispositifs de reprise d’annonce diagnostique assurée par des infirmières spécialisées et/ou des psychologues. Ceux-ci visent à améliorer l’adhésion au futur parcours de soins, à borner l’incertitude dans laquelle le patient et ses proches sont plongés à la suite des mots difficiles du diagnostic et à cerner leurs projections sur l’avenir.
Rôles du médecin généraliste à cette étape : accompagner, rassurer, orienter
Après orientation, le médecin traitant doit être informé de la confirmation diagnostique et de la stratégie thérapeutique mise en place. Il convient de ne pas méconnaître les ressources disponibles localement ou en région pour mieux accompagner le patient. Revoir le patient après la première consultation spécialisée permet de repérer les réactions thymiques afin de mieux le rassurer et l’orienter si besoin. Ce moment peut également permettre de reprendre les questions qu’il se pose concernant la maladie au regard de ce que l’on sait aujourd’hui : même s’il existe la possibilité que le quotidien soit altéré, des solutions existent et peuvent être proposées aux patients.
Un grand nombre d’idées reçues sont à déconstruire, invalidées par la publication de nombreuses données rassurantes : l’image d’un jeune patient en fauteuil roulant, l’effort ou le sport à proscrire, l’idée d’une grossesse à abandonner, le déclenchement par les vaccins ou la chaleur. Il s’agit surtout de retenir que le paysage thérapeutique et la prise en charge ont évolué au cours des deux dernières décennies, permettant une qualité de vie améliorée pour les patients atteints de sclérose en plaques.
Prise en charge thérapeutique au long cours
Ce qui n’a pas changé
Il n’existe pas, à ce jour, de traitement curatif de la maladie, et les trois axes de prise en charge sont le traitement de la poussée, le traitement préventif de la maladie et le traitement symptomatique. Le traitement de la poussée repose, dès qu’il existe une gêne fonctionnelle, sur une corticothérapie à forte dose (1 g/j pendant 3 à 5 jours). Elle permet une récupération plus rapide mais pas forcément meilleure. Il est donc important de prendre un peu de temps pour différencier les fluctuations cliniques d’anciennes séquelles, plus ou moins perceptibles au quotidien, des poussées de la maladie. Ces fluctuations surviennent lors de contextes particuliers (infections, fièvre, altération de l’état général, chaleur environnementale, charge mentale ou physique exagérée) et ne reflètent pas l’activité clinique de la maladie.
Ce qui a changé
Traitements de fond et leur utilisation
En vingt-cinq ans, nous sommes passés de l’interféron bêta et de l’acétate de glatiramère à une quinzaine de molécules qui sont mieux tolérées sur le plan général et, pour certaines, plus efficaces. Toutes bénéficient d’une mise en route la plus précoce possible.4,5 On classe ces molécules en deux (ou trois) gammes d’efficacité : les traitements d’efficacité modérée et les traitements de haute efficacité (certains scindent en deux ce deuxième groupe pour isoler les molécules de « très » haute efficacité).
Le choix initial de la gamme d’efficacité est fondé sur les critères pronostiques identifiés au cours du bilan initial (localisation des poussées, récupération, atteinte médullaire, âge, répétition des poussées au cours des deux premières années…).6
La montée en gamme se fait en cas de persistance d’une activité clinique (poussée de la maladie) ou d’évolution visible à l’imagerie (IRM).
Le délai d’action des traitements étant de l’ordre de trois à six mois, leur efficacité n’est pas toujours remise en cause au cours de cette période.
L’effet préventif sur l’aggravation du handicap a été observé dans les essais thérapeutiques comme dans les suivis de cohortes. Les cohortes historiques affichaient, à quinze-vingt ans d’évolution, un risque d’environ 50 % d’évolution progressive ou d’utilisation d’une canne pour marcher. Les cohortes actuelles qui bénéficient, entre autres, d’un diagnostic et d’un traitement précoce voient ce risque chuter autour 12 - 15 %.7
Repérer les effets indésirables
L’utilisation plus fréquente, plus large et plus longue de ces traitements – pour la plupart immunosuppresseurs (seuls les interférons, l’acétate de glatiramère et, le plus souvent, les esters de fumarate sont immunomodulateurs) – a d’autres répercussions. Cette durée de prescription, probablement de plus de vingt ans, nécessite un encadrement de ses risques (infectieux et carcinologiques) avec une surveillance régulière.
La vaccination, desservie par le débat des années 1990 sur les liens entre vaccination contre le virus de l’hépatite B et SEP, prend une place particulière. Il faut retenir que les données publiées durant les vingt-cinq dernières années sont rassurantes sur l’absence de sur-risque de poussée post-vaccinale et sur l’absence de déclenchement de la maladie. Les traitements immunosuppresseurs peuvent, en revanche, favoriser une infection (opportuniste ou non), limiter la réponse vaccinale, voire contre-indiquer certains vaccins (les vaccins vivants atténués). Il est donc très important, dès le diagnostic, de remettre à jour le calendrier vaccinal des patients. Ceci a donné lieu à des recommandations de la Société francophone de la SEP en 2018 (SFSEP : https ://sfsep.org/).
Le risque carcinologique avait été identifié avec les anciens traitements immunosuppresseurs, actuellement très peu utilisés (mitoxantrone, cyclophosphamide, azathioprine). Il reste surveillé avec les nouveaux traitements, sans signal d’alerte évident à ce jour. Nous recommandons toutefois, dès lors qu’un patient reçoit un immunosuppresseur, un suivi annuel dermatologique et, chez les femmes, de bien s’astreindre au suivi gynécologique préconisé dans la population générale.
Quid de la grossesse ?
Concernant les patientes avec un désir de grossesse, des évolutions sont aussi notables. Si la grossesse n’est pas contre-indiquée dans la SEP, elle reste associée à un rebond de la maladie dans le post-partum. La gestion du projet relève bien sûr de la consultation neurologique, mais les récentes recommandations permettent d’envisager de traiter tout aussi efficacement une patiente qui a un désir de grossesse et d’améliorer le risque de rebond. Ces recommandations sont disponibles sur le site de la SFSEP (https ://sfsep.org/).
Un âge limite ?
Enfin, il semblerait pertinent d’envisager l’arrêt des traitements de fond entre 55 et 60 ans. Des essais sont en cours pour valider ou non cette approche. Cette question tient au fait que les mécanismes à l’origine du handicap dans la SEP évolueraient dans le temps schématiquement en trois « phases » :
- au cours de la première, des vagues d’inflammation liées à la présence de lymphocytes T autoréactifs circulants passent la barrière hématoméningée et sont responsables d’une inflammation focale (coopération avec les lymphocytes B et le macrophages) ; ceci donne lieu aux hypersignaux de la substance blanche en IRM et aux poussées cliniques ;
- la deuxième phase correspondrait à une inflammation compartimentée, derrière la barrière hématoméningée ; l’activation microgliale jouerait ici un rôle important. Ceci serait en lien avec une aggravation progressive des symptômes. La traduction IRM de cette phase n’est pas toujours accessible sur les séquences disponibles actuellement (extension des hypersignaux FLAIR, anneau paramagnétique perilésionnel) ;
- la troisième phase semble liée aux deux précédentes et se met en place plus tard. Elle ne relève plus de mécanismes inflammatoires mais plutôt de ceux du vieillissement, comme si celui-ci survenait plus tôt du fait des lésions inflammatoires alors cicatricielles. L’IRM n’évolue plus, si ce n’est sur un mode atrophique. Ceci explique l’enjeu des traitements immuno-actifs pour enrayer au plus tôt la maladie et le fait qu’on envisage leur arrêt à cet âge-là.
Prise en charge symptomatique
Elle a également évolué et insiste sur l’importance d’une rééducation, qui doit être elle aussi précoce, et d’une activité physique (adaptée ou non) régulière ayant aussi une action symptomatique et possiblement neuroprotectrice dès lors qu’elle a une certaine intensité. Certains centres bénéficient d’une réelle coordination entre les différents acteurs médicaux (neurologie, urologie, médecine physique et de réadaptation, médecine du travail), paramédicaux et médico--sociaux, permettant un parcours de soins adapté à chaque patient pour améliorer son quotidien.
Éducation thérapeutique
L’émergence des programmes d’éducation thérapeutique a permis d’impliquer activement les patients dans leur prise en charge dès le diagnostic. Ces programmes visent à mieux connaître la maladie, les traitements et la prise en charge globale, et à mieux comprendre le quotidien pour, à défaut d’accepter la maladie, mieux s’adapter à cette nouvelle vie après un diagnostic, une mise en route de traitement ou la survenue d’un handicap, par exemple.
Prise en charge générale
Il est important de bien traiter les comorbidités cardio-vasculaires (diabète, hypertension artérielle, surpoids, sédentarité)8 et d’encourager le sevrage tabagique.9 Tous ces facteurs sont en effet associés à une évolution plus sévère de la maladie.
Ce qui importe à cette étape en médecine générale
Le médecin généraliste peut s’impliquer sur trois aspects : l’observance du traitement de fond, la prise en charge symptomatique et le contrôle des comorbidités. En outre, il est important de s’assurer que les patients restent dans le parcours de soins, et il ne faut pas hésiter à les (ré)orienter vers celui-ci en cas de besoin.
Participation à la gestion du traitement de fond
Savoir que ces traitements sont efficaces, ajustés et réévalués régulièrement en fonction de leur tolérance et de leur efficacité (clinique et IRM) permet de rassurer les patients vis-à-vis des changements qui peuvent être fréquents au début. Savoir qu’il sera possible de s’adapter à un projet de grossesse est aussi important.
Par ailleurs, le recours à un traitement de fond immunosuppresseur étant très probable, ceci nécessite rapidement la mise à jour du calendrier vaccinal, notamment pour une immunisation contre le pneumocoque, la varicelle et l’hépatite B. Certaines vaccinations sont, en effet, contre-indiquées (vaccins vivants) une fois ces traitements débutés. La fenêtre de réalisation peut donc être assez courte et il s’agit de ne pas retarder la mise en route d’un traitement efficace. La vaccination anti-SARS-CoV- 2 est actuellement -recommandée et efficace. En cas d’infection aiguë, la suspension du traitement est parfois décidée et nécessite d’échanger avec le neurologue traitant : prise en compte du type d’infection (prudence en cas de zona, herpès, infections sévères ou opportunistes) et de la pertinence d’une fenêtre courte d’arrêt. En effet, dans la plupart des situations, les demi-vies des traitements et le caractère rémanent de l’immunodépression rendent une suspension peu pertinente. Les infections ne déclenchent pas de poussée de la maladie mais peuvent faire fluctuer les symptômes séquellaires du fait de l’altération de l’état général et de la fièvre, et non d’une inflammation focale du système nerveux.
Du fait de ce caractère immunosuppresseur au long cours, les mesures de dépistage carcinologique préconisées pour la population générale (dermatologie, gynécologie et, en fonction des antécédents familiaux, gastroentérologie) s’appliquent. La découverte d’un cancer invasif fait suspendre et rediscuter les traitements immunosuppresseurs, sauf dans le cas des cancers bénins de la peau.
Ce qui change pour les traitements symptomatiques et la vie au quotidien
L’activité physique régulière et la rééducation sont bénéfiques pour les patients. Elles peuvent se faire en ambulatoire, en hôpital de jour ou en hospitalisation complète en médecine physique et de réadaptation en fonction de l’importance du handicap. La rééducation et l’activité physique doivent respecter la fatigabilité mais faire travailler l’endurance des patients. Il est important de les orienter vers des professionnels formés ou participant à des réseaux de soins SEP et de les stimuler dans cette direction.
Plus de la moitié des patients ont une atteinte cognitive. Ils rapportent des oublis, des difficultés à suivre longtemps une conversation ou un film, ou un manque du mot. Cette atteinte tient à des difficultés dans le maintien de l’attention, dans le travail en double tâche ou à une altération des fonctions exécutives. L’impact sur le travail et la vie sociale et familiale devient vite important.
La fatigue est un symptôme extrêmement fréquent. Elle survient souvent sans signe avant-coureur, mais peut aussi se majorer au fil de la journée ou des efforts (fatigabilité). La fatigabilité est souvent source d’une majoration des symptômes séquellaires (moteurs, ataxiques ou cognitifs). Ce handicap, « invisible » au quotidien, contraste fréquemment avec un examen neurologique réalisé dans le plan du lit, au repos, nécessairement moins marqué. Il est donc important de le retranscrire dans les certificats des démarches médico-sociales, en particulier auprès des maisons départementales du handicap (MDPH) et pour les dossiers de reconnaissance en qualité de travailleur handicapé (RQTH).
Gestion des comorbidités
Enfin, la surveillance et la correction des comorbidités, notamment cardiovasculaires, et la lutte contre le tabagisme sont des éléments majeurs favorisant la neuroprotection. Il convient donc de bien les prendre en charge.
Que dire à vos patients
- La prise en charge des patients atteints de SEP a beaucoup évolué et permet de limiter de manière efficace le risque de handicap.
- Les traitements de fond sont ajustés à la sévérité potentielle ou avérée de la maladie.
- Il existe des réseaux de soins et des centres experts pour permettre une prise en charge efficace.
- Les infections et les vaccinations ne déclenchent pas de poussée, mais la fatigue peut faire réapparaître ou majorer des sensations antérieures.
- Il est recommandé de ne pas fumer et de faire du sport.
- De nombreuses informations destinées aux patients sont disponibles sur le site de la SFSEP (https ://sfsep.org/) et sur ceux des associations de patients (https ://afsep.fr/ ; https ://www.arsep.org/ ; https ://www.notresclerose.org/ ; https ://www.unisep.org/ par exemple), ainsi que sur les sites des réseaux de soins régionaux.
2. Lublin FD, Reingold SC, Cohen JA, et al. Defining the clinical course of multiple sclerosis: the 2013 revisions. Neurology 2014;83(3):278-86.
3. Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018;17(2):162-73.
4. Iaffaldano P, Lucisano G, Butzkueven H, et al. Early treatment delays long-term disability accrual in RRMS: Results from the BMSD network. Mult Scler 2021;27(10):1543-55.
5. Rollot F, Casey R, Leray E, et al. Cumulative effects of therapies on disability in relapsing multiple sclerosis. Mult Scler 2021;27(11):1760-70.
6. Bourre B, Casez O, Ciron J, et al. Paradigm shifts in multiple sclerosis management: Implications for daily clinical practice. Rev Neurol 2023;S0035-3787(22)00819-0.
7. University of California, San Francisco MS-EPIC Team, Cree BA, Gourraud PA, et al. Long-term evolution of multiple sclerosis disability in the treatment era. Ann Neurol 2016;80(4):499-510.
8. Marrie RA. Comorbidity in multiple sclerosis: implications for patient care. Nat Rev Neurol 2017;13(6):375-82.
9. Rosso M, Chitnis T. Association Between Cigarette Smoking and Multiple Sclerosis: A Review. JAMA Neurol 2020;77(2):245-53.

 Encadrés
Encadrés