Médecine périnatale. L’objectif du suivi immuno-hématologique d’une femme enceinte est d’assurer sa sécurité transfusionnelle mais aussi la prise en charge optimale de la maladie hémolytique fœtale et néonatale, pouvant compliquer une immunisation maternelle. Ce suivi repose sur le respect du calendrier de recherche des agglutinines irrégulières.
La grossesse et l’accouchement sont des situations dans la vie d’une femme où l’immuno-hématologie prend toute son importance. D’une part du fait du risque de complications à type d’hémorragie de la délivrance et d’un éventuel recours aux transfusions en concentrés de globules rouges et autres produits sanguins labiles ; d’autre part du fait du risque de développement d’une immunisation anti-érythrocytaire : synthèse d’allo-anticorps dirigés contre des déterminants antigéniques des groupes sanguins paternels portés par les globules rouges fœtaux. Une allo-immunisation peut se développer en cours de toute grossesse en réponse au passage d’hématies fœtales vers la mère (hémorragie fœto-maternelle) de façon physiologique a minima pendant toute grossesse et délivrance ou massive (spontanée ou provoquée : amniocentèse, version…). Cependant, l’allo-immunisation reste rare du fait de nombreux facteurs encore incomplètement déterminés : « tolérance » immunitaire maternelle de la grossesse, variabilité de l’immunogénicité des antigènes de groupe sanguin, du volume d’hémorragie fœto-maternelle… Une allo-immunisation maternelle va avoir des conséquences transfusionnelles pour la mère et, en cas d’incompatibilité entre fœtus et mère pour l’antigène concerné, générer une maladie hémolytique fœtale et néonatale de gravité variable.
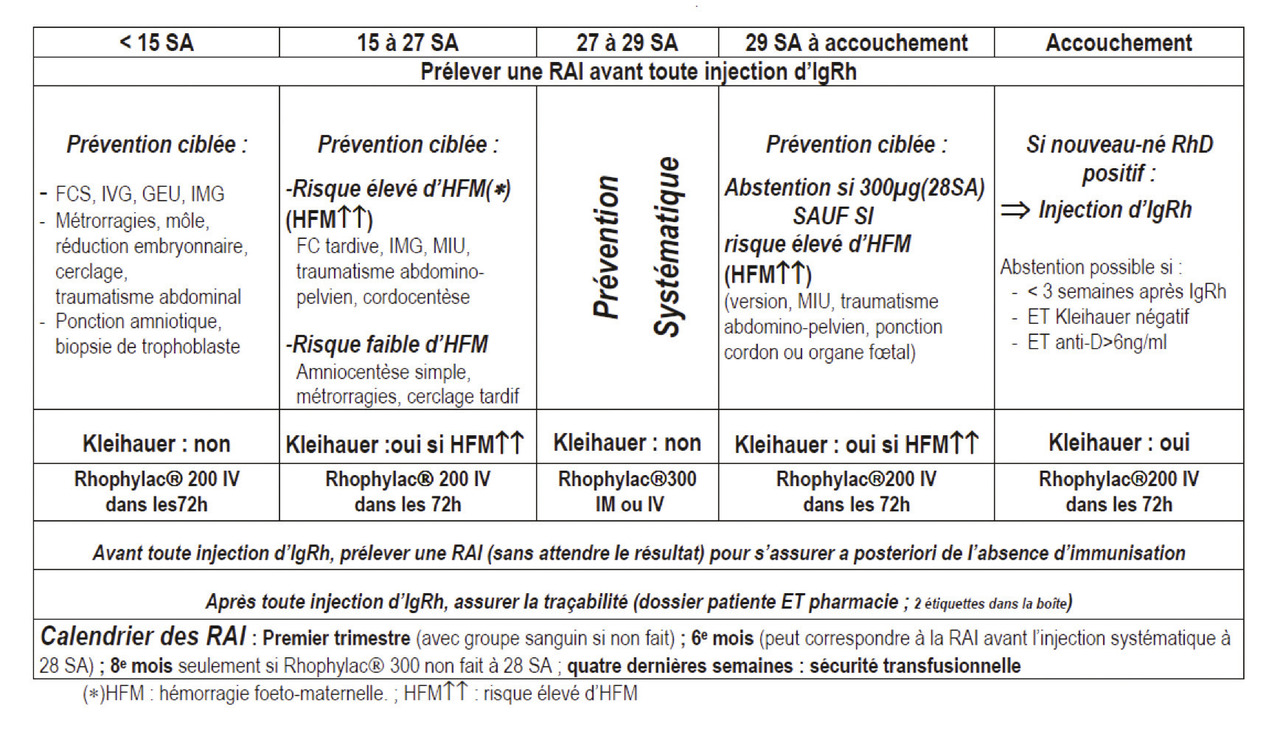
Prophylaxie anti-D
En France, 15 % des femmes en moyenne sont rhésus D (RhD)-négatives, c’est-à-dire n’expriment pas l’antigène RhD. Cet antigène étant le plus immunogène,1 l’immunisation anti-RhD est la plus fréquente des allo-immunisations. C’est aussi la seule qui bénéficie d’une prophylaxie par injection d’immunoglo- bulines anti-D. En 2005, le Collège national des gynécologues et obstétriciens français (CNGOF), le Centre national de référence en hémobiologie périnatale (CNRHP) et la Société française de médecine périnatale (SFMP) ont publié des recommandations nationales pour la prévention de l’allo-immunisation anti-D en associant une injection prophylactique systématique à la 28e semaine d’aménorrhée (SA) [6e mois] à la prophylaxie ciblée aux situations à risque d’hémorragie fœto-maternelle identifiées pendant la grossesse et à l’accouchement (tableau 1).2 Ces recommandations concernent tou-tes les femmes RhD-négatives non immunisées (recherche des agglutinines irrégulières [RAI] négative) et enceintes d’un conjoint RhD-positif ; même si on estime à 40 % les chances pour que la grossesse soit RhD-compatible du fait de l’hétérozygotie RhD du conjoint. Depuis mai 2017, le remboursement par la Caisse primaire d’assurance maladie de l’analyse du génotypage RhD fœtal à partir de sang maternel (examen non invasif) permet de restreindre la prophylaxie aux seuls cas où le fœtus est RhD- positif ou indéterminé.3 Ce génotypage peut être réalisé à partir de 12 SA dans des laboratoires ayant une autorisation de l’Agence de la biomédecine. Il permet aussi d’alléger le suivi des femmes RhD-négatives si le fœtus s’avère RhD-négatif (statut confirmé sur un deuxième prélèvement à 15 jours d’intervalle).
L’immunoprophylaxie par immunoglobulines anti-D n’évite pas l’acti- vation d’une immunisation anti-D déjà présente, imposant un contrôle négatif de la recherche des agglu- tinines irrégulières de moins de 7 jours avant toute administration d’immunoglobulines anti-D. Son efficacité dépend du délai d’admi- nistration des immunoglobulines anti-D après l’événement à risque (optimal dans les 72 heures), et du ratio dose d’immunoglobulines/ volume de l’hémorragie fœto-maternelle. Ainsi, la posologie des immunoglobulines anti-D commercialisées en France sous le nom Rhophylac est adaptée en fonction des résultats du test de Kleihauer, analyse de quantification de l’hémorragie fœto-maternelle. Il est recommandé de vérifier l’efficacité de l’immunoprophylaxie par une recherche des agglutinines irrégulières à 6 mois après l’accouchement.
Suivi immuno-hématologique des femmes enceintes non immunisées
Le calendrier de suivi immuno- hématologique est déterminé par le statut RhD-positif ou négatif de la patiente identifié lors des déterminations de groupage ABO-D, ainsi que par la notion d’antécédents trans- fusionnels (v. figure). Pour toutes, il y a une recherche des agglutinines irrégulières dès le 1er trimestre (dépistage d’une immunisation à risque fœtal) et une autre au 8e-9e mois pour dépister une immunisation à risque transfusionnel maternel et fœtal. Les patientes RhD-positives peuvent en effet, à la suite d’une hémorragie fœto-maternelle, s’allo-immuniser contre d’autres antigènes de groupe sanguin que le RhD, en particulier l’antigène Rhc (RH4) RhE (RH3) ou Kell (KEL1), sans immunoprophylaxie disponible. Compte tenu du risque d’immunisation en cours de grossesse plus important chez les femmes RhD-négatives enceintes d’un fœtus RhD-positif, il y a chez ces femmes une recherche des agglutinines irrégulières supplémentaire programmée au 6e mois de grossesse, avant l’injection systématique d’immunoglobulines anti-D.
Enfin, il est recommandé une recherche des agglutinines irrégulières à l’entrée en salle de naissance (au moment de l’accouchement) afin, si besoin, de répondre rapidement à des demandes de produits sanguins labiles dans le peri-partum.
Le calendrier des recherches des agglutinines irrégulières pendant la grossesse pour les femmes non immunisées est présenté dans la figure ci-dessous.4, 5
En plus du respect de ce calendrier, il est recommandé de faire réaliser et/ou de documenter deux déterminations ABO-D phénotype RHK afin d’avoir un groupe sanguin exploitable en cas de nécessité de réaliser une transfusion. Ces déterminations permettent d’identifier certains phénotypes maternels moins fréquents, voire rares, pour lesquels les ressources transfusionnelles pour couvrir les éventuels besoins à l’accouchement devront être anticipées pendant la grossesse.
Outre la prévention des conséquences fœtales et néonatales d’une allo-immunisation, le calendrier de suivi immuno-hématologique de la grossesse permet de sécuriser les éventuels actes transfusionnels à réaliser chez la mère et l’enfant. Ainsi, une transfusion de concentrés de globules rouges, tant pour la mère allo-immunisée que pour l’enfant, se fera en concentrés compatibilisés au laboratoire (épreuve directe de comptabilité au laboratoire [EDCL]) entre le plasma maternel et la poche de globules rouges. De plus, en fonction de l’allo-immunisation, le dépôt de sang de la maternité ne disposera pas forcément de poches respectant la spécificité de l’anticorps, d’où la nécessité d’anticiper tout besoin transfusionnel de la mère et de l’enfant, avec la structure de délivrance de produits sanguins labiles ou l’Établissement français du sang, en amont de l’accouchement
Que faire en cas de recherche d’agglutinines irrégulières positive ?
Identifier l’anticorps
Si une recherche d’agglutinines irrégulières pendant la grossesse s’avère positive, une identification est obligatoire afin de déterminer la spéci- ficité de l’allo-anticorps, c’est-à-dire contre quel antigène de groupe sanguin est précisément dirigé l’anticorps. Afin d’associer l’identification de l’allo-anticorps et la sécurité transfusionnelle, l’identification devrait au mieux être réalisée par le laboratoire travaillant avec la structure de délivrance de produits sanguins de la maternité d’accouchement. On distingue trois grandes catégories d’anticorps, les anticorps à risque d’anémie fœtale et de maladie hémolytique néonatale, les anticorps à risque de maladie hémolytique néonatale, et enfin les anticorps sans incidence obstétricale (c’est-à-dire sans risque pour l’enfant) [tableau 2]. Néanmoins, ces distinctions ne sont qu’indicatives, et la vigilance est recommandée (en particulier en anténatal) quand la quantité d’anticorps même réputés « sans risque » est élevée.
Quantifier l’anticorps
Titrage
Le titre va dépendre en partie de la concentration de l’anticorps mais surtout de son affinité vis-à-vis de l’antigène cible. La technique utilisée est un test indirect à l’antiglobuline à partir de dilutions du plasma maternel sur des hématies natives. Le titre est l’inverse de la dernière dilution donnant une réaction positive.6
Dosage pondéral
Le dosage pondéral, applicable uniquement pour les allo-anticorps du système rhésus, consiste à mesurer par méthode semi-quantitative et automatisée la concentration en anticorps. La technique de référence est une technique d’hémagglutination automatisée en flux continu (Autoanalyser). Pour les anti-D (RH1) et les anti-c (RH4), l’apport de cette technique dans l’évaluation du risque d’atteinte fœtale et de celle de la gravité de l’atteinte néonatale est supérieur à celui du titrage.6
Affirmer la situation d’incompatibilité fœto-maternelle érythrocytaire ?
Après avoir identifié et quantifié l’anticorps, il est important de déterminer s’il existe une situation d’incompatibilité fœto-maternelle érythrocytaire, c’est-à-dire si le fœtus est porteur de l’antigène cible de l’anticorps. Pour cela, un phénotype du procréateur est réalisé : l’incompatibilité est exclue uniquement si le procréateur ne porte pas l’antigène cible. En cas d’hétérozygotie, le doute persiste. Un génotypage d’ADN fœtal à partir du sang maternel peut être également réalisé. À ce jour, il est réalisable pour les antigènes D, C, E, c, (RH1, RH2, RH3, RH4) ainsi que pour l’antigène Kell (KEL1).6
Si l’incompatibilité est avérée, il est nécessaire d’effectuer un suivi biologique de l’immunisation (identification et quantification) répété à intervalle réglé par le terme de la grossesse et le type d’anticorps qui conditionne le risque de réactivation de l’immunisation. C’est la quantification de l’anticorps qui permet de définir le risque d’atteinte fœtale et donc de guider la mise en place de sa surveillance par Doppler. Attention ! si pour documenter l’incompatibilité fœto-maternelle érythrocytaire, le phénotype du conjoint et/ou le génotype fœtal n’est pas contributif (ou en attente de résultat), la grossesse doit être prise en charge et surveillée comme « a priori » incompatible.
Enfin, toute grossesse incompatible doit être discutée et, si besoin, référée au centre pluridisciplinaire de diag- nostic prénatal (CPDPN) régional.
Dans le tableau 3 est présenté le suivi immuno-hématologique des trois anticorps les plus dangereux en période anténatale.
Immunisations et incompatibilités fœto-maternelles érythrocytaires
L’immunisation est maternelle par développement d’anticorps par la mère contre des antigènes de groupes sanguins qu’elle ne connaît pas (d’origine paternelle ou post-transfusionnelle en cas d’antécédents de transfusion incompatible). L’incompatibilité fœto-maternelle érythrocytaire concerne l’enfant, elle est définie par la fixation des anticorps maternels sur les globules rouges du fœtus et du nouveau-né. Elle est donc caractérisée biologiquement chez le nouveau-né par un phénotype incompatible pour l’antigène concerné avec un test direct à l’antiglobuline (test de Coombs direct) positif et une élution qui retrouve l’anticorps maternel.
Fréquence
Il existe à ce jour plus de 350 antigènes de groupes sanguins, et de nombreux sont exprimés sur les globules rouges du fœtus dès les premières semaines de grossesse comme les antigènes du système RH (D, c, C, E, e), du système Kell, Duffy… et d’autres s’expriment plus tardivement au 3e trimestre, comme les antigènes A et B.
L’incompatibilité fœto-maternelle érythrocytaire ABO est la plus fréquente : si 15 à 25 % des couples mères-enfants sont ABO-incompatibles, elle n’est cliniquement symptomatique que dans 1 % des cas. L’incompatibilité fœto-maternelle érythrocytaire s’exprime le plus souvent par un ictère précoce et rapidement évolutif avec ou sans anémie. Néanmoins, la gravité de la maladie clinique peut être aussi importante que celle des « maladies rhésus » avec des ictères à risque neurologique (et recours à l’exsanguino-transfusion) et des formes avec anémie du fœtus décrites dans la population d’Afrique subsaharienne.
Les immunisations et incompati- bilités fœto-maternelles érythro- cytaires non ABO sont mises en évidence par des recherches des agglutinines irrégulières maternelles positives. Les plus fréquentes sont celles à anti-D (RH1) [en France de 0,9 pour 1 000 naissances] symp- tomatiques dans 50 % des cas, dont un quart de formes sévères avec des manifestations anténatales (anémie fœtale) s’exprimant pour moitié avant 34 SA. Les autres immunisations et incompatibilités non ABO représentent 0,5 pour 1 000 naissances, avec les anti-Kell, anti-c (RH4) et anti-E (RH3) par ordre de dangerosité.7
Maladie hémolytique fœtale et néonatale
L’immunisation maternelle n’a d’impact fœtal et néonatal que s’il y a immunisation et incompatibilité fœto-maternelles érythrocytaires. Les manifestations de cette incompatibilité démarrent pendant la vie fœtale, puisque les groupes sanguins sont exprimés par les globules rou- ges dès le début de la grossesse pour la plupart et se poursuivent pendant 2 à 3 mois après la naissance. Le conflit antigène-anticorps génère une immuno-hémolyse tissulaire qui se manifeste par une anémie associée à une hyperbilirubinémie, caractéristiques de la « maladie rhésus », la plus fréquente des maladies hémolytiques fœtales et néonatales.
Anémie fœtale et néonatale
L’anémie se constitue progressi- vement selon une cinétique très variable d’un couple mère-enfant à un autre pour un même type d’anticorps ; elle peut démarrer avant la naissance pour certains anticorps (tableau 2). Une anémie sévère et qui dépasse les capacités de réponse de l’organisme constitue un tableau d’anasarque visible à l’échographie. Le diagnostic précoce de l’anémie fœtale repose sur la mesure par échographie-Doppler du pic systolique de vélocité de l’artère cérébrale moyenne (PSV-ACM). Toute immunisation sévère, c’est-à-dire avec une quantification de l’anticorps qui fait suspecter un risque d’anémie fœtale, doit conduire à un suivi hebdomadaire des PSV-ACM, en coordination avec une équipe entraînée à la transfusion fœtale (via les CPDPN ; la correction de l’anémie par transfusion fœtale est possible dès 16-17 SA). L’anémie, même si l’immunisation maternelle est sévère, peut se manifester seulement après la naissance. Elle est fortement régé- nérative initialement et surtout évolutive : l’hémolyse liée au conflit antigène-anticorps va se sur-apposer au phénomène de ralentissement de production des globules rouges physiologique entre 2 et 6 semaines d’âge post-natal. Ainsi, si l’anémie n’est pas précoce, elle va se démasquer dans les 6 premières semaines de vie imposant un suivi régulier de la numération sanguine sur cette période chez tout enfant ayant un test de Coombs direct positif, quelles que soient les manifestations cliniques précoces.7
Hyperbilirubinémie et ictère
La bilirubine est produite en excès par l’hémolyse de l’incompatibilité fœto-maternelle érythrocytaire dès la vie fœtale. Ce processus se poursuit en post-natal mais chez le nouveau-né les capacités d’élimination de la bilirubine sont limitées. La bilirubine peut alors s’accumuler et atteindre rapidement des concentrations à risque neurologique. La prise en charge d’un ictère hémo- lytique suppose la mise en place d’une photothérapie intensive dès la première heure de vie avec une surveillance biologique de l’efficacité rapprochée afin de recourir si besoin à une exsanguino-transfusion.
Diagnostic à la naissance
Afin de pouvoir d’une part confirmer rapidement la situation d’incompatibilité fœto-maternelle et d’autre part d’évaluer la gravité de la maladie hémolytique (évolutive) et d’en adapter la prise en charge, tout nouveau-né de mère immunisée doit bénéficier précocement (naissance ou avant la 2e heure) d’une évaluation clinique (avec recherche de signes d’hémolyse : pâleur, ictère, hépatosplénomégalie) et d’un bilan sanguin (test direct à l’antiglobuline, élu- tion, phénotype, bilirubine totale et conjuguée et taux d’hémoglobine et réticulocytes).7
Détection précoce
Le respect du calendrier immuno- hématologique d’une femme enceinte permet de détecter de manière précoce une allo-immunisation anti-érythrocytaire pouvant avoir des conséquences prénatales mais toujours post-natales s’il existe une situation d’incompatibilité fœto-maternelle. En cas de recherche positive des agglutinines irrégulières chez une femme enceinte, il est indispensable d’identifier l’anticorps, de le quantifier et de documenter la situation d’incompatibilité fœto-maternelle. En fonction de la spécificité de l’anticorps et de sa quantification répétée, le suivi de la grossesse (obstétrical et immuno -hématologique) est centralisé par le CPDPN du réseau périnatal pour anticiper la maladie hémolytique fœtale et néonatale. L’incompatibilité fœto-maternelle érythrocytaire anti-D est la plus dangereuse et reste la plus fréquente (après l’incompatibilité ABO) malgré la prophylaxie par immunoglobulines anti-D. L’introduction à la nomenclature des actes de biologie médicale du génotypage RhD fœtal sur sang maternel permet de limiter la prophylaxie aux seules femmes RhD-négatives avec un fœtus RhD-positif, mais aussi d’alléger le suivi des grossesses immunisées anti-D si le fœtus est RhD-négatif. D’autres allo-immunisations, en particulier anti-c et anti- Kell, peuvent entraîner également une maladie hémolytique fœtale et néonatale et peuvent être identifiées précocement par le respect du calendrier. Enfin, il est important d’anticiper bien avant l’entrée en salle de naissance les éventuels besoins transfusionnels d’une mère immu- nisée et de son enfant en cas d’allo- immunisation et de situation d’incompatibilité fœto-maternelle érythrocytaire
1. Bailly P, Chiaroni J, Roubinet F. « Système RH ». In : Les groupes sanguins érythrocytaires. Montrouge : John Libbey Eurotext, 2015:87‑108.
2. Collège national des gynécologues et obstétriciens français. Prévention de l’allo-immunisation rhésus D fœto-maternelle. Recommandations pour la pratique clinique. J Gynecol Obstet Biol Reprod 2006;34:360-5.
3. Décision du 24 mai 2017 de l’Union nationale des caisses d’assurance maladie relative à la liste des actes et prestations pris en charge par l’assurance maladie.
4. Mannessier L. Suivi immuno-hématologique des femmes enceintes : nouvelles recommandations. Transfus Clin Biol 2009;16:195-200.
5. Miquel E, Cavelier B, Bonneau JC, Rouger P. Incompatibilités fœto-maternelles érythrocytaires (IFME) : de la surveillance immunohématologique des femmes enceintes à la maladie hémolytique du nouveau-né (MHNN). Transfus Clin Biol 2005;12:45-55.
6. Huguet-Jacquot S, Toly-Ndour C, Cortey A, Carbonne B, Mailloux A. Diagnostic et suivi biologiques des allo-immunisations anti-érythrocytaires chez la femme enceinte. Rev Francoph Lab 2015;2015:73‑80.
7. Cortey A, Mailloux A, Huguet-Jacquot S, et al. Incompatibilités fœtomaternelles érythrocytaires. EMC-Pédiatrie-Mal Infect 2012;7:1‑22.