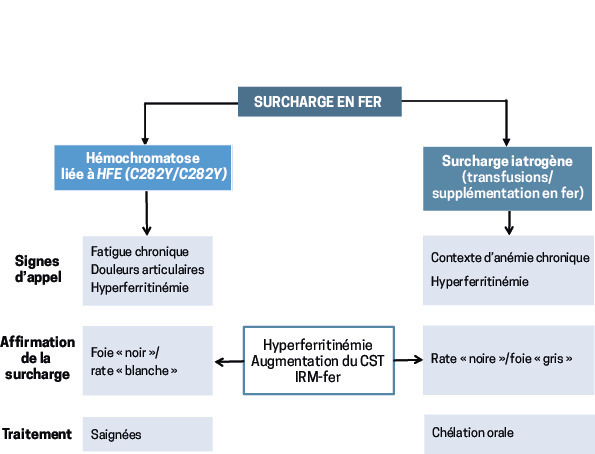
Le médecin généraliste peut être confronté à deux grands types de surcharge en fer : une hémochromatose liée au gène HFE (homozygotie C282Y) ou une surcharge « iatrogène ». Si le contexte clinique et l’approche thérapeutique sont différents, les examens paracliniques qui confirment la surcharge sont les mêmes (fig. 1 ).
Deux grandes causes
Hémochromatose liée au gène HFE
Le diagnostic peut être évoqué en deux circonstances.
Hors enquête familiale, elle est le plus souvent suspectée devant une asthénie chronique inexpliquée ; des douleurs articulaires – étiquetées arthrose ou polyarthrite – qui touchent plus volontiers les deuxièmes et troisièmes métacarpophalangiennes (avec la crainte d’une poignée de main trop vigoureuse), ainsi que les chevilles.
L’hyperferritinémie est la voie d’entrée diagnostique de loin la plus fréquente. Une cytolyse hépatique modérée (moins de 2 fois la limite supérieure de la normale) sans cause dysmétabolique, alcoolique, médicamenteuse ou virale doit également faire évoquer la maladie.
Contact dans un cadre familial. Lorsqu’un diagnostic d’hémochromatose est posé dans une famille, c’est la personne malade concernée (le probant), et non le médecin, qui doit informer les membres de sa famille et les inviter à consulter.
Hors enquête familiale, elle est le plus souvent suspectée devant une asthénie chronique inexpliquée ; des douleurs articulaires – étiquetées arthrose ou polyarthrite – qui touchent plus volontiers les deuxièmes et troisièmes métacarpophalangiennes (avec la crainte d’une poignée de main trop vigoureuse), ainsi que les chevilles.
L’hyperferritinémie est la voie d’entrée diagnostique de loin la plus fréquente. Une cytolyse hépatique modérée (moins de 2 fois la limite supérieure de la normale) sans cause dysmétabolique, alcoolique, médicamenteuse ou virale doit également faire évoquer la maladie.
Contact dans un cadre familial. Lorsqu’un diagnostic d’hémochromatose est posé dans une famille, c’est la personne malade concernée (le probant), et non le médecin, qui doit informer les membres de sa famille et les inviter à consulter.
Surcharges « iatrogènes »
Le dénominateur commun est ici un contexte d’anémie chronique, donnée différentielle majeure par rapport à l’hémochromatose (absence d’anémie).
Par transfusions multiples. La surcharge accompagne un syndrome myélodysplasique, une chimiothérapie, une greffe de cellules souches hématopoïétiques, ou survient sur un terrain d’hémoglobinopathie constitutionnelle (surtout de type bêta-thalassémie majeure).
Par supplémentation parentérale excessive en fer. Sont en cause des perfusions thérapeutiques pour une anémie chronique par déperdition sanguine prolongée (hémodialyses ou maladie digestive inflammatoire chronique).
Par transfusions multiples. La surcharge accompagne un syndrome myélodysplasique, une chimiothérapie, une greffe de cellules souches hématopoïétiques, ou survient sur un terrain d’hémoglobinopathie constitutionnelle (surtout de type bêta-thalassémie majeure).
Par supplémentation parentérale excessive en fer. Sont en cause des perfusions thérapeutiques pour une anémie chronique par déperdition sanguine prolongée (hémodialyses ou maladie digestive inflammatoire chronique).
Objectiver la surcharge en fer
La confirmation diagnostique est désormais totalement non invasive, combinant examens sanguins et imagerie.
Examens sanguins
Ferritine. Toute surcharge en fer donne une hyperferritinémie (> 300 ng/mL chez l’homme, > 200 ng/mL chez la femme), qui peut être qualifiée de modérée jusqu’à 500 ng/mL, franche entre 500 et 1 000, et majeure au-delà de 1 000. À l’inverse, une hyperferritinémie n’est pas obligatoirement synonyme de surcharge martiale. Il est donc essentiel d’exclure une autre cause d’élévation, avec au premier rang : le syndrome métabolique (de loin la plus fréquente), l’alcoolisme chronique ou un syndrome inflammatoire.
Coefficient de saturation de la transferrine (CST, fer/transferrine). Normalement inférieur à 45 %, il s’élève franchement (pouvant atteindre 100 %) tant lors de l’hémochromatose que des surcharges iatrogènes. Son intérêt diagnostique est double : son élévation (à confirmer toujours par un second examen) a une importance majeure, car c’est, dans l’hémochromatose, le témoin biologique le plus précoce (traduisant l’hyperabsorption digestive de fer) ; sa non-élévation permet, face à une hyperferritinémie, d’exclure une hémochromatose et, selon le contexte, de conforter le diagnostic d’hyperferritinémie dysmétabolique ou de syndrome inflammatoire.
Le test génétique HFE ne se conçoit que si l’on suspecte une hémochromatose : il ne doit donc pas être demandé si le CST est normal. Il consiste en la recherche de la mutation C282Y : seule une homo- zygotie C282Y (c’est-à-dire le résultat C282Y/C282Y) permet d’affirmer le profil génétique hémochromatosique. Les mutations H63D et S65C n’ont pas de valeur diagnostique.
Coefficient de saturation de la transferrine (CST, fer/transferrine). Normalement inférieur à 45 %, il s’élève franchement (pouvant atteindre 100 %) tant lors de l’hémochromatose que des surcharges iatrogènes. Son intérêt diagnostique est double : son élévation (à confirmer toujours par un second examen) a une importance majeure, car c’est, dans l’hémochromatose, le témoin biologique le plus précoce (traduisant l’hyperabsorption digestive de fer) ; sa non-élévation permet, face à une hyperferritinémie, d’exclure une hémochromatose et, selon le contexte, de conforter le diagnostic d’hyperferritinémie dysmétabolique ou de syndrome inflammatoire.
Le test génétique HFE ne se conçoit que si l’on suspecte une hémochromatose : il ne doit donc pas être demandé si le CST est normal. Il consiste en la recherche de la mutation C282Y : seule une homo- zygotie C282Y (c’est-à-dire le résultat C282Y/C282Y) permet d’affirmer le profil génétique hémochromatosique. Les mutations H63D et S65C n’ont pas de valeur diagnostique.
IRM-fer : un double apport
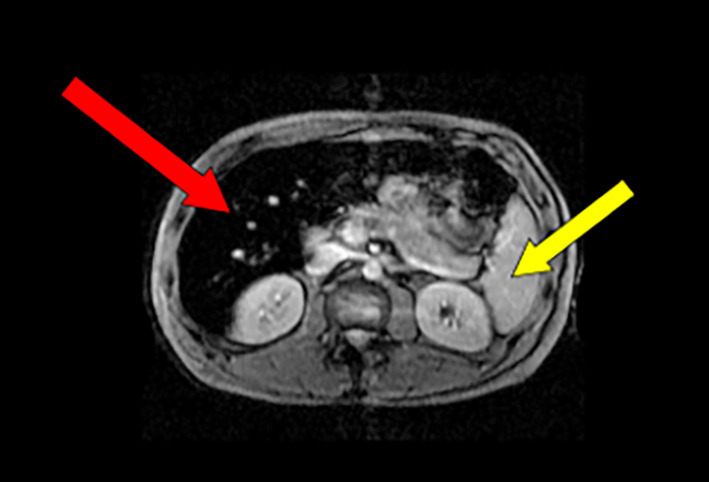
Visualiser en la quantifiant la surcharge en fer. Si le taux de ferritinémie, rigoureusement interprété, fournit une information de qualité sur l’intensité de la surcharge, seule une vision quantifiable apporte une certitude. Un foie « noir » correspond à une surcharge massive (fig. 2 ).
En préciser le mécanisme. La surcharge hémochromatosique donne, typiquement, une image de foie « noir » et de rate « blanche » (dénuée de fer), en rapport avec le déficit en hepcidine (hormone de régulation systémique du fer). Celui-ci est en effet à l’origine d’un afflux de fer dans les hépatocytes, provenant à la fois de son hyperabsorption digestive et de sa libération excessive à partir de la rate (où se poursuit physiologiquement la dégradation des globules rouges).
À l’inverse, une surcharge en fer « iatrogène » provoque une surcharge splénique, donc un aspect de rate « noire » car le fer provenant de la destruction des globules rouges (cas de la surcharge transfusionnelle) ou de la forme chimique du fer injecté (si supplémentation excessive en fer) est stocké essentiellement au niveau des macrophages dont la rate est particulièrement riche.
En préciser le mécanisme. La surcharge hémochromatosique donne, typiquement, une image de foie « noir » et de rate « blanche » (dénuée de fer), en rapport avec le déficit en hepcidine (hormone de régulation systémique du fer). Celui-ci est en effet à l’origine d’un afflux de fer dans les hépatocytes, provenant à la fois de son hyperabsorption digestive et de sa libération excessive à partir de la rate (où se poursuit physiologiquement la dégradation des globules rouges).
À l’inverse, une surcharge en fer « iatrogène » provoque une surcharge splénique, donc un aspect de rate « noire » car le fer provenant de la destruction des globules rouges (cas de la surcharge transfusionnelle) ou de la forme chimique du fer injecté (si supplémentation excessive en fer) est stocké essentiellement au niveau des macrophages dont la rate est particulièrement riche.
Quelle prise en charge ?
En cas d’hémochromatose, le traitement est centré sur les saignées. Une première phase d’induction, pour éliminer l’excès initial en fer, consiste en des saignées hebdomadaires, le volume soustrait étant de l’ordre de 7 mL/kg, jusqu’à ce que la ferritine avoisine 50 ng/mL. Le CST ne doit être contrôlé que vers la fin de la phase d’induction, c’est-à-dire lorsque la « désaturation » approche (en pratique à partir du moment où la ferritinémie descend au-dessous de 300 ng/mL chez l’homme et de 200 ng/mL chez la femme). En effet, ce coefficient reste élevé pendant la majeure partie de la phase d’induction, ne reflétant donc pas l’efficacité des saignées.
Vient ensuite le traitement d’entretien, en théorie à vie, destiné à éviter la reconstitution de la surcharge au fil du temps. Le plus souvent, la périodicité des saignées est alors de 2 à 4 mois, adaptée surtout en fonction de la ferritinémie, qui doit demeurer proche de 50 ng/mL.
Piste d’avenir, la supplémentation en hepcidine permettra la restauration d’un métabolisme ferrique normal.
Pas de saignée dans la surcharge en fer iatrogène (en raison de l’anémie chronique). Son traitement repose désormais sur la chélation du fer par voie orale.
Le médicament essentiel est le déférasirox (Exjade). Prescrit sous forme de comprimés pelliculés, en une seule prise quotidienne et à la dose totale initiale de 20 mg/kg/j, il demande une surveillance surtout dans les domaines gastro-intestinal (tolérance améliorée par cette nouvelle formulation) et rénal. Son efficacité doit être évaluée sur les données conjuguées de la ferritinémie et de l’IRM-fer.
La défériprone (Ferriprox) est un autre chélateur oral mais dont les indications sont très limitées compte tenu du risque rare mais imprévisible d’agranulocytose.
Vient ensuite le traitement d’entretien, en théorie à vie, destiné à éviter la reconstitution de la surcharge au fil du temps. Le plus souvent, la périodicité des saignées est alors de 2 à 4 mois, adaptée surtout en fonction de la ferritinémie, qui doit demeurer proche de 50 ng/mL.
Piste d’avenir, la supplémentation en hepcidine permettra la restauration d’un métabolisme ferrique normal.
Pas de saignée dans la surcharge en fer iatrogène (en raison de l’anémie chronique). Son traitement repose désormais sur la chélation du fer par voie orale.
Le médicament essentiel est le déférasirox (Exjade). Prescrit sous forme de comprimés pelliculés, en une seule prise quotidienne et à la dose totale initiale de 20 mg/kg/j, il demande une surveillance surtout dans les domaines gastro-intestinal (tolérance améliorée par cette nouvelle formulation) et rénal. Son efficacité doit être évaluée sur les données conjuguées de la ferritinémie et de l’IRM-fer.
La défériprone (Ferriprox) est un autre chélateur oral mais dont les indications sont très limitées compte tenu du risque rare mais imprévisible d’agranulocytose.
Références
1. Brissot P, Pietrangelo A, Adams PC, de Graaff B, McLaren CE, Loreal O. Haemochromatosis. Nat Rev Dis Primers 2018;4:18016.
2. Bardou-Jacquet E, Lainé F, Hamdi-Rozé H, Jouanolle AM, Deugnier Y. Hémochromatoses et autres surcharges hépatiques en fer. EMC (Elsevier SAS), Hépatologie, 2017, article [7-007-B-22].
3. Allali S, de Montalembert M, Brousse V, Chalumeau M, Karim Z. Management of iron overload in hemoglobinopathies. Transfus Clin Biol 2017;24:223-6.
4. Brissot E, Bernard DG, Loreal O, Brissot P, Troadec MB. Too much iron: A masked foe for leukemias. Blood Rev 2020;39:100617.
2. Bardou-Jacquet E, Lainé F, Hamdi-Rozé H, Jouanolle AM, Deugnier Y. Hémochromatoses et autres surcharges hépatiques en fer. EMC (Elsevier SAS), Hépatologie, 2017, article [7-007-B-22].
3. Allali S, de Montalembert M, Brousse V, Chalumeau M, Karim Z. Management of iron overload in hemoglobinopathies. Transfus Clin Biol 2017;24:223-6.
4. Brissot E, Bernard DG, Loreal O, Brissot P, Troadec MB. Too much iron: A masked foe for leukemias. Blood Rev 2020;39:100617.