La surface oculaire est organisée en unité fonctionnelle, incluant notamment conjonctive, cornée, paupières, glandes lacrymale et de Meibomius (sécrétant du meibum, un corps gras lubrifiant).1 Le film lacrymal, principalement constitué de mucus, d’eau et de lipides, joue un rôle majeur dans le maintien de son homéostasie.
Ses pathologies sont fréquemment rencontrées en pratique clinique (25 % des consultations ophtalmologiques tout venant), a fortiori chez les sujets de plus de 60 ans.2
Elle est à la fois un lieu d’échange (collyres et topiques) et de défense, assurant l’intégrité cornéenne, organe noble de cette région, en la maintenant transparente et non douloureuse.
En cas de dysfonctionnement, des complications majeures peuvent apparaître : fibrose conjonctivale, le plus souvent secondaire à une inflammation chronique, ou néovascularisation cornéenne mettant en péril le pronostic visuel et réduisant significativement la qualité de vie du patient. Parmi ces troubles extrêmement variés, nous citerons les pathologies les plus fréquemment rencontrées : sécheresse oculaire, allergies et phénomènes toxiques iatrogènes.
Sécheresse oculaire
Comme la cataracte et la dégénérescence maculaire liée à l’âge, sa prévalence augmente beaucoup avec l’âge. Multifactorielle, elle entraîne des symptômes allant de l’inconfort à la douleur, une gêne visuelle et/ou un larmoiement.3
Les principaux facteurs de risque sont, en dehors de l’âge, le sexe féminin, les maladies de système, notamment rhumatismale, et les prises médicamenteuses (psychotropes). Localement, le port de lentilles de contact ou les antécédents de chirurgie réfractive cornéenne sont également des facteurs favorisants. Tous sont à même d’entraver la régulation du film lacrymal, sous double dépendance : hormonale (diminution des androgènes lors de la ménopause) et nerveuse (modifications des terminaisons des nerfs cornéens).
Classiquement, on distingue 2 catégories de sécheresse oculaire, fonction de l’étiologie :
- hyperévaporation, dont la principale cause est la dysfonction des glandes de Meibomius situées sur le bord des paupières ;
- baisse de la production aqueuse, apanage du syndrome de Gougerot-Sjögren, du fait d’une fibrose progressive des glandes lacrymales pouvant aussi être aggravée par iatrogénie (antidépresseurs, anxiolytiques neuroleptiques).
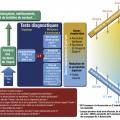
Quel que soit le mécanisme impliqué, l’inflammation est le maître mot. Elle alimente un cercle vicieux : instabilité et hyperosmolarité du film lacrymal, apoptose des cellules épithéliales et diminution des cellules à mucus, renforçant l’inflammation de surface alors même qu’elle s’avère peu ou pas visible au niveau conjonctival. L’acuité visuelle peut, de la même façon, être conservée et dissociée de la plainte fonctionnelle majeure du patient. Malgré cela, de nombreuses études ont démontré l’impact considérable de la sécheresse oculaire sur la qualité de vie des sujets,4 qui souffrent plus fréquemment de symptômes anxiodépressifs (fig. 1).5, 6
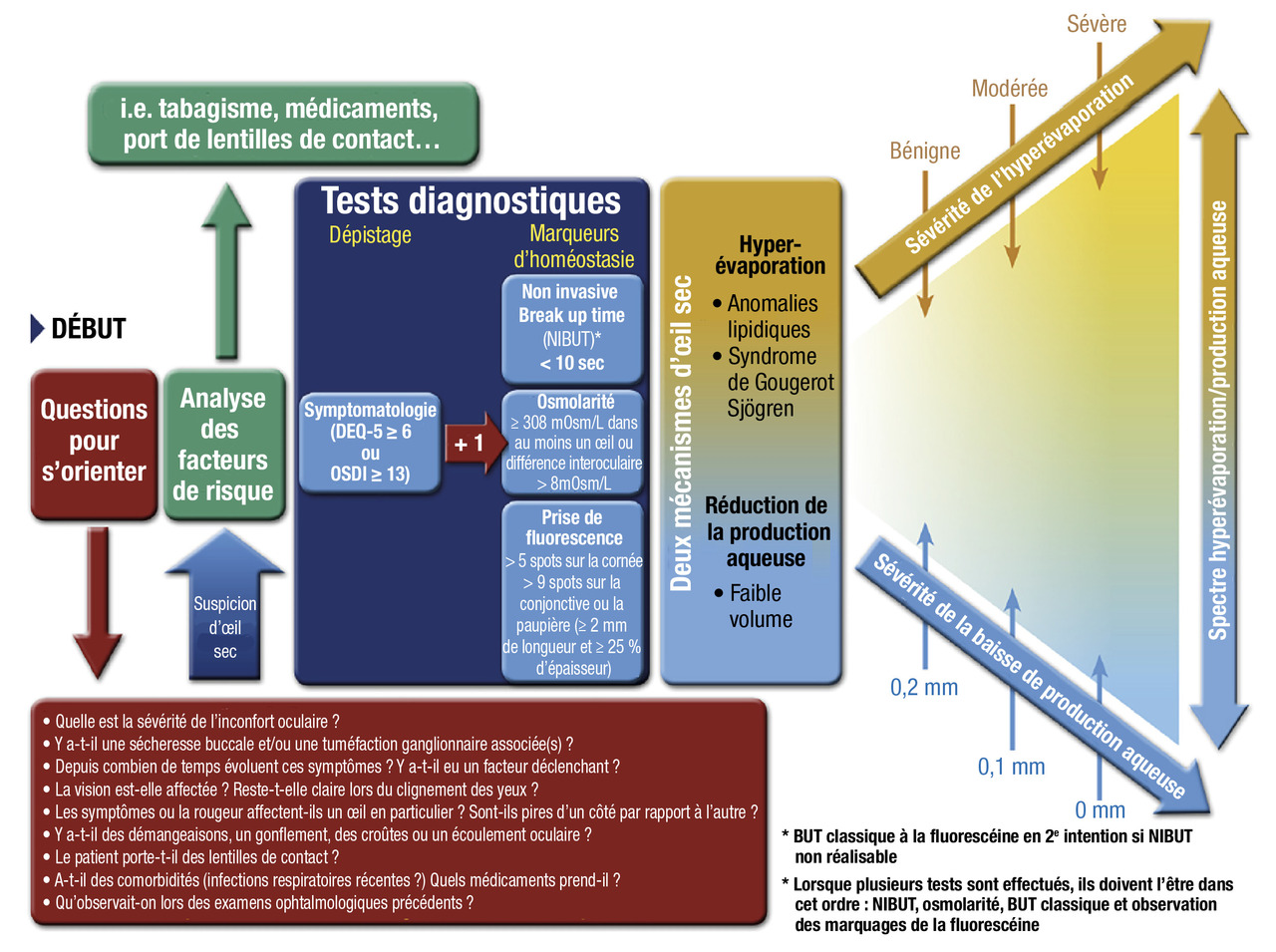
La prise en charge d’un œil sec fait appel à une double évaluation : subjective, le questionnaire le plus utilisé étant l’OSDI (Ocular Surface Disease Index), et objective :
- le test de Schirmerconsiste à recueillir les larmes sur du papier buvard millimétré. On mesure ensuite la hauteur atteinte par l’humidification, qui se propage par capillarité (normale : 20 mm en 5 min sans anesthésie). Il est important d’éviter le contact entre la bandelette et la cornée qui pourrait déclencher un larmoiement réflexe et rendre le test ininterprétable :
- en cas de test < 5 mm, le mécanisme d’hyposécrétion lacrymale par déficit aqueux est suspecté et évoque le diagnostic de Gougerot-Sjögren. A contrario, un test de Schirmer normal ne doit pas amener à exclure le diagnostic d’œil sec par atteinte des phases muciniques ou lipidiques (hyperévaporation des larmes) ;
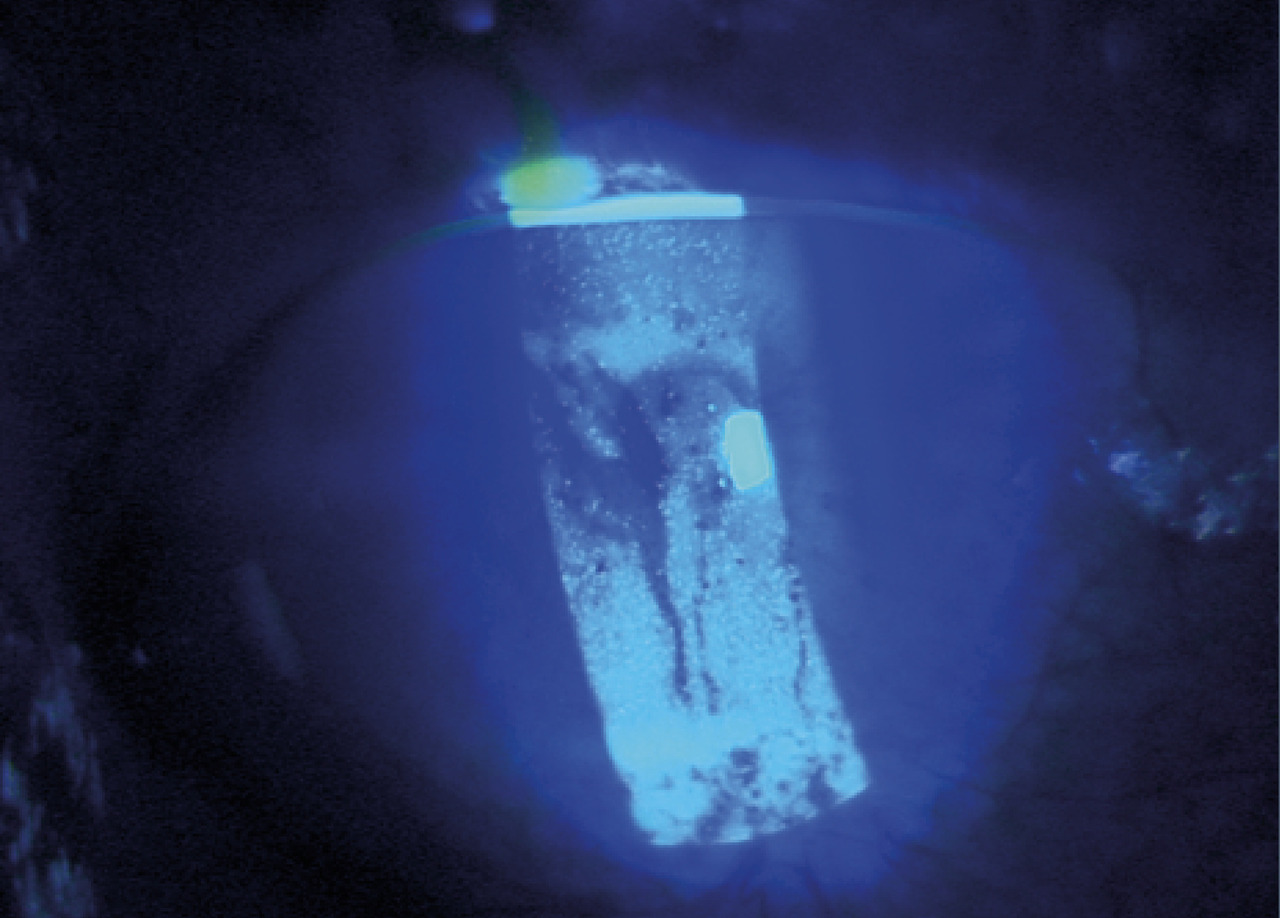
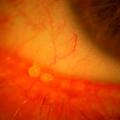
- s’il est compris entre 5 et 20 mm, le déficit aqueux n’est pas spécifique du syndrome de Gougerot-Sjögren. De nombreuses études ont désormais prouvé l’association des mécanismes d’hyposécrétion (atteinte de la production aqueuse par la glande lacrymale) et d’hyperévaporation (dysfonction de la production de la phase lipidique des glandes de Meibomius chez les sujets atteints de Gougerot-Sjögren).7 L’examen en lampe à fente évalue alors la surface oculaire dans son ensemble. Il cherche à identifier une blépharite (inflammation palpébrale), une hyperhémie conjonctivale ou une kératite, mise en évidence par des colorants vitaux, dont le chef de file est la fluorescéine (fig. 2) ;
- d’autres tests sont réalisés par le spécialiste lors de l’examen en lampe à fente (fig. 1), tels que le Break-up time (BUT) [fig. 2] ou le Non-Invasive Break-up time (NIBUT) : il évalue la stabilité du film lacrymal sur la cornée à partir de clignements, en comptant le temps que va mettre le film pour se rompre en projetant une grille sur la cornée (NIBUT normal > 10 s ; sécheresse oculaire < 10 s). Contrairement au BUT, il n’y a pas d’instillation de fluorescéine.
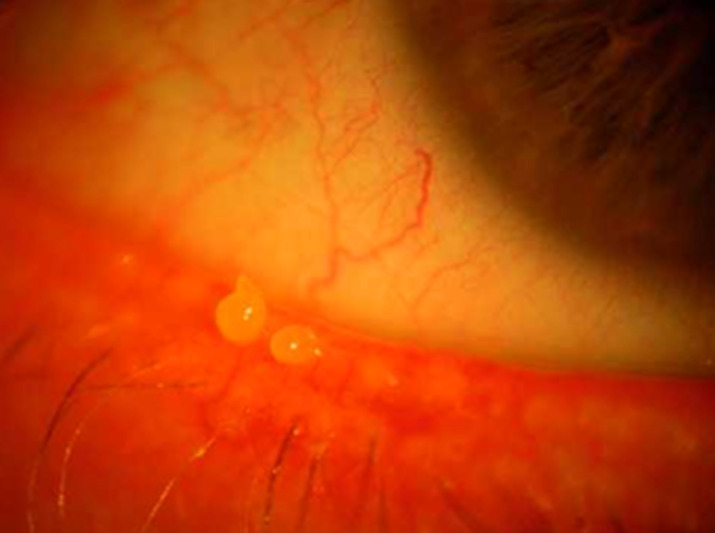
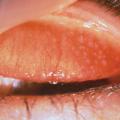
L’examen du visage du patient, à la recherche d’un aspect évocateur de rosacée oculaire en premier lieu, puis l’examen de la marge palpébrale orientent assez facilement vers une blépharite associée ou non à une meibomite, sur l’aspect de l’orifice des glandes, la présence de croûtes et l’association à une inflammation locale (fig. 3).
L’arsenal thérapeutique dans le syndrome sec s’est nettement étoffé depuis plusieurs années. Ainsi, le clinicien a à sa disposition substituts lacrymaux, traitements anti-inflammatoires (ciclo-sporine), sérum autologue en collyre, bouchons lacrymaux et lentilles sclérales. En cas de dysfonction meibomienne associée, on préconise un traitement par chauffage/massage des paupières ou de nouveaux dispositifs. Ils combinent à la fois la thermothérapie pulsée à un massage palpébral séquentiel (LipiFlow principalement ; iLux et Alcon sont en développement). Leur utilisation en France est marginale en raison de leur prix élevé (consommable très onéreux). Un effet favorable chez des patients souffrant de dysfonction meibomienne a été rapporté bien que des essais cliniques supplémentaires soient nécessaires.8 Les substituts lacrymaux sont à prescrire en 1re intention en associant différentes classes selon l’efficacité obtenue (tableau 1) et en privilégiant les formes sans conservateurs.
Les autres thérapeutiques, de 2e ligne, sont du ressort de l’ophtalmologiste.
Allergie oculaire
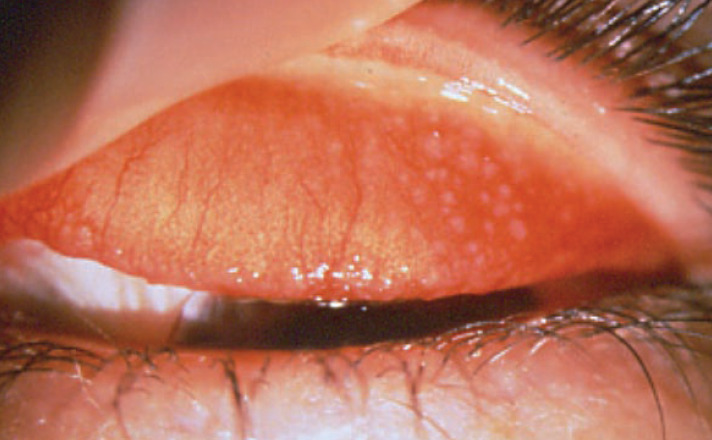
C’est un motif de consultation fréquent en médecine générale. Ce terme générique regroupe 6 entités cliniques distinctes : conjonctivite saisonnière, perannuelle, gigantopapillaire, kératoconjonctivite vernale ou atopique et allergie de contact. Ces dénominations correspondent aux formes cliniques historiquement décrites que nous aborderons, bien que certains auteurs proposent une classification selon le mécanisme d’hypersensibilité impliqué, IgE-médiée ou non.9Les formes les plus fréquentes sont aussi les moins graves. Elles proviennent d’une hypersensibilité IgE-médiée, la différence étant le caractère saisonnier ou non de l’allergène.La conjonctivite saisonnière est la forme la plus courante. Elle peut être associée ou non à une rhinite allergique. Le pollen est le plus souvent incriminé, d’où la saisonnalité de la pathologie. En cas de conjonctivite perannuelle, il faut rechercher des allergènes tels qu’acariens, moisissures et/ou phanères d’animaux domestiques dans l’environnement du patient. Le diagnostic repose sur un interrogatoire « policier » et sur des tests allergologiques, davantage indiqués dans la forme perannuelle car l’allergène coupable est plus difficile à identifier.La conjonctivite gigantopapillaire est une forme à part entière bien identifiée, de bon pronostic sans atteinte cornéenne, essentiellement rencontrée chez le porteur de lentilles ou de prothèse oculaire. Elle est la conséquence d’une allergie associée à une irritation mécanique, le plus souvent liée à une atopie dirigée contre le produit d’entretien plutôt que contre le matériau de la lentille. Des papilles géantes sont observées sur la conjonctive tarsale (celle située à la face interne des paupières, par opposition à la conjonctive bulbaire, tapissant une partie du globe oculaire). La gravité de la pathologie allergique est liée à l’atteinte cornéenne que l’on retrouve chez le jeune garçon (kératoconjonctivite vernale) et chez l’adulte (kératoconjonctivite atopique). Dans les 2 cas, elle peut grever le pronostic visuel en altérant profondément la surface oculaire.Enfin, l’eczéma palpébral correspond à une allergie de contact des paupières, le plus souvent réactionnelle à des produits cosmétiques ou à l’application de traitements locaux. L’allergie oculaire repose sur l’existence d’un prurit, d’une sensation de grain de sable, d’un larmoiement et de sécrétions matinales claires associées à un terrain atopique ou à une périodicité particulière. Celle-ci n’est pas spécifique, une allergie de type perannuelle pouvant simplement s’exprimer sous la forme d’une sécheresse oculaire. L’examen s’attache à rechercher hyperhémie et papilles conjonctivales, et eczéma palpébral (fig. 4).Douleurs, baisse d’acuité visuelle, rougeur intense ou symptomatologie résistant aux traitement entrepris doivent faire demander un avis spécialisé afin de rechercher une atteinte cornéenne qui signera la gravité de la pathologie. La place du bilan allergologique est discutée, mais certaines indications sont bien identifiées : forme sévère, récidivante ou pour laquelle l’allergène n’a pas de périodicité permettant de l’identifier aisément. Ces tests sont en général réalisés par un allergologue.Si les kératoconjonctivites vernales et atopiques relèvent du spécialiste en raison de la nécessité d’examen à la lampe à fente de la cornée, les conjonctivites allergiques bénignes et de contact peuvent être prises en charge par le généraliste.Leur traitement repose sur des mesures symptomatiques (éducation du patient, éviction de l’allergène, lavages oculaires au sérum froid) et des antiallergiques topiques (tableau 2). Habituellement, les collyres antidégranulants, antihistaminiques ou ceux combinant les 2 effets sont les plus utilisés. Les antihistaminiques soulagent la crise aiguë quand les antidégranulants jouent un rôle préventif à plus long terme. Là encore, il convient, lors d’une utilisation de plusieurs semaines, de privilégier les formes sans conservateur, moins agressives pour la surface oculaire.Quant aux antihistaminiques par voie orale, ils trouveront toute leur place, en cas d’atopie généralisée, en traitement adjuvant. La corticothérapie locale, bien qu’efficace, est du ressort du spécialiste afin d’éviter la survenue de complications insidieuses (hypertonie intraoculaire, cataracte). Une exception : l’eczéma de contact palpébral qui bénéficie de l’application de dermocorticoïdes locaux associés à des crèmes hydratantes adaptées aux paupières.
Surface oculaire et iatrogénie
Bien que l’allergie médicamenteuse de contact existe sous la forme d’un eczéma périoculaire, elle est rare et de diagnostic aisé. En revanche, la toxicité médicamenteuse de surface est très fréquente, insidieuse et de diagnostic difficile.Elle est corrélée à la dose et à la durée d’utilisation des collyres et concerne donc des patients traités pour des pathologies chroniques telles que le glaucome. Il n’est plus à démonter aujourd’hui que le rôle des conservateurs est essentiel dans l’apparition de la toxicité des collyres.10 Cette dernière est responsable de façon indirecte d’une dissolution de la phase lipidique et, plus directement, d’une action cytotoxique au niveau des cellules épithéliales conjonctivo-cornéennes. Les conservateurs sont à proscrire chez les patients souffrant de pathologies chroniques ophtalmologiques, a fortiori en cas de traitement prolongé comme chez les glaucomateux. La prise en charge de la toxicité iatrogène de la surface oculaire repose sur la prévention des facteurs favorisants tels que l’exposition à des conservateurs et pourra rejoindre celle du syndrome sec par l’adjonction de substituts lacrymaux selon la sévérité de l’atteinte.
Actualisation de l’article : Kanav Khanna R, Pisella PJ. Troubles chroniques de la surface oculaire. Rev Prat Med Gen 2021 ;35(1054) ;66 - 9
Que dire à vos patients
Savoir expliquer :
- la chronicité de la sécheresse oculaire, sans guérison à attendre ;
- le caractère substitutif et non curatif du traitement et la nécessité de l’adapter à sa gêne pluriquotidiennement et au long cours.
Rassurer le patient : sauf exception, la vue n’est pas menacée par le syndrome sec.
S’entourer d’autres professionnels de santé comme le dermatologue (dans la rosacée oculaire), l’allergologue, voire un psychologue (soutien psychothérapeutique).
Essentiel
- Forte répercussion sur la qualité de vie des troubles chroniques de la surface oculaire.
- Évaluations objective et subjective définissent le type et la sévérité du syndrome sec.
- Substituts lacrymaux seuls ou en association de classes en première intention.
- Bilan allergologique en cas d’allergie oculaire sévère, récidivante ou d’allergène difficilement identifiable.
2. Pisella P, Baudouin C, Hoang-Xuan T. Surface oculaire. Rapport SFO 2015.
3. Craig JP, Nichols KK, Akpek EK, et al. TFOS DEWS II definition and classification report. Ocul Surf 2017;15(3):276‑83.
4. Habay T, Majzoub S, Perrault O, et al. [Objective assessment of the functional impact of dry eye severity on the quality of vision by double-pass aberrometry]. J Fr Ophtalmol 2014;37(3):188‑94.
5. Labbé A, Wang YX, Jie Y, et al. Dry eye disease, dry eye symptoms and depression: the Beijing Eye Study. Br J Ophthalmol 2013;97(11):1399‑403.
6. Wolffsohn JS, Arita R, Chalmers R, et al. TFOS DEWS II Diagnostic Methodology report. Ocul Surf 2017; 15(3):539‑74.
7. Foulks GN, Forstot SL, Donshik PC, et al. Clinical guidelines for management of dry eye associated with Sjögren disease. Ocul Surf 2015;13(2):118‑32.
8. Finis D, Hayajneh J, König C, et al. Evaluation of an automated thermodynamic treatment (LipiFlow) system for meibomian gland dysfunction: a prospective, randomized, observer-masked trial. Ocul Surf 2014;12(2):146‑54.
9. Leonardi A, Doan S, Fauquert JL, et al. Diagnostic tools in ocular allergy. Allergy 2017;72(10):1485‑98.
10. Baudouin C, Labbé A, Liang H, et al. Preservatives in eyedrops: the good, the bad and the ugly. Prog Retin Eye Res 2010;29(4):312‑34.

 Encadrés
Encadrés