Pouvant mettre en jeu le pronostic vital, c’est l’urgence gynécologique par excellence.
Grâce à l’amélioration du diagnostic, qui est plus précoce, et de la prise en charge, moins invasive, la morbi- mortalité a diminué. En parallèle, son incidence a augmenté dans les pays développés (environ 2 % des grossesses en France1).
Redouter la rupture
Faire le diagnostic est donc capital. Une GEU doit être évoquée chez toute femme en âge de procréer ayant des douleurs pelviennes et/ou des métrorragies. Dans ces situations, très fréquentes au premier trimestre de grossesse, l’enjeu est d’identifier les rares patientes concernées parmi les nombreuses grossesses d’évolution normale ou en cours d’avortement spontané.
Deux examens permettent d’éliminer le diagnostic : un dosage des hCG (human Chorionic Gonadotropin) négatif ; en cas de hCG positifs, la visualisation échographique d’une grossesse intra-utérine.
Examen clinique
L’assistance médicale à la procréation (AMP) est également considérée favorisante même si la part liée à la technique (insémination, FIV) est souvent intriquée avec la cause de l’infertilité (origine tubaire ? endométriose ?). Les grossesses hétérotopiques (présence concomitante d’une grossesse extra- et intra-utérine) sont extrêmement rares mais plus fréquentes en cas d’AMP.
Enfin, le dispositif intra-utérin (DIU) au lévonorgestrel est aussi un facteur de risque (cf. microprogestatif) ; le DIU au cuivre, par sa position, n’agit que sur l’implantation intra-utérine sans bloquer l’ovulation. Il n’est pas un facteur de risque de GEU mais ne peut pas l’empêcher.
Signes fonctionnels à rechercher :
– des douleurs pelviennes d’apparition récente, latéralisées ou non ;
– des métrorragies, souvent peu abondantes et foncées (« sépia ») ;
– un éventuel retard de règles (inconstant) ;
– en faveur d’une GEU rompue : douleur pelvienne intense, malaise, troubles de conscience, scapulalgies (par irritation péritonéale liée à un hémopéritoine).
L’examen physique débute par la prise des constantes pour identifier un éventuel trouble hémodynamique (GEU rompue). La palpation abdominale recherche une douleur, souvent latéralisée. Une défense, voire une contracture généralisée, font suspecter une rupture. L’examen au spéculum caractérise les éventuelles métrorragies et confirme leur origine endo-utérine.
Le toucher vaginal peut provoquer une douleur annexielle, voire au niveau du cul- de-sac vaginal postérieur (Douglas), en faveur d’un hémopéritoine. La palpation d’une masse annexielle n’est pas fréquente, surtout si le toucher est limité par la douleur. L’utérus est classiquement de taille normale, éventuellement en contradiction avec un terme de grossesse supposé avancé. En cas de GEU rompue, l’irritation péritonéale est telle que le toucher vaginal est douloureux dans son ensemble.
Explorations
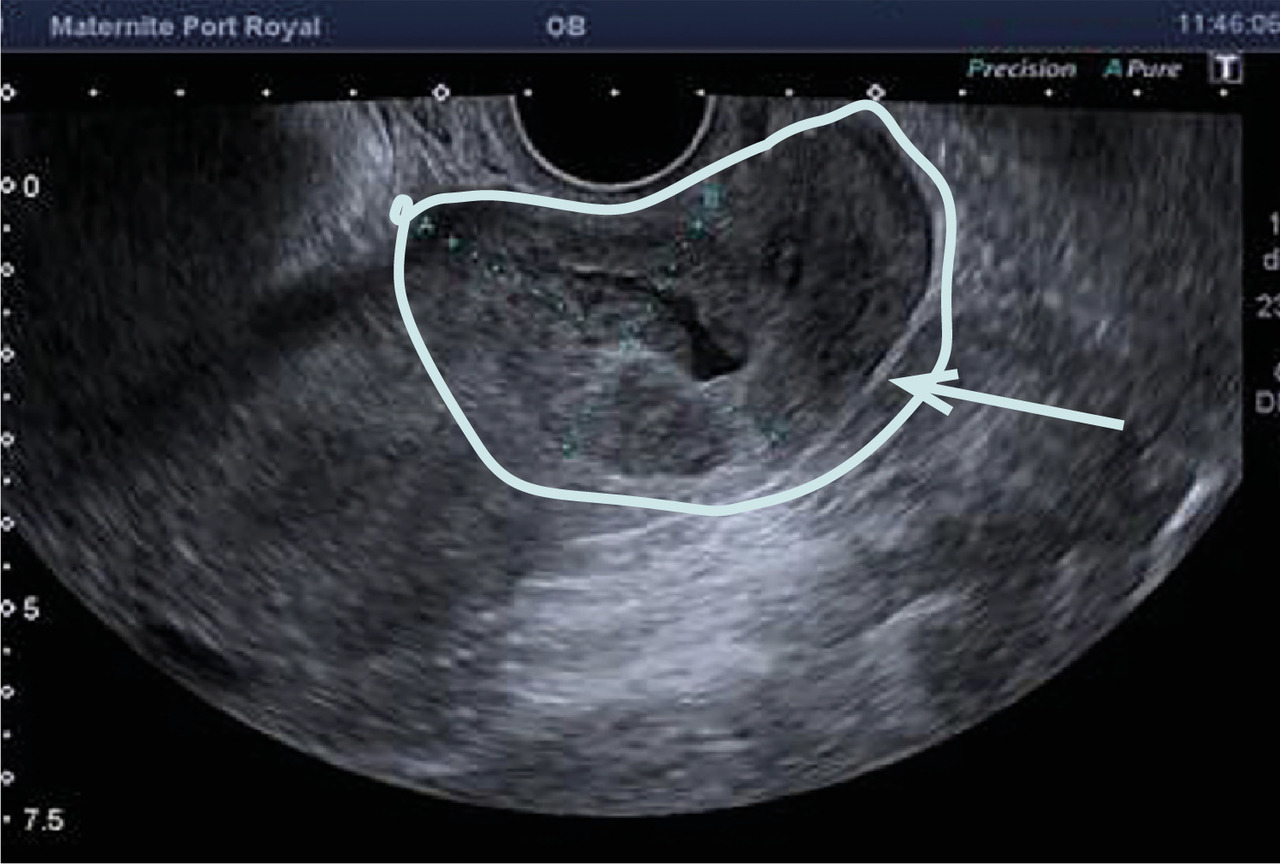
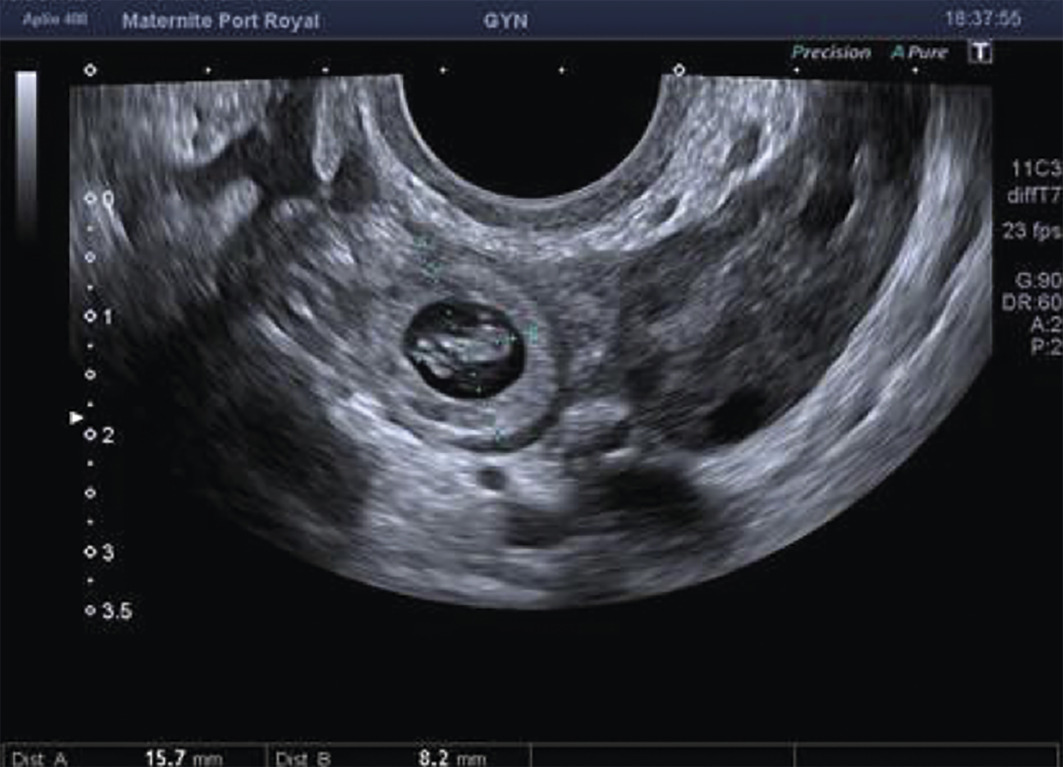
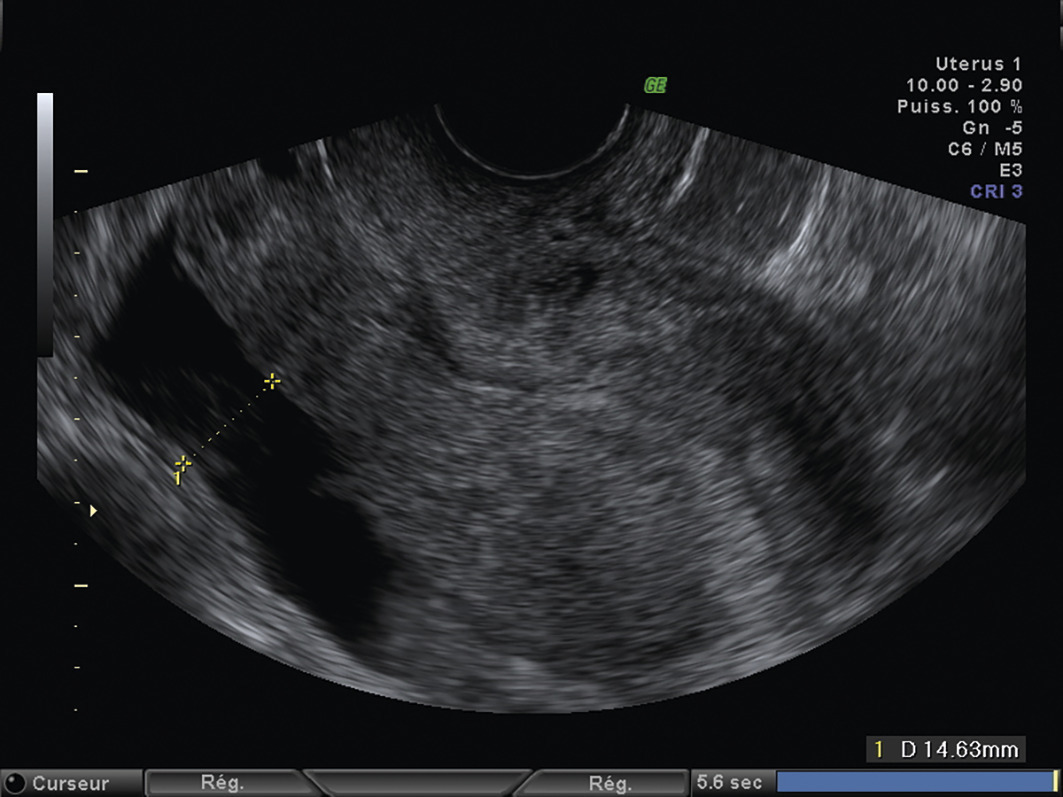
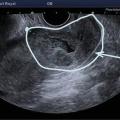
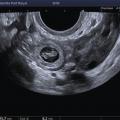
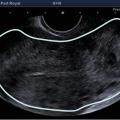
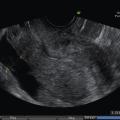
L’échographie, indispensable, doit examiner le pelvis mais aussi l’abdomen. Elle est donc réalisée par voie endovaginale, sus-pubienne et abdominale. On peut visualiser une masse latéro-utérine (
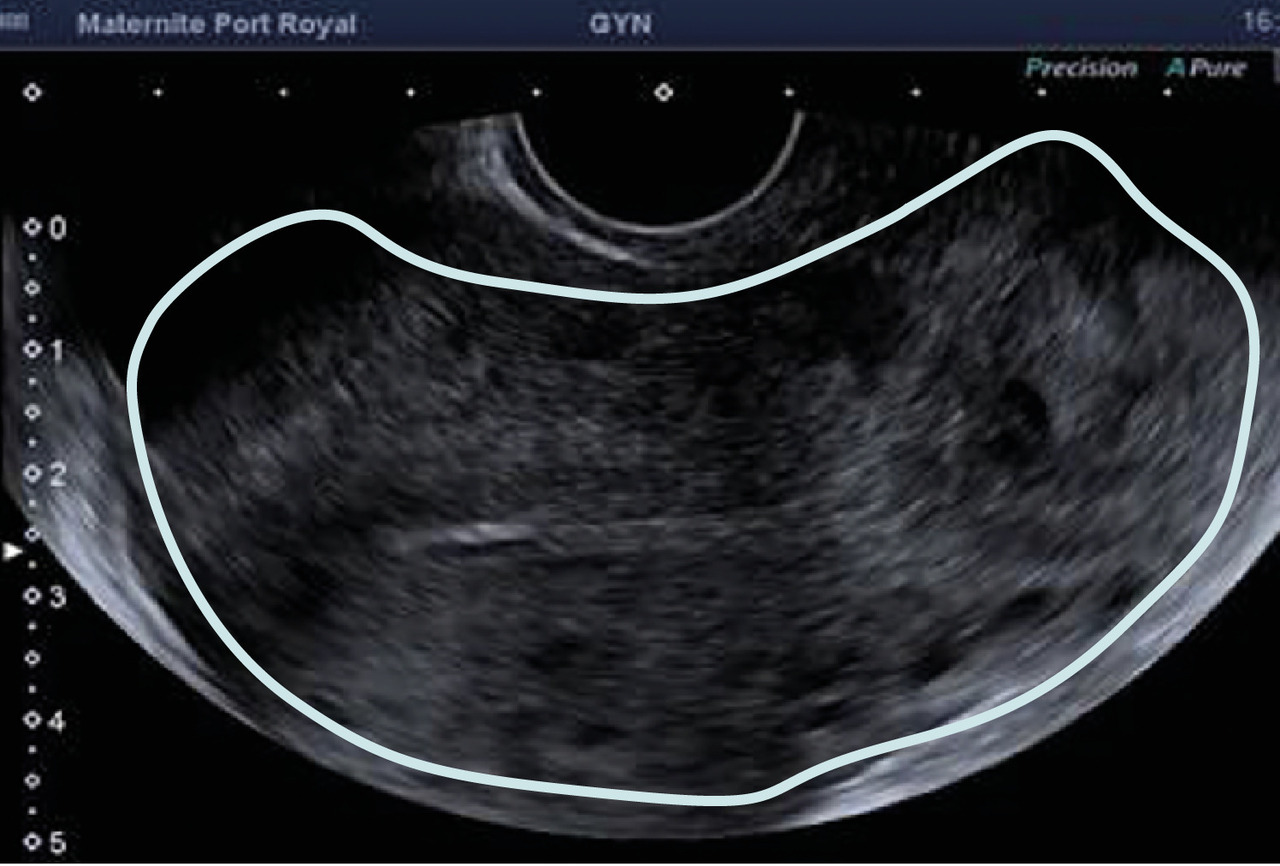
Souvent, le principal signe est indirect :
– vacuité utérine (
– épanchement abdomino-pelvien, traduisant un hémopéritoine. Il est visible en échographie pelvienne dans le cul-de-sac de Douglas et en écho abdominale dans l’espace de Morrison (situé entre le foie et le rein droit ; dans ce cas, évoquer une GEU rompue avec hémopéritoine important).
D’autres examens non utiles au diag- nostic sont nécessaires pour la prise en charge ultérieure : numération formule sanguine pour rechercher une anémie (GEU rompue) ; bilan rénal et hépatique avant traitement médical ; groupe sanguin avec rhésus (bilan prétransfusionnel).
Traiter selon l’urgence
Chez une patiente paucisymptomatique (situation la plus fréquente), le diagnostic peut être difficile à établir avec certitude si le taux de hCG est faible et/ou si l’échographie ne parvient pas à mettre en évidence de masse latéro-utérine.
La cinétique des hCG (sur des dosages répétés à 48 heures d’intervalle), voire une biopsie d’endomètre (recherche des villosités choriales affirmant une grossesse intra-utérine) sont alors utiles.
Durant cette période d’exploration qui peut nécessiter plusieurs jours, il est recommandé aux patientes de ne pas s’éloigner de l’hôpital et de consulter en cas de fortes douleurs ou de saignements abondants.
Une fois le diagnostic posé, en l’absence de signe de rupture ou de douleurs, un traitement médical est possible.6 Il repose sur une injection intramusculaire de méthotrexate (1 mg/kg) après avoir vérifié l’absence de perturbation du bilan (hépatique et rénal, NFS). Le taux de réussite oscille entre 70 et 80 % selon les études. Le but est d’interrompre l’évolution de la grossesse. En revanche, cela n’empêche pas la rupture, ce qui impose une surveillance jusqu’à négativation des hCG.
Ainsi, un éloignement géographique de l’hôpital, un voyage en avion, mais aussi des difficultés de communication avec la patiente sont des contre-indications. En cas de stagnation des hCG lors des contrôles hebdomadaires, une seconde injection de méthotrexate est envisageable. Dans ce cas, elle est réalisée immédiatement à la suite du contrôle clinique, biologique et échographique, à J7 de la première administration.
Le taux initial des hCG prédit la réponse. Une valeur supérieure à 5 000 UI/L est associée à un risque d’échec important et proscrit le traitement médical. Ce seuil n’est pas consensuel (certaines équipes fixent la limite à 10 000 UI/L). Une activité cardiaque dans une GEU embryonnée est aussi une contre-indication.
Lorsque les taux de hCG sont faibles (< 1 500 UI/L), l’intérêt de la prise en charge par rapport au placebo est régulièrement discuté.7 Ainsi, chez une femme ayant une GEU asymptomatique et une décroissance spontanée des hCG plasmatiques, l’abstention thérapeutique est possible. La surveillance est la même qu’après injection de méthotrexate : contrôle échographique à 1 semaine et suivi hebdomadaire des hCG plasmatiques jusqu’à négativation.
En cas de grossesse cornuale, sur cicatrice de césarienne, ou cervicale, la prise en charge est individualisée, selon la clinique et les habitudes de l’équipe.9 Injection in situ de méthotrexate directement dans la grossesse extra-utérine (en cours de cœlioscopie si grossesse cornuale ou sous contrôle échographique en cas de grossesse cervicale ou sur cicatrice), résection chirurgicale de corne ou injections répétées de méthotrexate en intramusculaire peuvent être proposées.
Quel suivi après une GEU ?
La demi-vie d’élimination plasmatique du méthotrexate étant de 3 à 4 heures, il est possible d’entamer une nouvelle grossesse assez rapidement ; en pratique, lors du cycle qui suit la négativation (soit environ 1 mois après la fin de la surveillance).
Chez ces femmes, il faut préférer les contraceptions bloquant l’ovulation (estroprogestatifs), en l’absence de contre-indication. Les microprogestatifs et les DIU (microprogestatifs ou au cuivre) ne sont pas recommandés. La patiente doit être informée du risque de récidive, et le choix est fait en tenant compte de la balance bénéfices-risques.
Grossesse ectopique paraît plus adapté aux localisations interstitielles ou cornuales (corne utérine : partie intramyométriale de la trompe), cervicales ou sur cicatrice de césarienne, beaucoup plus rares.
Toute patiente opérée pour une GEU doit être prévenue des risques de laparoconversion (passage d’une cœlioscopie à une laparotomie en cours d’intervention) mais aussi de salpingectomie (ablation de la trompe).
En théorie, l’approche est la plus conservatrice possible mais, en pratique, l’absence de différence en termes de fertilité ultérieure entre salpingotomie et salpingectomie8 fait préférer cette dernière d’emblée à certaines équipes.
Faire une échographie de localisation précoce (vers 6-7 SA environ).
Le délai pour une nouvelle grossesse après une injection de méthotrexate est d’un mois environ.
Arrêter le tabac.
L’évoquer toujours devant des métrorragies et/ou des douleurs pelviennes chez une femme en âge de procréer.
Examens de première intention : dosage des hCG et échographie.
La prise en charge est chirurgicale (cœlioscopie).
En cas de forme paucisymptomatique, un traitement médical (ou une surveillance) peut être discuté.
Extra-utérine ou ectopique ?
Grossesse extra-utérine signifie que la nidation de l’œuf est hors cavité utérine. Dans la très grande majorité des cas, l’implantation est tubaire (au niveau de la trompe) mais elle peut aussi être ovarienne, voire exceptionnellement abdominale.
Grossesse ectopique paraît plus adapté aux localisations interstitielles ou cornuales (corne utérine : partie intramyométriale de la trompe), cervicales ou sur cicatrice de césarienne, beaucoup plus rares.
Salpingectomie ou salpingotomie ?
Toute patiente opérée pour une GEU doit être prévenue des risques de laparoconversion (passage d’une cœlioscopie à une laparotomie en cours d’intervention) mais aussi de salpingectomie (ablation de la trompe).
En théorie, l’approche est la plus conservatrice possible mais, en pratique, l’absence de différence en termes de fertilité ultérieure entre salpingotomie et salpingectomie8 fait préférer cette dernière d’emblée à certaines équipes.
Quels conseils donner après une GEU ?
Consulter en cas de nouvelle grossesse si métrorragies et/ou douleurs.
Faire une échographie de localisation précoce (vers 6-7 SA environ).
Le délai pour une nouvelle grossesse après une injection de méthotrexate est d’un mois environ.
Arrêter le tabac.
2. Lozeau AM, Potter B. Diagnosis and management of ectopic pregnancy. Am Fam Physician 2005;72: 1707-14.
3. Bouyer J, Coste J, Shojaei T, al. Risk factors for ectopic pregnancy: a comprehensive analysis based on a large case-control population-based study in France. Am J Epidemiol 2003;157:185-94.
4. Murray H, Baakdah H, Bardell T, Tulandi T. Diagnosis and treatment of ectopic pregnancy. CMAJ 2005;173: 905-12.
5. Gervaise A, Fernandez H. Prise en charge diagnostique et thérapeutique des grossesses extra-utérines. J Gynecol Obstet Biol Reprod 2010;39(3 Suppl):F17-24.
6. Mol F, Mol BW, Ankum WM, van der Veen F, Hajenius PJ. Current evidence on surgery, systemic methotrexate and expectant management in the treatment of tubal ectopic pregnancy: a systematic review and meta-analysis. Hum Reprod Update 2008 14:309-19.
7. Jurkovic D, Memtsa M, Sawyer E, et al. Single-dose systemic methotrexate vs expectant management for treatment of tubal ectopic pregnancy: a placebo-controlled randomized trial. Ultrasound Obstet Gynecol 2017;49:171-6.
8. Fernandez H, Capmas P, Lucot JP, Panel P, Bouyer J; GROG. Fertility after ectopic pregnancy: the DEMETER randomized trial. Hum Reprod 2013;28:1247-53.
9. Moawad NS, Mahajan ST, Moniz MH, Taylor SE, Hurd WW. Current diagnosis and treatment of interstitial pregnancy. Am J Obstet Gynecol 2010;202:15-29.

 Encadrés
Encadrés