La prise en charge est complexe et ne se limite pas à l’implantation d’un défibrillateur. D’ailleurs, la plupart des patients n’en ont pas besoin.
Faire le diagnostic est crucial
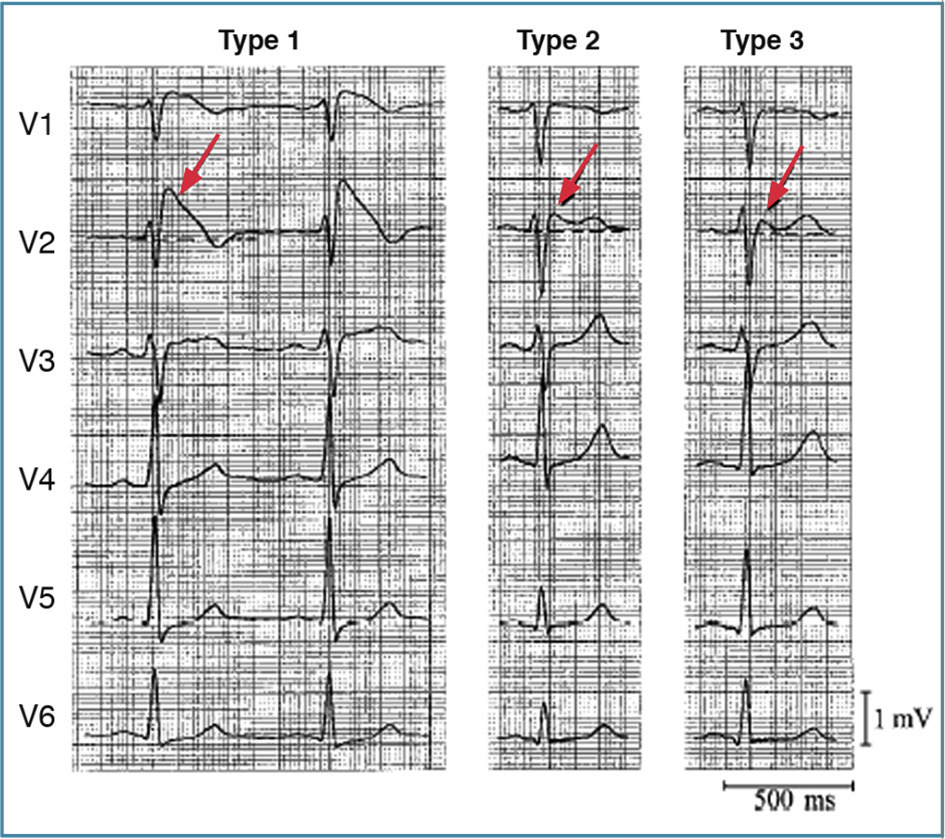
Il repose sur l’ECG : sus-décalage du segment ST convexe et de plus de 2 mm dans les dérivations précordiales droites (en particulier en V1 et en V2 ;
Selon la dernière conférence de consensus, une anomalie dans une seule dérivation suffit.1
Ondes T volontiers négatives dans les mêmes dérivations. Fonction cardiaque normale, absence de symptôme.
Mais risque de syncope et de mort subite (par troubles du rythme ventriculaire) justifiant une évaluation complète +++.
Rare en population générale, retrouvé le plus souvent chez des hommes autour 40 ans. Exceptionnel chez les enfants avant l’adolescence.2
Habituellement asymptomatique. Survient parfois après une syncope ou plus rarement un arrêt cardiaque.3
Souvent, aspect initial incomplet, non concluant.
Bien distinguer une anomalie évocatrice (types 2 et 3 ;
ECG variable dans le temps. En cas de doute diagnostique et pour le dépistage familial, proposer un test à l’ajmaline (de préférence) ou à la flécaïne qui « démasque » l’anomalie si l’ECG est normal.4
Quelles causes ?
Origine génétique et transmission autosomique dominante : proposer un dépistage familial à tous les apparentés du premier degré+++.
Idéalement : test à l’ajmaline (sensibilité de l’ordre de 97 %).
Affection complexe, associant des mutations dans le gène SCN5A (codant pour la sous-unité a du canal sodique) mais également des variants (fréquents) ; leur relation avec le syndrome n’est pas totalement élucidée.
Le dépistage des apparentés ne peut se limiter à l’analyse génétique. Examen clinique obligatoire.5
Quel risque rythmique ?
Une fois le diagnostic établi, faut-il poser un défibrillateur ? Actuellement, aucun médicament n’a démontré son efficacité. Prise en charge dictée par l’évaluation du risque rythmique, complexe, fondée sur les symptômes et aspect spontané de Brugada.
Recommander à tous les patients de traiter agressivement la fièvre – par antipyrétiques – (risque augmenté d’événements rythmiques) et d’éviter les médicaments pouvant être aggravants (
Proscrire les alcoolisations aiguës massives (impact péjoratif) ainsi que les activités physiques lorsqu’il fait chaud. Pas de contre-indication à la pratique du sport.
Ralentir progressivement l’effort en cas d’activité physique intense afin d’éviter l’à-coup vagal post-effort pouvant majorer l’aspect de ce syndrome et potentiellement le risque rythmique.
Risque le plus élevé :
– patients ayant fait des syncopes considérées d’origine rythmique ou une mort subite récupérée avec ECG de type 1 spontané ;
– défibrillateur automatique implantable sans aucun doute+++.
Mais symptômes parfois atypiques :
– syncope durant la nuit et le sommeil se traduisant par réveil brutal et énurésie nocturne occasionnelle ;
– syncopes vagales fréquentes ;
– troubles du rythme ventriculaire survenant volontiers dans un contexte vagal ;
– pas toujours simple de les différencier d’un véritable trouble du rythme ventriculaire.
À l’inverse, chez les patients asymptomatiques n’ayant pas d’ECG de type 1, risque faible : pas de défibrillateur.
Pour tous les autres, décision complexe :
– risque rythmique d’un sujet asymptomatique avec Brugada spontané : 1 % d’événements par an ;
– cumulatif au cours du temps, avec un taux de 10 % à 10 ans +++ ;
– ainsi pour des individus de 40 ans, par ailleurs en parfaite santé, conduite à tenir : pas évidente.
Aucun autre paramètre ECG ne permet de bien classer les patients.
L’exploration électrophysiologique – sonde positionnée dans le ventricule droit pour stimuler le cœur et tenter de déclencher une fibrillation ventriculaire – initialement très populaire n’est habituellement plus pratiquée (valeur prédictive très discutée).
Plus récente :
– ablation par radiofréquence de l’épicarde de l’infundibulum du ventricule droit ;
– geste invasif actuellement réservé aux patients déjà implantés d’un défibrillateur ayant régulièrement des troubles du rythme ventriculaire ;
– même s’il paraît séduisant, on manque de recul pour déterminer son réel bénéfice et ses risques.
Dimension psychologique
Le plus souvent, le diagnostic concerne un patient ne se considérant pas comme malade.
Prendre en compte l’impact psychologique, d’autant plus qu’il y a un risque de transmission à la descendance +++.
L’informer sur les diverses options thérapeutiques : essentielle tout au long du suivi (avantages et inconvénients de chacune et conséquences personnelles, professionnelles et sociales).
L’associer aux choix thérapeutiques est crucial sachant que la prise en charge à très long terme implique toute la famille. Lui laisser mûrir sa réflexion, en particulier dans les situations de risque intermédiaire, les plus fréquentes.
Pour cette raison, le suivi en centre spécialisé (liste des centres de compétence disponible sur le site Cardiogen, https://bit.ly/32S2lDH) est fortement recommandé.
Points clés
Diagnostic à l’ECG : sus-décalage du segment ST de plus de 2 mm convexe vers le haut dans les dérivations précordiales droites.
Dépistage chez tous les apparentés du premier degré.
Défibrillateur pour les patients les plus à risque, ayant fait un arrêt cardiaque ou des syncopes d’origine rythmique.
Chez les asymptomatiques avec aspect ECG typique, le défibrillateur est discuté.
1. Antzelevitch C, Yan GX, Ackerman MJ, et al. J-Wave syndromes expert consensus conference report: Emerging concepts and gaps in knowledge. Europace 2017;19:665-94.
2. Probst V, Denjoy I, Meregalli PG, et al. Clinical aspects and prognosis of Brugada syndrome in children. Circulation 2007;115:2042-8.
3. Probst V, Veltmann C, Eckardt L, et al. Long-term prognosis of patients diagnosed with Brugada syndrome: Results from the FINGER Brugada Syndrome Registry. Circulation 2010;121:635-43.
4. Therasse D, Probst V, Gourraud JB. Sodium channel blocker challenge in Brugada syndrome: Role in risk stratification. Int J Cardiol 2018;264:100-1.
5. Probst V, Wilde AA, Barc J, et al. SCN5A mutations and the role of genetic background in the pathophysiology of Brugada syndrome. Circ Cardiovasc Genet 2009;2:552-7.

 Encadrés
Encadrés