Cette complication sévère, mimant un syndrome de kawasaki, se déclare plusieurs semaines après une infection par le SARS-Cov-2.
Chez l’adulte, les formes graves de Covid-19 sont caractérisées par une pneumonie sévère et un syndrome de détresse respiratoire aiguë (SDRA).1 Chez l’enfant, les formes symptomatiques de Covid-19 sont moins fréquentes2, et beaucoup moins sévères, pour des raisons encore mal comprises.3 Lors de la première vague de la pandémie, caractérisée par une incidence élevée de la maladie, des cas groupés d’état de choc associé à des biomarqueurs cardiaques élevés et à une vasoplégie insolite (pression artérielle diastolique diminuée) dans un contexte hyperinflammatoire (fièvre élevée et prolongée, élévation de la CRP et hyperferritinémie) ont été rapportés quasi simultanément en Angleterre, en France et aux États-Unis.
Cette nouvelle entité, appelée « Multisystem Inflammatory Syndrome in Children » (MIS-C) ou « Paediatric Inflammatory Multisystem Syndrome temporally associated with SARS-Cov-2 » (PIMS-TS), correspond à un syndrome post-infectieux hyperinflammatoire dont les symptômes (fièvre élevée et persistante, hyperhémie conjonctivale, langue framboisée, lèvres vermillon sèches et craquelées, rash cutané, œdème des extrémités, adénopathies cervicales) miment parfois un syndrome de Kawasaki.4
Ce syndrome, de cause jusqu’à présent inconnue, peut se compliquer d’un état de choc et/ou d’une myocardite aiguë et d’anévrismes tardifs des artères coronaires. L’association d’une perfusion d’immunoglobulines humaines non spécifiques, d’une corticothérapie, voire d’une biothérapie si nécessaire, et d’un traitement antiagrégant plaquettaire (acide acétylsalicylique) prolongé permet, dans la plupart des cas, de contrôler ces complications.
Cette nouvelle entité, appelée « Multisystem Inflammatory Syndrome in Children » (MIS-C) ou « Paediatric Inflammatory Multisystem Syndrome temporally associated with SARS-Cov-2 » (PIMS-TS), correspond à un syndrome post-infectieux hyperinflammatoire dont les symptômes (fièvre élevée et persistante, hyperhémie conjonctivale, langue framboisée, lèvres vermillon sèches et craquelées, rash cutané, œdème des extrémités, adénopathies cervicales) miment parfois un syndrome de Kawasaki.4
Ce syndrome, de cause jusqu’à présent inconnue, peut se compliquer d’un état de choc et/ou d’une myocardite aiguë et d’anévrismes tardifs des artères coronaires. L’association d’une perfusion d’immunoglobulines humaines non spécifiques, d’une corticothérapie, voire d’une biothérapie si nécessaire, et d’un traitement antiagrégant plaquettaire (acide acétylsalicylique) prolongé permet, dans la plupart des cas, de contrôler ces complications.
Une nouvelle entité mimant un syndrome de Kawasaki
Mi-avril 2020, le South Thames Retrieval Service (London) a transporté, sur une période de seulement dix jours, huit enfants en état de choc hyperinflammatoire, ayant les caractéristiques d’un « toxic shock syndrome » ou d’un syndrome de Kawasaki, dont le nombre ne dépassait habituellement pas un ou deux cas par semaine.5 Six de ces enfants étaient d’origine afro-caribéenne et sept étaient en surpoids.
La présentation clinique initiale était très semblable, avec une fièvre prolongée, à 39-40 °C, un rash cutané, une conjonctivite bilatérale, des douleurs des extrémités et des troubles digestifs. Tous progressaient vers un état de choc vasoplégique nécessitant un remplissage vasculaire et des vasopresseurs (noradrénaline et milrinone). La plupart de ces enfants n’avaient pas de défaillance respiratoire prédominante, bien que sept d’entre eux aient été ventilés du fait de leur état de choc. Aucun enfant n’a été testé positif par PCR pour le Covid-19 sur une aspiration nasopharyngée ou un lavage broncho-alvéolaire, probablement parce que cette phase inflammatoire survenait après une première phase d’infection virale à SARS-Cov-2.
Les marqueurs inflammatoires (CRP, procalcitonine [PCT], ferritine, D-dimères et triglycérides) étaient très élevés. L’atteinte myocardique primitive de ces patients a été authentifiée par une élévation des enzymes cardiaques. Tous les enfants ont reçu 2 g/kg d’immunoglobulines intraveineuses et 50 mg/kg/j d’acide acétylsalicylique pendant au moins un mois. Tous sont sortis de réanimation pédiatrique après 4 à 6 jours, sauf un, qui a développé un état de choc cardiogénique réfractaire et est décédé sous assistance respiratoire extracorporelle (Extracorporelle Membrane Oxygénation [ECMO]) d’une hémorragie cérébrale.
La présentation clinique initiale était très semblable, avec une fièvre prolongée, à 39-40 °C, un rash cutané, une conjonctivite bilatérale, des douleurs des extrémités et des troubles digestifs. Tous progressaient vers un état de choc vasoplégique nécessitant un remplissage vasculaire et des vasopresseurs (noradrénaline et milrinone). La plupart de ces enfants n’avaient pas de défaillance respiratoire prédominante, bien que sept d’entre eux aient été ventilés du fait de leur état de choc. Aucun enfant n’a été testé positif par PCR pour le Covid-19 sur une aspiration nasopharyngée ou un lavage broncho-alvéolaire, probablement parce que cette phase inflammatoire survenait après une première phase d’infection virale à SARS-Cov-2.
Les marqueurs inflammatoires (CRP, procalcitonine [PCT], ferritine, D-dimères et triglycérides) étaient très élevés. L’atteinte myocardique primitive de ces patients a été authentifiée par une élévation des enzymes cardiaques. Tous les enfants ont reçu 2 g/kg d’immunoglobulines intraveineuses et 50 mg/kg/j d’acide acétylsalicylique pendant au moins un mois. Tous sont sortis de réanimation pédiatrique après 4 à 6 jours, sauf un, qui a développé un état de choc cardiogénique réfractaire et est décédé sous assistance respiratoire extracorporelle (Extracorporelle Membrane Oxygénation [ECMO]) d’une hémorragie cérébrale.
Une série complémentaire de 58 enfants dans huit hôpitaux anglais
Cette description initiale du MIS-C a été complétée par une série de 58 enfants, d’âge médian 9 ans (écart interquartile [EIQ] : 5,7-14), dont 33 (57 %) étaient des filles et 40 (60 %), d’origine africaine ou asiatique, ayant un PIMS-TS, constituée par huit hôpitaux anglais entre le 23 mars et le 16 mai 2020.6
La PCR à la recherche de SARS-Cov-2 et la sérologie IgG étaient positives chez respectivement 15 (26 %) sur 58 patients et 40 (87 %) sur 46 patients. Tous les enfants avaient de la fièvre et des signes digestifs non spécifiques, comme des vomissements (45 %), des douleurs abdominales (53 %) et de la diarrhée (52 %). Un rash était présent dans 52 % des cas et une hyperhémie conjonctivale dans 45 % des cas. La biologie mettait en évidence une réaction inflammatoire marquée (CRP médiane : 229 mg/L [EIQ : 156-338] ; ferritine : 610 µg/L [EIQ : 359-1 290]).
Parmi ces enfants :
– 29 (50 %) ont évolué vers un état de choc avec une élévation des biomarqueurs cardiaques, nécessitant un traitement inotrope et un remplissage vasculaire, et 23 (80 %) ont dû être ventilés mécaniquement ;
– 13 (22 %) remplissaient les critères de l’American Heart Association du syndrome de Kawasaki, mais 23 (40 %) avaient une fièvre et une inflammation sans signes de choc ni de syndrome de Kawazaki ;
– 8 (14 %) ont développé une dilatation ou un anévrisme d’une artère coronaire.
La comparaison des tableaux de PIMS-TS, des syndromes de Kawasaki et des syndromes de Kawasaki avec état de choc a révélé des différences cliniques et biologiques notables : notamment d’âge médian, respectivement 9 ans vs 2,7 et 3,8 ans, et des marqueurs de l’inflammation comme la CRP médiane : 229 mg/L vs 67 et 193 mg/L.
La PCR à la recherche de SARS-Cov-2 et la sérologie IgG étaient positives chez respectivement 15 (26 %) sur 58 patients et 40 (87 %) sur 46 patients. Tous les enfants avaient de la fièvre et des signes digestifs non spécifiques, comme des vomissements (45 %), des douleurs abdominales (53 %) et de la diarrhée (52 %). Un rash était présent dans 52 % des cas et une hyperhémie conjonctivale dans 45 % des cas. La biologie mettait en évidence une réaction inflammatoire marquée (CRP médiane : 229 mg/L [EIQ : 156-338] ; ferritine : 610 µg/L [EIQ : 359-1 290]).
Parmi ces enfants :
– 29 (50 %) ont évolué vers un état de choc avec une élévation des biomarqueurs cardiaques, nécessitant un traitement inotrope et un remplissage vasculaire, et 23 (80 %) ont dû être ventilés mécaniquement ;
– 13 (22 %) remplissaient les critères de l’American Heart Association du syndrome de Kawasaki, mais 23 (40 %) avaient une fièvre et une inflammation sans signes de choc ni de syndrome de Kawazaki ;
– 8 (14 %) ont développé une dilatation ou un anévrisme d’une artère coronaire.
La comparaison des tableaux de PIMS-TS, des syndromes de Kawasaki et des syndromes de Kawasaki avec état de choc a révélé des différences cliniques et biologiques notables : notamment d’âge médian, respectivement 9 ans vs 2,7 et 3,8 ans, et des marqueurs de l’inflammation comme la CRP médiane : 229 mg/L vs 67 et 193 mg/L.
78 entrées en réanimation au Royaume-Uni du 1er avril au 10 mai 2020
Les caractéristiques des 78 enfants admis pour PIMS-TS dans 21 des 23 unités de réanimation pédiatrique du Royaume-Uni entre le 1er avril et le 10 mai 2020 ont fait l’objet d’une analyse séparée.7 Le plus frappant était la brusque augmentation du nombre moyen d’enfants admis pour PIMS-TS pendant cette période (14 versus 1 par semaine en temps normal). L’âge médian était de 11 ans [EIQ : 8-14]. Le sexe masculin était surreprésenté (52 sur 78 [67 %]), de même qu’une origine ethnique minoritaire (61 sur 78 [78 %]). Une fièvre élevée et durable était observée chez 100 % des enfants, un état de choc chez 87 % d’entre eux et des troubles digestifs (douleur abdominale, vomissements, diarrhée) dans 66 % des cas.
Au cours des quatre premiers jours, probablement du fait des immunoglobulines intraveineuses (76 %), de la corticothérapie (73 %) et/ou de la biothérapie (22 %), l’évolution comportait une diminution des marqueurs inflammatoires (CRP médiane : de 264 à J1 à 96 mg/L à J4 ; D-dimères : de 4 030 à 1 659 µg/L ; ferritinémie : de 1 042 à 757 µg/L), tandis que la troponine sérique augmentait de 157 à 358 µg/L. Vingt-huit enfants (36 %) avaient des anomalies coronariennes, dont 18 anévrismes caractérisés. Trois enfants ont nécessité une ECMO et deux sont décédés.
Au cours des quatre premiers jours, probablement du fait des immunoglobulines intraveineuses (76 %), de la corticothérapie (73 %) et/ou de la biothérapie (22 %), l’évolution comportait une diminution des marqueurs inflammatoires (CRP médiane : de 264 à J1 à 96 mg/L à J4 ; D-dimères : de 4 030 à 1 659 µg/L ; ferritinémie : de 1 042 à 757 µg/L), tandis que la troponine sérique augmentait de 157 à 358 µg/L. Vingt-huit enfants (36 %) avaient des anomalies coronariennes, dont 18 anévrismes caractérisés. Trois enfants ont nécessité une ECMO et deux sont décédés.
En France, 35 enfants en état de choc
En France, 35 enfants en état de choc, avec une dysfonction ventriculaire gauche et un syndrome inflammatoire sévère, ont été rétrospectivement identifiés en deux mois par 14 unités de réanimation pédiatrique.8 Leur âge médian était de 10 ans (extrêmes 2-16). Des comorbidités (asthme, obésité) étaient présentes dans 25 % des cas. La fraction d’éjection ventriculaire était inférieure à 30 % chez un tiers de ces patients ; un support inotrope et une ECMO ont été nécessaires pour respectivement 80 % et 28 % d’entre eux.
Les marqueurs inflammatoires suggéraient fortement un « orage cytokinique » (interleukine-6 [IL-6] médiane : 135 pg/mL) et une activation macrophagique (D-dimères médians : 5 284 ng/mL) ; 88 % de ces enfants ont été testés à la recherche de Covid-19 par prélèvement nasopharyngé (PCR) ou sérologie. Tous les patients avaient reçu des immunoglobulines intraveineuses et un tiers d’entre eux une corticothérapie. La fonction ventriculaire gauche s’est normalisée chez 71 % des enfants sortis de réanimation. Aucun décès n’a été déploré, et tous les patients placés sous ECMO ont pu être sevrés.
Les marqueurs inflammatoires suggéraient fortement un « orage cytokinique » (interleukine-6 [IL-6] médiane : 135 pg/mL) et une activation macrophagique (D-dimères médians : 5 284 ng/mL) ; 88 % de ces enfants ont été testés à la recherche de Covid-19 par prélèvement nasopharyngé (PCR) ou sérologie. Tous les patients avaient reçu des immunoglobulines intraveineuses et un tiers d’entre eux une corticothérapie. La fonction ventriculaire gauche s’est normalisée chez 71 % des enfants sortis de réanimation. Aucun décès n’a été déploré, et tous les patients placés sous ECMO ont pu être sevrés.
Une grande étude observationnelle aux États-Unis
Aux États-Unis, 186 enfants répondant à la définition du MIS-C lié au SARS-Cov-2 ont été inclus dans une large étude observationnelle menée sous l’égide du Center for Disease Control and Prevention dans 26 États, entre le 15 mars et le 20 mai 2020.9
Parmi ces enfants :
– le délai médian entre les premiers symptômes cliniques et la survenue du MIS-C était de 25 jours (extrêmes : 6-51) ;
– l’âge médian était de 8,3 ans [EIQ : 3,3-12,5] ;
– 115 (62 %) étaient de sexe masculin et 135 (73 %) antérieurement sains ;
– 70 % avaient une PCR positive pour SARS-CoV-2 et 30 % d’entre eux avaient eu un contact direct avec un patient infecté par le Covid-19 ;
– 92 % avaient des marqueurs inflammatoires (CRP, PCT, ferritine, D-dimères) très élevés et 73 % des biomarqueurs cardiaques (BNP, troponine) élevés ;
– 71 % avaient une défaillance viscérale impliquant les fonctions digestive (92 %), cardiovasculaire (80 %), hématologique (72 %), cutanéomuqueuse (74 %) et respiratoire (70 %) ;
– 80 % avaient été transférés en réanimation pédiatrique pour un traitement inotrope ou vasopresseur (48 %), une ventilation mécanique (20 %) ou une ECMO (4 %) ;
– 2 % sont décédés. La durée médiane d’hospitalisation était de quatre jours [EIQ : 4-10] pour les survivants et de cinq jours [2-5] pour les enfants décédés ;
– 90 % des enfants avaient eu une fièvre durant plus de quatre jours et 40 % durant plus de cinq jours, avec quatre des cinq critères cliniques du syndrome de Kawasaki (fièvre prolongée, adénopathies périphériques, conjonctivite, chéilite, exanthème suivi d’une desquamation périphérique), outre des marqueurs biologiques inflammatoires très élevés.
Tous les enfants ont reçu une perfusion intraveineuse d’immunoglobulines humaines (2 g/kg), complétée par une corticothérapie (50 %) et/ou une biothérapie (25 %), soit un inhibiteur de l’IL-6 ou du récepteur de l’IL-1. Une dilatation coronarienne tardive a été observée chez 8 % des enfants.
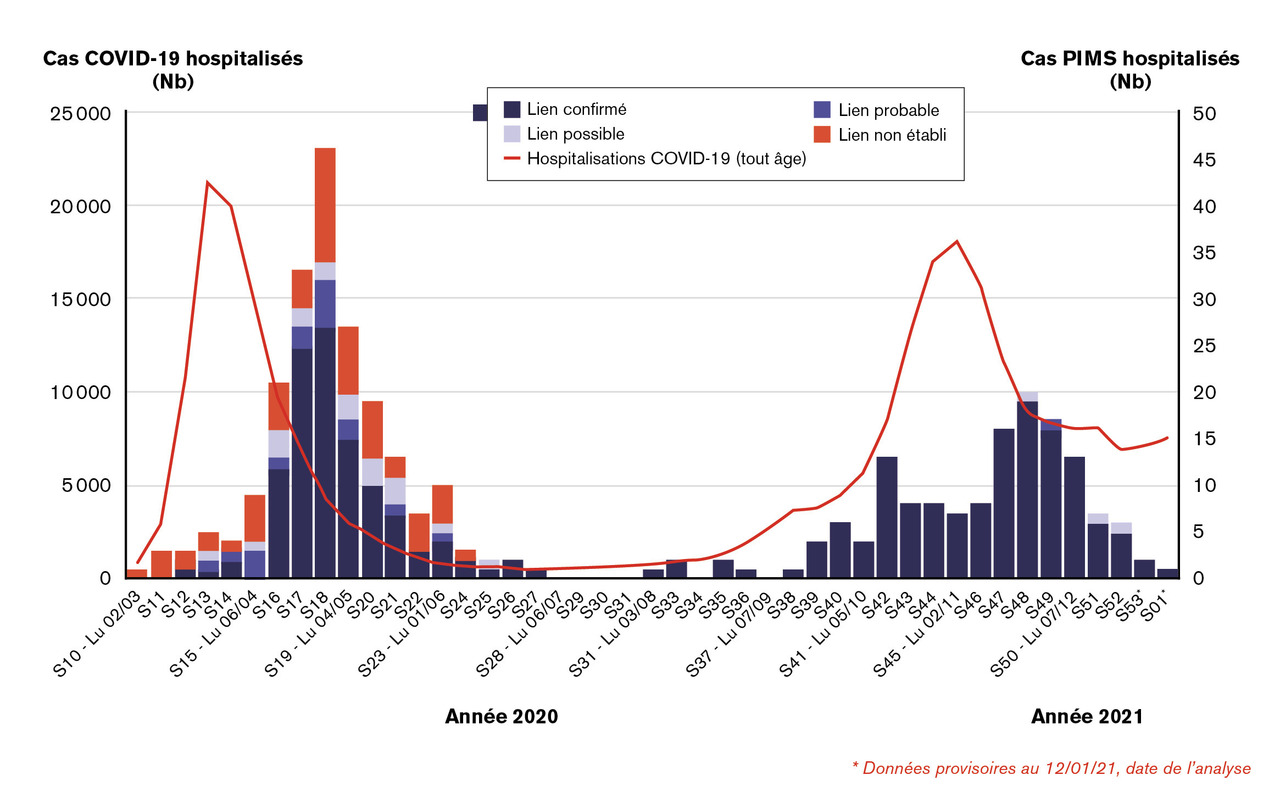
Le plus surprenant était le délai médian de quatre à six semaines entre les premiers symptômes de d’infection par le Covid-19 et cet état de défaillance multiviscérale hyperinflammatoire, confirmé par les données de l’Observatoire de Santé publique France (fig. 1 ).
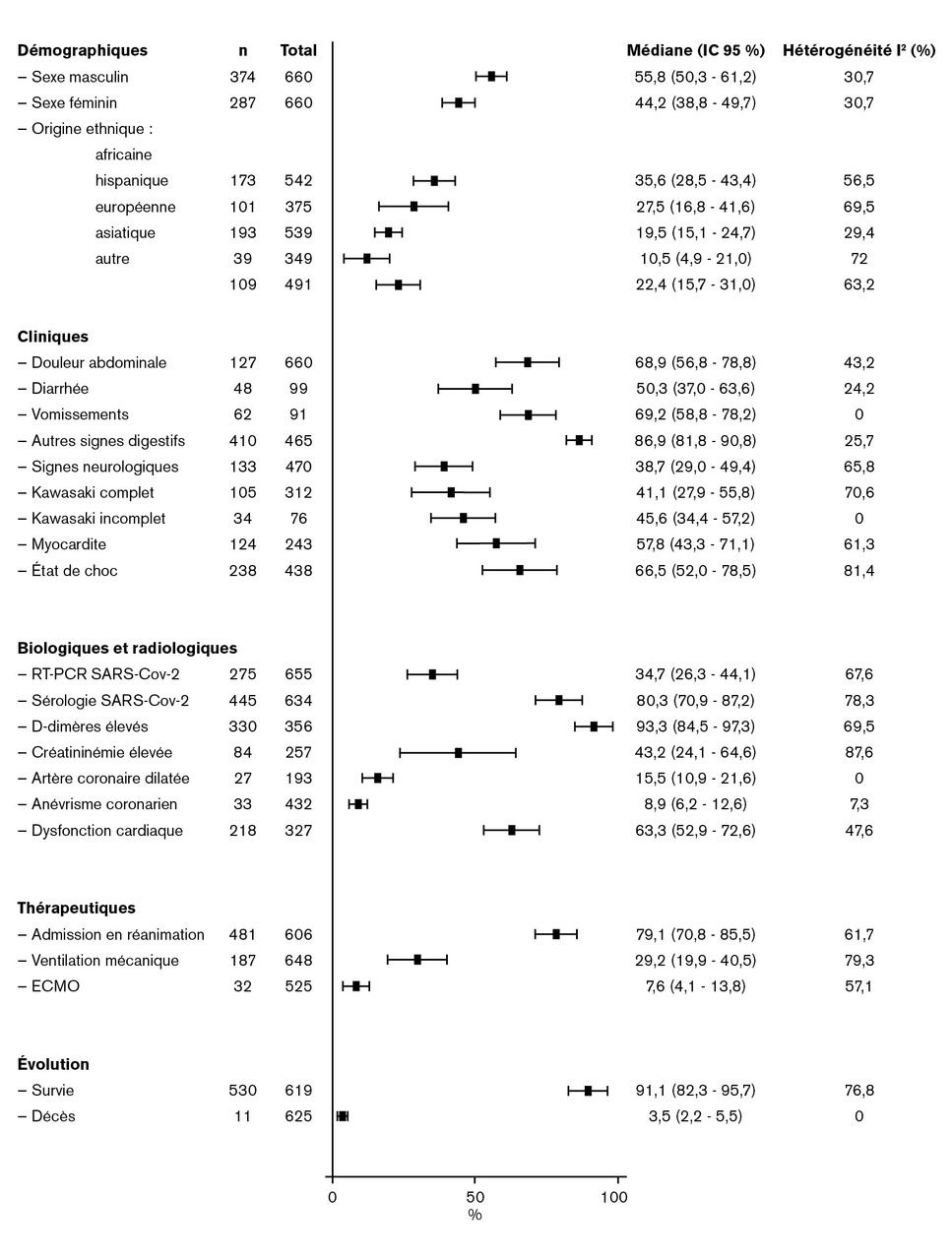
Une méta-analyse de 660 cas indique la fréquence médiane (intervalle de confiance à 95 % [IC à 95 %]) des caractéristiques cliniques, biologiques et thérapeutiques observées (fig. 2 ).10
Parmi ces enfants :
– le délai médian entre les premiers symptômes cliniques et la survenue du MIS-C était de 25 jours (extrêmes : 6-51) ;
– l’âge médian était de 8,3 ans [EIQ : 3,3-12,5] ;
– 115 (62 %) étaient de sexe masculin et 135 (73 %) antérieurement sains ;
– 70 % avaient une PCR positive pour SARS-CoV-2 et 30 % d’entre eux avaient eu un contact direct avec un patient infecté par le Covid-19 ;
– 92 % avaient des marqueurs inflammatoires (CRP, PCT, ferritine, D-dimères) très élevés et 73 % des biomarqueurs cardiaques (BNP, troponine) élevés ;
– 71 % avaient une défaillance viscérale impliquant les fonctions digestive (92 %), cardiovasculaire (80 %), hématologique (72 %), cutanéomuqueuse (74 %) et respiratoire (70 %) ;
– 80 % avaient été transférés en réanimation pédiatrique pour un traitement inotrope ou vasopresseur (48 %), une ventilation mécanique (20 %) ou une ECMO (4 %) ;
– 2 % sont décédés. La durée médiane d’hospitalisation était de quatre jours [EIQ : 4-10] pour les survivants et de cinq jours [2-5] pour les enfants décédés ;
– 90 % des enfants avaient eu une fièvre durant plus de quatre jours et 40 % durant plus de cinq jours, avec quatre des cinq critères cliniques du syndrome de Kawasaki (fièvre prolongée, adénopathies périphériques, conjonctivite, chéilite, exanthème suivi d’une desquamation périphérique), outre des marqueurs biologiques inflammatoires très élevés.
Tous les enfants ont reçu une perfusion intraveineuse d’immunoglobulines humaines (2 g/kg), complétée par une corticothérapie (50 %) et/ou une biothérapie (25 %), soit un inhibiteur de l’IL-6 ou du récepteur de l’IL-1. Une dilatation coronarienne tardive a été observée chez 8 % des enfants.
Le plus surprenant était le délai médian de quatre à six semaines entre les premiers symptômes de d’infection par le Covid-19 et cet état de défaillance multiviscérale hyperinflammatoire, confirmé par les données de l’Observatoire de Santé publique France (
Une méta-analyse de 660 cas indique la fréquence médiane (intervalle de confiance à 95 % [IC à 95 %]) des caractéristiques cliniques, biologiques et thérapeutiques observées (
MIS-C et syndrome de Kawasaki : une physiopathologie différente mais un traitement similaire
Ce nouveau syndrome, appelé MIS-C ou PIMS-TS, partage-t-il les mêmes mécanismes physiopathologiques que le syndrome de Kawasaki ?11 La cause du syndrome de Kawasaki reste à ce jour mystérieuse. Une prédisposition génétique pourrait être partiellement expliquée par des gènes de susceptibilité associés au système immunitaire. Cependant, les grandes variations d’incidence entre les pays, une certaine saisonnalité spécifique entre régions, et l’existence de clusters de cas ou de petites épidémies, suggèrent une origine infectieuse. Des études anatomopathologiques ont récemment mis en évidence des inclusions intracytoplasmiques au niveau de l’épithélium bronchique des enfants atteints, qui soutiendraient l’hypothèse d’un nouveau virus, identifié comme un Hepacivirus C NS4A.12
Un phénomène distinct du syndrome de Kawasaki
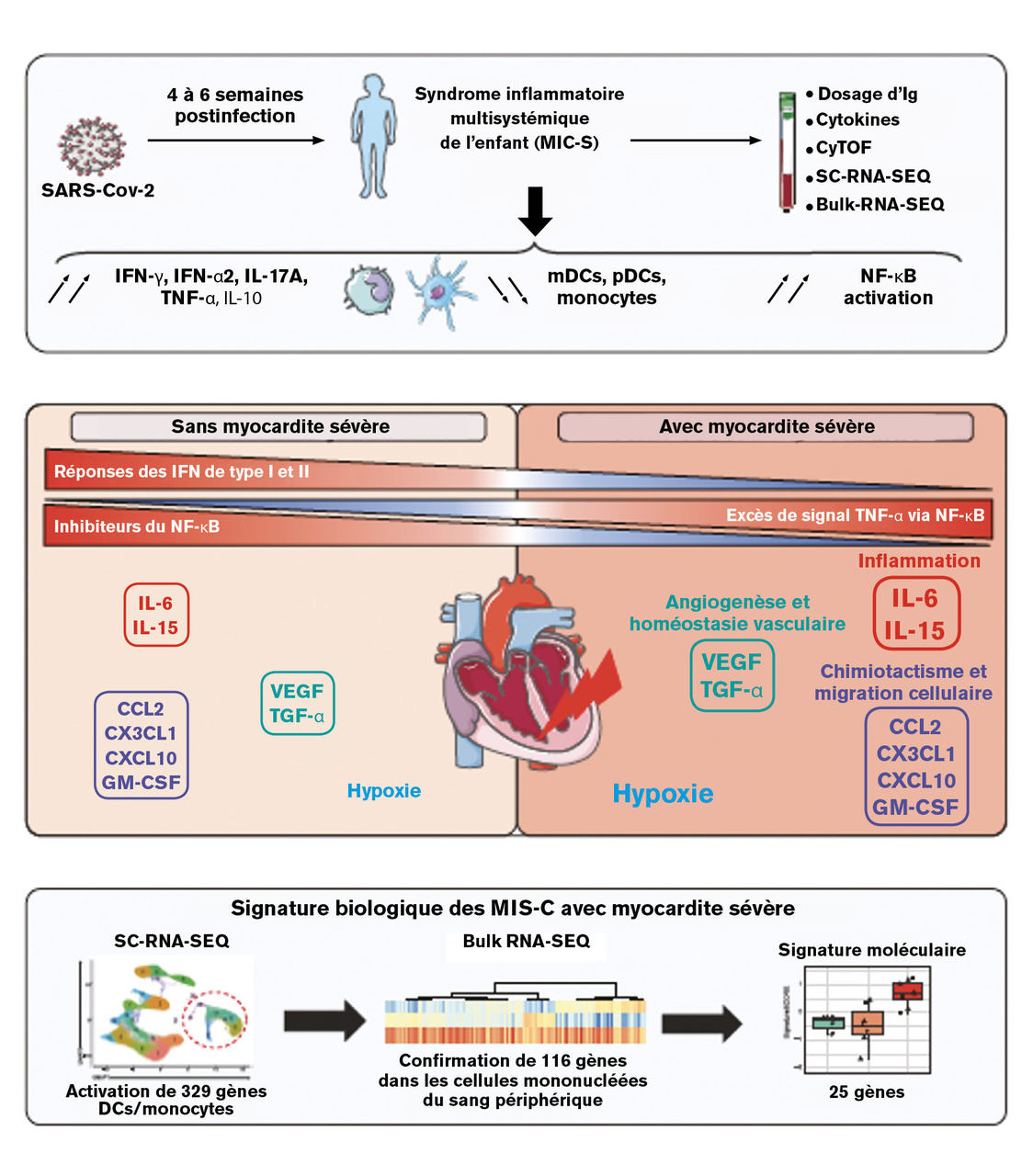
Globalement, le MIS-C se présente comme un phénomène auto-immun qui apparaît distinct du syndrome de Kawasaki.13 L’IL-17A est une cytokine impliquée dans l’inflammation du syndrome de Kawasaki, mais pas dans celle du MIS-C.14 En outre, l’analyse protéomique a mis en évidence des anticorps anti-endogline, possiblement pathogènes. Récemment, une signature moléculaire des formes les plus sévères de MIS-C a été identifiée. Notamment une myocardite sévère est caractérisée par un excès de signal TNF-α via NF-κB dans un environnement hypoxique et une hyperinflammation en l’absence de réponse antivirale par interférons de type I et II (fig. 3 ).15
Des études pour valider le traitement
Afin de valider le traitement physiopathologique du MIS-C, empiriquement calqué sur celui, validé, du syndrome de Kawasaki, une étude observationnelle a été menée chez 614 enfants de 32 pays entre juin 2020 et février 2021 : 246 d’entre eux ont reçu des immunoglobulines intraveineuses (IVIG) seules, 208 des IVIG et des glucocorticoïdes, 99 des glucorticoïdes seuls, 22 une autre combinaison incluant des biothérapies et 39 aucun traitement immunomodulateur.16 Un traitement inotrope, un support ventilatoire ou le décès ont concerné 56 patients traités par IVIG et glucocorticoïdes (risque relatif [RR] = 0,77 ; IC à 95 % : 0,33-1,82) vs 246 ayant reçu des IVIG seules et 17 patients traités seulement par glucocorticoïdes (RR = 0,54 ; IC à 95 % : 0,22-1,33). De même, il n’y avait aucune différence significative entre les groupes tant en termes de réduction de la sévérité du MIS-C que de rapidité de normalisation. Il a ainsi été conclu qu’aucun traitement immunomodulateur n’était supérieur à l’autre.
Ces résultats négatifs contrastent avec l’expérience française chez 181 enfants, au cours de laquelle 3 des 34 patients (9 %) traités par IVIG et méthylprednisolone et 37 des 72 patients (51 %) traités par IVIG seules n’avaient pas répondu au traitement.17 Selon cette étude, le traitement immunomodulateur associant IVIG et méthylprednisolone était donc associé à un pronostic plus favorable, et les raisons de cette différence ont été discutées.18
Cette conclusion a été corroborée par une troisième étude observationnelle, menée aux États-Unis chez 518 enfants et adolescents ; le traitement initial du MIS-C par IVIG et glucocorticoïdes était associé à un risque inférieur de dysfonction cardiaque et/ou d’état de choc à J2 par rapport aux IVIG seules (17 % vs 31 % ; RR = 0,56 ; IC à 95 % : 0,34-0,94).19
Ces résultats négatifs contrastent avec l’expérience française chez 181 enfants, au cours de laquelle 3 des 34 patients (9 %) traités par IVIG et méthylprednisolone et 37 des 72 patients (51 %) traités par IVIG seules n’avaient pas répondu au traitement.17 Selon cette étude, le traitement immunomodulateur associant IVIG et méthylprednisolone était donc associé à un pronostic plus favorable, et les raisons de cette différence ont été discutées.18
Cette conclusion a été corroborée par une troisième étude observationnelle, menée aux États-Unis chez 518 enfants et adolescents ; le traitement initial du MIS-C par IVIG et glucocorticoïdes était associé à un risque inférieur de dysfonction cardiaque et/ou d’état de choc à J2 par rapport aux IVIG seules (17 % vs 31 % ; RR = 0,56 ; IC à 95 % : 0,34-0,94).19
Une réaction inflammatoire auto-immune postinfectieuse
Bien que l’infection à SARS-Cov-2 atteigne moins souvent les enfants que les adultes et apparaisse nettement moins sévère, avec une faible mortalité, un nombre croissant de cas pédiatriques caractérisés par un état de choc cardiogénique et/ou vasoplégique, dans un contexte hyperinflammatoire, a été rapidement identifié dans les pays occidentaux.
Le remarquable délai de quatre à six semaines entre l’infection initiale à SARS-Cov-2 et les symptômes cliniques évoque une réaction inflammatoire auto-immune postinfectieuse mimant le syndrome de Kawasaki mais dont la physiopathologie est, semble-t-il, différente.
Malgré des progrès dans la reconnaissance d’une biosignature évocatrice d’une atteinte myocardique au cours de ce syndrome multisystémique inflammatoire chez l’enfant, les thérapeutiques immunomodulatrices sont fondées, comme pour le syndrome de Kawasaki, sur la perfusion d’immunoglobulines intraveineuses, associées ou non à une corticothérapie précoce, voire à une biothérapie spécifique. La grande majorité des MIS-C répond à ce traitement, qui raccourcit la durée de prise en charge de l’état de choc en réanimation et permet un pronostic excellent. Toutefois, un suivi prolongé est nécessaire afin de s’assurer de l’absence de séquelles, notamment de la normalisation des anomalies coronariennes.
Le remarquable délai de quatre à six semaines entre l’infection initiale à SARS-Cov-2 et les symptômes cliniques évoque une réaction inflammatoire auto-immune postinfectieuse mimant le syndrome de Kawasaki mais dont la physiopathologie est, semble-t-il, différente.
Malgré des progrès dans la reconnaissance d’une biosignature évocatrice d’une atteinte myocardique au cours de ce syndrome multisystémique inflammatoire chez l’enfant, les thérapeutiques immunomodulatrices sont fondées, comme pour le syndrome de Kawasaki, sur la perfusion d’immunoglobulines intraveineuses, associées ou non à une corticothérapie précoce, voire à une biothérapie spécifique. La grande majorité des MIS-C répond à ce traitement, qui raccourcit la durée de prise en charge de l’état de choc en réanimation et permet un pronostic excellent. Toutefois, un suivi prolongé est nécessaire afin de s’assurer de l’absence de séquelles, notamment de la normalisation des anomalies coronariennes.
Références
1. Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott AC. Pathophysiology, transmission, diagnosis, and treatment of coronary disease 2019 (Covid-19). A review. JAMA 2020;324(8):782-93.
2. Viner RM, Mytton OT, Bonell C, Melendez-Torres GJ, Ward J, Hudson L, et al. Susceptibility to SARS-Cov-2 infection among children and adolescents compared with adults: a systematic review and meta-analysis. JAMA Pediatr 2021;75(2):143-56.
3. Bailey LC, Razzaghi H, Burrows EK, Bunnell HT, Camacho PEF, Christakis DA, et al. Assessment of 135 794 pediatric patients tested for severe acute respiratory distress syndrome 2 across the United States. JAMA Pediatr 2021;75(2):176-84.
4. McCrindle BW, Rowley AH, Newburger JW, Burns JC, Bolger AF, Gewitz M, et al. Diagnosis, treatment, and long-term management of Kawasaki disease. A scientific statement for health professionals from the American Heart Association. Circulation 2017;135(17):e927-e99.
5. Riphagen S, Gomez X, Gonzalez-Martinez C, Wilkinson N, Theocharis P, et al. Hyperinflammatory shock in children during Covid-19 pandemic. Lancet 2020;395(10237):1607-8.
6. Whittaker E, Bamford A, Kenny J, Kaforou M, Jones CE, Shah P, et al; PIMS-TS Study Group and EUCLIDS and PERFORM Consortia. Clinical characteristics of 58 children with a Pediatric Inflammatory Multisystem Syndrome Temporally Associated with SARS-Cov-2. JAMA 2020;324(3):259-69.
7. Davies P, Evans C, Kanthaminathan HK, Lillie J, Brierley J, Waters G, et al. Intensive care admissions of children with paediatric inflammatory multisystem syndrome temporally associated with SARS-Cov-2 (PIMS-TS) in the UK: a multicentre observational study. Lancet Child Adolesc Health 2020;4(9):669-77.
8. Belhadjer Z, Méot M, Bajolle F, Khraiche D, Legendre A, Abakka S, et al. Acute heart failure in multisystem inflammatory syndrome in children in the context of global SARS-CoV-2 pandemic. Circulation 2020;142(5):429-36.
9. Feldstein LR, Rose EB, Horwitz SM, Collins JP, Newhams MM, Son MBF, et al; Overcoming Covid-19 Investigators; CDC Covid-19 Response Team. Multisystem inflammatory syndrome in US children and adolescents. N Engl J Med 2020;383(4):334-46.
10. Jiang L, Tang K, Levin M, Irfan O, Morris SK, Wilson K, et al. Covid-19 and multisystem inflammatory syndrome in children and adolescents. Lancet Infect Dis 2020;20(11):e276-88.
11. McCrindle BW, Manlhiot C. SARS-Cov-2-related inflammatory multisystem syndrome in children: different or shared etiology and pathophysiology as Kawasaki disease? JAMA 2020;324(3):246-8.
12. Rowley AH, Baker SC, Arollo D, Gruen LJ, Bodnar T, Innocentini N, et al. A protein epitope targeted by the antibody response to Kawasaki disease. J Infect Dis 2020;222(1):158-68.
13. Carter MJ, Fish M, Jennings A, Doores KJ, Wellman P, Seow J, et al. Peripheral immunophenotypes in children with multisystem inflammatory syndrome associated with SARS-Cov-2 infection. Nat Med 2020;26(11):1701-7.
14. Consiglio CR, Cotugno N, Sardh F, Pou C, Amodio D, Rodriguez L, et al; CACTUS Study Team. The immunology of multisystem inflammatory syndrome in children with Covid-19. Cell 2020;183(4):968-81.
15. De Cevins C, Luka M, Smith N, Meynier S, Magérus A, Carbone F, et al. A monocyte/dendritic cell molecular signature of SARS-CoV-2-related multisystem inflammatory syndrome in children with severe myocarditis. Med (N Y) 2021;2(9):1072-92.
16. McArdle AJ, Vito O, Patel H, Seaby EG, Shah P, Wilson C, et al; BATS Consortium. Treatment of multisystem inflammatory syndrome in children. N Engl J Med 2021;385(1):11-22.
17. Ouldali N, Toubiana J, Antona D, Javouhey E, Madhi F, Lorrot M, et al; French Covid-19 Paediatric Inflammation Consortium. Association of intravenous immunoglobulins plus methylprednisolone vs immunoglobulins alone with course of fever in multisystem inflammatory syndrome in children. JAMA 2021;325(9):855-64.
18. Ouldali N, Belot A, Angoulvant F. Therapy for multisystem inflammatory response in children. N Engl J Med 2021;385(13):e42.
19. Son MBF, Murray N, Friedman K, Young CC, Newhams MM, Feldstein LR, et al; Overcoming Covid-19 Investigators. Multisystem inflammatory syndrome in children – initial therapy and outcomes. N Engl J Med 2021;385(1):23-34.
2. Viner RM, Mytton OT, Bonell C, Melendez-Torres GJ, Ward J, Hudson L, et al. Susceptibility to SARS-Cov-2 infection among children and adolescents compared with adults: a systematic review and meta-analysis. JAMA Pediatr 2021;75(2):143-56.
3. Bailey LC, Razzaghi H, Burrows EK, Bunnell HT, Camacho PEF, Christakis DA, et al. Assessment of 135 794 pediatric patients tested for severe acute respiratory distress syndrome 2 across the United States. JAMA Pediatr 2021;75(2):176-84.
4. McCrindle BW, Rowley AH, Newburger JW, Burns JC, Bolger AF, Gewitz M, et al. Diagnosis, treatment, and long-term management of Kawasaki disease. A scientific statement for health professionals from the American Heart Association. Circulation 2017;135(17):e927-e99.
5. Riphagen S, Gomez X, Gonzalez-Martinez C, Wilkinson N, Theocharis P, et al. Hyperinflammatory shock in children during Covid-19 pandemic. Lancet 2020;395(10237):1607-8.
6. Whittaker E, Bamford A, Kenny J, Kaforou M, Jones CE, Shah P, et al; PIMS-TS Study Group and EUCLIDS and PERFORM Consortia. Clinical characteristics of 58 children with a Pediatric Inflammatory Multisystem Syndrome Temporally Associated with SARS-Cov-2. JAMA 2020;324(3):259-69.
7. Davies P, Evans C, Kanthaminathan HK, Lillie J, Brierley J, Waters G, et al. Intensive care admissions of children with paediatric inflammatory multisystem syndrome temporally associated with SARS-Cov-2 (PIMS-TS) in the UK: a multicentre observational study. Lancet Child Adolesc Health 2020;4(9):669-77.
8. Belhadjer Z, Méot M, Bajolle F, Khraiche D, Legendre A, Abakka S, et al. Acute heart failure in multisystem inflammatory syndrome in children in the context of global SARS-CoV-2 pandemic. Circulation 2020;142(5):429-36.
9. Feldstein LR, Rose EB, Horwitz SM, Collins JP, Newhams MM, Son MBF, et al; Overcoming Covid-19 Investigators; CDC Covid-19 Response Team. Multisystem inflammatory syndrome in US children and adolescents. N Engl J Med 2020;383(4):334-46.
10. Jiang L, Tang K, Levin M, Irfan O, Morris SK, Wilson K, et al. Covid-19 and multisystem inflammatory syndrome in children and adolescents. Lancet Infect Dis 2020;20(11):e276-88.
11. McCrindle BW, Manlhiot C. SARS-Cov-2-related inflammatory multisystem syndrome in children: different or shared etiology and pathophysiology as Kawasaki disease? JAMA 2020;324(3):246-8.
12. Rowley AH, Baker SC, Arollo D, Gruen LJ, Bodnar T, Innocentini N, et al. A protein epitope targeted by the antibody response to Kawasaki disease. J Infect Dis 2020;222(1):158-68.
13. Carter MJ, Fish M, Jennings A, Doores KJ, Wellman P, Seow J, et al. Peripheral immunophenotypes in children with multisystem inflammatory syndrome associated with SARS-Cov-2 infection. Nat Med 2020;26(11):1701-7.
14. Consiglio CR, Cotugno N, Sardh F, Pou C, Amodio D, Rodriguez L, et al; CACTUS Study Team. The immunology of multisystem inflammatory syndrome in children with Covid-19. Cell 2020;183(4):968-81.
15. De Cevins C, Luka M, Smith N, Meynier S, Magérus A, Carbone F, et al. A monocyte/dendritic cell molecular signature of SARS-CoV-2-related multisystem inflammatory syndrome in children with severe myocarditis. Med (N Y) 2021;2(9):1072-92.
16. McArdle AJ, Vito O, Patel H, Seaby EG, Shah P, Wilson C, et al; BATS Consortium. Treatment of multisystem inflammatory syndrome in children. N Engl J Med 2021;385(1):11-22.
17. Ouldali N, Toubiana J, Antona D, Javouhey E, Madhi F, Lorrot M, et al; French Covid-19 Paediatric Inflammation Consortium. Association of intravenous immunoglobulins plus methylprednisolone vs immunoglobulins alone with course of fever in multisystem inflammatory syndrome in children. JAMA 2021;325(9):855-64.
18. Ouldali N, Belot A, Angoulvant F. Therapy for multisystem inflammatory response in children. N Engl J Med 2021;385(13):e42.
19. Son MBF, Murray N, Friedman K, Young CC, Newhams MM, Feldstein LR, et al; Overcoming Covid-19 Investigators. Multisystem inflammatory syndrome in children – initial therapy and outcomes. N Engl J Med 2021;385(1):23-34.