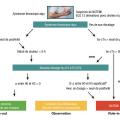
Diagnostiquer un syndrome coronarien aigu, une angine de poitrine et un infarctus du myocarde. Identifier les situations d’urgence et planifier leur prise en charge préhospitalière et hospitalière. Argumenter l’attitude thérapeutique et planifier le suivi du patient.
Décrire les principes de la prise en charge au long cours.
Angor stable
Rappel de physiologie coronaire
Le débit de perfusion myocardique (Qc) dépend de la demande métabolique, du contrôle neuro-humoral autonome et de l’endothélium. Plus de 50 % des résistances coronaires siègent dans le compartiment distal artériolaire (< 100 µm), ou microcirculation, principal déterminant de l’autorégulation coronaire, qui permet le maintien d’un Qc stable pour des variations de pression de perfusion entre 50 et 150 mmHg.
Une sténose d’une artère épicardique causée par l’athérosclérose induit un gradient de pression de perfusion. Les résistances diminuent, conséquence d’une vasodilatation adaptative de la microcirculation. Ce mécanisme assure la perfusion myocardique jusqu’à un point (réserve de vasodilatation coronaire) au-delà duquel il est dépassé, et toute augmentation des besoins myocardiques (à l’effort) mènera à l’ischémie et ses conséquences cliniques (angor).
Diagnostiquer un angor stable
- un siège : rétrosternale ou précordial gauche, parfois épigastrique ;
- une irradiation : aux mâchoires, épaules, avant-bras ou dans le dos ;
- un type : oppression « sensation d’étau », lourdeur, brûlure, plus rarement une blockpnée. La fatigue, la baisse des performances physiques et les signes digestifs sont des manifestations atypiques ;
- une durée : brève, dépendante de l’effort et cédant rapidement à l’arrêt de l’effort ou à la prise de trinitrine. Accentuée par le froid et la marche en plan incliné. Indépendante de la position et de la respiration. Rarement soulagée par la poursuite de l’effort (syndrome d’échauffement) ;
- une intensité variable définie par la classification de la Canadian Cardiovascular Society (
tableau 1 ).
- bilan biologique : hémoglobine, glycémie à jeun, recherche d’une anomalie lipidique, créatinine, BNP (brain natriuretic peptide) si suspicion d’insuffisance cardiaque ;
- électrocardiogramme (ECG) 12 dérivations de repos ;
- radiographie pulmonaire ;
- échocardiographie transthoracique (ETT) : fraction d’éjection ventriculaire gauche (FEVG).
Estimer la probabilité clinique d’une maladie coronaire avant le test diagnostique (probabilité pré-test [PPT])
Sélectionner le test diagnostique approprié
Les tests fonctionnels non invasifs sont l’échocardiographie de stress, d’effort ou à la dobutamine, (Se = 85 %, Sp = 82 %), la scintigraphie (SPECT) myocardique de stress ± sensibilisée par un agent vasodilatateur (Se = 87 %, Sp = 70 %) et l’IRM myocardique sous vasodilatateur ou dobutamine (Se = 90 %, Sp = 80 %). Quel que soit le test sélectionné, son interprétation dépend de l’expertise de l’opérateur. L’ECG d’effort n’est plus recommandé en première intention pour le diagnostic d’angor stable en raison de ses faibles performances diagnostiques (Se = 58 %, Sp = 52 %). Il reste néanmoins une alternative en cas de non-disponibilité des imageries de stress, utile dans l’évaluation de la performance physique, des symptômes, du rythme ou du profil tensionnel à l’effort. Réalisé démaquillé des traitements anti-ischémiques, l’effort est mené ≥ 85 % de la fréquence maximale théorique (FMT = 220 – âge). Un sous-décalage ST descendant ou horizontal ≥ 1 mm à 0,06-0,08 s du point J dans au moins une dérivation suggère une ischémie. La présence d’un bloc de branche, d’un stimulateur cardiaque, d’un syndrome de préexcitation, d’une élévation ST ≥ 1 mm au repos et d’un traitement par digitaliques gêne son interprétation.
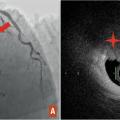
La coronarographie d'emblée lorsque les tests non invasifs sont non contributifs, chez les patients à très haut risque d’événements ou restant symptomatiques malgré un traitement médical optimal. Elle ne doit pas être proposée aux patients refusant toute stratégie invasive et pour lesquels la revascularisation n’apporterait aucun bénéfice sur la qualité et/ou l’espérance de vie. Les sténoses intermédiaires (50-90 % de diamètre) ou les atteintes pluritronculaires justifient une évaluation fonctionnelle invasive par FFR (fractional flow reserve) avant revascularisation.
La FFR est obtenue à l’aide d’un guide de pression positionné en aval de la sténose. En théorie, il s’agit du ratio entre le débit myocardique maximal du vaisseau avec sténose et le débit myocardique maximal du vaisseau sain. La FFR est mesurée en hyperhémie grâce à une vasodilatation maximale obtenue par injection d’adénosine. Les résistances coronaires étant abolies, la FFR devient le ratio de la pression distale au guide (Pd) sur la pression aortique (Pa). La FFR donne une information sur le frein hémodynamique engendré par la sténose et prédit le bénéfice sur le débit coronaire après revascularisation. Une FFR < 0,80 est le seuil à partir duquel il existe un bénéfice clinique en cas de revascularisation. L’intégration systématique de la FFR lors de la coronarographie permet de réorienter les stratégies thérapeutiques dans près de la moitié des cas.
Stratifier le risque d’événements
Prendre en charge l’angor stable
Intervention sur le mode de vie
Il s’agit de :- la prise en charge des facteurs de risque cardiovasculaire ;
- l’hygiène alimentaire (régime riche en fruits, légumes et céréales complètes, acides gras saturés < 10 % des apports, alcool < 100 g/sem ou 15 g/j) ;
- l’activité physique régulière (30-60 min d’activités physique modérée 5 j/sem) ;
- l’obtention d’un poids idéal pour un indice de masse corporelle < 25 kg/m2 ;
- le contrôle des facteurs psychosociaux et environnementaux ;
- la vaccination antigrippale annuelle ;
- la réadaptation cardiovasculaire.
Traitement pharmacologique
Le traitement optimal est celui qui soulage les symptômes tout en prévenant les complications de l’athérosclérose avec une adhésion maximale et le minimum d’effets indésirables.Traitement antiangineux :
- lors de la crise aiguë : arrêt de l’effort en cours et dérivés nitrés à action rapide par voie sublinguale. La persistance de la douleur justifie l’appel du 15 ;
- traitement de fond : bêtabloquants en première intention (les plus utilisés sont les bloqueurs sélectifs du récepteur ß1 : nébivolol, bisoprolol, métoprolol et aténolol). Les inhibiteurs calciques (bradycardisants [vérapamil ou diltiazem] ou dihydropyridines) et l’ivabradine sont indiqués en cas d’intolérance aux bêtabloquants ou en association. Les autres (nicorandil, molsidomine et trimétazidine) sont des traitements adjuvants.
- antiagrégants plaquettaires (aspirine ou clopidogrel, en association en post-angioplastie) ;
- hypolipémiants (statines ou ézétimibe ou anti-PCSK9) avec un objectif de LDLc ≤ 0,55 g/dL ou une diminution ≥ 50 % du taux initial ;
- inhibiteurs de l’enzyme de conversion (IEC) ou antagonistes des récepteurs de l’angiotensine II (ARA II), en cas d’hypertension artérielle (HTA), fraction d’éjection ventriculaire gauche (FEVG) ≤ 40 %, diabète ou insuffisance rénale.
Revascularisation myocardique
Les indications sont pronostiques (sténose du tronc commun > 50 %, sténose de l’interventriculaire antérieure (IVA) proximale > 50 %, atteinte bi- ou tritronculaire avec sténose > 50 % et FEVG ≤ 35 %, ischémie à l’imagerie de stress > 10 % du myocarde, sténose isolée > 90 % ou mesure de la réserve coronaire (FFR) < 0,80) ou symptomatiques (sténose avec FFR < 0,80 ou > 90 % du diamètre avec persistance des symptômes sous traitement optimal). La revascularisation est chirurgicale (par pontage aortocoronaire) ou percutanée (par angioplastie). Les modalités sont discutées lors d’une réunion multidisciplinaire (heart team).Une étude clinique récente (ISCHEMIA) n’a pas retrouvé de bénéfice sur la survenue d’événements cardiovasculaires à 3 ans d’une revascularisation précoce comparée au traitement médical seul dans l’angor stable avec ischémie modérée à sévère. Néanmoins, il semblerait exister un bénéfice fonctionnel en cas de revascularisation.
Infarctus du myocarde (IDM)
- des symptômes d’ischémie myocardique aiguë ;
- ou des modifications récentes à l’ECG en faveur d’une ischémie ;
- ou l’apparition d’une onde Q de nécrose ;
- ou un trouble de la cinétique segmentaire ventriculaire, d’origine ischémique, à l’imagerie ;
- ou la présence d’un thrombus intracoronaire à la coronarographie ou lors de l’autopsie (IDM de type 1).
L’IDM de type 2 correspond à un déséquilibre entre les besoins et les apports myocardiques en oxygène, en dehors de toute complication aiguë de l’athérosclérose. L’IDM de type 2 est fréquemment rencontré en pratique clinique. Les mécanismes physiopathologiques sont variés : hypotension/état de choc, anémie sévère, hypoxémie, hypertension artérielle sévère ± hypertrophie ventriculaire gauche, tachyarythmie soutenue, valvulopathie sévère… La co-existence d'une athérosclérose coronaire est fréquente, aggravant alors l’ischémie myocardique.
Les IDM de type 3 sont les morts subites dont la cause coronarienne est suspectée devant des symptômes et/ou des anomalies de l’ECG.
La distinction entre STEMI (sus-décalage ST) et NSTEMI (pas de sus-décalage ST) lors d’un IDM aigu dépend de l’analyse de l’ECG, élément clé dans la décision du traitement adapté.
Il est important de préciser qu’en dehors de l’ischémie myocardique, les causes d’élévation des troponines cardiaques sont nombreuses, on parle alors de souffrance myocardique.
Syndrome coronarien aigu avec sus-décalage du segment ST (ou STEMI, pour ST-elevation myocardial infarction)
Diagnostic
La trinitrine n’a aucune valeur diagnostique dans le syndrome coronarien aigu avec sus-décalage du segment ST, et son utilisation, possiblement délétère, doit être abandonnée dans ce contexte.
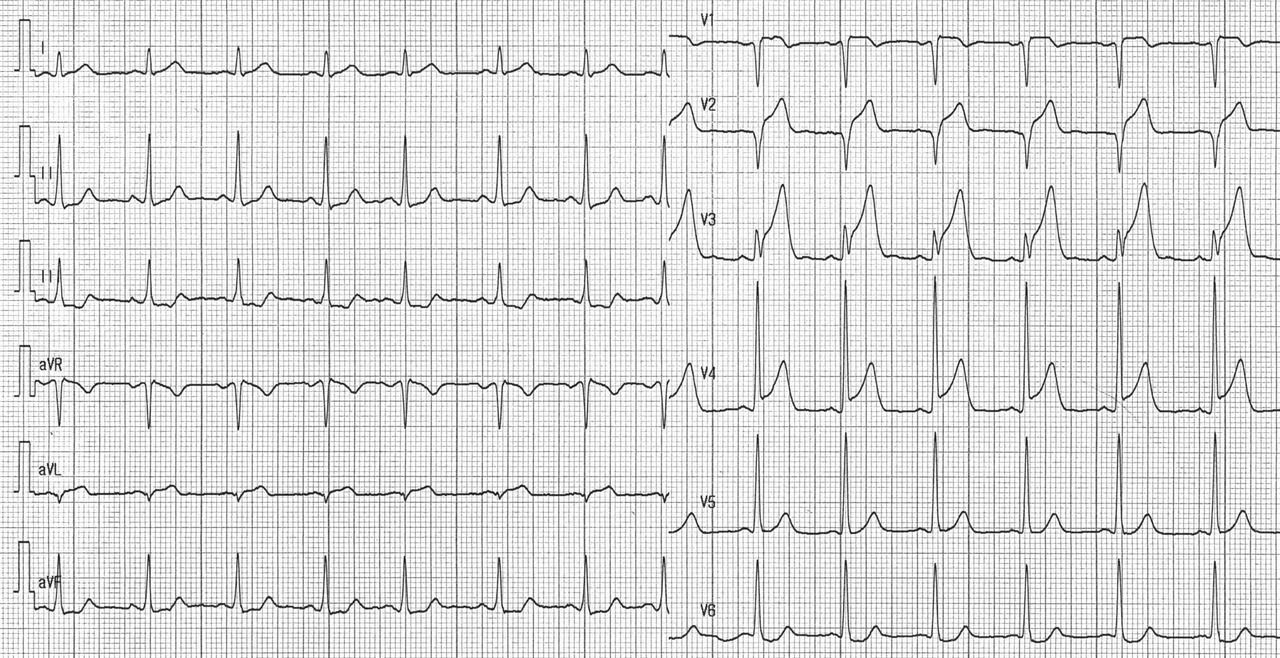
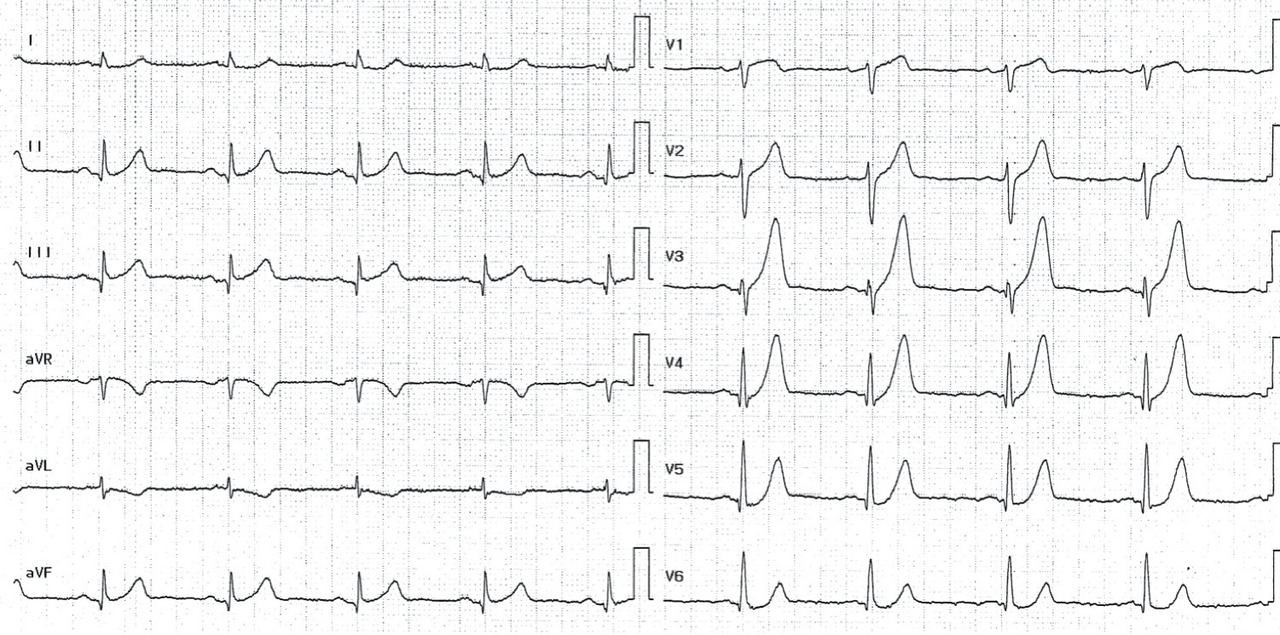
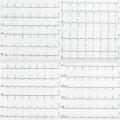
L’ECG 12 dérivations (souvent complété des dérivations droites et postérieures) est réalisé dès le premier contact médical. La présence d’un sus-décalage du segment ST avec miroir électrique suggère l’occlusion aiguë d’une coronaire : dans ≥ 2 dérivations adjacentes, élévation du segment ST ≥ 2 mm au niveau du point J chez l’homme > 40 ans (≥ 2,5 mm chez l’homme < 40 ans) ou ≥ 1,5 mm chez la femme dans les dérivations précordiales et ≥ 1 mm dans les dérivations frontales (
Le dosage des troponines cardiaques n’a pas sa place dans le diagnostic de syndrome coronarien aigu avec sus-décalage du segment ST (STEMI). Il est réalisé a posteriori lors de la surveillance après reperfusion.
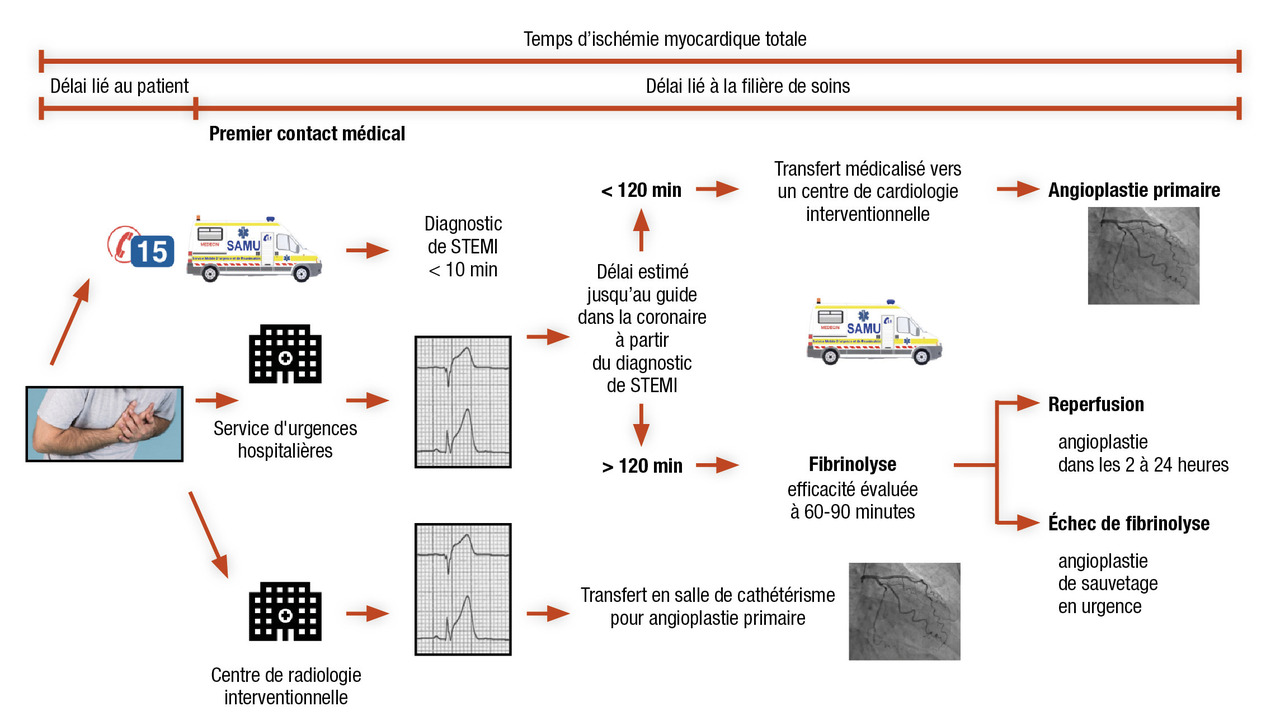
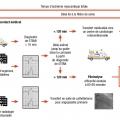
Traitements de reperfusion : angioplastie primaire ou thrombolyse ? (fig. 8)
La décision dépend du délai estimé entre le diagnostic de STEMI et le passage du guide d’angioplastie dans la coronaire occluse :
- > 120 min : la fibrinolyse est administrée en bolus dans les 10 min suivant le diagnostic. Son efficacité est évaluée à 60-90 min du bolus. La disparition de la douleur, la régression > 50 % du sus-ST et les arythmies ventriculaires de reperfusion (rythme idioventriculaire accéléré [RIVA]) sont les critères de succès. La fibrinolyse est d’autant plus efficace que son administration est précoce par rapport au début des symptômes (< 3 h). Les contre-indications doivent être prises en compte. En cas d’échec, une angioplastie en urgence est réalisée. Sinon, celle-ci est proposée dans les 2 à 24 h suivant le diagnostic ;
- < 120 min : une angioplastie primaire est indiquée, avec un transport médicalisé vers le centre de cardiologie interventionnelle le plus proche. La voie radiale (vs fémorale) et la pose de stents actifs (vs non actifs) sont recommandées.
Traitement adjuvant
Le traitement antithrombotique associe :
- une double antiagrégation plaquettaire (DAPT) :
. ticagrélor en dose de charge orale de 180 mg ou prasugrel en dose de charge orale de 90 mg. Le clopidogrel est proposé en deuxième intention ou en cas de fibrinolyse. Le ticagrélor et le prasugrel sont contre-indiqués en cas de fibrinolyse devant un sur-risque hémorragique,
. anti-Gp IIb-IIIa IV réservés à la salle de cathétérisme ;
- une anticoagulation :
. héparine non fractionnée (70-100 UI/kg IV),
. bivalirudine IV (sauf si fibrinolyse).
Le traitement symptomatique associe :
- de l’oxygène en cas de désaturation < 90 %. L’hyperoxie semble délétère sur le myocarde en cas d’ischémie ;
- des antalgiques. La titration de morphine, largement utilisée, retarde et diminue l’efficacité des antiagrégants plaquettaires administrés par voie orale ;
- des anxiolytiques.
Traitement au long cours et suivi
La mobilisation est précoce pour la majorité des patients. La durée d’hospitalisation est déterminée individuellement en fonction du risque cardiaque, des comorbidités, de l’autonomie et du soutien social du patient.
Le traitement pharmacologique associe :
- une double antiagrégation plaquettaire pendant 12 mois (pour tout type de stent) : aspirine 75 à 100 mg et ticagrélor 90 mg matin et soir ou prasugrel 10 mg ou clopidogrel 75 mg. Au- delà, l’aspirine est poursuivie à vie. En cas d’anticoagulation curative au long cours, le clopidogrel est privilégié (l’aspirine est alors maintenue 1 à 6 mois en fonction du risque hémorragique du patient) ;
- un bêtabloquant est recommandé pour tout patient en l’absence de contre-indication, surtout si insuffisance cardiaque et/ou FEVG ≤ 40 % ;
- des statines à fortes doses (atorvastatine 80 mg ou rosuvastatine 20 mg) avec un objectif de LDLc ≤ 0,55 g/dL ou une diminution ≥ 50 % du taux initial ;
- les IEC et ARA II sont indiqués en cas d’insuffisance cardiaque, de diabète, d’insuffisance rénale ou d’infarctus du myocarde antérieur ;
- les inhibiteurs de la pompe à protons sont réservés aux patients à risque de saignements gastro-intestinaux pendant la durée de la double antiagrégation plaquettaire ;
- la trinitrine en spray sublingual en cas d’angine de poitrine réfractaire.
Deux consultations sont planifiées dans la première année, avec un bilan biologique (fonction rénale, bilan lipidique, numération formule sanguine plaquettes [NFS]), un électrocardiogramme, une échocardiographie, un test d’ischémie non invasif et un bilan vasculaire.
Complications du syndrome coronarien aigu avec sus-décalage du ST (STEMI)
- l’insuffisance cardiaque : de la congestion pulmonaire (Killip-Kimball II-III) au choc cardiogénique (Killip-Kimball IV) [
tableau 2 ] ;
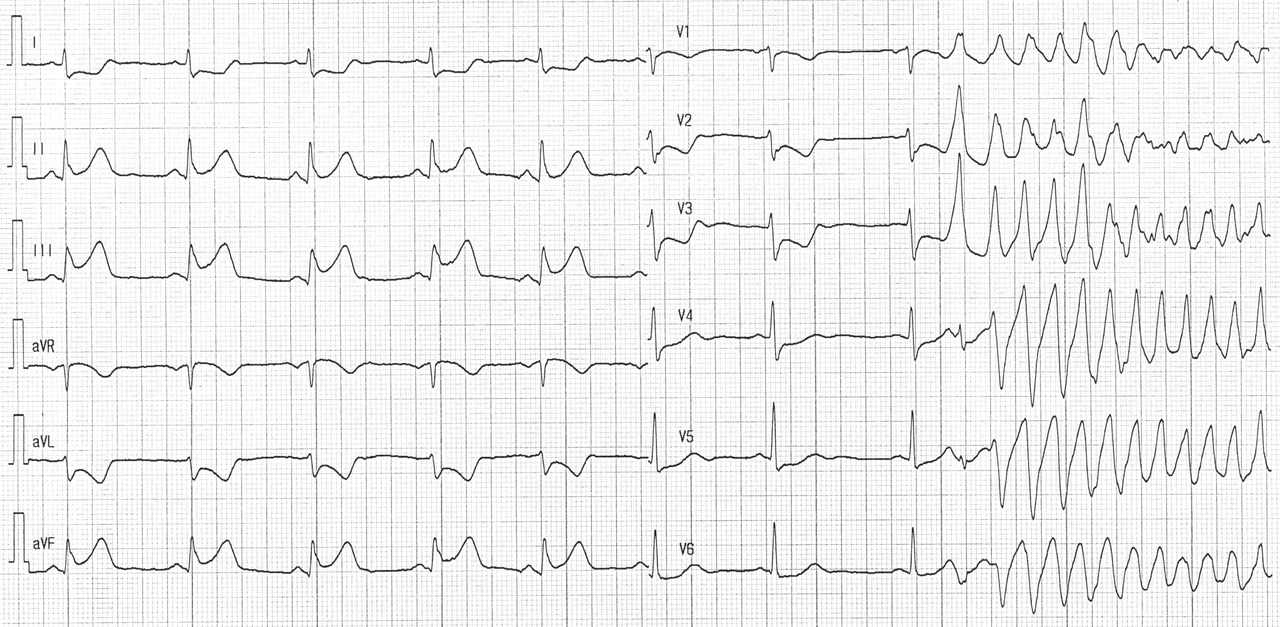
- la tachycardie et la fibrillation ventriculaire (
fig. 9 )
- la fibrillation auriculaire ;
- le bloc auriculo-ventriculaire et dysfonction sinusale (
fig. 10 ) ;
- les complications mécaniques : rupture du pilier mitral (surtout postéro-médian), rupture septale, rupture de la paroi libre.
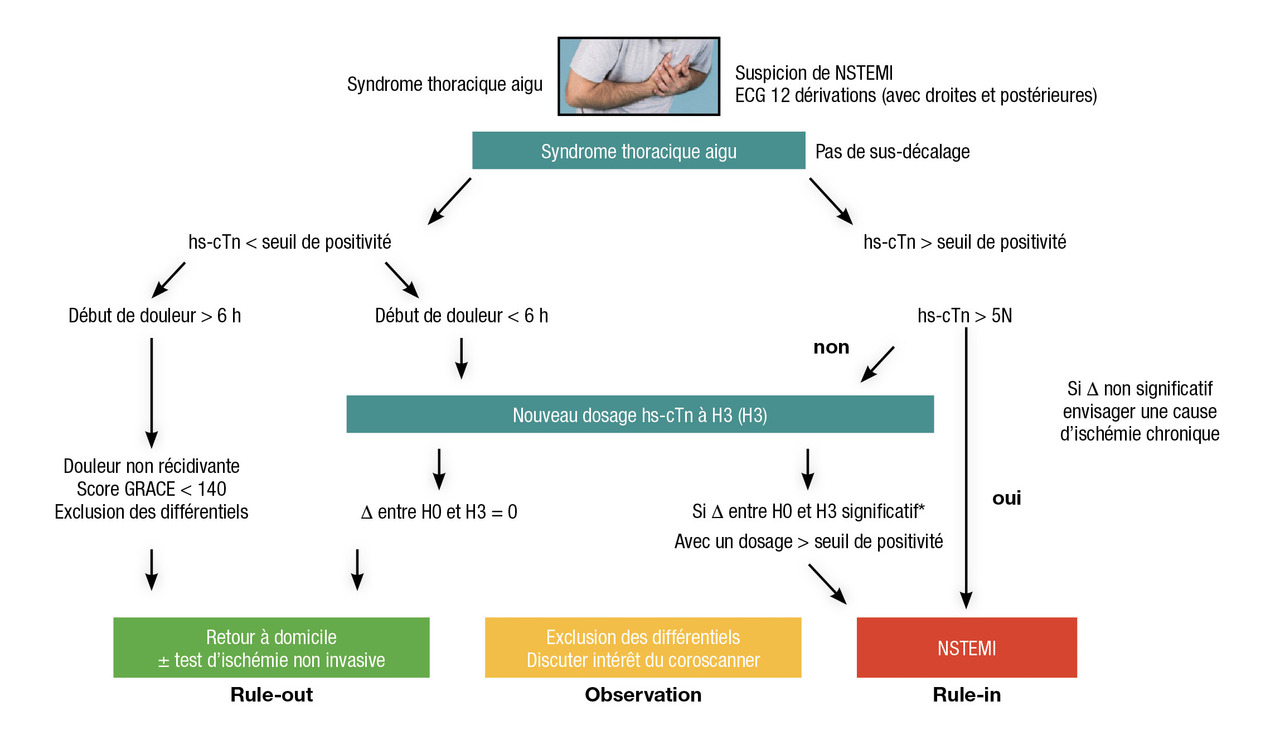
Syndrome coronarien aigu sans sus-décalage du segment ST (ou NSTEMI pour non ST-elevation myocardial infarction)
Diagnostic
L’ECG 12 dérivations (complété par les postérieures et droites) est réalisé lors du premier contact médical en per- ou post-critique (
Traitement pharmacologique
Le traitement antithrombotique comprend l’aspirine administré dès le diagnostic de syndrome coronarien aigu sans sus-décalage du segment ST (NSTEMI). Le prétraitement par un anti- P2Y12 (ticagrélor, prasugrel, clopidogrel) est remis en question. La dose de charge sera administrée en salle de cathétérisme si une angioplastie est indiquée. L’anticoagulation repose sur le fondaparinux (2,5 mg SC). Un bolus complémentaire d’héparine non fractionnée (HNF) est administré lors de l’angioplastie.
Quand réaliser la coronarographie ?
- en urgence (moins de 2 h) en cas d’instabilité hémodynamique ou de choc cardiogénique, de douleur thoracique persistante ou récidivante malgré le traitement anti-ischémique, d’arrêt cardiaque ou d’arythmie ventriculaire menaçante, de complications mécaniques post-infarctus du myocarde, d’insuffisance cardiaque ;
- avant 24 h en cas d’élévation significative des troponines, d’anomalies dynamiques de la repolarisation, de score GRACE (Global Registry of Acute Coronary Events) > 140 (
tableau 3 ) ;
- avant 72 h en cas de diabète, d’insuffisance rénale, de FEVG < 40 %, d’angor précoce post-infarctus du myocarde, d’antécédent d’angioplastie ou de pontage, de score GRACE > 109
La revascularisation par angioplastie est proposée en première intention lorsqu’une lésion dite « coupable » est clairement identifiée. Une double antiagrégation plaquettaire est introduite pour une durée de 12 mois (réduite en cas de risque hémorragique élevé). La FFR ne permet pas d’identifier la lésion coupable dans le syndrome coronarien aigu sans sus-décalage du segment ST (NSTEMI). Le pontage aortocoronaire est proposé lors de la même hospitalisation pour les atteintes du tronc commun ou pluritronculaire. Dans 10 % des cas, aucune sténose ≥ 50 % n’est identifiée, le traitement est alors médical.
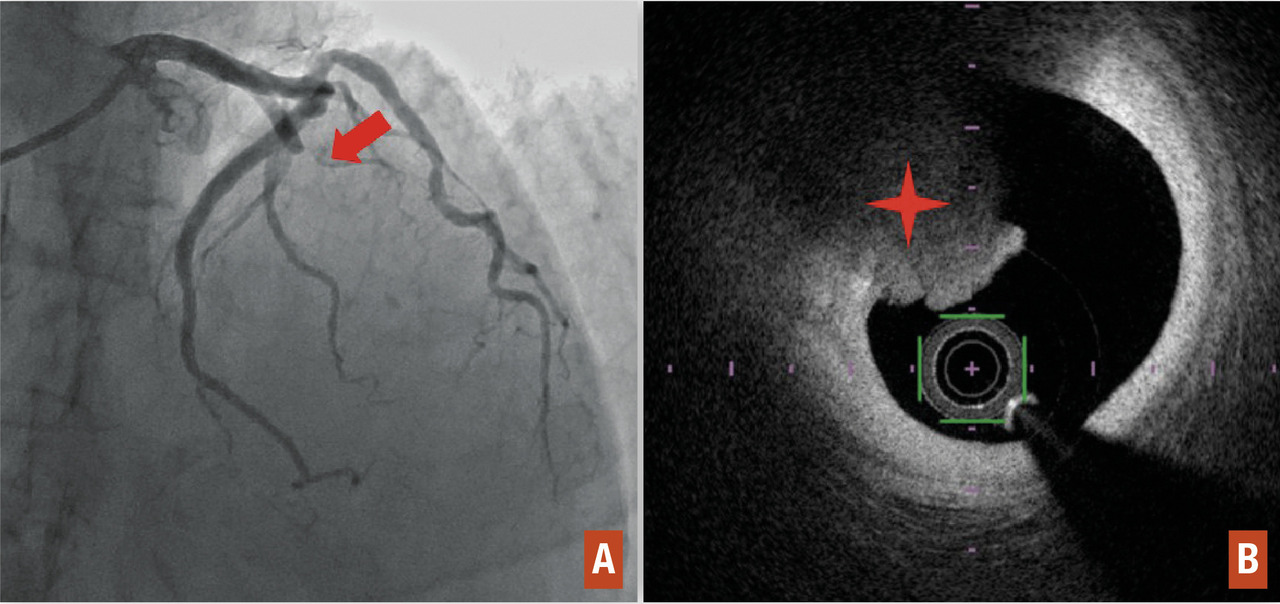
En l’absence de sténose coronaire à la coronarographie, la myocardite, le Tako-Tsubo, un spasme épicardique ou micro- vasculaire, une dissection coronaire spontanée ou un embole coronaire sont des diagnostics à évoquer. Le recours à l’IRM cardiaque, aux tests de provocation (Methergin) ou à l’imagerie endocoronaire est à discuter.
POINTS FORTS À RETENIR
La caractérisation de l’angor, le recueil des antécédents et des facteurs de risque cardiovasculaire sont déterminants dans le diagnostic de l’angor stable.
La probabilité prétest conditionne le choix du test diagnostique.
Le traitement pharmacologique et le contrôle des facteurs de risque cardiovasculaire sont la base de la prise en charge de l’angor stable.
L’indication d’une revascularisation est symptomatique ou pronostique et est discutée lors d’une réunion heart team. L’information et le consentement du patient sont des obligations légales.
Le STEMI est l’expression d’une occlusion aiguë d’une coronaire dont le mécanisme principal est la thrombose. Il s’agit d’une urgence absolue.
Le diagnostic repose sur les caractéristiques des symptômes et l’analyse de l’ECG.
Deux délais sont importants dans le STEMI :
- le délai entre le début des symptômes et le diagnostic de STEMI < 12 h et traitement de reperfusion (angioplastie primaire OU fibrinolyse) ;
- le délai estimé entre le diagnostic de STEMI et le passage du guide d’angioplastie dans la coronaire occluse si > 120 min fibrinolyse, si < 120 min angioplastie primaire.
Le NSTEMI est un cadre nosologique plus hétérogène. Peut être une complication aiguë de l’athérosclérose (IDM de type 1) ou l’expression d’un déséquilibre entre les besoins et les apports en oxygène au myocarde (IDM de type 2).
La troponine ultrasensible joue un rôle central dans la démarche diagnostique.
La coronarographie est proposée dans des délais qui dépendent du niveau de risque du patient. Pour les patients à faible risque, une évaluation fonctionnelle non invasive est raisonnable.
Syndromes coronariens aigus
Le STEMI doit être parfaitement connu car sa prise en charge est une urgence absolue.
Le NSTEMI est une présentation plus hétérogène devant laquelle il est nécessaire de prendre du recul sauf en cas de signes cliniques de gravité.
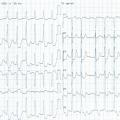
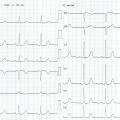
Exemple de Cas clinique
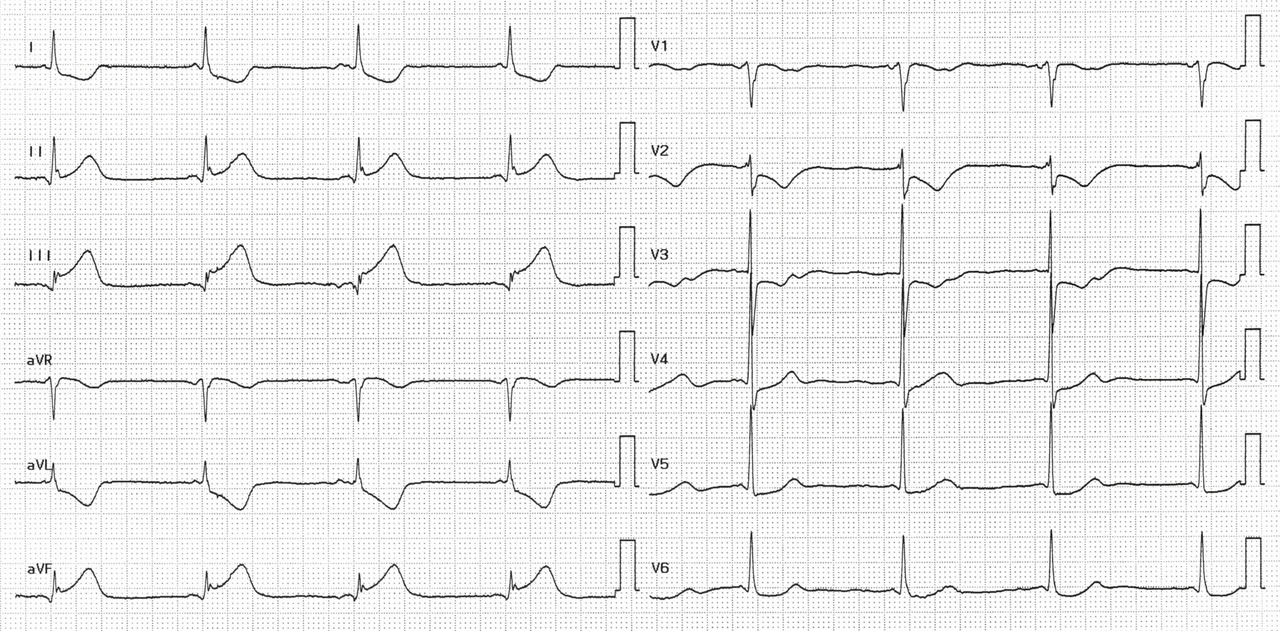
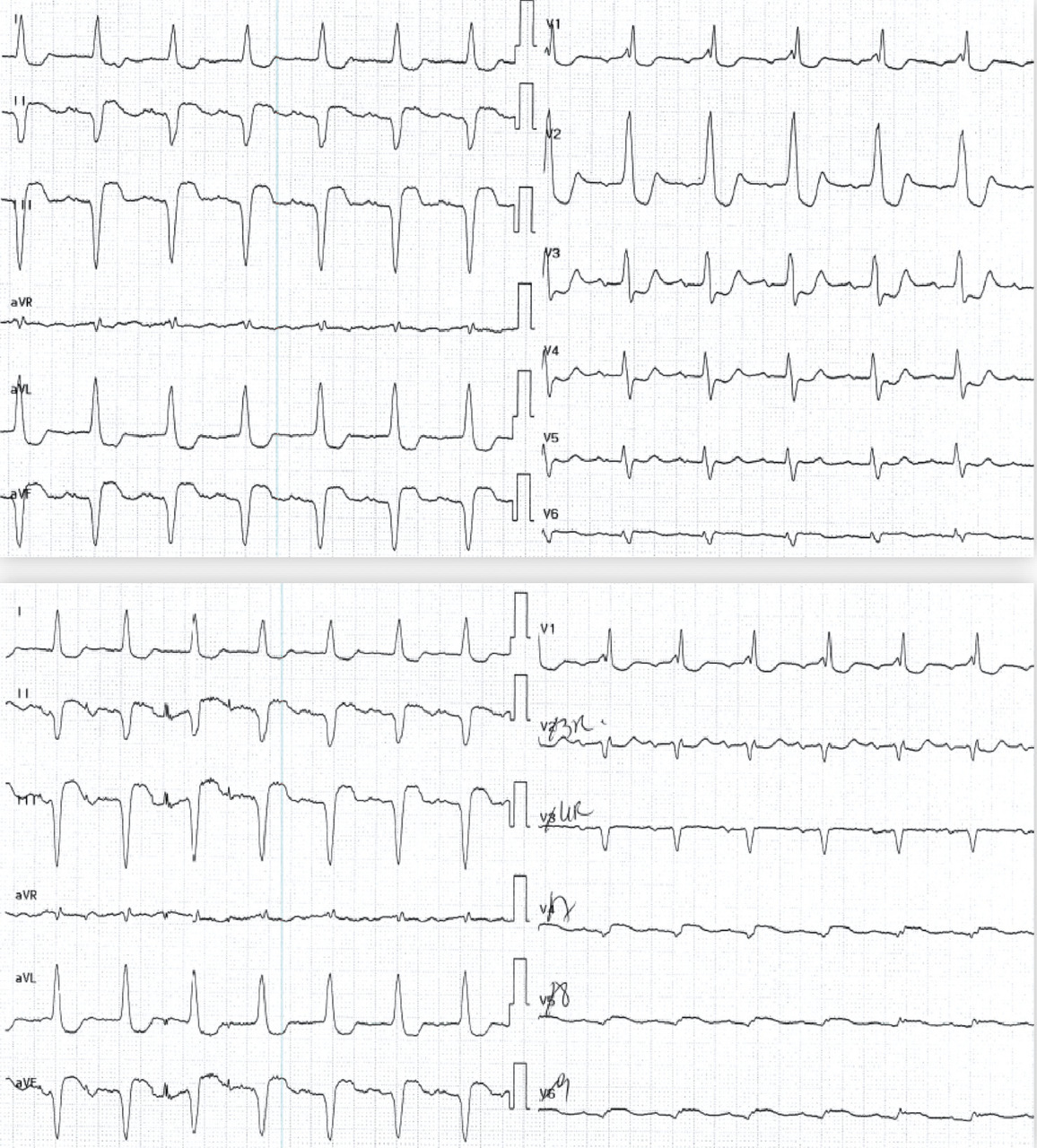
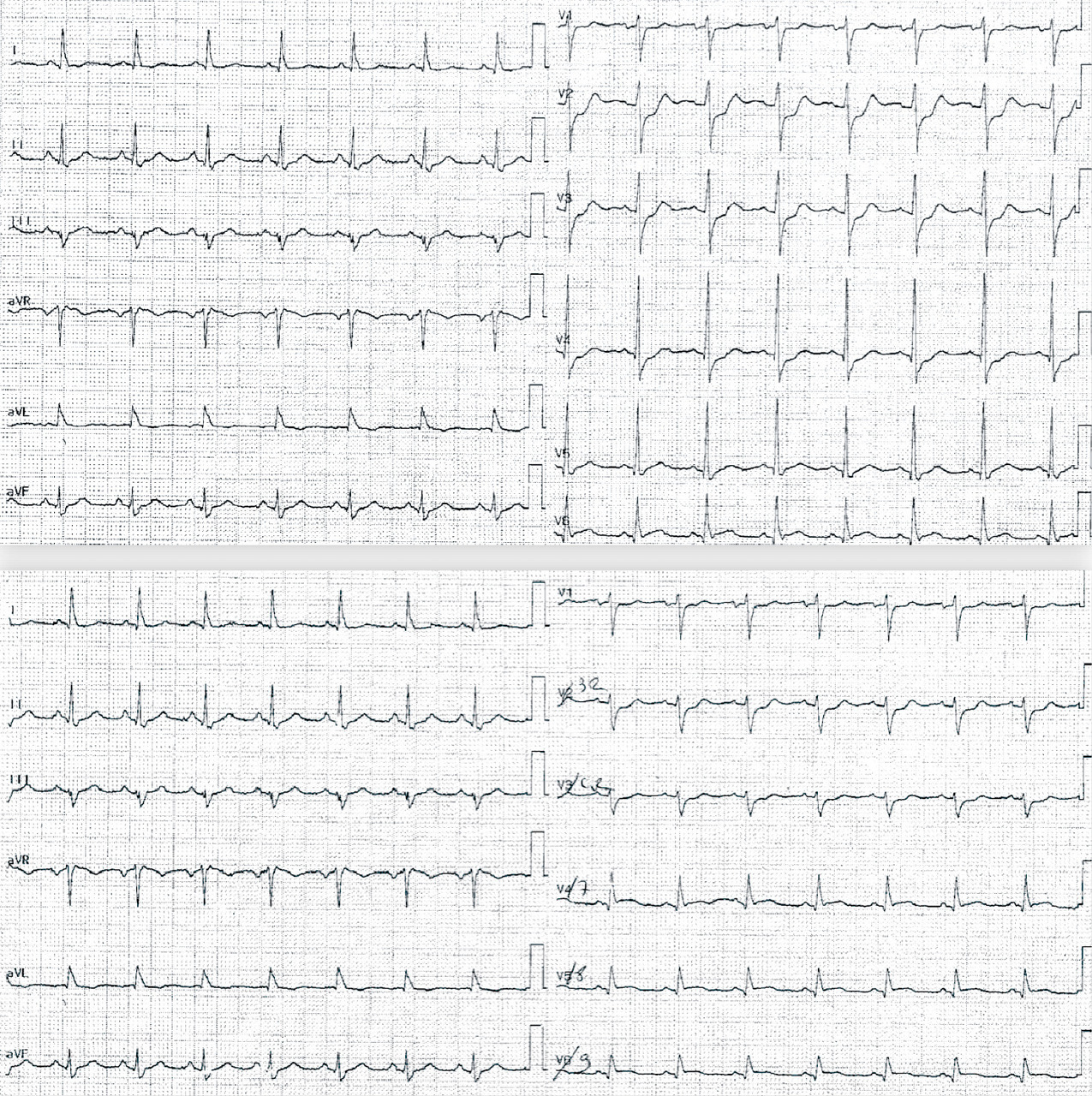
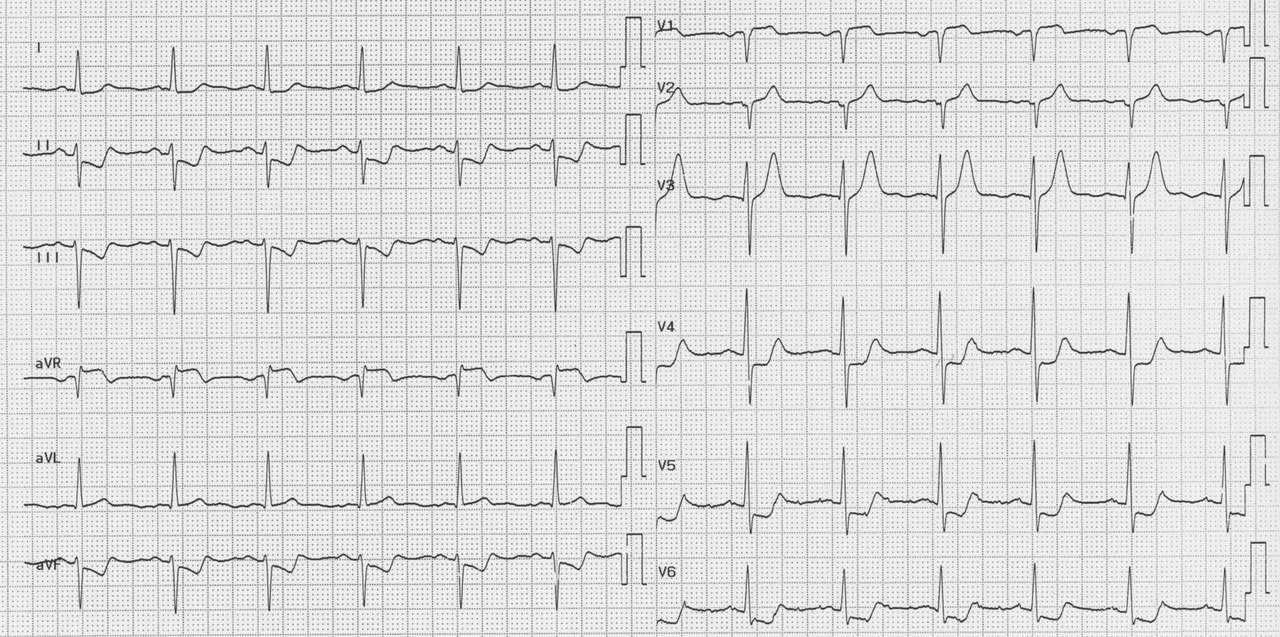
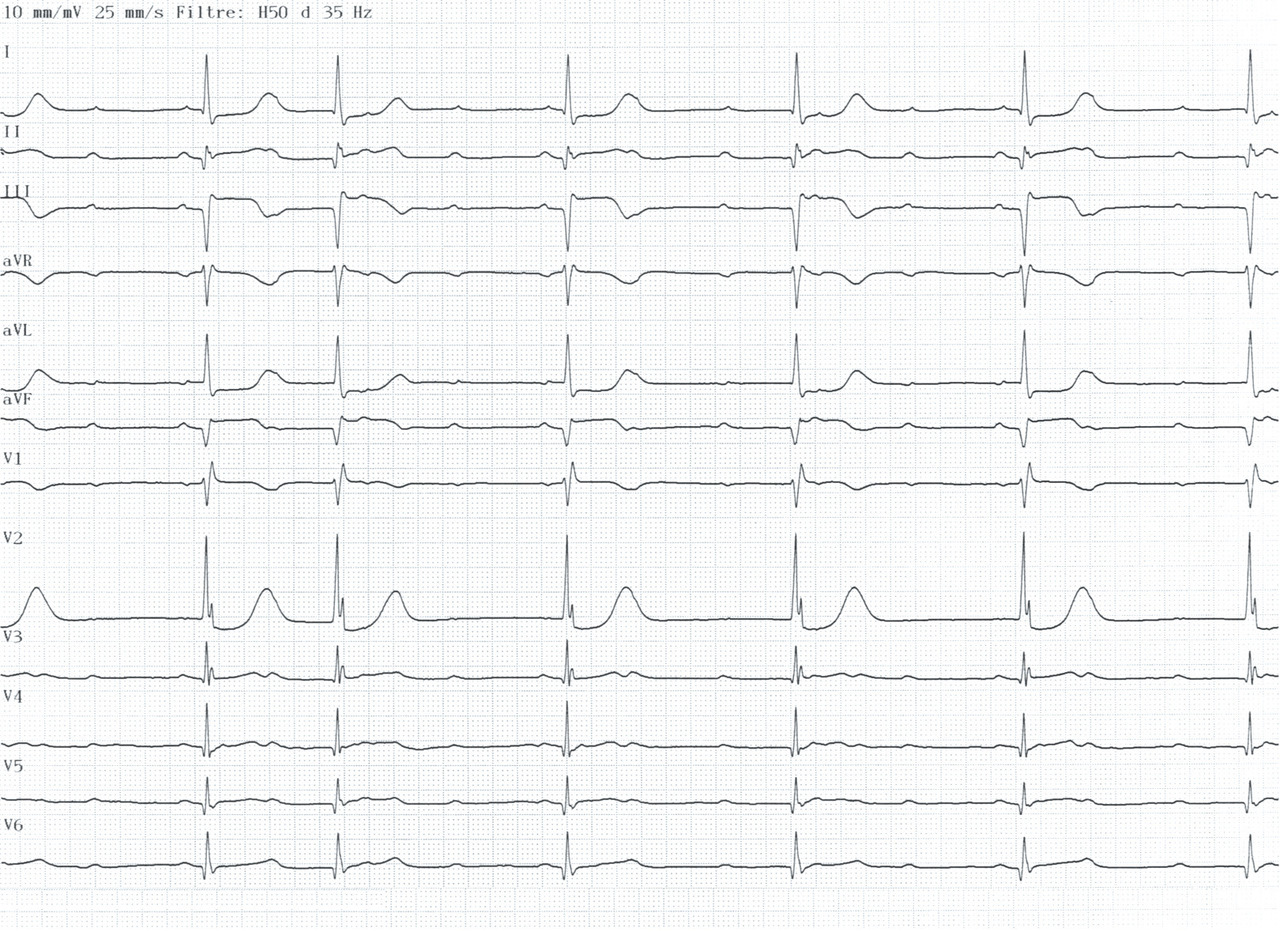
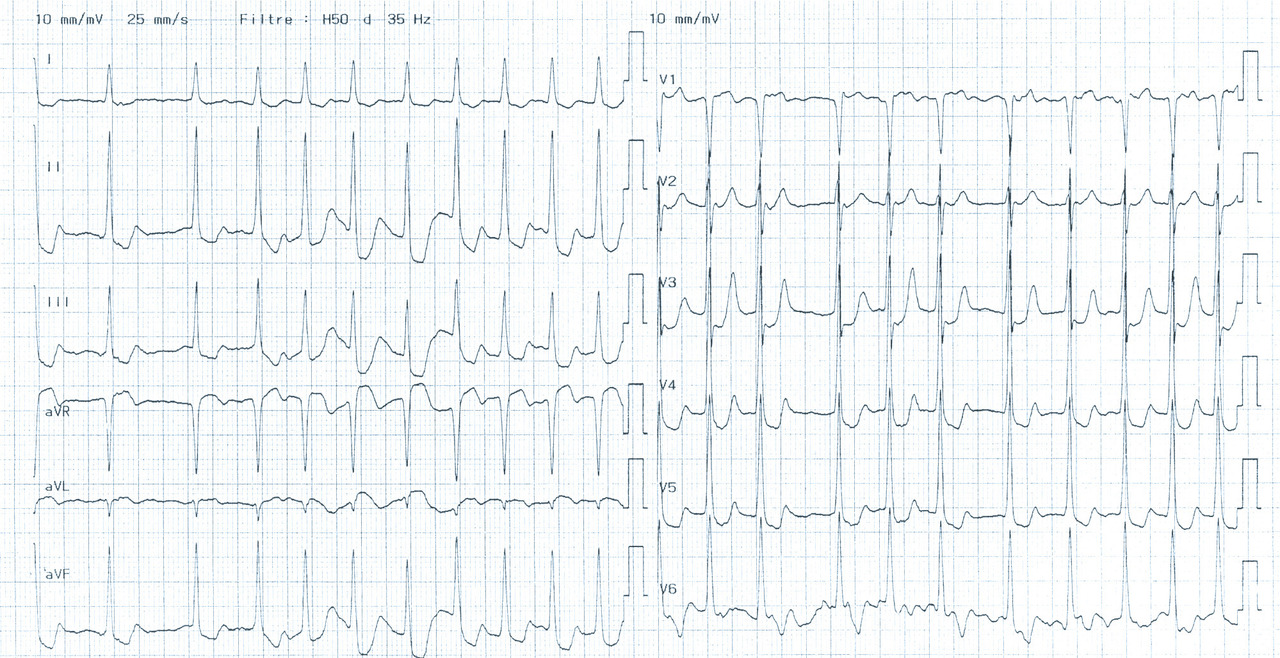
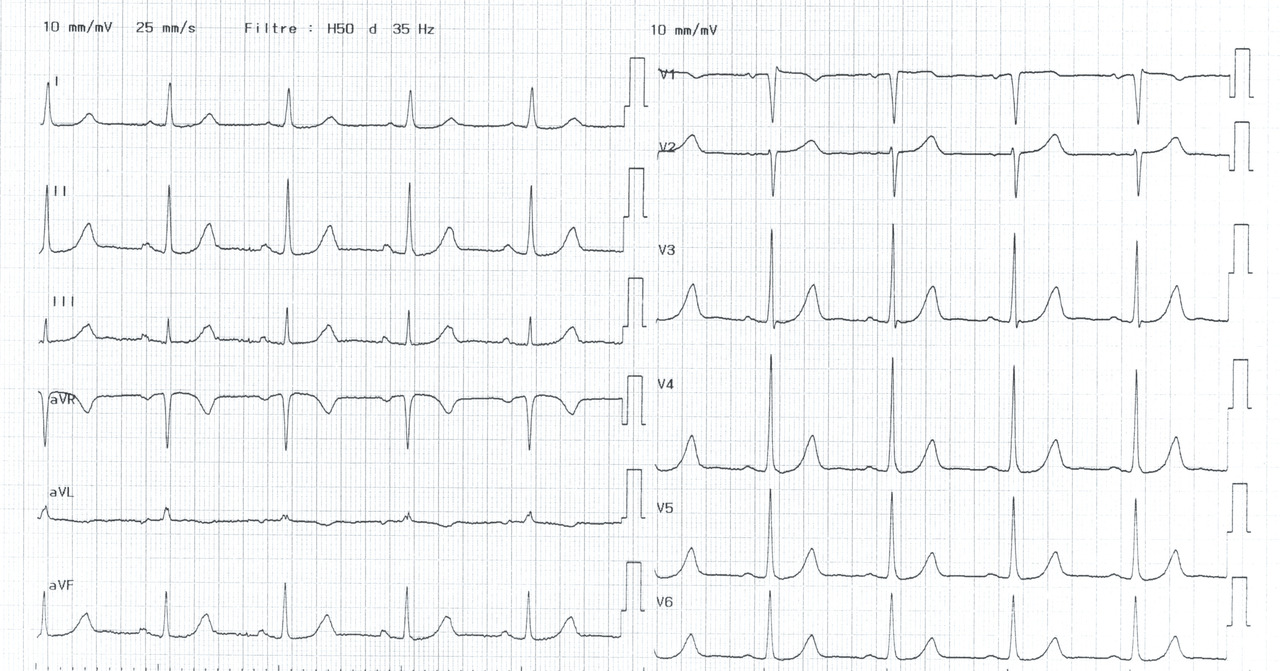
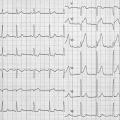
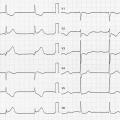
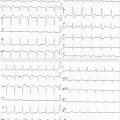
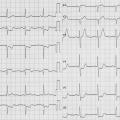
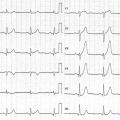
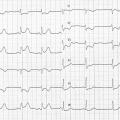
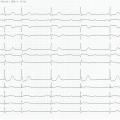
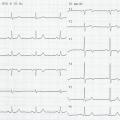
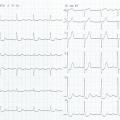
Patiente de 79 ans avec douleur thoracique et palpitations depuis 2 heures. L’ECG (n° 1) montre une FA avec sous-décalage diffus marqué. Il existe un souffle de rétrécissement aortique. La troponine sera à H+6 à 170 ng/L. Il s’agit d’un NSTEMI mais sur un mécanisme d’IDM de type 2. La réduction de la FA permet une normalisation de la repolarisation (ECG n° 2). La coronarographie ne retrouve pas de sténose > 50 %. Le rétrécissement aortique nécessite un complément de bilan. La prise en charge concerne la FA et le rétrécissement aortique.

 Encadrés
Encadrés