Médicaments. Les ruptures de stock de médicaments se multiplient, avec des conséquences qui peuvent être majeures. Quelles solutions pour y faire face ?
santé & société
Les pénuries de médicaments se sont multipliées ces dernières années et constituent un problème majeur de santé publique. Il peut s’agir de tensions d’approvisionnement lorsque des médicaments sont disponibles mais en quantité insuffisante pour répon- dre aux besoins. Dans certains cas, le laboratoire est dans l’impossibilité de fabriquer un médicament, entraînant une rupture d’approvisionnement des pharmacies de ville ou hospitalières qui sont dans l’incapacité de dispenser ce médicament à un patient. On parle alors de rupture de stock.
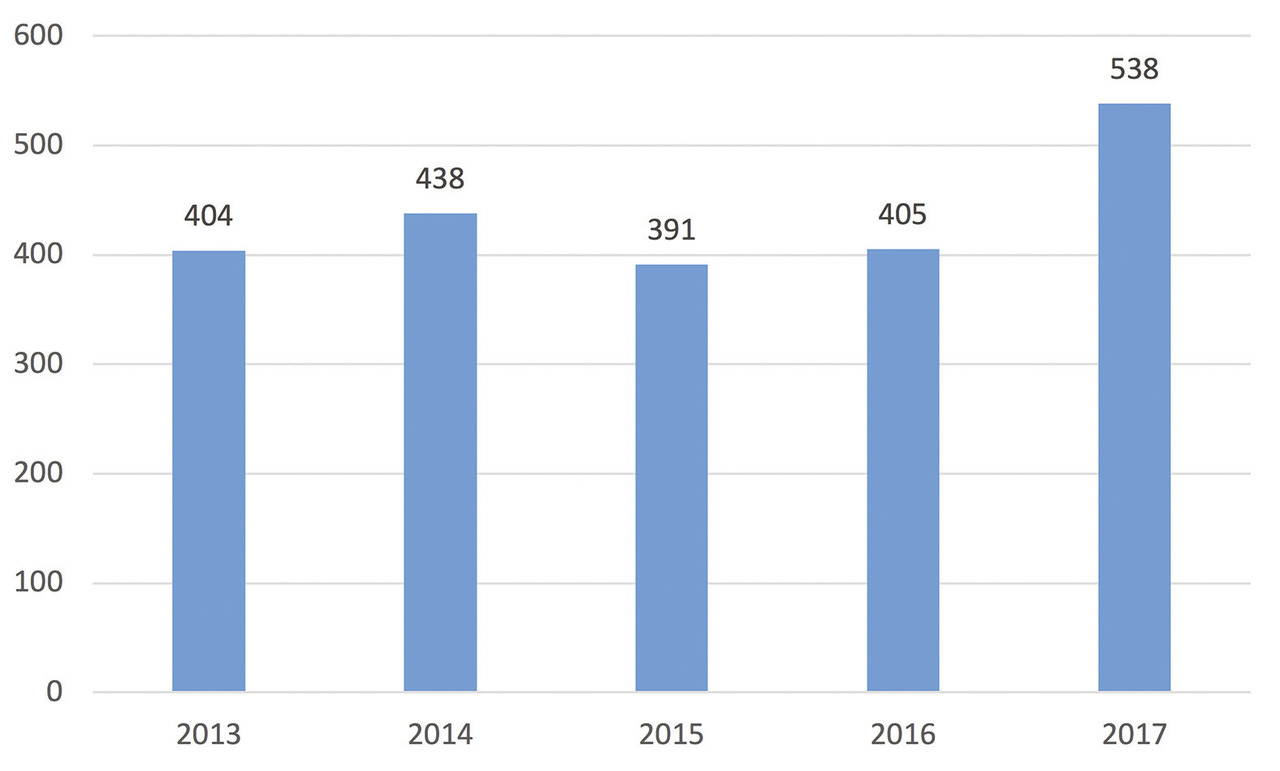
Pénurie de médicaments : bilan des signalements et origine des ruptures
Le nombre de signalements de ruptures et risques de rupture de stock des médicaments d’intérêt thérapeutique majeur
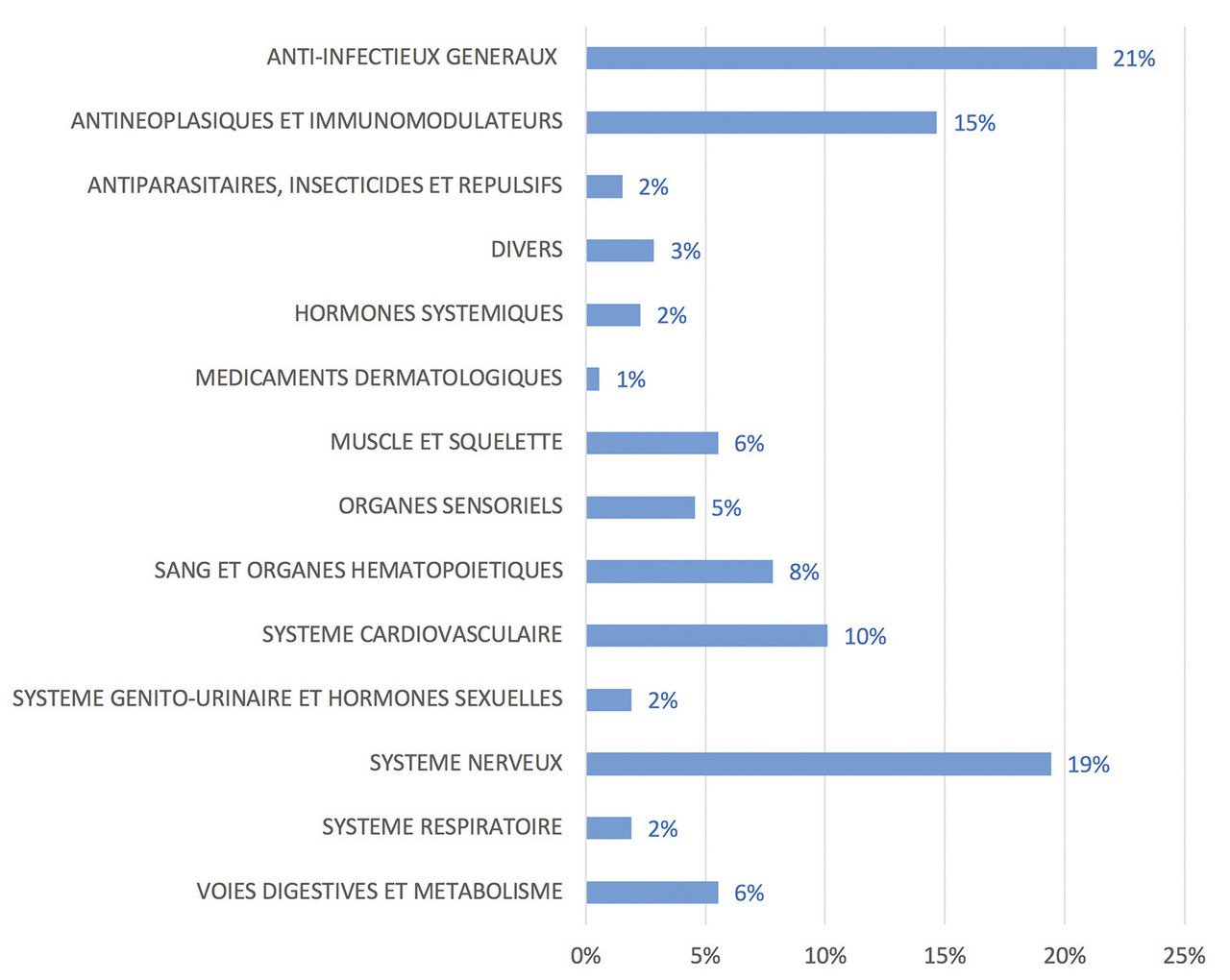
Les trois classes thérapeutiques les plus impactées par ces ruptures de stock en 2017 en France étaient les médicaments anti-infectieux (administrés par voie générale), les médicaments du système nerveux et les médicaments anticancéreux. Elles totalisaient à elles seules plus de la moitié de l’ensemble des ruptures de médicaments d’intérêt thérapeutique majeur déclarées à l’ANSM en 2017
Rôle de l’ANSM et des laboratoires dans la gestion des pénuries
Actuellement, il n’existe pas de système centralisé de gestion des pénuries au niveau européen : chaque pays est responsable de la gestion des ruptures de stock sur son territoire. En France, elle s’appuie sur une réglementation nationale qui a permis la mise en place d’un dispositif de prévention des ruptures à partir de 20122 et qui a été renforcé en 2016.3 En cas de rupture ou risque de rupture, l’ANSM définit et coordonne les actions appropriées en lien avec le laboratoire pharmaceutique concerné qui en assure la mise en œuvre. En pratique, l’ANSM cherche à sécuriser l’approvisionnement des médicaments d’intérêt thérapeutique majeur. Elle peut également effectuer des contrôles sur les procédures de gestion des ruptures mises en place par les laboratoires et dispose d’un pouvoir de sanctions financières en cas de manquements à leurs obligations (par exemple en cas de non-respect de l’obligation d’information d’un risque de rupture ou d’une rupture, ou de non-respect de l’obligation de mettre en place des solutions alternatives ou des mesures prévues dans les plans de gestion des pénuries). Enfin, elle est chargée d’informer les professionnels de santé et les patients sur les ruptures effectives ou à venir ainsi que sur les alternatives disponibles.
Cependant, l’ANSM ne peut se substituer aux laboratoires pharma- ceutiques en ce qui concerne la production des médicaments. Le renforcement de la réglementation intervenu en 2016 vise à replacer les laboratoires pharmaceutiques au cœur de leur responsabilité. Ils ont, entre autres, l’obligation de garantir un approvisionnement approprié et continu du marché national, de manière à couvrir les besoins des patients en France. Pour y parvenir, les laboratoires doivent élaborer des plans de gestion des pénuries pour les médicaments d’intérêt thérapeutique majeur en fonction de certains critères : existence ou non d’alternatives thérapeutiques, fragilité et complexité des opérations de fabrication et distribution. Par ailleurs, ils ont l’obligation d’informer sans délai l’ANSM de toute rupture ou risque de rupture sur un médicament d’intérêt thérapeutique majeur. L’anticipation devient la règle : dès lors que l’ANSM a connaissance qu’un médicament d’intérêt thérapeutique majeur ne sera plus disponible à court terme, une course contre la montre s’engage afin de préserver les stocks disponibles et envisager le plus rapidement possible le recours à des alternatives.
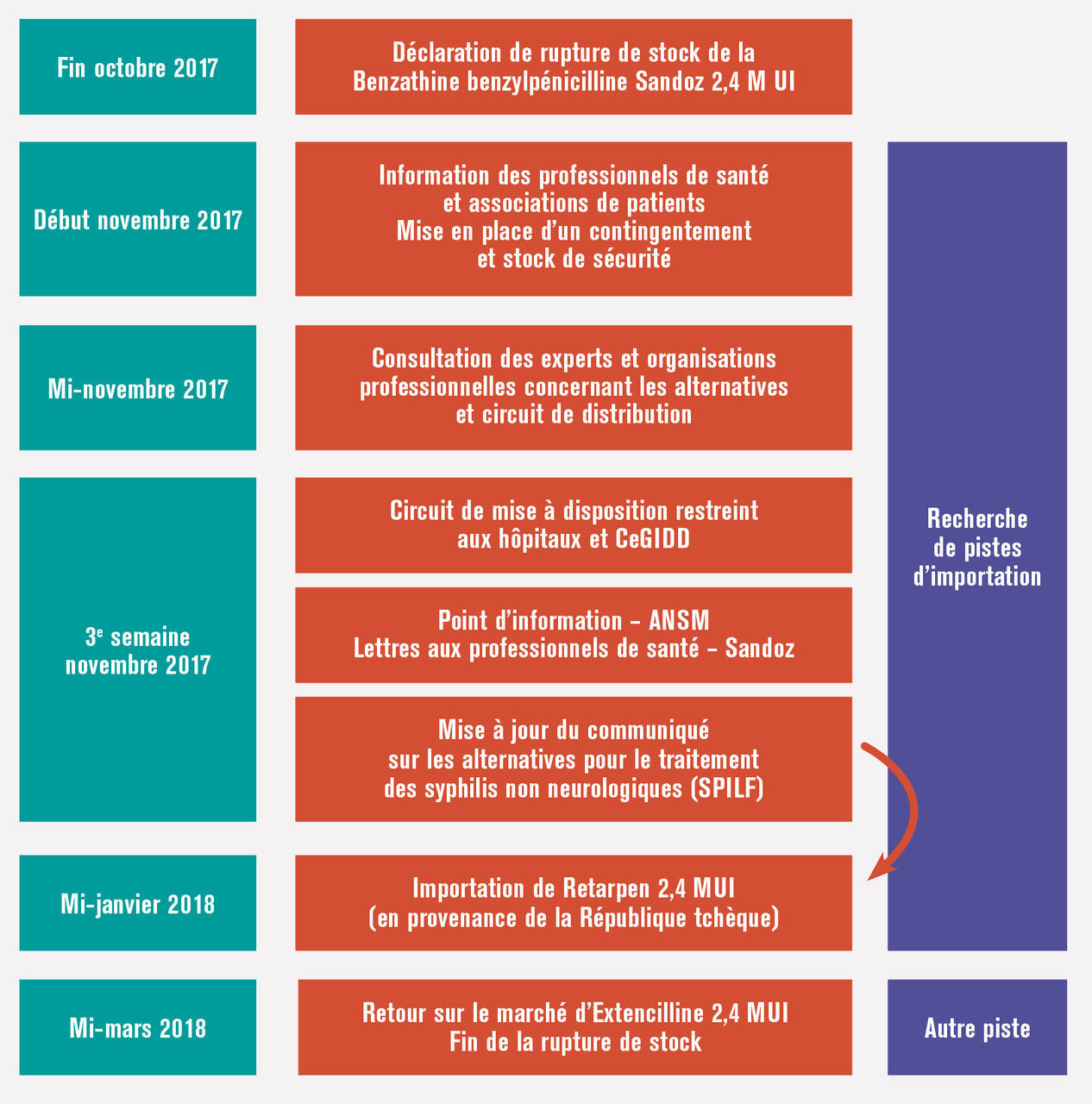
Complexité du problème : l’exemple des ruptures de stock de la benzathine benzylpénicilline
La benzathine benzylpénicilline, antibiotique injectable de la famille des bêtalactamines (groupe des pénicillines de type G à action retard), est un antibiotique de référence dans le traitement de la syphilis et dans la prévention des rechutes du rhumatisme articulaire aigu. Il est également utilisé dans la prophylaxie de l’érysipèle récidivant.
Rupture de stock d’Extencilline
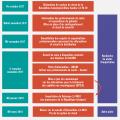
Jusqu’en février 2014, Extencilline était le seul médicament à base de benzathine benzylpénicilline disponible en France. Commercialisé depuis 1954 par le laboratoire Sanofi et administré par voie intramus- culaire, Extencilline existait sous trois dosages : 0,6, 1,2 et 2,4 MUI. Bien que Sanofi fût titulaire des autorisations de mise sur le marché (AMM) en France, il sous-traitait la production de cet antibiotique au laboratoire Sandoz. Lorsque ce dernier n’a plus été en mesure de fabriquer certains excipients entrant dans la composition d’Extencilline à la suite de la fermeture d’une de ses usines, Sanofi a informé l’ANSM courant 2013 d’une future rupture de stock consécutive à la décision prise d’arrêter la commercialisation de ce médicament de faible rentabilité dont le coût pour un flacon était alors de 4,38 euros. La recherche d’une alternative devenait la priorité, et de nombreux laboratoires commercialisant un médicament similaire ont été contactés en Europe et dans le reste du monde. La solution est venue d’Italie : le laboratoire Biopharma commercialisait la spécialité Sigmacillina 1,2 MUI (à base de benzathine benzylpénicilline), permettant d’envisager une importation en France à partir de février 2014 après distribution des dernières doses d’Extencilline. Si l’importation de ce médicament permettait de pallier de manière provisoire l’arrêt de commerciali- sation d’Extencilline, la situation n’était pas satisfaisante (un seul dosage disponible, médicament accessible uniquement à l’hôpital et dans les centres d’information, de dépistage et de diagnostic des infections sexuellement transmissibles [IST]) et restait fragile au regard des besoins. C’est dans ce contexte que l’ANSM a poursuivi ses investigations afin de réintroduire en France des médicaments disposant d’une AMM.
Autorisation en France de la Benzathine benzylpénicilline Sandoz
La piste du laboratoire Sandoz est apparue comme la plus robuste, celui-ci commercialisant dans plusieurs États européens un médicament appelé Retarpen contenant le même principe actif qu’Extencilline mais avec une composition différente en excipients. En novembre 2014, l’ANSM a octroyé des AMM aux spécialités de Sandoz (trois dosages) sous la dénomination Benzathine benzylpénicilline Sandoz. Ces médicaments ont bénéficié d’une revalorisation du prix à 11 euros (1 flacon) lors de l’examen du dossier par le Comité économique des produits de santé (CEPS). Cependant, les contraintes liées aux capacités de production allaient différer leur commercialisation qui n’est intervenue en France qu’en avril 2016 (uniquement pour deux dosages : 1,2 et 2,4 MUI) mettant fin à l’importation de Sigmacillina 1,2 MUI. La situation était à nouveau similaire à celle qui existait avec Extencilline, à savoir une situation de monopole : la disponibilité de la benzathine benzylpénicilline était totalement dépendante d’une seule source d’approvisionnement. Par conséquent, tout problème survenant dans la chaîne de fabri- cation de cet antibiotique était susceptible de provoquer une nouvelle rupture de stock.
Rupture de stock de la Benzathine benzylpénicilline Sandoz
À la suite de problèmes de production survenus chez l’un de ses sous-traitants, le laboratoire Sandoz informait l’ANSM fin octobre 2017 d’une rupture de stock pour la spécialité Benzathine benzylpénicilline Sandoz 2,4 MUI à compter de décembre pour une durée d’au moins six mois. Devant cette situation critique, l’ANSM a déployé un plan d’action, qui se décline en trois axes : informer, prendre les mesures urgentes qui s’imposent, et identifier d’autres médicaments similaires disponibles à l’étranger. Comme en 2014, la Société de pathologie infectieuse de langue française (SPILF), le Groupe de pathologie infectieuse pédiatrique (GPIP) de la Société française de pédiatrie (SFP) et la Société française de dermatologie (SFD) ont été informées rapidement des nouvelles difficultés rencontrées ainsi que les associations de patients, comme le Groupe inter-associatif traitements et recherche thérapeutique (TRT-5). Afin de préserver les stocks disponibles et dans l’attente des nouveaux approvisionnements, les premières mesures ont été prises : suivi hebdomadaire des consommations ; mise en place d’un contingentement par le laboratoire Sandoz ; mise à disposition restreinte en milieu hospitalier et dans les centres gratuits d’information, de dépistage et de diagnostic des infections par le VIH, des hépatites virales et des IST (CeGIDD) et création d’un stock de sécurité pour les demandes de dépannage d’urgence. Des lettres d’information ont été envoyées par le laboratoire aux professionnels de santé, et l’ANSM a publié plusieurs points d’information sur son site internet.4 La SPILF a actualisé son communiqué relatif aux alternatives pour le traitement des syphilis non neurologiques5 en tenant compte des informations du Centre national de référence (CNR) de la syphilis sur le niveau élevé de résistance des souches de tréponème à l’azithromycine, antibiotique qui n’est donc plus recommandé comme alternative. En parallèle, l’ANSM a engagé des démarches auprès de Sandoz et d’autres laboratoires afin d’importer des spécialités similaires disponibles à l’étranger. Sandoz disposait d’un stock d’une spécialité identique (Retarpen 2,4 MUI) en République tchèque qui pouvait être mobilisé pour le marché français. En janvier 2018, l’ANSM autorisait l’importation de Retarpen 2,4 MUI permettant, en complément des mesures déjà prises, de repousser de deux mois et demi la rupture totale du dosage à 2,4 MUI qui interviendra le 12 février 2018. À partir de cette date, il ne restait plus en France que le dosage à 1,2 MUI, imposant deux injections pour obtenir l’équivalent d’une injection à 2,4 MUI pour le traitement de la syphilis de l’adulte. En raison de l’enjeu de santé publique engendré par cette situation critique d’épisodes récurrents de ruptures de stock, la remise sur le marché des spécialités Extencilline a fait partie des pistes envisagées par l’ANSM pour mettre à disposition de façon pérenne d’autres spécialités de benzathine benzylpénicilline en France
Retour d’Extencilline
En 2016, le laboratoire Delbert a racheté les dossiers d’AMM d’Ex- tencilline au laboratoire Sanofi, avec l’objectif de relancer rapidement la production de cet antibiotique. Cependant, la mise à jour des dossiers d’AMM incluant de nouveaux sites de production qui doivent être autorisés par l’ANSM est une procédure longue et complexe. Mi-mars 2018, Extencilline 2,4 MUI fait son retour sur le marché français en ville et à l’hôpital, suivi des deux autres dosages fin avril, mettant ainsi fin à la situation de rupture de stock. Le prix obtenu par le nouveau titulaire de l’AMM pour les trois dosages d’Extencilline est identique au prix revalorisé accordé à Sandoz en 2016 pour ses spécialités, à savoir 11 euros (ce prix fixé par le CEPS est à distinguer du prix négocié par les hôpitaux dans le cadre des appels d’offres). Il est à noter que les différents sites de production d’Extencilline sont tous localisés en Europe et que le dosage à 0,6 MUI, notamment adapté à la population pédiatrique pour la prophylaxie du rhumatisme articulaire aigu, qui n’était plus disponible depuis la rupture intervenue en 2014, est fabriqué sur les nouveaux sites autorisés.
Discussion
Les ruptures de stock constituent des enjeux de santé publique dans la mesure où elles peuvent être à l’origine de perturbations majeures dans l’organisation des soins et la prise en charge des patients. Des situations rencontrées avec certains antibiotiques en sont une illustration. La problématique posée par les pénuries de « vieux » antibiotiques est majeure car, bien qu’ils occupent une place importante dans l’arsenal thérapeutique et permettent une diversité pharmacologique indispensable dans la lutte contre l’antibiorésistance, leur prix est généralement très faible et leur coût de production plus élevé lors- qu’il s’agit de produits injectables. Une faible rentabilité pourrait expliquer le désengagement des laboratoires pharmaceutiques conduisant à la disparition progressive de certaines molécules. Ce phénomène rejoint les problématiques générales décrites sur la mondialisation de la produc- tion des médicaments. En outre, les répercussions des ruptures de stock peuvent être néfastes sur les stratégies de bon usage des médicaments. Elles peuvent entraîner une modification de la prescription vers une alternative pouvant ne pas correspondre aux préconisations thérapeutiques de prise en charge en vigueur d’une pathologie donnée. Cela est particulièrement redouté pour les antibiotiques dans la mesure où la pénurie du traitement de référence peut imposer le report vers un autre antibiotique à plus large spectre et/ou particulièrement générateur de résistances bactériennes. Ainsi, la situation engendrée par des ruptures de stock peut aller à l’encontre de l’exigence requise pour une utilisation raisonnée d’antibiotiques alors qu’aujourd’hui l’ensemble des politiques nationales et internationales fonde leurs recommandations sur un usage maîtrisé des antibiotiques pour combattre la résistance aux antimicrobiens.
De plus, par « effet domino », le report vers des alternatives peut provoquer une tension d’approvisionnement, voire une rupture sur ces alternatives. Le circuit de mise à disposition des médicaments a également une influence sur l’impact des pénuries. Alors qu’en ville les officines peuvent se procurer auprès des grossistes- répartiteurs un médicament similaire d’un autre laboratoire pharmaceutique, la situation apparaît plus complexe à l’hôpital en raison du code des marchés publics. Pour un médicament donné, l’hôpital, via le système des appels d’offres, est approvisionné généralement par un seul laboratoire qui s’engage par contrat à honorer les commandes. Afin de remporter les marchés publics, un laboratoire peut proposer des prix lui permettant d’obtenir un quasi- monopole auprès des hôpitaux. En cas de rupture de stock de ce médicament, il est difficile pour la pharmacie hospitalière de pouvoir recourir à un médicament similaire pourtant disponible auprès d’un autre laboratoire, car ce dernier, compte tenu de ses volumes de vente plus faibles, ne va pas pouvoir répondre à la demande. En outre, ce laboratoire va approvisionner préférentiellement les hôpitaux avec lesquels il a obtenu le marché public et, de ce fait, est réticent à dépanner les autres hôpitaux pour ne pas lui-même se retrouver en difficulté. En effet, le laboratoire défaillant devra supporter les coûts majorés pour la pharmacie en raison de l’achat d’un médicament similaire auprès d’un autre laboratoire. Par conséquent, pour sécuriser leur approvisionnement, les hôpitaux doivent envisager la possibilité de recourir à plusieurs fournisseurs pour un même médicament d’intérêt thérapeutique majeur.
Une coopération européenne indispensable
Les difficultés d’approvisionnement deviennent récurrentes et, si elles touchent aujourd’hui de façon critique les antibiotiques, d’autres médicaments comme les anticancéreux ou les médicaments du système nerveux sont eux aussi particulièrement impactés. La mondialisation et la complexité croissante des circuits de distribution représentent des éléments importants de fragilité et d’instabilité à l’origine de la majorité des pénuries de médicaments. L’exemple de la benzathine benzyl- pénicilline est illustratif des problématiques industrielles rencontrées dans le milieu pharmaceutique et des diverses actions menées par les acteurs concernés pour garantir l’accès au traitement. Les « vieux » antibiotiques (principalement injectables) sont particulièrement exposés aux risques de rupture, voire d’arrêt de commercialisation. Dans un contexte de carence d’antibiotiques innovants et de menace croissante de bactéries résistantes, il est donc indispensable de conserver notre « patrimoine antibiotique » composé pour l’essentiel de vieilles molécules. L’ANSM, dans la limite de son champ de compétence, est particulièrement engagée dans l’ensemble du dispositif de gestion des ruptures. Cependant, les stratégies déployées à l’échelon national pour limiter les conséquences de l’indisponibilité du médicament pour le patient ne peuvent apporter que des solutions partielles à ce problème. Du fait de la complexité et de l’impact international du phénomène, il ne pourra y avoir de réponse efficace sans un plan stratégique décidé au niveau européen
Qu’est-ce qu’un médicament d’intérêt thérapeutique majeur ?
Les médicaments d’intérêt thérapeutique majeur* sont des médicaments ou des classes de médicaments pour lesquels une interruption de traitement est susceptible de mettre en jeu le pronostic vital des patients à court ou moyen terme, ou représente une perte de chance importante pour les patients au regard de la gravité ou du potentiel évolutif de la maladie.
* Article L. 5111-4 du code de la santé publique.
La coopération européenne se met en place
Les tensions d’approvisionnement et les ruptures de stock des médicaments constituent un problème croissant, et l’Europe reconnaît que c’est un sujet de grande préoccupation pour l’ensemble des acteurs concernés. L’Agence européenne des médicaments (EMA) et le réseau des directeurs des Agences nationales ont donc créé un groupe de travail chargé de fournir un soutien stratégique ainsi que d'élaborer des recommandations pour faire face aux tensions d’approvisionnement/ruptures des médicaments et garantir leur disponibilité. Le périmètre couvre à la fois les médicaments humains et vétérinaires, quelle que soit leur voie d’autorisation (européenne ou nationale). Ce groupe européen a récemment publié son programme de travail pour les deux prochaines années. Les actions proposées s’articulent autour de trois axes : faciliter l’autorisation de nouveaux médicaments et réduire les délais d’instruction, faciliter la surveillance des ruptures de stock en Europe, améliorer la communication interne entre les autorités et les industriels ainsi que la communication externe vers le public.
1. Académie nationale de pharmacie. Médicaments : ruptures de stock, ruptures d’approvisionnement. Recommandations de l’Académie nationale de pharmacie, avril 2013.
2. Décret n° 2012-1096 du 28 septembre 2012 relatif à l’approvisionnement en médicaments à usage humain.
3. Décret n° 2016-993 du 20 juillet 2016 relatif à la lutte contre les ruptures d’approvisionnement de médicaments.
4. Agence nationale de sécurité des médicaments et des produits de santé. Difficultés d’approvisionnement en benzathine benzylpénicilline. Point d’information ANSM, novembre 2017.
5. Société de pathologie infectieuse de langue française. Alternatives pour le traitement des syphilis non neurologiques dans un contexte de rupture de stock de benzathine pénicilline. Communiqué de la SILF, novembre 2017.

 Encadrés
Encadrés