Un patient de 24 ans, sans antécédents pathologiques notables, consulte pour des lombalgies d’horaire inflammatoire fulgurantes installées depuis trois mois, sans facteur déclenchant ni signes accompagnateurs et non calmées par des antalgiques de niveau 2.
L’examen clinique révèle une boiterie à la marche ainsi qu’une raideur du rachis lombaire (indice de Schober à 10 + 3 cm). Les manœuvres des sacro-iliaques et la mobilité des hanches sont douloureuses, mais sans limitation. Des douleurs à la pression des articulations chondrocostales sont également mises en évidence. Par ailleurs, l’examen pleuropulmonaire, cardiovasculaire, abdominal et ganglionnaire est sans anomalie.
Devant ce tableau clinique, le patient a été mis sous célécoxib 400 mg/j, sans résultat probant après deux semaines ; une aggravation a même été notée, aussi bien sur le plan douloureux que fonctionnel : le patient a été confiné au fauteuil roulant, incapable de marcher et de se mettre debout sans l’aide d’une tierce personne.
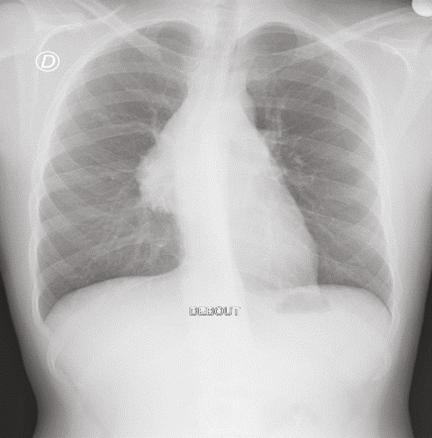
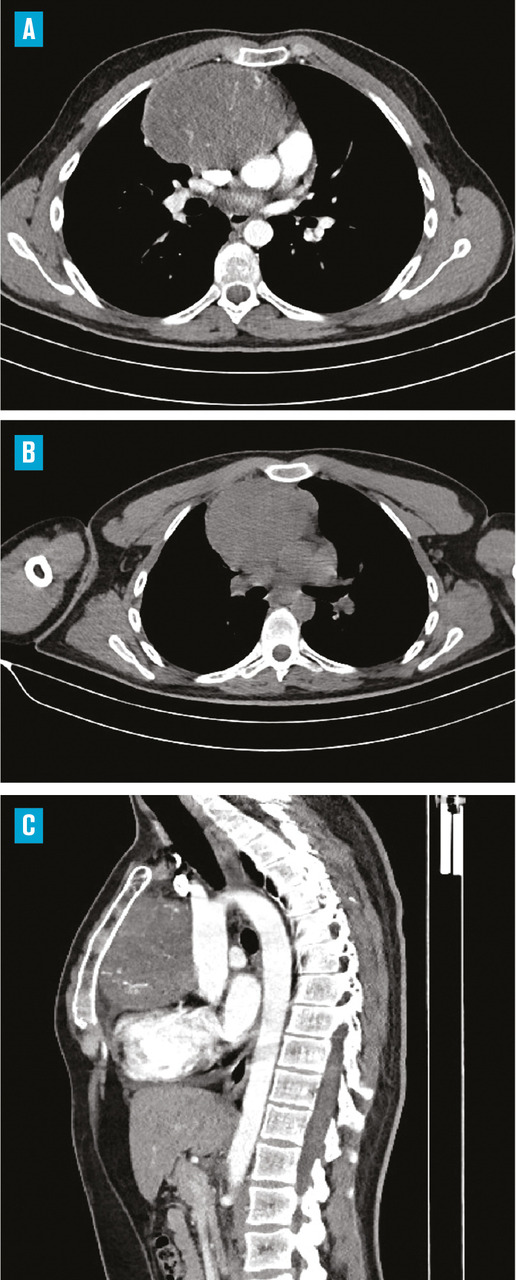
Le bilan biologique n’a pas montré de syndrome inflammatoire (hémogramme, protéine C réactive [CRP] et vitesse de sédimentation [VS] normaux). Les radiographies standard du bassin et du rachis lombaire, de même que l’échographie des hanches, étaient sans particularité. Mais la radiographie pulmonaire de face a mis en évidence une opacité médiastinale parahilaire droite se raccordant en pente douce avec le médiastin ainsi qu’une interface nette avec le poumon, évoquant une tumeur médiastinale (
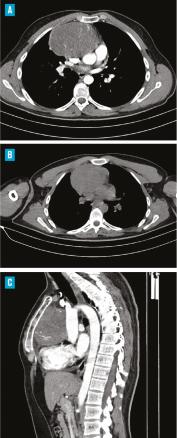
Un complément scanographique a montré la présence d’une masse du médiastin antérosupérieur, de forme ovalaire, mesurant 10 × 9,5 cm, de contours réguliers et nets, et se réhaussant de manière hétérogène après injection du produit de contraste. Une adénopathie médiastinale y était associée avec la même densité, sans autre anomalie pleuropulmonaire (
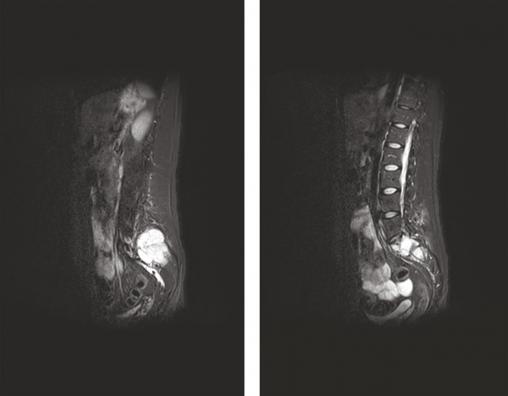
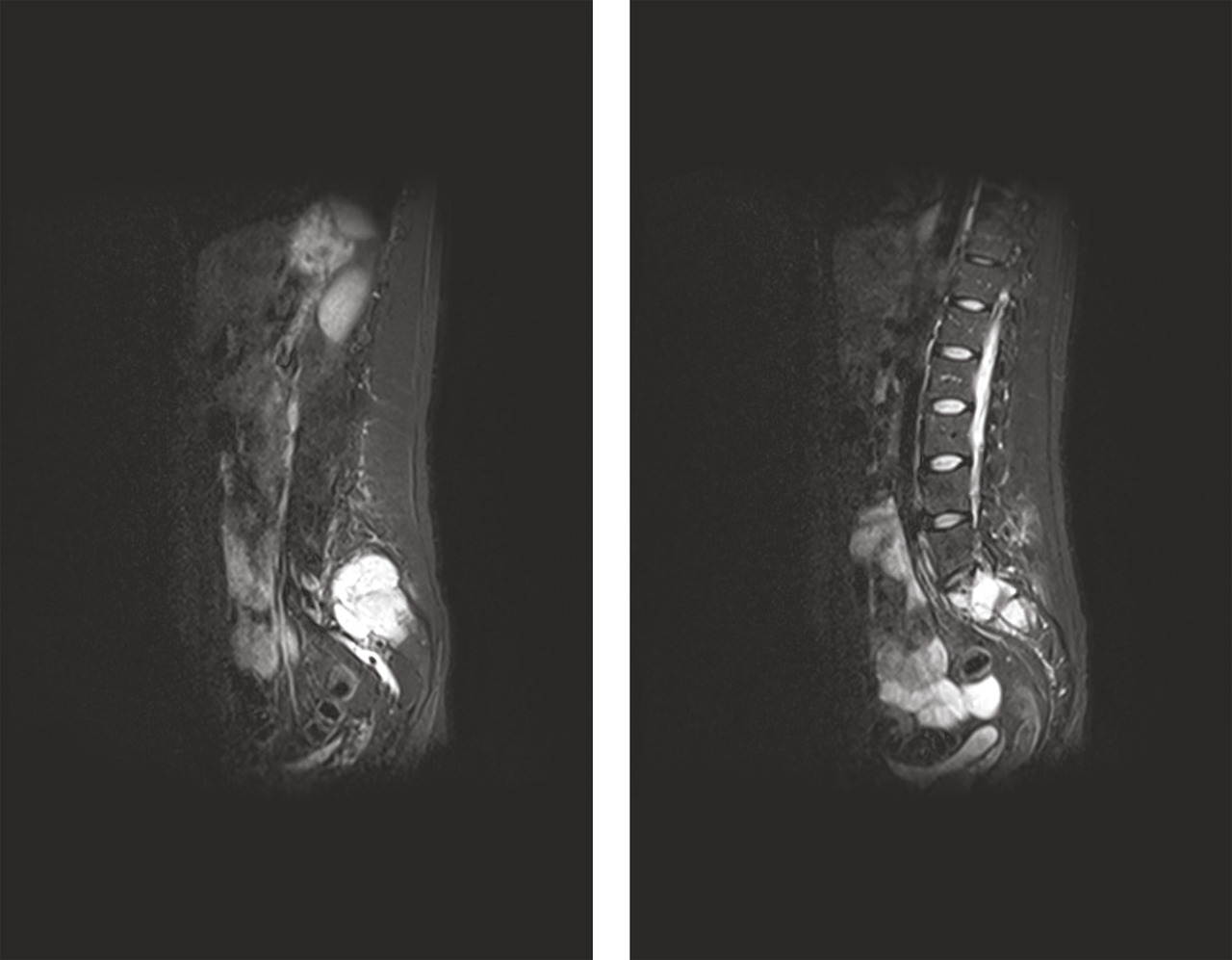
L’IRM couplée du rachis et du bassin a révélé la présence de trois lésions tissulaires vertébrales (en T3, T4 et T5) et d’une lésion plus volumineuse de l’aileron sacré gauche infiltrant le premier trou sacré gauche (
Deux biopsies ont été réalisées. La première, scannoguidée, a décrit des lésions de tuberculose alors que tous les arguments cliniques et d’imagerie plaidaient en faveur d’une tumeur maligne. Une seconde biopsie, organisée avec les chirurgiens thoraciques, a été effectuée ; elle a conclu à un tératome immature.
Le complément du bilan biologique comprenant un bilan phosphocalcique, une électrophorèse des protides sériques et une évaluation des fonctions rénale et hépatique était sans anomalie.
La scintigraphie osseuse a révélé une ostéolyse des 2e et 3e pièces gauche du sacrum ; le scanner abdominal n’a pas objectivé de métastases viscérales, notamment au niveau du foie ; l’échographie testiculaire, à la recherche d’une localisation gonadique, était normale ; les marqueurs tumoraux étaient élevés (alphafœtoprotéine [AFP] dosée à 448,4 ng/mL et hormone chorionique gonadotrope bêta [β-hCG] à 116 UI/L).
À la demande de la famille, le patient a été transféré dans un service d’oncologie en France. Il a bénéficié de six cures de chimiothérapie, mal supportées, et est malheureusement décédé.
Les tumeurs à cellules germinales sont souvent de localisation gonadique mais parfois cérébrale, sacro-coccygienne ou médiastinale. Elles ont la particularité de survenir chez des patients jeunes et reproduisent des structures de l’embryogenèse qui leur donnent des différenciations morphologiques très variées. Il est ainsi possible de les classer en deux catégories :
– les séminomes (nappes de cellules ressemblant à des gonocytes primordiaux) ;
– les tumeurs non séminomateuses : carcinomes embryonnaires et tératomes (dérivés de structures embryonnaires), choriocarcinome et tumeur vitelline (dérivés de structures extra-embryonnaires).
Tératomes : tumeurs germinales volontiers médiastinales
Toutes les variétés de tumeurs germinales peuvent être observées en localisations extragonadiques. Dans 6 % des cas, elles surviennent dans le médiastin ; elles représentent ainsi environ 15 % de l’ensemble des tumeurs médiastinales antérieures chez l’adulte et l’enfant.1 Les autres localisations extragonadiques, telles que l’espace péritonéal, les poumons, le foie et l’hypophyse, sont rares et associées à un mauvais pronostic.
Si les séminomes sont plus fréquents dans l’épiphyse, les tératomes sont quant à eux plus souvent retrouvés dans le rétropéritoine et le médiastin.
Sur le plan clinique, les tumeurs médiastinales sont généralement symptomatiques. Ainsi, les patients peuvent présenter des symptômes respiratoires tels qu’une dyspnée, une toux et une douleur thoracique ou bien des signes en rapport avec une compression vasculaire locale comme une insuffisance cardiaque ou un souffle valvulaire.
Tératomes matures ou immatures, la gravité n’est pas la même
Les tératomes peuvent être classés en deux types :
– les tératomes matures correspondant à des tumeurs bénignes et constitués entièrement de tissus adultes, matures. Simples (kyste épidermique, kyste entéroïde) ou complexes, ces tumeurs associent de multiples formations tissulaires mésenchymateuses et épithéliales plus ou moins organoïdes ou désordonnées (épiderme, annexes pilo-sébacées, cellules adipeuses, muscle lisse et strié, os, cartilage, épithélium respiratoire et digestif, tissu thyroïdien, dents…) ;
– les tératomes immatures, qui sont des tumeurs malignes contenant des tissus incomplètement différenciés, ressemblant à des tissus embryonnaires.
Caractère sécrétant ou non du tératome
Sur le plan biologique, deux marqueurs tumoraux sont des facteurs pronostiques essentiels au diagnostic et à la stratégie thérapeutique : l’alphafœtoprotéine (AFP) et la sous-unité bêta de l’hormone gonadotrophine chorionique (β-hCG). Leur élévation témoigne du caractère sécrétant de la tumeur, de pronostic plus péjoratif. Classiquement, le tératome mature n’est pas sécrétant.
Tératome immature médiastinal
Les tératomes immatures sont des tumeurs malignes rares et ne concernent que 1 % des tératomes médiastinaux.2 Tous les types de tissu peuvent y être représentés ; si le composant principal est généralement neurogène, les éléments mésodermiques sont également courants. Le tératome immature est caractérisé par un développement rapide, avec tendance à l’envahissement local et métastatique.3, 4 L’évolution rapidement progressive de notre patient illustre bien cette caractéristique.
L’imagerie, soutien au diagnostic
Le scanner est la technique d’imagerie de choix pour l’évaluation de ces lésions. Le tératome immature médiastinal s’y présente généralement comme une masse antérieure hétérogène contenant du tissu mou, du liquide, de la graisse et/ou des calcifications. Les lésions kystiques sans graisse ni calcification sont cependant observées dans 15 % des tumeurs. La tomodensitométrie est également utile pour évaluer les lésions pulmonaires associées. Il s’agit généralement d’une atélectasie, d’une pneumopathie ou de l’association des deux.
L’aspect le plus commun d’un tératome en IRM est celui d’une masse médiastinale antérieure hétérogène. Les éléments des tissus mous sont en iso-signal et possèdent des caractéristiques musculaires, tandis que les composants kystiques présentent une intensité de signal faible sur les images pondérées en T1 et un signal élevé sur les images pondérées en T2. La visualisation de la graisse, sous forme d’un signal d’intensité élevée sur les images pondérées en T1, est une aide au diagnostic. L’IRM est également utile pour évaluer l’inflammation à la périphérie de la tumeur. Il est néanmoins difficile de distinguer tératomes mature et immature à l’imagerie, nécessitant le recours à un examen histologique.
Résection complète, voire chimiothérapie
Chez les patients de plus de 15 ans, une résection chirurgicale complète du tératome médiastinal immature est indispensable.
Les tératomes situés dans des zones inaccessibles à la chirurgie ou de découverte tardive (formes avancées) sont parfois traités par chimiothérapie néoadjuvante.
L’évolution des tératomes immatures est marquée par une croissance tumorale très rapide ; l’extension est initialement locorégionale, puis la dissémination métastatique se fait préférentiellement aux niveaux pulmonaire, hépatique, osseux et cérébral. Lorsque la résection complète est associée à la chimiothérapie, une longue période de survie peut être espérée. Dans le cas contraire, le pronostic est mauvais.
Lombalgies chez le jeune, ne pas négliger une possible origine néoplasique
Chez notre patient, la lombalgie, la raideur du rachis, les coxalgies et les douleurs sacro-iliaques étaient secondaires aux métastases osseuses sacrées ; les douleurs thoraciques antérieures étaient, quant à elles, en rapport avec la localisation médiastinale de la tumeur. Le cas de ce jeune homme rappelle l’importance de ne pas écarter trop rapidement les causes néoplasiques des lombalgies, même à un âge précoce.
1. Kaikobad M, Cheng YC, Choi H, Teves D. Primary mediastinal embryonal carcinoma masquerading as chronic pancreatitis. WMJ 2007;106(4):225-8.
2. Das BB, Richardson C, Lala R, Sahoo S. Primary immature mediastinal teratoma in a newborn. Indian Pediatr 2001;38(10):1181-4.
3. Hiroshima K, Toyozaki T, Iyoda A, Yusa T, Fujisawa T, Ohwada H. Apoptosis and proliferative activity in mature and immature teratomas of the mediastinum. Cancer 2001;92(7):1798-806.
4. Cöl C. Immature teratoma in both mediastinum and liver of a 21-Year-old female patient. Acta Med Austriaca 2003;30(1):26-8.
Une question, un commentaire ?