Argumenter la stratégie de prise en charge globale d'une douleur aiguë ou chronique chez l'adulte. Connaître et prescrire les thérapeutiques antalgiques médicamenteuses et non médicamenteuses (voir item 326).
S’assurer de l'efficacité d'un traitement antalgique et l’adapter en fonction de l’évaluation.
La loi relative aux droits des malades et à la qualité du système de santé du 4 mars 2002 reconnaît le soulagement de la douleur comme un droit fondamental de toute personne. La lutte contre la douleur est une priorité inscrite dans la loi de santé publique de 2004.
Pratiquement toute pathologie est accompagnée de phénomènes douloureux et, inversement, les phénomènes douloureux témoignent d’une pathologie qui doit être identifiée et prise en charge. La prise en charge de la douleur doit s’inscrire dans la stratégie spécifique de chaque affection, mais doit aussi être globale, en prenant en considération l’individu dans son ensemble, avec les particularités inhérentes aux douleurs aiguës ou chroniques.
L’articulation entre la douleur et les thérapeutiques antalgiques repose sur la concordance entre le type de douleur (composante, durée, mécanisme, intensité, pathologie) et les molécules (classes pharmacologiques, mécanismes d’action, pharmacocinétique, etc.), méthodes ou techniques utilisées.
Classification de la douleur
- sensorielle (sensori-discriminative) ;
- affectivo-émotionnelle ;
- cognitive ;
- comportementale.
- aiguë : liée à une atteinte tissulaire brutale (traumatisme, lésion inflammatoire, distension d’un viscère…). C’est un signal d’alarme dont la « finalité » est d’informer l’organisme d’un danger pour son intégrité. Une fois son origine identifiée et le traitement spécifique mis en place, sa prise en charge nécessite sa reconnaissance et un traitement essentiellement pharmacologique reposant sur les antalgiques avec un objectif curatif ;
- chronique : définie par la Haute Autorité de santé (HAS) comme un syndrome multidimensionnel exprimé par la personne qui en est atteinte, qui présente plusieurs des caractéristiques suivantes :
. réponse insuffisante au traitement ;
. détérioration significative et progressive, du fait de la douleur, des capacités fonctionnelles et relationnelles du patient dans ses activités de la vie journalière.
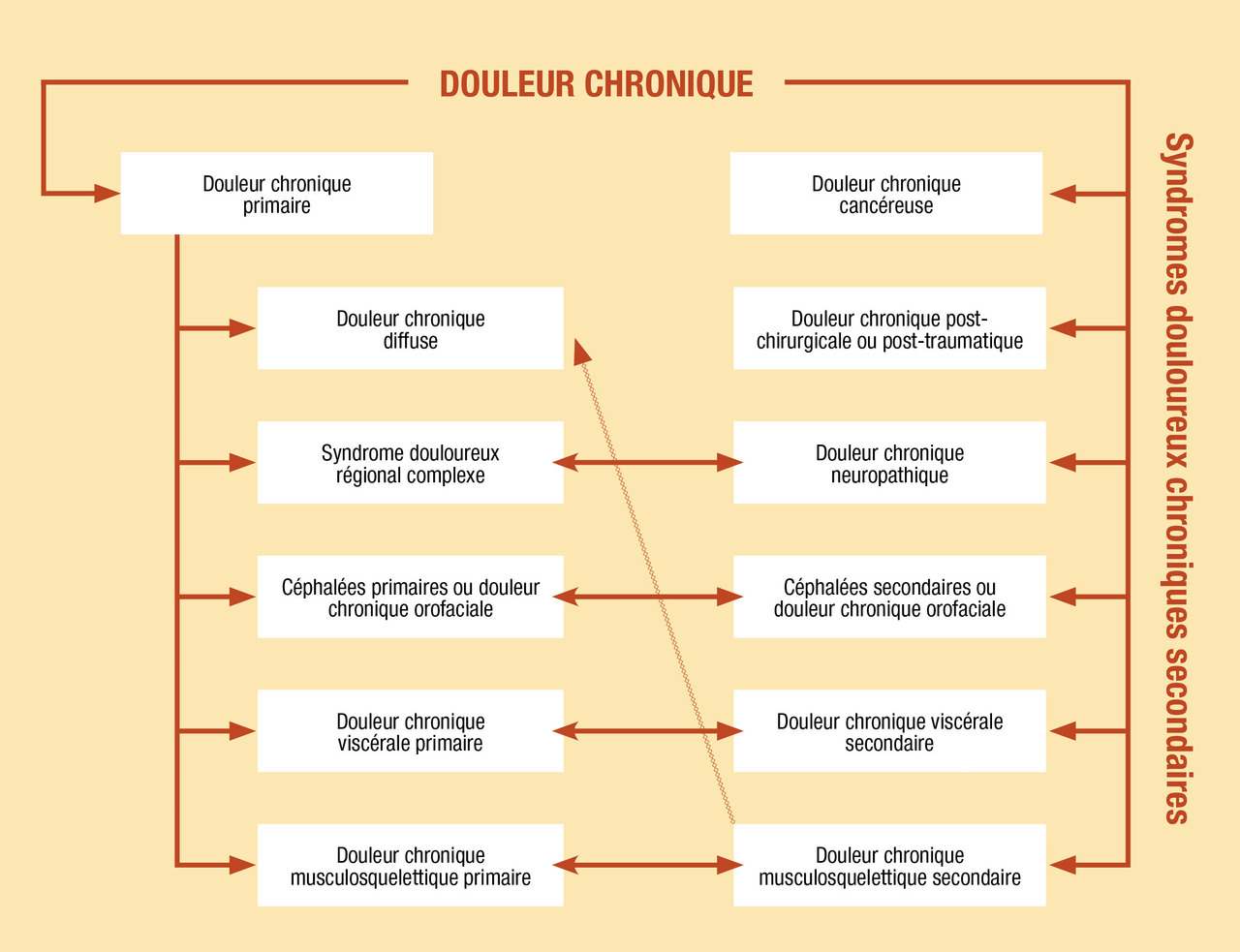
Récemment, l’Association internationale pour l’étude de la douleur a adopté une nouvelle classification des douleurs chroniques pour la Classification internationale des maladies (CIM-11), qui distingue les syndromes douloureux chroniques primaires et les syndromes douloureux chroniques secondaires, propose des définitions et caractéristiques précises des diagnostics de douleur chronique et intègre des diagnostics préexistants de pathologies douloureuses chroniques (comme les céphalées).
Cette classification rend obsolète la dichotomie entre douleurs somatiques et psychogènes et introduit un nouveau type de mécanisme (en plus des mécanismes nociceptif et neuropathique) : la douleur nociplastique.
Sont ainsi définies (
- la douleur chronique primaire (syndrome douloureux chronique primaire) : douleur dans au moins une région anatomique qui persiste plus de 3 mois et est associée à un stress émotionnel important ou un handicap fonctionnel ;
- la douleur chronique secondaire (syndrome douloureux chronique secondaire) : la douleur est le symptôme d’une maladie identifiée.
- nociceptif : liée à une stimulation persistante et excessive des récepteurs périphériques de la douleur ;
- neuropathique : liée à une lésion ou une maladie affectant le système somatosensoriel ;
- nociplastique : liée à une altération de la nociception malgré l’absence de preuve d’une lésion tissulaire activant les nocicepteurs ou d’une maladie ou lésion affectant le système somato-sensoriel.
Selon la pathologie : cancéreuse ou non.
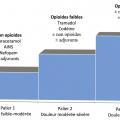
Stratégie de prise en charge globale d’une douleur aiguë ou chronique chez l’adulte (tableau 1)
Principes généraux
- tenir compte du type de douleur ;
- tenir compte de la pharmacodynamie des produits rapportée au type de douleur, de patient, de situation, etc. ;
- tenir compte de la pharmacocinétique ;
- respecter les contre-indications ;
- privilégier le traitement de la cause quand c'est possible ;
- évaluer/réévaluer (la douleur mais aussi l’effet du traitement) ;
- titrer ;
- prévenir/anticiper ;
- adapter.
Douleur aiguë :
- objectif : rechercher en principe le soulagement total, rapide ;
- associer le traitement antalgique à celui de la pathologie déclenchante ;
- quelques types de situations :
. la douleur aiguë en intrahospitalier : privilégier les formes LI et PO (per os), suivre les paliers de l’OMS, intérêt des protocoles, opioïde de choix (morphine),
. la douleur postopératoire : analgésie balancée et multimodale, réhabilitation précoce, prévention de la chronicisation,
. la douleur dans les services d’urgence,
. les épisodes d’exacerbation aiguë de douleur chronique, avec un aspect particulier : les accès douloureux paroxystiques (ADP) : prévoir le problème, anticiper, prévoir des interdoses,
. les douleurs induites par les soins.
Douleur chronique :
- définir les objectifs (douleur, fonction, qualité de vie, etc.) ;
- définir le traitement de fond/le traitement des acutisations ;
- balance formes à libération prolongée (LP)/LI ;
- approches multidisciplinaires ;
- approches non médicamenteuses ;
- quelques types de situations :
. la lombalgie chronique,
. la fibromyalgie,
. la douleur neuropathique.
Traitement médicamenteux
Les recommandations de l’OMS reposent sur 5 principes simples :
- privilégier l’administration des analgésiques par voie orale ;
- administrer les analgésiques à intervalles réguliers ;
- prescrire les analgésiques en fonction de l’intensité de la douleur mesurée selon une échelle d’intensité ;
- adapter le dosage du médicament à la personne ;
- prescrire les analgésiques en se préoccupant des détails.
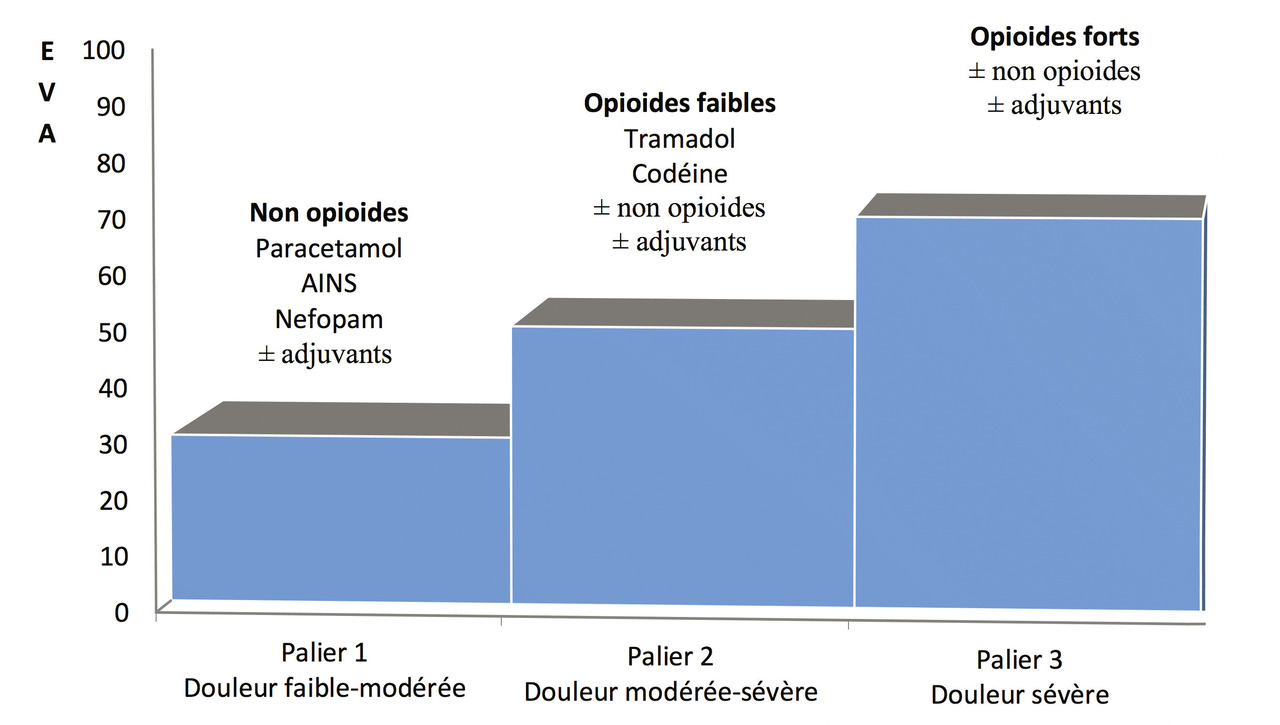
Thérapies médicamenteuses : paliers OMS
Palier I
Paracétamol
Pharmacodynamie : analgésique central et antipyrétique.Indications : traitement symptomatique des douleurs légères à modérées et/ou des états fébriles. Prescription et utilisation très larges, car bon rapport efficacité-tolérance. Analgésique de choix chez la femme enceinte.
Pharmacocinétique : délai d’action 30 min-1 h, durée 4-6 h imposant 4 prises par jour et une anticipation de la prescription. Excellente biodisponibilité.
Posologie : adulte 1 g x 4/j, enfant 15 mg/kg x 4/j.
Effets secondaires : pratiquement inexistants aux doses thérapeutiques ; sont à signaler des inquiétudes récentes sur un risque éventuel de poussées hypertensives et quelques rares réactions d’hypersensibilité.
Contre-indications : l’insuffisance hépatocellulaire.
Surdosage : hépatotoxicité potentiellement très grave, survenant à des doses supérieures à 8-10 g (tentatives d’autolyse fréquentes). La clinique est marquée par des douleurs abdominales et des vomissements à 12 h de l’ingestion, et la biologie par une cytolyse puis une insuffisance hépatocellulaire. La courbe de Prescott (taux sanguin par rapport au temps depuis l’ingestion) est un outil précieux (traiter pour une paracétamolémie au-dessus de 100-150 mg/L à H4). Le traitement repose sur la N-acétylcystéine (NAC) [150 mg/kg en 15 min puis 50 mg/kg en 4 h puis 100 mg/kg en 16 h), le traitement symptomatique et parfois le recours à la transplantation hépatique.
L’administration prolongée, chronique, de doses légèrement supérieures à la normale, à intervalles trop rapprochés ou en cas d’altération de la fonction hépatique peut également être délétère.
Formes et présentations : nombreuses présentations commerciales du produit seul (Doliprane, Efferalgan, Dafalgan, Perfalgan) ou en association (codéine, tramadol) par voie IV (intraveineuse), rectale ou PO.
Anti-inflammatoires non stéroïdiens (AINS)
Il s’agit de l’une des classes de médicaments les plus prescrites de la pharmacopée, surtout pour leur effet analgésique et anti-inflammatoire.Classification : (
Pharmacodynamie : (
Effet analgésique (doses modérées), antipyrétique et anti-inflammatoire (doses plus fortes).
Sous l’influence de la phospholipase A2, les phospholipides membranaires sont transformés en acide arachidonique. À son tour, celui-ci donnera naissance aux prostaglandines (Pg) [la prostacycline et le thromboxane], sous l’influence des cyclo-oxygénases COX-1 (constitutive) et COX-2 (inductible). Les AINS, y compris l’aspirine, inhibent la cyclo-oxygénase.
Les deux isoformes de la COX permettant la synthèse préférentielle de Pg aux propriétés différentes, leur rôle physiologique concerne :
- la COX-1 : la protection de la muqueuse gastroduodénale et l’agrégation plaquettaire (effet proagrégant) ;
- la COX-2 : la réaction inflammatoire et l’agrégation plaquettaire (effet antiagrégant) ;
- la COX-1 et la COX-2 : la régulation de l’hémodynamique intra-rénale donc le maintien de la perfusion glomérulaire.
- une action préférentielle sur la COX-1 entraîne un effet antiagrégant, augmente l’acidité gastrique, accroît le risque de complication au niveau du tube digestif ;
- une action préférentielle sur la COX-2 : augmente le risque de complication cardiovasculaire ;
- les deux peuvent induire un problème rénal.
Les AINS ont une courbe dose-effet avec un plateau précoce pour leur effet analgésique, qui est obtenu pour de faibles doses. L’effet anti-inflammatoire nécessite souvent des doses plus élevées.
Indications : elles varient selon les molécules : douleurs ostéo-articulaires, traumatiques, postopératoires, néoplasiques ; colique néphrétique ; dysménorrhée essentielle, migraines, etc.
Formes et présentations : les AINS sont administrés par voie systémique (per os, injectable intramusculaire [IM] et IV, rectale) et locale (pommades, gels). La biodisponibilité est très bonne. Compte tenu de leurs effets secondaires, la voie injectable doit être réservée à des situations cliniques particulières sans dépasser 24-48 h.
Effets indésirables : ils sont nombreux et potentiellement graves, et découlent de leur mécanisme d’action (v. ci-dessus).
Effets indésirables digestifs :
Manifestations : les problèmes peuvent aller de symptômes mineurs (gastralgies, douleurs abdominales, nausées) aux effets indésirables graves, au niveau gastroduodénal (ulcère, perforation digestive, hémorragie digestive, œsophagite, aggravation d’une diverticulose, ano-rectite).
Évaluation du risque digestif : les facteurs favorisants de complications digestives sous AINS sont :
- l’âge > 65 ans ;
- les antécédents d’ulcère ou d’hémorragie digestive ;
- l’infection à Helicobacter pylori ;
- les comorbidités sévères (cardiovasculaires) ;
- les maladies inflammatoires du tube digestif ;
- le type et la dose d’AINS ;
- la coprescription avec : autres AINS, antiagrégants plaquettaires, anticoagulants, corticoïdes, antidépresseurs IRSS.
Effets secondaires rénaux :
Manifestations : les AINS peuvent induire une insuffisance rénale (par inhibition de la synthèse des Pg), une rétention hydrosodée, une hyperkaliémie, une néphropathie interstitielle, un syndrome néphrotique.
Facteurs de risque rénal : hypovolémie, insuffisance rénale préexistante, insuffisance cardiaque, âge.
Recommandations : limiter leur utilisation.
Effets indésirables cardiovasculaires :
Manifestations : rétention hydrosodée, hypertension artérielle (surtout étoricoxib), faible augmentation du risque thrombotique artériel (surtout le diclofénac).
Facteurs de risque : hypertension artérielle (HTA), accident vasculaire cérébral (AVC), artériopathie obstructive des membres inférieurs (AOMI), etc.
Recommandations : éviter les coxibs et le diclofénac, surtout en cas d’antécédent cardiovasculaire récent.
Complications infectieuses :
Manifestations : infections sévères cutanéomuqueuses (dermohypodermites), pleuropulmonaires, neurologiques, oto-rhino-laryngées (ORL), surtout à streptocoque.
Facteurs de risque : la varicelle.
Recommandations : limiter l’utilisation (3 jours si fièvre, 5 jours en cas de douleurs).
Effets secondaires respiratoires : rhinites, conjonctivites, œdème de Quincke, crises d’asthme (comme l’aspirine), surtout si terrain allergique.
Effets cutanéomuqueux : pour les topiques : allergie, brûlures, photosensibilisation, coloration cutanée, et pour les systémiques effets divers.
Autres effets indésirables : hématologiques, hépatiques, neurosensoriels.
Recommandations générales :
- utiliser les AINS à la dose minimale efficace, pendant la durée la plus courte possible ;
- en cas de douleur chronique, réévaluer régulièrement la nécessité et l’efficacité du traitement par AINS, qui n’est que symptomatique ;
- ne pas associer deux AINS.
- interactions médicamenteuses déconseillées : autres AINS ou aspirine, anticoagulants, antiagrégants plaquettaires, diurétiques, inhibiteurs de l’enzyme de conversion [IEC], sartans, lithium, corticoïdes, antidépresseurs IRSS.
- recommandations chez le sujet âgé : prendre en compte le risque accru d’effets indésirables graves du fait des comorbidités fréquentes, de la polymédication et du terrain fragilisé ;
- femme enceinte : les AINS (y compris l’aspirine à fortes doses, > 100 mg/j), induisent chez le fœtus une constriction du canal artériel et une insuffisance rénale fœtale, même en cas de prise ponctuelle. Ils sont donc tous formellement contre-indiqués après 24 semaines d’aménorrhée. Les COX-2 sont contre-indiqués tout le long de la grossesse.
Acide acétylsalycilique
L’aspirine fait partie de la même classe que les AINS et possède les mêmes effets (antalgique, antipyrétique, anti-inflammatoire et antiagrégant plaquettaire) par action irréversible sur la COX-1.Utilisation :
- faibles doses (75 à 300 mg/j), à visée antiagrégante :
. possible chez la femme enceinte (prévention de la pré-éclampsie et prévention des fausses couches dans les SAPL) ;
- fortes doses (1 à 4 g/j) : à visée antalgique et anti-inflammatoire, utilisation restreinte, possible en l'absence de contre-indications.
Les contre-indications d’utilisation et d’association avec d’autres produits en découlent.
Néfopam
Le néfopam (Acupan) est un analgésique central puissant, non morphinique, classé dans les produits de palier I mais d’une puissance voisine des produits de palier II.Pharmacodynamie : il appartient à la famille des benzoxazocines et agit au niveau central par inhibition de la recapture de la dopamine, de la sérotonine et de la noradrénaline au niveau des synaptosomes ; il présente aussi un effet anticholinergique, anti-frisson et antihyperalgésique.
Pharmacocinétique : l’AMM concerne son utilisation par voie IV ou IM, 20 mg toutes les 4-6 h, l’intensité des effets secondaires étant liée à la vitesse d’administration du produit. La biodisponibilité permettrait son administration per os (hors AMM) souvent sur un sucre car le produit a un goût très amer.
Effets secondaires : ils sont nombreux, certains en rapport avec son activité anticholinergique (sueurs, tachycardie nausées, convulsions, rétention urinaire).
Contre-indications : elles découlent de l’effet atropinique (convulsions, glaucome, troubles du rythme et coronaropathie instable, adénome de la prostate).
Palier II (opioïdes faibles)
Codéine
Pharmacodynamie : opioïde, agoniste morphinique pur, de faible puissance (environ 1/6e par rapport à la morphine), analgésique et antitussif, agissant par l’intermédiaire la morphine qui est son métabolite.Effets indésirables : somnolence, dépression respiratoire.
Pharmacocinétique : variable selon la pharmacogénétique, (métaboliseurs ultra-rapides, rapides et lents). Les métaboliseurs ultrarapides risquent des effets secondaires importants, jusqu’au décès (d’où la contre-indication chez l’enfant). Chez les métaboliseurs lents l’effet sera moindre ou retardé. L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a publié en 2013 une série de mesures restrictives d’utilisation de la codéine (contre-indiquée en dessous de 12 ans, en certaines situations postopératoires, chez la femme enceinte ou allaitante, et jamais en première intention en général).
Formes, posologie, mode d’administration : en association avec le paracétamol (20-50 mg de codéine pour 300-500 mg de paracétamol, 3-4 fois par jour), ou seule sous forme de dihydrocodéine (Dicodin).
Tramadol
Pharmacodynamie : action mixte, agoniste morphinique faible (action sur les récepteurs µ) mais agit aussi par inhibition de la recapture de la sérotonine et de la noradrénaline.Pharmacocinétique : bonne biodisponibilité.
Effets secondaires : fréquents, liés en partie aux effets morphiniques (nausées, somnolence) et en partie à son activité monoaminergique (sécheresse buccale, vertiges, douleurs abdominales, convulsions). Il donne peu de dépression respiratoire.
Posologie et mode d’administration : multiples formes galéniques, voie IV ou per os, formes LI ou LP, seul ou en association (avec le paracétamol), dose maximale quotidienne de 400 mg/j.
C’est un produit efficace, l’un des rares antalgiques de palier II disponibles sur le marché, dont l’utilisation est malheureusement limitée par ses nombreux effets indésirables.
Opium
La poudre d’opium est commercialisée en association avec le paracétamol (Izalgi) ou avec le paracétamol et la caféine (Lamaline).Palier III (opioïdes forts)
Pharmacodynamie : les morphiniques agissent au niveau spinal, supra-spinal et en périphérie par l’intermédiaire des récepteurs morphiniques (µ, k, γ et OLR – opioid like receptor), chaque récepteur ayant des ligands spécifiques endogènes (opioïdes endogènes). Selon la spécificité de chaque récepteur et du degré d’affinité de chaque molécule pour ceux-ci, les effets varient d’un produit à l’autre. Ils sont ainsi classés en plusieurs groupes (tableau 5).
Il existe d’autres opioïdes puissants réservés à l’usage de l’anesthésie (rémifentanil, alfentanil).
Actions principales
Actions sur le système nerveux central :- antalgique : augmentation de tous les seuils nociceptifs ;
- psychomotrice : sédation (action classique) rarement agitation (patient âgé) ;
- psychoaffective : euphorie/dysphorie ;
- altération du niveau de la vigilance, confusion ;
- dépression respiratoire : dose dépendante, par perte de sensibilité au CO2, influencée par l’âge (nouveau-né, vieillard), diminuée par la douleur ;
- rigidité thoracique : histamino-libération (muscle lisse), ;
- bronchoconstriction ;
- dépression de la toux.
- bradycardie sinusale modérée, vasodilatation par histamino- libération, peu/pas de dépression myocardique ;
- nausées et vomissements (20-60 %) :
. action périphérique : retard à la vidange gastrique ;
- constipation :
. atonie des fibres longitudinales ;
. action biliaire : constriction du sphincter d’Oddi ;
- action sur l’appareil urinaire : rétention d’urines ;
- action sur l’œil : myosis ;
- histamino-libération : flush ;
- action cutanée : prurit.
Pharmacocinétique
Les propriétés physico-chimiques déterminent la diffusion dans le système nerveux central (passage de la barrière hémato-encéphalique). La fraction diffusible (fraction libre, non ionisée, non liée aux protéines) dépend du degré de fixation aux protéines plasmatiques et du pKa. La diffusion de la fraction libre dépend de la liposolubilité et du volume du compartiment central. Ces particularités ainsi que les phénomènes de diffusion-rediffusion expliquent les spécificités de classe et de chaque produit. Le métabolisme se fait par glucurono-conjugaison, avec des métabolites actifs (M6G) ou inactifs (M3G), et l’élimination est urinaire (possible surdosage en cas d’insuffisance rénale).Formes galéniques
Ce sont les formes :- orale : LI et LP ;
- injectable : SC et IV ;
- transdermique (fentanyl) ;
- transmuqueuse (fentanyl, sufentanil).
Produits
La morphine existe sous forme de chlorhydrate (IM, SC, IV et administration péri-médullaire), ou sulfate (forme orale, LI et LP). C’est l’opioïde de première intention dans les douleurs aiguës et chroniques, cancéreuses et non cancéreuses ; elle est largement disponible, il n’y a pas d’effet plafond en pratique habituelle, la demi-vie d’élimination est courte, elle a l’autorisation de mise sur le marché (AMM) en pédiatrie. La voie orale est la voie de référence car elle est simple, non invasive, facile à adapter, facile à titrer, et bénéficie de formes galéniques adaptées.L’oxycodone, agoniste semi-synthétique, est plus puissante que la morphine et a une bonne disponibilité. Utilisée surtout dans la douleur cancéreuse, elle a aussi un intérêt dans la douleur neuropathique. Elle est adaptée aux patients présentant une insuffisance rénale. Elle existe sous forme orale (LI et LP), mais aussi IV.
L’hydromorphone est un agoniste pur, sous forme LP, de durée d’action plus courte que la morphine.
Le fentanyl est un produit liposoluble, puissant, ce qui explique la possibilité d’utilisation par voie transdermique et transmuqueuse.
La forme transdermique classique (Durogésic) a une durée d’installation d’environ 12 h et une durée d’action de 72 h. Il existe aussi un système d’auto-administration transdermique du fentanyl par iontophorèse (Ionsys).
La forme transmuqueuse du fentanyl est indiquée dans les accès douloureux paroxystiques du cancer pour des patients ayant déjà un traitement de fond, grâce à son effet d’installation rapide (pas de premier passage hépatique). Il est commercialisé sous de nombreuses formes d’administration (buccale, sublinguale, gingivale, nasale, orodispersible).
Le sufentanil est disponible en IV, réservé à l’usage de l’anesthésie et à quelques rares cas de douleurs cancéreuses réfractaires. La voie sous-linguale (SL) est proposée depuis peu pour le postopératoire (dispositif d’analgésie contrôlée par le patient : Zalviso).
La méthadone, agoniste réservé au traitement substitutif des phénomènes de dépendance, peut avoir un certain intérêt dans les douleurs rebelles, en cas d’échec des autres molécules.
La buprénorphine, agoniste partiel, n’est plus utilisée pour ses propriétés antalgiques, mais seulement per os à visée substitutive (indication dans la toxicomanie).
La nalbuphine, agoniste antagoniste, est encore utilisée malgré son effet plafond, à visée antalgique, en postopératoire (pédiatrie) et dans la dystocie de démarrage du travail obstétrical. Compte tenu de son effet différentiel sur les récepteurs (activation k, blocage µ), son action antagoniste est mise à profit pour combattre les effets indésirables des agonistes µ purs (rétention d’urines, prurit).
La naloxone, antagoniste pur, est utilisée dans le traitement des surdosages. Ses formes galéniques :
- injectable IV, classique (Narcan) ;
- spray nasal (Nalscue) (kit prêt à l’emploi) ;
- forme IM (Prenoxad) (kit prêt à l’emploi).
Principes de traitement
Les morphiniques sont utilisés selon le schéma de l’OMS, en palier III, pour des douleurs d’intensité modérée à forte, d’emblée ou en cas d’échec des paliers précédents. La morphine reste le produit de 1re intention. La voie orale est toujours privilégiée. La voie parentérale peut être parfois nécessaire (contexte d’urgence, péri-opératoire, etc.). Les doses sont instaurées par une titration initiale (administration d’une quantité fractionnée de morphine jusqu'à l’obtention d’un soulagement jugé satisfaisant par le patient) et réajustées par auto-/hétéro-évaluation permanente. Selon le degré d’urgence et le contexte, la titration est réalisée par voie IV ou PO. Pour les formes orales, la titration initiale et les réajustements ultérieurs se font souvent par des formes immédiates seules puis par des produits LP avec des interdoses LI. Une interdose LI doit correspondre à 10 % de la dose journalière LP. Il n’y a pas de limite supérieure tant que les effets secondaires sont contrôlés. La prescription doit être rédigée sur une ordonnance sécurisée et la prescription/la délivrance sont limitées à 7, 14 ou 28 jours selon les produits.Indications
Douleurs aiguës : toutes les formes de douleurs intenses, d’emblée ou celles ne répondant pas aux produits palier II, traumatiques, viscérales, postopératoires, acutisations de douleurs chroniques, douleurs induites par les soins, etc.Douleurs chroniques :
- douleurs chroniques cancéreuses : les morphiniques représentent le traitement privilégié de la douleur cancéreuse, toutes les molécules peuvent y trouver une indication ;
- douleurs chroniques non cancéreuses : les opioïdes forts ont prouvé leur efficacité dans la douleur arthrosique des membres inférieurs, les lombalgies réfractaires et les douleurs neuropathiques. Ils doivent être introduits seulement après échec des autres thérapeutiques et dans le cadre d’une prise en charge multidisciplinaire, globale. Le traitement doit comporter les plus faibles doses pour la durée la plus courte possible.
Prise en charge des effets indésirables
La constipation est très fréquente et nécessite un traitement laxatif classique systématique, en même temps que la prescription de l’opioïde. De nouvelles molécules, dérivées des antagonistes morphiniques, avec un effet spécifique sur le tractus digestif par les récepteurs µ périphériques, peuvent être utilisées en 2e intention : le naloxégol (Moventig), qui est un dérivé PEGylé de la naloxone, et la méthylnaltrexone (Relistor).Les nausées et les vomissements doivent être systématiquement traités en préventif (dans l’administration courte et en début d’administration prolongée) et en curatif au besoin. Les molécules utilisées sont les neuroleptiques (métoclopramide, dropéridol), les corticoïdes, les antagonistes 5-HT3.
La sédation et la dépression respiratoire sont des effets potentiellement graves, qu’il convient d’identifier et de surveiller. Leur apparition doit entraîner l’arrêt de l’administration/la baisse des doses et au besoin un antidote (naloxone).
Surdosage en opioïdes
Le surdosage se traduit par une somnolence et une diminution de la fréquence respiratoire < 10. Le traitement comprend l’arrêt de l’administration, l’O2, les mesures de réanimation adaptées et la naloxone en titration. Depuis peu sont disponibles les formes nasales et IM de naloxone prêtes à l’emploi avec des modalités de délivrance élargies.Hyperalgésie induite par les opioïdes
Il s’agit d’un état de sensibilisation nociceptive engendré par l’exposition aux opiacés. Cette condition est caractérisée par une réponse paradoxale (abaissement du seuil douloureux). La kétamine pourrait prévenir ce phénomène.Mésusage
Définitions :- tolérance (accoutumance) : nécessité d’augmentation des doses pour l’obtention du même effet ;
- dépendance physique : syndrome de sevrage à l’arrêt brutal des morphiniques, avec un cortège de manifestations (larmoiements, rhinorrhée, sueurs, tachycardie, crampes abdominales, nausées, diarrhée, déshydratation, acidose, agitation, torpeur) ;
- dépendance psychologique (addiction, assuétude) : état de besoin ou de compulsion qui presse le sujet à répéter l’administration (pour les effets psychiques ou pour éviter les phénomènes de sevrage), par une envie irrépressible de consommer, en dehors de la recherche d’un effet antalgique, et malgré les conséquences délétères ;
- mésusage : non-respect de la prescription faite par le médecin.
Le ministère de la Santé vient de publier une « feuille de route 2019-2022 : prévenir et agir face aux surdoses d’opioïdes », qui comporte 5 objectifs :
- améliorer les pratiques professionnelles ;
- assurer une diffusion large de la naloxone prête à l’emploi ;
- impliquer les usagers et leur entourage ;
- mettre en réseau l’ensemble des acteurs au niveau territorial et favoriser les actions coordonnées de proximité ;
- renforcer le système de vigilance, d’alerte et de réponse.
Rotation des opioïdes
La rotation des opioïdes se définit par le changement d’un opioïde par un autre et se justifie lorsqu’il survient une diminution du ratio bénéfice-risque.Quelques situations pouvant nécessiter une rotation ::
- la survenue d’effets indésirables rebelles (troubles des fonctions cognitives, hallucinations, myoclonies, nausées) ;
- l’insuffisance d’analgésie ;
- les besoins liés à la qualité de vie (galénique) ;
- la résistance aux opioïdes (absence d’efficacité de l’opioïde associée à une absence d’effet indésirable malgré une augmentation massive et rapide des doses).
Déroulement pratique du processus :
- informer le patient sur les bénéfices et les risques attendus de la rotation ;
- évaluer la dose journalière de l’opioïde A ;
- calculer la dose journalière théorique de l’opioïde B en utilisant le tableau d’équi-analgésie (
tableau 7 ) ;
- prescrire systématiquement des réserves d’un opioïde à LI en complément jusqu’à la fin de la titration de l’opioïde B ;
- surveiller la survenue de symptômes de surdosage (nausées, somnolence) ou de sevrage (diarrhées, douleurs diffuses, irritabilité) ;
- réévaluer l’intensité de la douleur pour des ajustements de la dose totale quotidienne (par une augmentation ou une diminution de15 à 30 %).
Thérapies médicamenteuses : hors paliers OMS
Antidépresseurs
Propriétés
Ils sont thymo-analeptiques, anxiolytiques, sédatifs et antalgiques. Il existe un effet antalgique propre des antidépresseurs, indépendant de leur effet sur l’humeur, différent d’une classe à l’autre.Mécanisme d’action
Ils agissent au niveau spinal et supra-spinal, par une activation/renforcement des contrôles inhibiteurs et au niveau périphérique par inhibition des canaux sodiques.Classes, produits et utilisation
AD3 : antidépresseurs tricycliques (amitriptyline, clomipramine). Ils sont indiqués dans les douleurs neuropathiques et en prévention des migraines et des céphalées de tension. Ils peuvent être également utilisés dans la lombalgie chronique et dans la fibromyalgie. Ils ont beaucoup d’effets indésirables en raison de leur action anticholinergique (hypotension, sècheresse buccale, sédation).IRSN : inhibiteurs de la recapture de la sérotonine et de la noradrénaline. Il existe 2 sous-types selon l’affinité préférentielle :
- pour la sérotonine :
. la duloxétine (utilisée dans la polyneuropathie diabétique et dans la fibromyalgie) ;
- pour la noradrénaline :
IRSS : inhibiteurs spécifiques de la recapture de la sérotonine (fluoxétine, citalopram, paroxétine) :
- leur effet antalgique propre est faible, ils sont utilisés comme adjuvants pour leur action thymique ;
- effet indésirable grave : le syndrome sérotoninergique.
Antiépileptiques
Antiépileptiques de première génération
La carbamazépine agit au niveau des canaux sodiques membranaires. Elle représente le traitement de référence de la névralgie du trijumeau et a également une place dans d’autres types de douleurs neuropathiques, en cas d’échec des autres molécules.Le clonazépam appartient aux benzodiazépines. Il est de moins en moins utilisé comme antalgique en raison de son absence d’efficacité. Sa prescription est soumise à des règles strictes.
Antiépileptiques de deuxième génération
Les gabapentinoïdes (gabapentine et prégabaline) représentent le traitement de référence et de première intention des douleurs neuropathiques. Ils agissent au niveau des canaux calciques, en se liant aux sous-unités α2-δ. Ils ont un léger effet anxiolytique/sédatif associé. Les effets secondaires (sédation, ataxie, vertiges, prise de poids) peuvent être réduits par la titration et l’augmentation progressive des doses.D’autres antiépileptiques de deuxième génération (lamotrigine, oxcarbazépine, topiramate et lévatiracétam) ont une efficacité discutable, ils peuvent être utilisés dans la douleur neuropathique en deuxième intention.
Anesthésiques locaux
Il existe deux classes : les esters et les amides.
Ils ont leur place dans la prise en charge de la douleur sous plusieurs formes et modalités :
- applications locales : gels, sprays (surtout lidocaïne) sur la peau et sur les muqueuses ;
- produits spécifiques en applications locales :
. le Versatis, emplâtre de lidocaïne, employé dans la douleur neuropathique localisée (postzostérienne) ;
- techniques d’infiltration : superficielles (loco dolenti) ou profondes, ciblées ;
- techniques d’anesthésie locorégionale, réservées au cadre de l’anesthésie ou apparenté ;
- administration intraveineuse, réservée au cadre très strict de la lidocaïne administrée en péri-opératoire et postopératoire sur une période brève (48 h) dans la chirurgie majeure abdomino-pelvienne et rachidienne. Effet discutable dans certaines douleurs chroniques neuropathiques
Capsaïcine
Elle est utilisée soit à faibles doses, en applications topiques répétées, l’effet étant modeste, soit à fortes concentrations, sous forme d’emplâtre (Qutenza), en applications répétitives (une heure par application, une fois tous les 2-3 mois), sous surveillance rapprochée pendant l’application en raison de ses effets secondaires, avec un effet notable dans la douleur neuropathique périphérique localisée.
Kétamine
À fortes doses (2 mg/kg), elle a un effet anesthésique et analgésique intense. À faibles doses (0,15 mg/kg), administrée en péri-opératoire, elle a une action analgésique propre, sans effet indésirable majeur, prouvé par la diminution de la consommation de morphine en postopératoire.
Elle peut avoir un intérêt également dans la prévention de la chronicisation des douleurs postopératoires, dans certaines douleurs chroniques rebelles (postzostériennes, membre fantôme, algodystrophie) et dans les phénomènes d’hyperalgésie.
Corticoïdes
Indications des corticoïdes par voie générale dans le cadre de la douleur :
- certaines douleurs liées à des pathologies inflammatoires non infectieuses (sciatique, névralgie cervicobrachiale, pathologies rhumatismales) : utilisation large malgré la pauvreté des preuves, modalités mal définies ;
- certaines douleurs cancéreuses (compression médullaire, œdème péri-tumoral, cancers hématologiques) ;
- utilisation peropératoire : surtout pour diminuer les nausées et les vomissements et comme adjuvants pour les techniques d’analgésie/anesthésie locorégionale périphérique ; il semble exister aussi un discret effet propre sur la douleur postopératoire.
Biphosphonates
Agonistes α2
Clonidine
C’est un agoniste α2 qui intervient au niveau de la corne postérieure dont les effets principaux sont sédatifs et sympatholytiques (hypotension, bradycardie). Elle a un effet analgésique et antihyperalgésique propre, mais son utilisation pratique est limitée par ses actions principales. Elle peut être administrée sous surveillance stricte dans un cadre péri-opératoire, à très faibles doses, dans un but d’épargne morphinique, comme adjuvant des anesthésiques locaux en anesthésie locorégionale, ou en réanimation à visée sédative et analgésique. Son utilisation est de plus en plus limitée.Dexmédétomidine
C’est est un agoniste α2 très sélectif avec un rapport de sélectivité α2/α1 beaucoup plus élevé que celui de la clonidine. Elle a un effet sédatif et antalgique sans effet dépresseur respiratoire. Son utilisation est limitée à la sédation et comme adjuvant analgésique en réanimation. Elle est administrée en IV continue en accord avec sa pharmacocinétique.Analgésiques inhalatoires
Protoxyde d’azote (N2O)
Connu depuis plusieurs siècles (gaz hilarant), c’est un gaz inodore et incolore avec des propriétés analgésiques et anti-hyperalgésiques (agissant par le biais des opioïdes endogènes et des voies inhibitrices descendantes), légèrement anxiolytiques et sédatives.Il a une pharmacocinétique de type on-off, d’installation très rapide (3-5 min) et une durée d’action équivalente, une diffusion pulmonaire et un tropisme pour les cavités.
Il s’utilise mélangé à l’O2, en normoxie, sous surveillance, en veillant au respect des règles de bon usage et de sécurité d’emploi ; son utilisation est aisée et il n’a pas d’effet secondaire majeur.
Il est employé sous forme de mélange équimolaire d’oxygène et de protoxyde d’azote (MEOPA) pour des douleurs aiguës et des gestes douloureux brefs.
Méthoxyflurane (Penthrox)
Il s’agit d’un anesthésique halogéné ayant des propriétés antalgiques à faible concentration. Il est indiqué dans le soulagement en urgence des douleurs modérées à sévères associées à un traumatisme chez des patients adultes conscients. Il se présente sous forme liquide pour l’(auto-)administration avec un inhalateur.Son utilisation est limitée aux services d'accueil des urgences, SAMU et SMUR.
Cannabinoïdes
Les principaux produits actifs sont le Δ-9 tétrahydrocannabinol (Δ-9 THC) et le cannabidiol.
Leur effet antalgique est probablement limité.
Ils n’ont pas d’AMM dans la douleur mais peuvent avoir une autorisation temporaire d’utilisation (ATU) dans les douleurs cancéreuses et autres douleurs rebelles.
Toxine botuli(ni)que
Indications :
- les dystonies douloureuses cervicales (torticolis chronique) ;
- les épicondylites latérales chroniques (syndrome douloureux latéral du coude) ;
- certaines douleurs neuropathiques localisées.
Ziconotide
D’autres molécules sont à l’étude : les anticytokines, les inhibiteurs de l’activation gliale, l’anti-TNFα (étanercept), les anti-NGF.
Thérapies non médicamenteuses
Techniques de neurostimulation
Techniques non invasives :
- la neurostimulation électrique transcutanée (TENS) : technique facile, apprentissage aisé de l’auto-utilisation, indiquée dans l’insuffisance et/ou l’inadéquation des traitements médicamenteux, surtout en cas de douleur neuropathique ;
- la stimulation magnétique transcrânienne répétitive (rTMS) : basée sur le principe du courant électrique induit par une bobine magnétique, utilisée initialement en psychiatrie dans un objectif d’obtenir les bénéfices de la sismothérapie sans les effets secondaires. Elle est employée pour les douleurs neuropathiques centrales réfractaires comme test prédictif pré-implantatoire avant la stimulation corticale ou dans des pathologies douloureuses complexes nécessitant une prise en charge multidisciplinaire.
Techniques invasives
Utilisées seulement pour des douleurs rebelles, en cas d’échec du traitement pluridisciplinaire traditionnel bien conduit :- la stimulation médullaire : pour les douleurs neuropathiques rebelles ;
- la stimulation des nerfs périphériques : utilisation limitée ;
- la stimulation du cortex moteur : utilisée dans les douleurs neuropathiques centrales rebelles ;
- la stimulation cérébrale profonde : si échec des autres techniques.
Thérapies « physiques »
Les appareillages sont utiles dans les douleurs d’origine mécanique ou inflammatoire, selon leur objectif: immobilisation (plâtres, orthèses, strapping, ceintures), aide au mouvement/à l’appui (cannes, semelles), prothèses (de membre amputé), etc.
La physiothérapie est définie par l’utilisation d’agents physiques dans la pratique kinésithérapeutique :
- électrothérapie (dont la TENS) ;
- vibrations mécaniques (ultrasons, infrasons, ondes de choc-tendinites) ;
- courants de haute fréquence ;
- bio-feed-back ;
- thermothérapie (chaleur), fangothérapie (boue), parafangothérapie (paraffine) et froid (cryothérapie) ;
- hydrothérapie/balnéothérapie.
Thérapeutiques à visée psychologique
La psychothérapie comprend la prise en charge par un psychiatre et/ou un psychologue dans le cadre d’équipes pluridisciplinaires.
Les thérapies cognitives et comportementales (TCC) sont basées sur les théories de l’apprentissage. La douleur chronique est souvent associée à des cognitions erronées et à des craintes induisant des comportements inappropriés. C’est un ensemble d’outils et de stratégies dans un objectif d’adaptation/faire face à la douleur (« coping »), avec deux volets : cognitif (reformulation des croyances) et comportemental (réajustement des comportements).
L’hypnothérapie comprend un ensemble de techniques qui induisent un état modifié de conscience, dont le bénéfice a été prouvé dans de nombreuses situations douloureuses, aiguës ou chroniques.
La relaxation vise l’obtention d’une détente musculaire et mentale.
La sophrologie est une autre méthode de relaxation.
Les techniques de méditation et de pleine conscience sont basées sur des notions comme l’acceptation et l’engagement.
Thérapies complémentaires
L’acupuncture appartient à la médecine traditionnelle chinoise, elle est basée sur le concept millénaire de l’équilibre entre deux entités énergétiques : le yin et le yang. Les approches scientifiques modernes essayent d’expliquer cette discipline par l’existence d’une densité supranormale de structures nerveuses au niveau des points d’acupuncture ou sur les trajets des méridiens et tentent de découvrir des corrélations entre les formations anatomiques classiques et ces systèmes.
La réflexologie et l’auriculothérapie s’y apparentent et sont basées sur le principe de la somatotopie.
L’ostéopathie se définit comme une médecine manuelle holistique, fondée sur le concept d’interdépendance anatomie-fonction et de la globalité de l’être humain. S’en rapprochent la chiropraxie et les manipulations rachidiennes.
L’homéopathie est une pratique pseudo-scientifique de médecine alternative, basée sur la croyance dans la possibilité de soigner un patient en diluant très fortement des substances qui, si elles étaient concentrées, provoqueraient des symptômes similaires à ceux qu’il rencontre. Cette pratique est considérée inefficace (son effet thérapeutique n’est pas supérieur au placebo) et son utilisation est discutable. Elle ne sera plus remboursée.
Le tai chi et le qi gong sont des exercices physiques complexes, pratiqués régulièrement, couplés à des éléments de contrôle psychique, émotionnel et spirituel (discipline « corps-esprit »), qui associent relaxation, respiration maîtrisée et profonde et postures définies enchaînées l’une à l’autre par des mouvements lents et harmonieux.
Traitement placebo
L’effet placebo est l’effet thérapeutique non spécifique, produit par la prescription de toute substance ou thérapie, plus largement par toute relation thérapeutique.
L’effet nocebo est l’effet indésirable lié au placebo (latin nocere, « déplaire »).
L’effet placebo a certainement une place dans le paysage des traitements antalgiques.
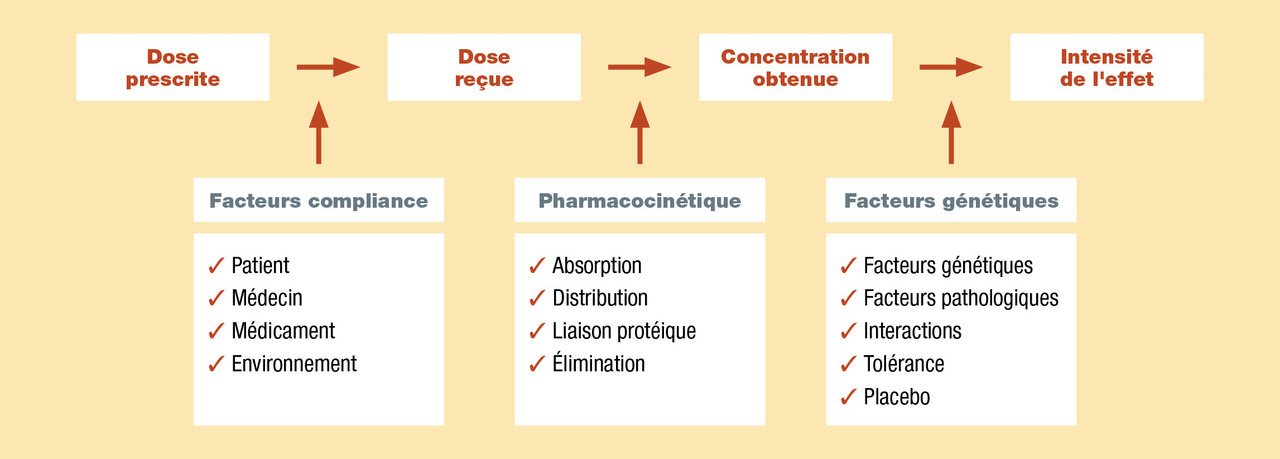
Efficacité d’un traitement antalgique et adaptation en fonction de l’évaluation
Efficacité
- pharmacocinétiques ;
- pharmacodynamiques (la puissance, l’efficacité maximale, la courbe concentration-effet, la variabilité individuelle) ;
- liés au patient (âge, sexe, morbidités associées, etc.).
Tolérance (tolérabilité)
En pharmacologie, un effet secondaire (latéral) est un effet survenant en plus de l’effet primaire (ou principal) désiré lors de l’application d’un traitement, pour une indication donnée. Un effet secondaire peut être désirable, indésirable, ou neutre.
Selon l’OMS, un effet indésirable est une réaction nocive et non voulue, se produisant aux posologies normalement utilisées chez l’homme pour la prophylaxie, le diagnostic ou le traitement d’une maladie ou la modification d’une fonction physiologique.
D’un point de vue objectif les effets indésirables s’identifient selon le mécanisme, la prévisibilité, la fréquence d’apparition et le degré de gravité.
D’un point de vue subjectif prime le ressenti du patient entre les bénéfices apportés par les médicaments et les effets secondaires.
Quelques exemples d’effets secondaires ou indésirables avec les antalgiques :
- prévisibles et fréquents (la constipation liée aux morphiniques, traitement prophylactique et/ou curatif) ;
- évitables (les vertiges dus aux antiépileptiques, augmenter progressivement les doses) ;
- prévisibles nécessitant une surveillance (dépression respiratoire aux morphiniques, surveiller) ;
- moins prévisibles, graves (dépression respiratoire à la codéine inattendue par rapport aux doses chez les métaboliseurs ultrarapides inconnus).
Observance/compliance
L’observance concerne la manière dont un médicament prescrit est réellement pris (doses, horaires, délais, associations). Les soignants doivent aussi dépister la sous/sur/mauvaise utilisation d’un médicament et repérer les prises médicamenteuses cachées, connues ou méconnues (AINS délivrés sans prescription, co-analgésiques).
Les facteurs de mauvaise observance/compliance sont liés au patient (compréhension, crainte d’effets secondaires, etc.), au médecin (explications, temps accordé), à la prescription même (coprescriptions, trop de médicaments, horaires ne convenant pas, formes galéniques – taille du comprimé, goût, odeur, type d’administration), à la situation (ambulatoire, auto-administration ou hospitalière, administration imposée), au pharmacien, etc.
Évaluation
L’outil, le moment, la fréquence de l’évaluation dépendent du type de douleur, de l’objectif fixé, des caractéristiques du produit.
Le degré de soulagement possible (résultat obtenu par rapport à l’objectif initial) peut s’exprimer de manière quantitative (pourcentage de réduction, seuil d’acceptabilité) ou qualitative (notion de traitement équilibré). La littérature scientifique prend souvent comme seuil des chiffres entre 30 et 50 % de réduction initiale.
Le moment de l’évaluation dépend de critères pharmacocinétiques (elle doit être faite au moment du pic pharmacocinétique du produit mais aussi au moment où sa concentration est la plus basse) et de critères liés à la situation (état de base ou mobilisation/mouvement/effort/soins).
Moyens pour ajuster le traitement
- d'adapter le choix du traitement au patient ;
- d'informer le patient : le prévenir des effets secondaires possibles et des moyens de les éviter, en expliquant le rapport bénéfice-risque ;
- d'anticiper/détecter la survenue d’effets indésirables ;
- de traiter les effets secondaires (préventif/curatif) ;
- de s’assurer du maintien de l’analgésie ;
- d'ajuster le traitement (à la baisse ou à la hausse) ;
- de changer de traitement si besoin (rotation).
- l’objectif recherché vise en principe le soulagement total, rapide ;
- les échelles d’évaluation choisies sont simples, globales (EVA, EVS, EVN) ;
- le moment et la fréquence de l’évaluation dépendent de la pharmacocinétique de l’agent administré (minutes pour la titration IV, dizaines de minutes pour les formes LI données PO, heures/jours pour les formes LP) ;
- la tolérabilité concerne souvent les effets secondaires aigus, apparaissant dès les premières utilisations (par exemple nausées avec le tramadol, sueurs et vomissements avec le néfopam) ;
- l’observance est le plus souvent bonne.
- l’objectif recherché doit être établi par un « contrat » entre le patient et le soignant et doit être raisonnable, réaliste ;
- l’objectif peut être quantitatif (intensité de la douleur, fréquence des crises), qualitatif, il peut concerner la douleur même, le handicap ou la qualité de vie (impression de changement, patient global impression of change [PGIC]) ;
- l’évaluation doit être répétée en utilisant le même type d’outil le long du suivi ;
- la tolérance concerne les effets secondaires apparaissant pour des prises au long cours ;
- l’observance est souvent médiocre.
Exemples de schémas thérapeutiques
Douleur aiguë nociceptive intense, résistant aux paliers I et II de l’OMS
- voie IV : douleurs très intenses : titration (1-3 mg/5 min) relais PCA si durée prolongée prévisible ;
- voie PO : formes LI ou orodispersible : 10-20 mg /4-6 h ;
- voie SC : pharmacocinétique variable ;
- effets secondaires : somnolence, dépression respiratoire ;
- ajuster les doses/ intervalles chez le sujet âgé, insuffisant rénal.
Douleur postopératoire
- évaluation préopératoire (outil global, adapté : par exemple EVA) et décision de la stratégie en amont ;
- préhabilitation : traitement de la douleur préopératoire, équilibration des comorbidités (diabète, maladie coronarienne, hypertension artérielle), amaigrissement/renutrition, kinésithérapie.
- analgésie multimodale/balancée (association de plusieurs types de molécules et techniques analgésiques, à effet additif ou synergique, dans un objectif d’augmenter l’effet antalgique souhaité en diminuant les effets secondaires) ;
- kétamine faibles doses (0,15 µg/kg) peropératoire, pour la prévention de la chronicisation des douleurs et pour la prévention de l’hyperalgésie ;
- antalgiques de palier I (paracétamol, AINS injectable, néfopam) administration à démarrer avant la fin de l’intervention,
- antalgiques de palier II discutables en association avec les opioïdes forts, d’autant plus si associés aux anti-5HT3, plutôt à éviter ;
- place des techniques d’anesthésie/analgésie locorégionale, dose unique ou administration prolongée par cathéter :
. blocs nerveux périphériques,
. anesthésie péri médullaire (rachianesthésie et péridurale).
Période postopératoire (SSPI) :
- évaluation : outil global, simple (EN, EVS, EVA) ;
- antalgiques morphiniques pour le postopératoire : morphine : titration IV +++ en salle de surveillance postinterventionnelle et mise en place d’une PCA pour la suite (surveillance S somnolence et R respiration) ;
- poursuite des paliers I et II.
- poursuivre l’évaluation répétitive (repos/mobilisation/soins…) ;
- PCA (surveillance) ;
- poursuivre les paliers I et II ;
- anesthésiques locaux par cathéter (péridurale ou périnerveux) le cas échéant, surveillance adaptée ;
- passage rapide des formes IV aux formes PO ;
- mesures de réhabilitation (mobilisation, ablation des sondes et drains, reprise rapide de l’alimentation, etc.).
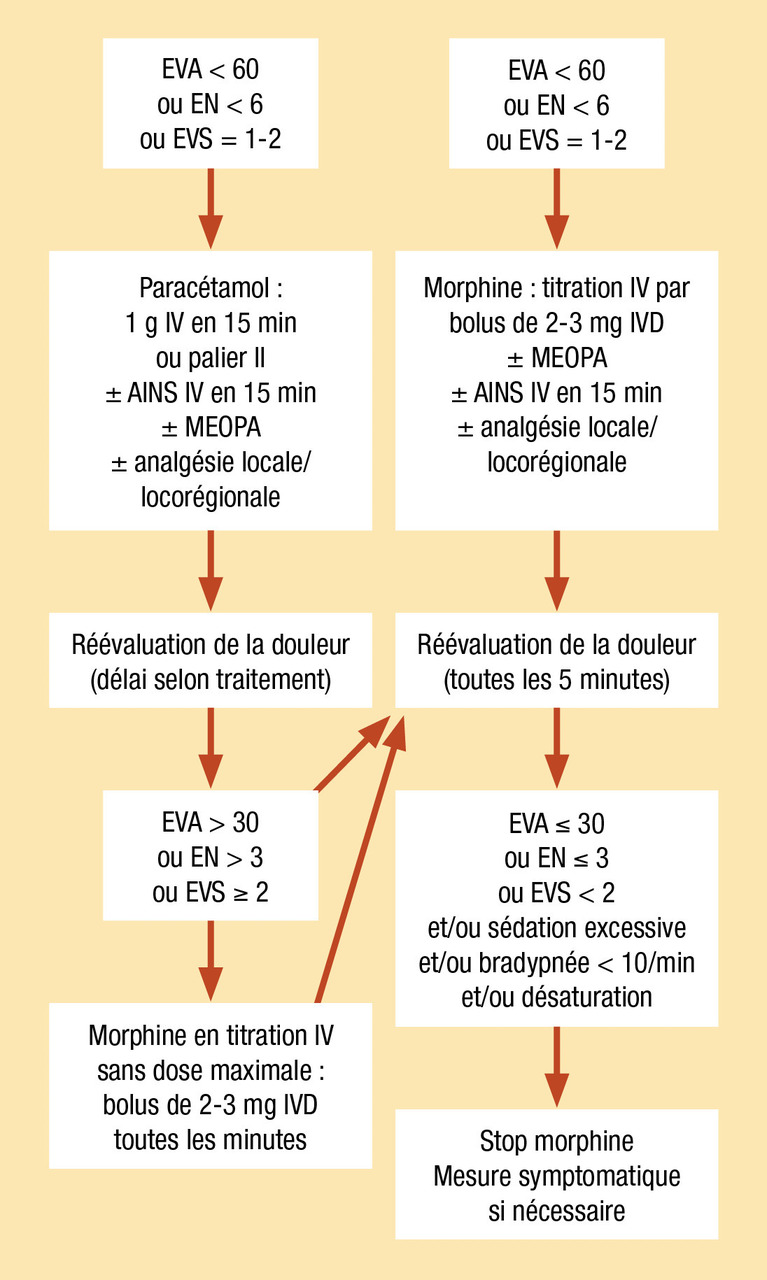
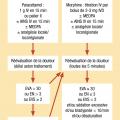
Douleur aux urgences et en préhospitalier (fig. 4)
- urgences > 70 % dont sévère > 40 % ;
- préhospitalier > 40 % dont sévère > 70 %.
Antalgique de référence pour les douleurs sévères : la morphine (titration+++)
Mesures simples : réduction fractures, immobilisation, froid.
Agents inhalatoires : N2O.
Cas particulier : sédation analgésie procédurale (sédation + analgésie modérée à profonde mais brève afin de rendre possible et supportable des actes douloureux) protocoles associant propofol/ kétamine/ parfois midazolam à la morphine
Place de l’anesthésie locorégionale (ALR) :
- bloc ilio-fascial : seul bloc réalisable sans échographe, sur des repères anatomiques ; territoire (nerf fémoral, indication : fracture du fémur) ;
- tous les autres blocs : réalisables mais sous échographie, personnel formé, respecter les précautions et les contre-indications.
- colique néphrétique simple : AINS de première intention : kétoprofène 100 mg IVL, et morphine titrée IV si échec ou contre-indication ;
- migraine : AINS ou triptan, pas de morphinique ;
- parage de plaie/suture : ALR et/ou MEOPA ;
- fracture du fémur : bloc ilio-fascial.
- reperfusion coronarienne dans l’infarctus du myocarde ;
- immobilisation d’un foyer de fracture.
Douleurs liées aux soins
- s’assurer que le geste est indispensable ;
- considérer des techniques alternatives (tubes de microprélèvements, ponction du lobe de l’oreille) ;
- prévoir du matériel adapté et du personnel formé ;
- bien informer le patient, et lui permettre le choix de la stratégie si possible ;
- prévenir la douleur ;
- tenir compte de la pharmacocinétique du produit ;
- privilégier les anesthésiques locaux, Emla (1-2 h avant), gels lidocaïne, ou en injection SC locale ; et le N2O ;
- respecter les protocoles de soins ;
- réévaluer pour l’adaptation des gestes ultérieurs.
Douleur neuropathique
- de proposer en première intention une monothérapie (amitriptyline, gabapentine, prégabaline, duloxétine).
- de changer avec une autre de ces molécules si mauvaise tolérance.
- de rajouter un palier II de l’OMS si insuffisant.
- d'envisager les traitements locaux (lidocaïne, capsaïcine) pour les zones limitées.
- en cas d’échec, d'opter pour une bithérapie parmi les molécules sus-citées et/ou opioïdes forts.
- de tester la neurostimulation électrique transcutanée (TENS).
- la prise en charge globale habituelle d’une douleur chronique.
- de discuter d'autres techniques de stimulation/invasives en cas d’échec.
Intérêt des opioïdes dans la douleur chronique non cancéreuse
- douleur : diminution modérée, 10-30/100, quelle que soit la cause ;
- fonction : effet modéré ;
- qualité de vie : faible effet sur la composante psychique, pas d’effet démontré sur la composante physique.
- les douleurs arthrosiques des membres inférieurs : après échec des paliers I et II, AINS, rééducation, traitements locaux, thérapie cognitivo-comportementale (TCC) ;
- les lombalgies chroniques réfractaires (discopathie dégénérative, spondylolisthésis, hernie discale ou canal lombaire étroit) : après échec des paliers I et II, AINS, rééducation, traitements locaux, TCC ;
- les douleurs neuropathiques périphériques ou centrales : après échec des AD3, IRSS, IRSN, antiépileptiques, traitements topiques, stimulation.
- après un diagnostic de certitude ;
- si échec du traitement ci-dessus bien conduit ;
- si non-indication chirurgicale ;
- prise en charge globale, dont prise en charge psychologique le cas échéant ;
- contrat de soins.
- la fibromyalgie ;
- la migraine et les céphalées.
- prévenir les effets indésirables fréquents (surtout digestifs) par une prescription systématique anticipée (l’arrêt du traitement est plus souvent dû aux effets indésirables qu’a l’inefficacité) ;
- évaluer le risque de mésusage (OTR, opioid risk tool) et le dépister (POMI, prescription opioid misuse index) ;
- privilégier les formes LP, ne pas utiliser le fentanyl TM à libération rapide ;
- poursuivre > 3 mois seulement si efficacité sur au moins un critère (douleur, fonction, qualité de vie) ;
- prendre l’avis d’un spécialiste si besoin.
Lombalgie et lombosciatique commune de moins de trois mois
- lombalgie = douleur de la région lombaire n’irradiant pas au-delà du pli fessier ;
- lombosciatique = douleur lombaire avec irradiation douloureuse distale dans le membre inférieur de topographie radiculaire L5 ou S1.
- éliminer une lombalgie symptomatique (traumatique, tumorale, infectieuse) ;
- éliminer une urgence :
. sciatique paralysante,
. syndrome de la queue de cheval.
Traitement :
- paliers I et II et décontracturants musculaires ;
- pas de repos au lit/ poursuite des activités habituelles compatibles avec la douleur ;
- manipulations rachidiennes pour la lombalgie ;
- possible bénéfice des infiltrations épidurales dans la lombosciatalgie ;
- pas d’efficacité des corticoïdes.
Lombalgie chronique commune
Évaluation initiale :
- éliminer une lombalgie symptomatique (inflammatoire, traumatique, tumorale, infectieuse) ;
- 3 volets : douleur, fonction, composante anxiodépressive.
– médicamenteux par voie générale :
- palier I : paracétamol ++, AINS cures courtes ;
- palier II : après ou avec palier I ;
- palier III : v. ci-dessus ;
- myorelaxants : peu de preuves ;
- AD3 : effet discutable, IRS : pas d’effet ;
- gels AINS : effet non prouvé ;
- corticoïdes :
. infiltration intra articulaire postérieure: population sélectionnée ;
– non médicamenteux :
. repos au lit : contre-indiqué/exercice physique : indiqué++ ;
. effet possiblement bénéfique (plutôt à court terme) : massages, balnéothérapie, TENS, manipulations vertébrales, thermalisme,
. ceinture lombaire : discutable (pas en première intention),
. prise en charge globale : pluridisciplinaire, école du dos, thérapies comportementales ;
- techniques invasives :
. indications chirurgicales : rares, patients sélectionnés.
Schéma proposé par l’ANAES dans la lombalgie commune, 4 volets :
- prise en charge de la douleur :
. en accompagnement ou remplacement : myorelaxants, massages, balnéothérapie, stimulation électrique transcutanée, acupuncture,
. à titre complémentaire, selon expériences individuelles : infiltrations articulaires de corticoïdes, manipulations,
. thermalisme,
. AD3 selon le bénéfice-risque pour le patient,
. pratiquement pas d’indication de la chirurgie,
. apprendre au patient à vivre au quotidien avec sa douleur ;
- restauration de la fonction :
. soit seul, soit avec un kinésithérapeute, soit dans un programme pluridisciplinaire ;
- accompagnement psychologique :
. prise en charge spécifique d’une anxiété et/ou d’une dépression ;
. thérapies comportementales bénéfiques sur l’intensité de la douleur et sur l’apprentissage du contrôle de la douleur ;
- réinsertion professionnelle.
Fibromyalgie
Définition : syndrome douloureux chronique, évoluant depuis au moins 3 mois, associant : score de douleurs diffuses > 7, score de sévérité > 5 ou score de douleurs diffuses de 4–6 et score de sévérité > 9, et touchant au moins 4 sur 5 régions du corps.
Étapes de la prise en charge :
- diagnostic et évaluation initiale ;
- éducation du patient et remise d’une fiche conseil ;
- mesures non médicamenteuses :
. TCC,
. exercices dans l’eau,
. acupuncture,
. techniques de relaxation, qi gong, yoga, tai chi ;
- mesures médicamenteuses : si douleur sévère (faiblement recommandées) :
. IRSN : duloxétine, milnacipran,
. tramadol,
. pregabaline ;
- psychothérapie :
. surtout TCC ;
- si handicap sévère/arrêt de travail : programme de réhabilitation multidisciplinaire.
Douleur chronique du cancer
Classification des douleurs, à l’origine du type de traitement :
- type : aiguë/chronique ;
- rythme : permanente/incidente/paroxystique ;
- intensité : faible/modérée/sévère/rebelle ;
- localisation ;
- mécanisme : nociceptive/neuropathique/mixte ;
- organe : osseuse/viscérale ;
- étiologie : cancer (croissance tumorale, substances algogènes)/traitements (chirurgie, chimiothérapie, techniques invasives, radiothérapie, hormonothérapie, immunothérapie) ;
- origine : spontanée/provoquée.
- chimiothérapie ;
- facteurs anti-angiogénétiques ;
- hormonothérapie ;
- chirurgie ;
- radiothérapie (externe, métabolique, curiethérapie, radiochirurgie, stéréotaxique, etc.), surtout pour les compressions médullaires ou nerveuses, les douleurs rebelles et les fractures pathologiques instables ;
- immunothérapie ;
- thérapies ciblées.
- paliers de l’OMS (approche séquentielle) ;
- recours rapide aux opioïdes, en appliquant les notions déjà abordées (titration, effets secondaires, rotation, mésusage) ;
- évaluation/ titration/adaptation/réévaluation ;
- témoins d’une bonne efficacité thérapeutique :
. accès douloureux : moins de 4, soulagés > 50 %,
. sommeil,
. activités habituelles,
. effets indésirables ;
- place de la méthadone ? (effet mixte opioïde et anti-NMDA) douleurs rebelles.
Douleurs provoquées, cas particuliers :
- ponction lombaire ;
- biopsie ostéo-médullaire ;
- ponction artérielle ;
- ponction veineuse.
- corticoïdes : douleurs inflammatoires, occlusions, compressions nerveuses ;
- biphosphonates : douleurs osseuses, hypercalcémie ;
- benzodiazépines : pas d’effet antalgique propre, effet anxiolytique ;
- antispasmodiques : douleurs abdominales, viscérales ;
- antidépresseurs : composante anxiodépressive, douleur neuropathique.
Thérapies interventionnelles :
- techniques d’analgésie locorégionale, périmédullaire ou périnerveuse ;
- blocs neurolytiques (alcoolisation cœliaque) de moins en moins pratiqués ;
- radiologie interventionnelle (vertébroplastie, kyphoplastie, cimentoplastie, radiofréquence, chimio-embolisation) ;
- administration intra-/périthécale : douleurs rebelles (morphiniques, ziconotide).
Douleur de la personne âgée
- prévalence élevée ;
- difficultés d'évaluation ;
- spécificités thérapeutiques :
. particularités métaboliques,
. insuffisance rénale fréquente,
. risque d'accumulation ;
- effets secondaires : risque amplifié.•
POINTS FORTS À RETENIR
Le traitement de la douleur est un des éléments essentiels de la prise en charge de toute pathologie.
Il repose sur deux volets, les thérapies médicamenteuses et non médicamenteuses.
Les principes généraux d’un traitement antalgique médicamenteux sont : l’adaptation des caractéristiques du produit au type et au contexte de la douleur, l’évaluation et la réévaluation, la prévention et l’anticipation, la titration et l’adaptation.
Parmi les thérapeutiques médicamenteuses, l’approche classique, recommandée par l’OMS, est une stratégie séquentielle, en paliers, adaptée surtout à la douleur nociceptive (palier I = non morphiniques, palier II = morphiniques faibles et palier III = morphiniques forts).
L’approche classique médicamenteuse de l’OMS par paliers est très utile pour la douleur nociceptive mais peu adaptée pour d’autres types de douleur (neuropathique et nociplastique). D’autres molécules sont indiquées en première intention dans ce contexte : antidépresseurs, antiépileptiques, etc.
La prise de conscience collective du problème, la meilleure connaissance de la physiopathologie et les avancées thérapeutiques ont permis une meilleure prise en charge de la douleur ces dernières années. En contrepartie, l’utilisation élargie des traitements antalgiques peut avoir aussi des conséquences néfastes (phénomènes liés aux effets secondaires, mésusage, etc.), qu’il faut connaître, identifier et traiter.
À côté des thérapeutiques médicamenteuses, la prise en charge de la douleur repose aussi sur des thérapeutiques non médicamenteuses : les techniques de stimulation, les méthodes de rééducation, les approches à visée psychologique et les thérapies complémentaires.
Il faut faire la distinction entre la douleur aiguë, qui nécessite une approche classique, un objectif curatif et un modèle médical classique et la douleur chronique, qui exige une stratégie pluridimensionnelle, un objectif réadaptatif et un modèle byo-psycho-social.
Recommandations de l’ANSM concernant les AINS (2013)
Comme tous les médicaments, les AINS exposent à des effets indésirables pouvant être graves, en particulier gastro-intestinaux, cardiovasculaires et rénaux.
Le choix d’un AINS repose sur la prise en considération :
– des facteurs de risque individuels du patient ;
– du profil de sécurité d’emploi propre à chaque AINS ;
– des préférences personnelles du patient.
Contre-indications générales (pour toute la classe) :
– ulcère gastro-duodénal évolutif ;
– antécédents d’ulcère peptique ou d’hémorragie récurrente (au moins 2 épisodes objectivés) ;
– insuffisance hépatocellulaire sévère ;
– antécédents de saignement ou de perforation digestifs survenus sous AINS ;
– insuffisance cardiaque sévère ;
– insuffisance rénale sévère ;
– grossesse (voir ci-dessous).
Contre-indications spécifiques (profil de risque particulier) :
– les coxibs et le diclofénac si :
. cardiopathie ischémique avérée,
. artériopathie périphérique,
. antécédent d’accident vasculaire cérébral (dont accident ischémique transitoire) ;
– l’étoricoxib a une autre contre-indication : l’hypertension artérielle non contrôlée.
Femme enceinte :
– tous les AINS sont contre-indiqués dès le début du 6e mois de grossesse (24 semaines d’aménorrhée) ;
– les coxibs (célécoxib, étoricoxib, parécoxib) sont contre-indiqués pendant toute la grossesse.
Sujet âgé : il est recommandé de prendre en compte le risque accru d’effets indésirables graves du fait des comorbidités fréquentes, de la polymédication et du terrain fragilisé.
Dans cet article
- Classification de la douleur
- Stratégie de prise en charge globale d’une douleur aiguë ou chronique chez l’adulte (tableau 1)
- Traitement médicamenteux
- Thérapies médicamenteuses : paliers OMS
- Thérapies médicamenteuses : hors paliers OMS
- Thérapies non médicamenteuses
- Efficacité d’un traitement antalgique et adaptation en fonction de l’évaluation
- Exemples de schémas thérapeutiques

 Encadrés
Encadrés