Des techniques de radiologie interventionnelle contribuent au traitement des affections dégénératives vertébrales et des fractures-tassements vertébrales ostéoporotiques, qui sont les deux formes de vieillissement de la colonne vertébrale les plus fréquentes.
Le vieillissement du rachis se traduit le plus souvent, soit par des lombosciatiques et lombocruralgies par hernie discale, des lomboradiculalgies arthrosiques avec canal lombaire rétréci, des lomboradiculalgies par kyste synovial articulaire postérieur, des lombalgies communes sans radiculalgies ou une discopathie « active », soit par des fractures vertébrales ostéoporotiques. Quelles sont, dans ces situations, les indications des thérapeutiques mini-invasives sous guidage radiologique ?
Quelle prise en charge pour les affections dégénératives vertébrales ?
Les « infiltrations » radio-guidées de corticoïdes, réalisées à bon escient, sont utiles. Leurs précautions d’emploi doivent cependant être bien connues.
Hernie discale : des moyens simples ermettent le plus souvent d’éviter la chirurgie
Pour traiter la sciatique par hernie discale, aucun traitement mini-invasif n’a, à ce jour, pu remplacer la chimionucléolyse à la chymopapaïne (abandonnée), qui permettait d’éviter l’intervention chirurgicale chez deux tiers des patients en échec du traitement médical. L’efficacité des autres techniques de nucléolyse chimique (collagénase, aprotinine, alcool, ozone…) ou de la nucléotomie percutanée (mécanique, par radiofréquence ou laser) est inférieure à celle de la chimionucléolyse à la chymopapaïne. Fort heureusement, cette perte est en partie compensée par :
− une meilleure information du patient et du médecin, notamment sur l’évolution, parfois retardée mais très habituellement spontanément favorable, de la radiculalgie d’origine discale ;
− la dédramatisation d’une hernie discale présente sur une IRM ou un scanner (qui concerne environ 20 % de la population asymptomatique) ;
− une prise en charge médicale plus précise, et notamment un meilleur maniement des différentes classes d’antalgiques, bien aidée par les injections vertébrales radioguidées de corticoïdes locaux (« infiltrations »).
Grâce à ces moyens simples, un faible pourcentage des lombosciatiques par hernie discale nécessite finalement un recours chirurgical.1
À propos des « infiltrations » de corticostéroïdes
Le rationnel des « infiltrations » épidurales de corticostéroïdes dans la lombosciatique aiguë tient à l’existence, dans la genèse des douleurs rachidiennes et radiculaires, d’une composante inflammatoire que le corticoïde pourrait réduire. Cette composante inflammatoire, et notamment une « sécrétion cytokinique » du nucleus pulposus, a été démontrée dans les radiculalgies par conflit discoradiculaire. Tout récemment, un marqueur de la neuro-inflammation a aussi été mis en évidence dans les radiculalgies chroniques, associé à une réponse après infiltration épidurale de corticostéroïdes.2
Les infiltrations rachidiennes radioguidées donnent de meilleurs résultats que celles qui reposent uniquement sur des repères cliniques. En effet, une étude a montré que 40 % des infiltrations visant l’espace épidural réalisées à partir des repères cliniques ne l’atteignent pas.
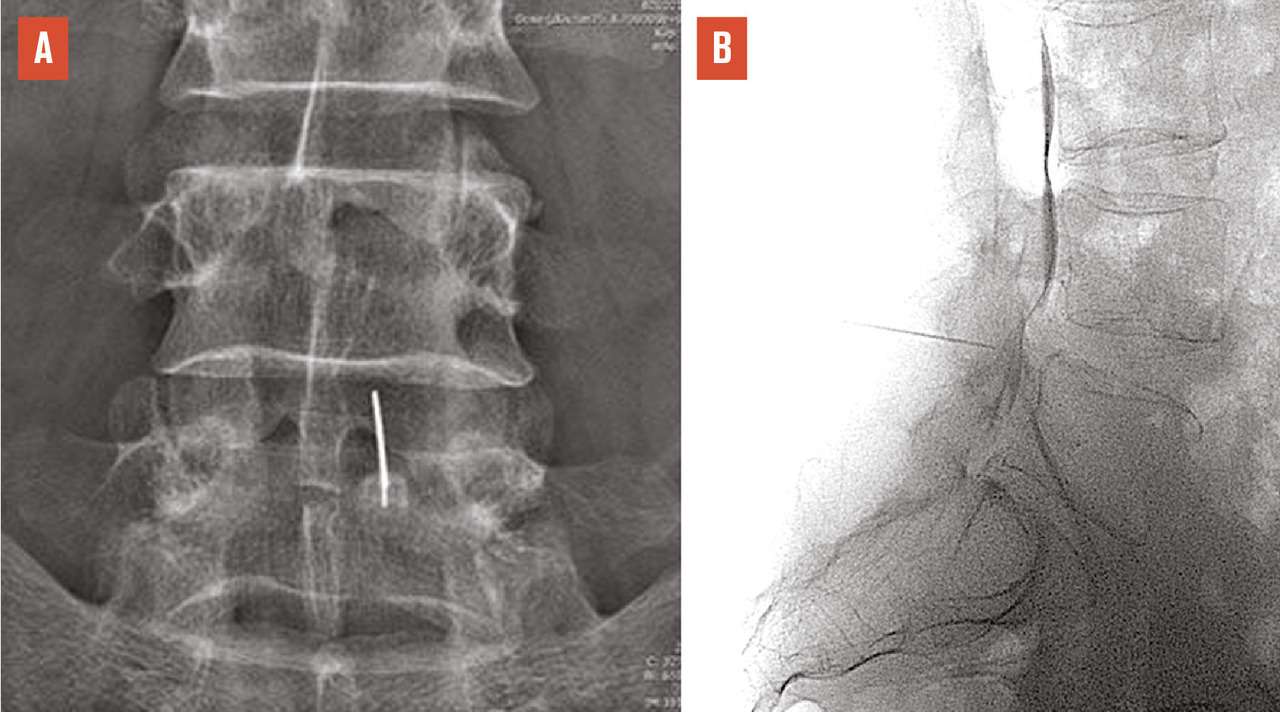
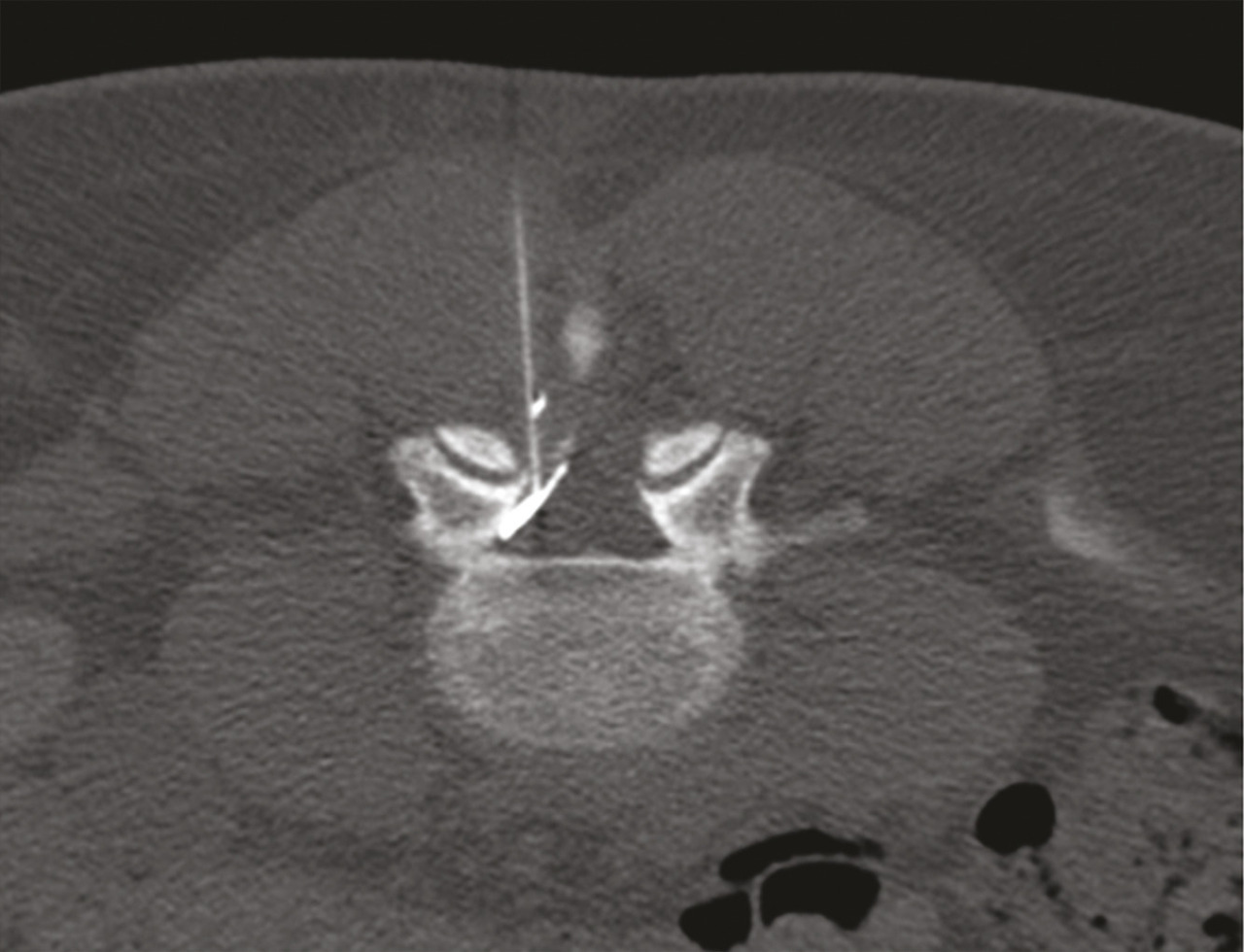
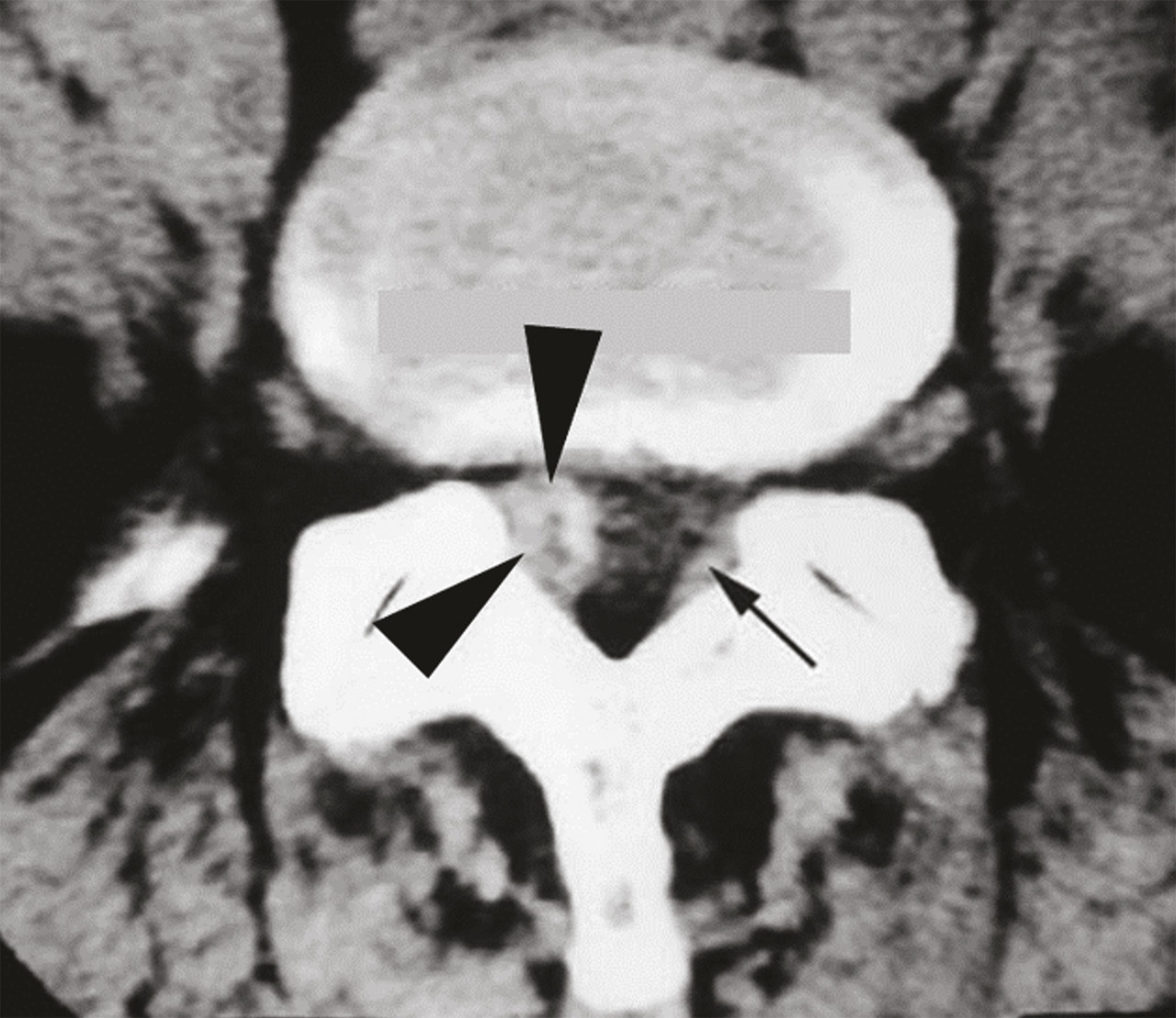
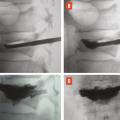
Les deux sites anatomiques d’injection sont l’espace épidural, site privilégié en cas de douleur radiculaire, et les articulations postérieures, qui sont plus volontiers « infiltrées » dans les lombalgies, surtout si les caractéristiques de la lombalgie orientent vers une origine articulaire postérieure (majoration de la douleur lors de l’extension du rachis et du relever d’un fauteuil), dans les spondylolisthésis par arthrose érosive postérieure et les lomboradiculalgies dues à la compression d’une racine nerveuse par un kyste synovial articulaire postérieur (v. infra).
Pour atteindre l’espace épidural, on peut utiliser les voies interépineuse, interlamaire (
L’efficacité des infiltrations vertébrales de corticostéroïdes est démontrée,6, 7 mais elle est de courte durée, de l’ordre de quelques semaines à deux ou trois mois, tout au plus.8 Leur principale indication est la radiculalgie aiguë, afin de passer un cap algique de quelques semaines, permettant d’attendre l’effet de l’évolution naturelle, le plus souvent favorable. Elles ne sont donc pas indiquées dans les lombalgies chroniques, sauf parfois pour passer un cap aigu. Les injections peuvent être répétées, à un rythme raisonnable (de l’ordre de 3 par an maximum), pour ne pas s’exposer aux effets secondaires locaux et généraux des corticoïdes car, même sous forme cristalline, une partie du produit passe par voie systémique.
L’évaluation du service rendu par les infiltrations épidurales est particulièrement compliquée, du fait, non seulement de la variété des douleurs traitées et de la diversité des techniques utilisées, notamment en termes de voies d’abord et de type de dérivé cortisonique, mais aussi de la résonance des douleurs vertébrales dans les champs psychologique, social et professionnel. Ces difficultés méthodologiques expliquent la relative rareté des essais randomisés de haut niveau de qualité.
Lomboradiculalgie arthrosique et canal lombaire rétréci
La conjonction de lésions dégénératives multiples [discarthrose, arthrose postérieure, dégénérescence ligamentaire, laxité articulaire à l’origine de subluxations (petits spondylolisthésis ou rétrolisthésis arthrosiques), et parfois d’une étroitesse canalaire constitutionnelle, peut entraîner la compression d’une racine nerveuse dans le canal radiculaire, ou de la queue de cheval dans le canal vertébral central lombaire.
La symptomatologie du canal lombaire rétréci apparaît quand le sac dural est réduit de plus de deux tiers, autrement dit quand il ne reste plus suffisamment d’espace pour les racines de la queue de cheval (qui n’occupent en moyenne qu’un tiers du sac dural sur une tranche axiale, le reste de l’espace étant occupé par le liquide cérébrospinal).
La prise en charge médicale des lombosciatiques arthrosiques et du canal lombaire rétréci repose sur les antalgiques, la physiothérapie, le port d’un corset souple et des infiltrations locales de corticoïdes, dont le rôle d’appoint n’est pas négligeable. Elles peuvent réduire la douleur, et parfois le handicap, donc donner un répit de plusieurs semaines, ou parfois beaucoup plus long, avant de devoir porter l’indication d’une intervention chirurgicale. En effet, l’évolution de la symptomatologie du canal rétréci et de la sciatique arthrosique est volontiers capricieuse.
La cible des injections de corticoïdes, articulaires postérieures ou dans l’espace épidural, diffère selon les auteurs et les cas particuliers. Il n’y a pas dans la littérature de données suffisantes pour juger de l’efficacité des injections de corticoïdes dans le canal lombaire rétréci.
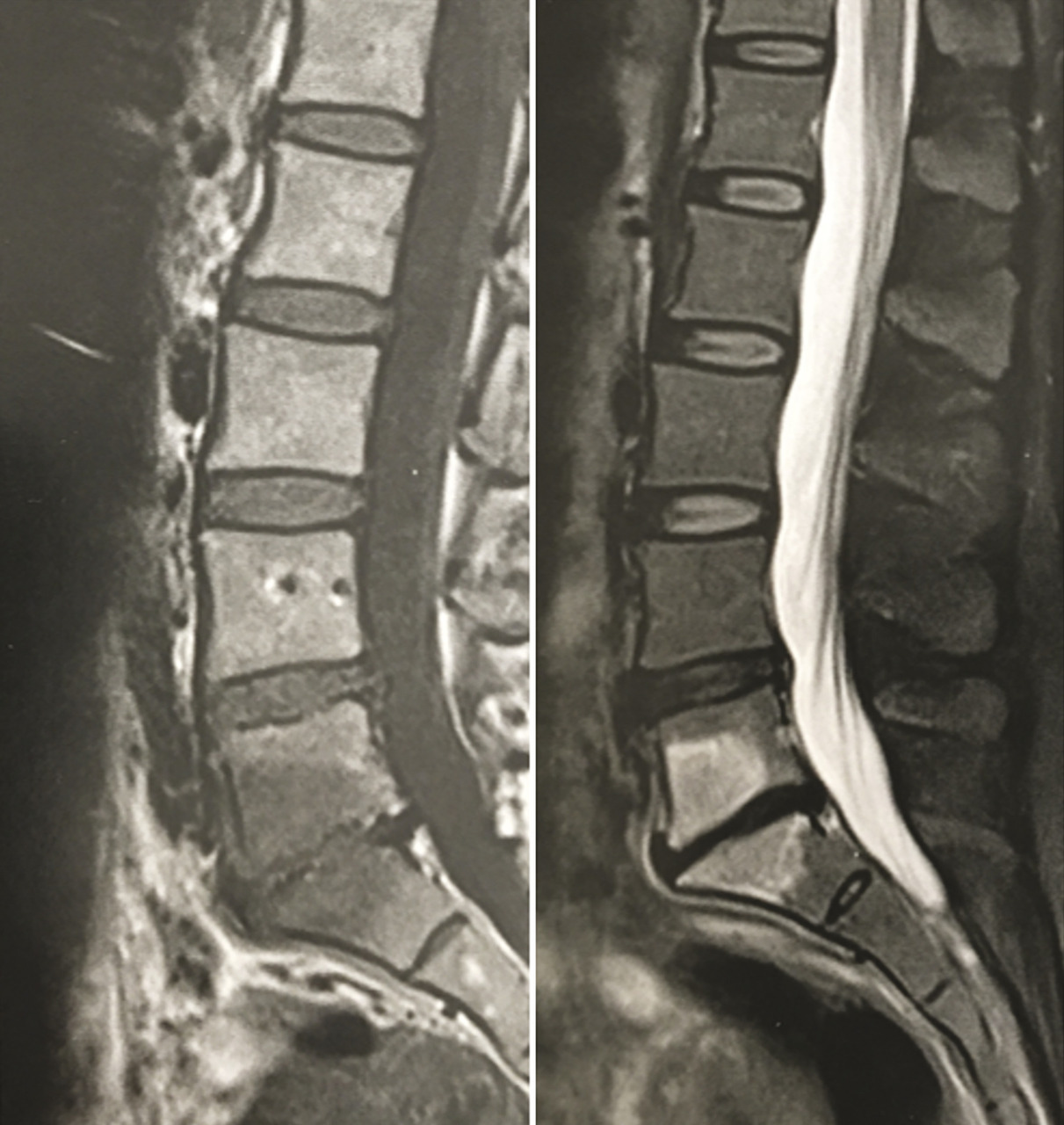
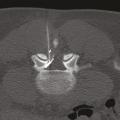
Spécificités du kyste synovial articulaire postérieur
Un kyste synovial développé aux dépens d’une articulation interapophysaire postérieure peut provenir de l’arrière et comprimer l’émergence d’une racine nerveuse (
Lombalgie commune sans radiculalgie : pas de supériorité des infiltrations
Les lombalgies communes sont la première cause de consultation en pathologie ostéoarticulaire. Elles ne sont pas l’apanage du sujet âgé mais leur fréquence, leur durée et surtout le handicap fonctionnel dont elles sont responsables croissent avec l’âge. Elles sont en rapport avec la dégénérescence des structures rachidiennes, qui débute dès la seconde décennie de la vie mais dont l’intensité est très différente d’un sujet à l’autre.
La prise en charge des lombalgies communes est médicale : corset, ergothérapie, physiothérapie, prévention, entraînement à l’effort, antalgiques pendant des périodes courtes. Les anti-inflammatoires non stéroïdiens sont évités chez le sujet âgé, du fait de leur toxicité cardiovasculaire et rénale, surtout quand ils sont administrés au long cours.
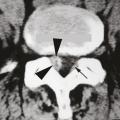
La plupart des rhumatologues français réalisent les injections de corticostéroïdes dans les articulations interapophysaires postérieures pour passer un cap douloureux aigu, dans les cas où l’examen clinique ou la présence d’un hypersignal « œdémateux » en IRM, sur les séquences pondérées en T2 avec suppression du signal de la graisse (
Cas particulier de la discopathie « active »
Le cas des discopathies dégénératives dites « actives », avec un signal « œdémateux » (hypersignal T2) des plateaux vertébraux en IRM (« Modic 1 ») est particulier (
De graves accidents neurologiques suite à des infiltrations vertébrales
Des accidents neurologiques graves (paraplégies, quadriplégies, décès) ont été rapportés à partir des années 2000, après des infiltrations cervicales et lombaires de corticoïdes particulaires (en suspension), principalement par voie foraminale et, moins fréquemment, épidurale.14-18 Ces accidents sont heureusement très rares, mais difficilement acceptables dans le cadre de la prise en charge d’une affection bénigne. Trois principaux facteurs sont en cause dans ces accidents : l’utilisation d’un corticoïde particulaire, la voie d’abord foraminale et un antécédent de chirurgie vertébrale à l’étage injecté. Une variante anatomique ou une artère radiculomédullaire, provenant du rachis lombaire inférieur ou sacré et vascularisant le cône terminal, est probablement aussi en cause à l’étage lombaire.
En France, l’arrêt de la commercialisation du cortivazol (Altim®), seul corticoïde particulaire qui ne provoquait pas d’agglutination des hématies in vivo et in vitro,15, 16 a conduit les autorités et les Sociétés françaises de rhumatologie et de radiologie à établir des préconisations et des recommandations très précises, sur l’usage de l’acétate de prednisolone (hydrocortancyl), en injection vertébrale, afin de prévenir ces accidents neurologiques graves17 :
− Il est possible de continuer à utiliser l’acétate de prednisolone, seul corticoïde possédant une autorisation de mise sur le marché pour usage au rachis, lombaire seulement, dont le libellé indique : « pour les infiltrations épidurales par voie interépineuse postérieure, avec ou sans contrôle d’imagerie, ou voie interlamaire sous contrôle d’imagerie chez un sujet non opéré du rachis lombaire ».17, 19
− Les injections d’acétate de prednisolone à l’étage cervical17 et chez tous les patients et à un étage lombaire préalablement opéré sont proscrites.
− En cas d’antécédent chirurgical, l’infiltration épidurale lombaire doit impérativement être faite à distance du site opéré, le choix de l’étage à infiltrer devant être discuté lors d’une réunion de concertation pluridisciplinaire, ou emprunter la voie du hiatus sacro-coccygien.
Le phosphate sodique de dexaméthasone, ester inorganique hydrosoluble de dexaméthasone, qui ne comporte pas les risques neurologiques des corticoïdes particulaires, est disponible en France sous la forme d’une solution pure, depuis l’épidémie de Covid-19. Sa durée d’action est théoriquement plus brève, mais son efficacité antalgique semble proche, ou peu inférieure, de celle des corticostéroïdes particulaires.20
Des cimentoplasties percutanées pour les fractures ostéoporotiques
Les fractures vertébrales ostéoporotiques sont extrêmement fréquentes à partir d’un certain âge, notamment chez la femme après la ménopause, mais aussi chez l’homme âgé. Chaque année en France, 40 à 50 000 fractures vertébrales sont responsables de douleurs rachidiennes, plus ou moins invalidantes, mais environ deux tiers des fractures vertébrales sont asymptomatiques et passent donc inaperçues.
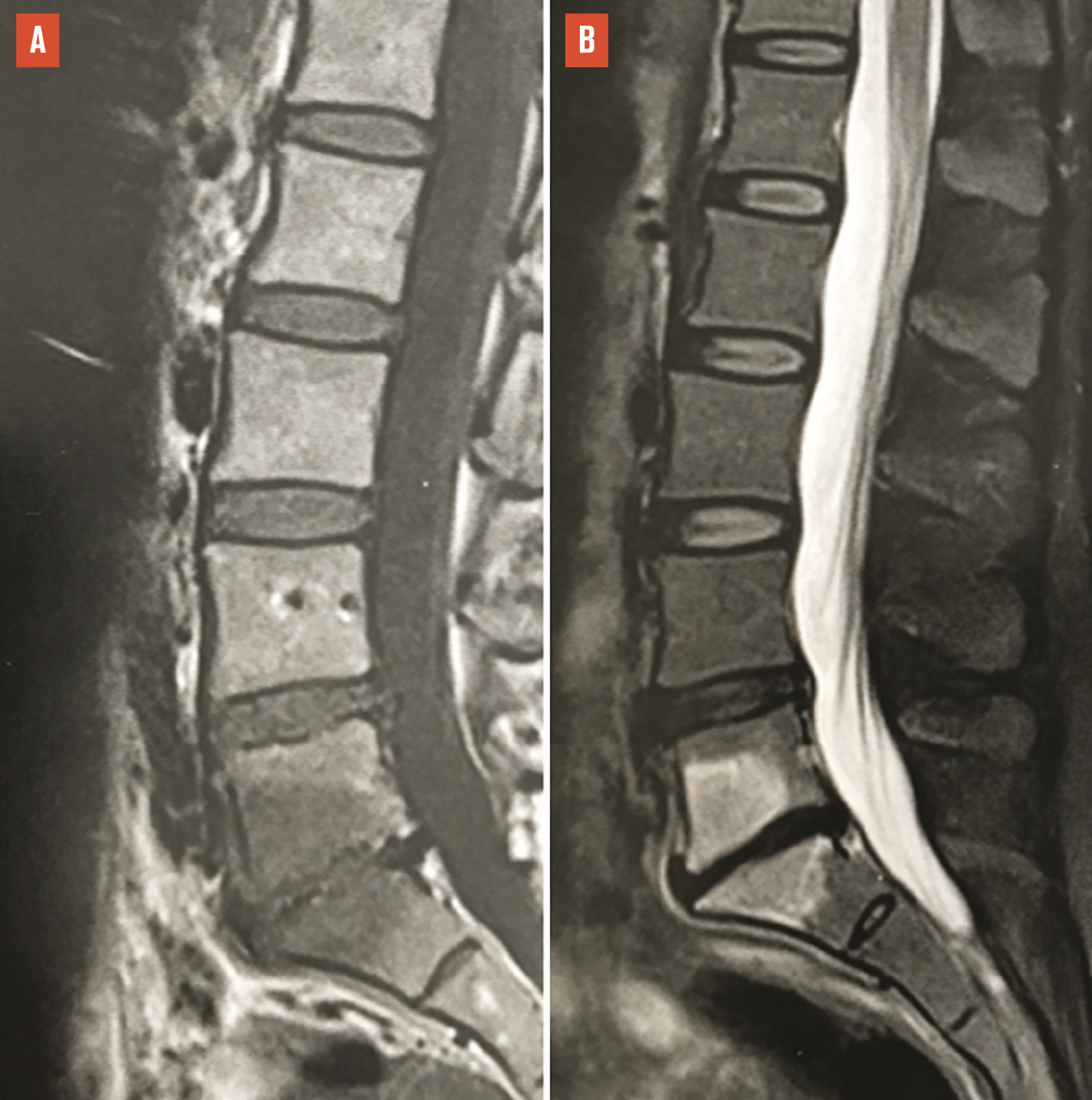
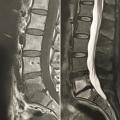
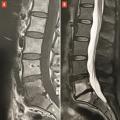
Le plus souvent, les fractures ostéoporotiques consolident et les douleurs peuvent être gérées par le traitement médical avant de disparaître spontanément en quelques semaines. Dans certains cas cependant, la pérennisation des douleurs requiert des morphiniques et contraint le patient à un alitement prolongé, avec les risques inhérents chez une personne âgée. La fracture peut aussi se majorer progressivement, ce qui peut entraîner une perte importante de hauteur du corps vertébral et majorer la cyphose. Parfois encore, chez le sujet âgé, la fracture ne consolide pas et une véritable pseudarthrose, avec image de « vide » (gaz) intrasomatique se constitue, source de douleurs mécaniques et d’évolution prolongée. On peut alors observer, sur les radiographies et en scanner, une image cavitaire linéaire intracorporéale qui peut contenir du gaz (
Les fractures vertébrales tendent naturellement à se multiplier
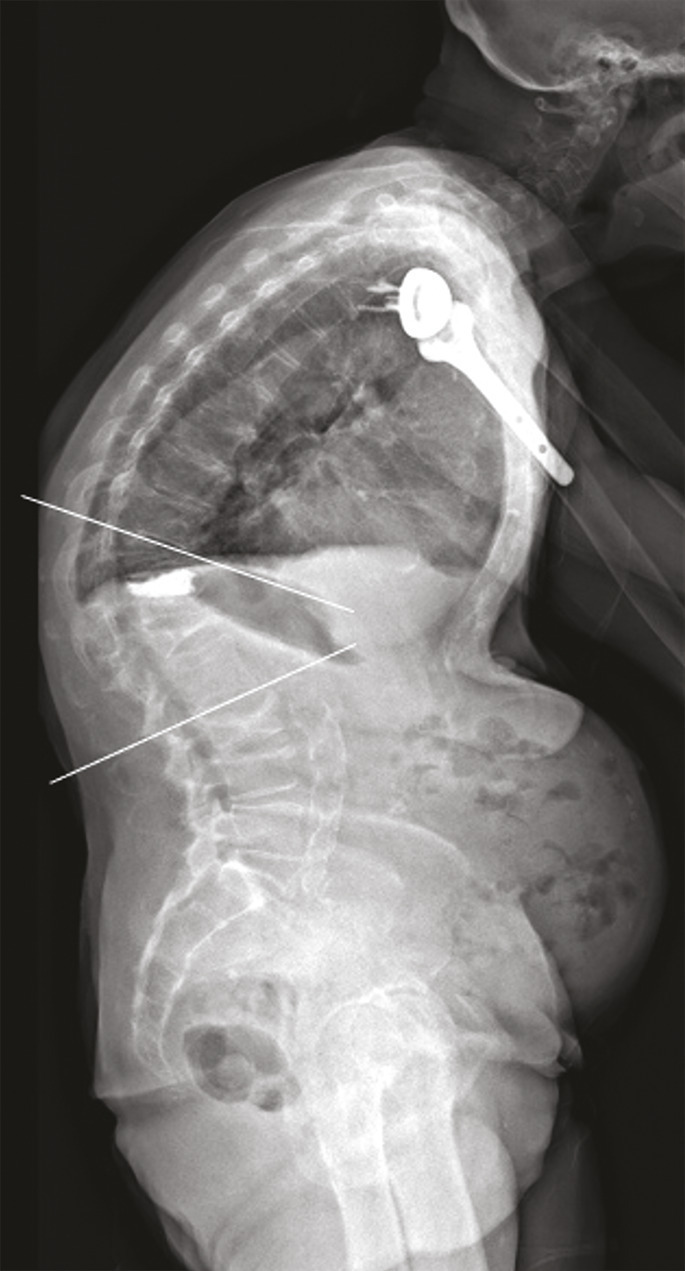
La présence de fractures incidentes augmente le risque de nouvelles fractures. Outre les douleurs, la multiplication des fractures vertébrales peut avoir des conséquences très délétères sur la statique rachidienne : perte de la lordose lombaire et augmentation de la cyphose thoracique. En particulier, les fractures de la charnière thoraco-lombaire, siège de prédilection des fractures ostéoporotiques, à la jonction d’un segment rachidien relativement fixe et d’un segment mobile, entraînent souvent une cyphose angulaire importante et préjudiciable sur le plan fonctionnel. Une seule fracture cunéiforme de la charnière thoraco-lombaire ou du rachis thoracique inférieur peut même générer 15 à 20° de cyphose, ce qui est loin d’être anodin.21 La cyphose vertébrale est un marqueur du vieillissement physiologique et un facteur de morbidité, du fait du déséquilibre sagittal du rachis, de la diminution des capacités fonctionnelles et respiratoire, de la majoration du risque de chute et donc de nouvelles fractures (
Les fractures vertébrales ostéoporotiques ont tendance à se multiplier et à s’enchaîner, non seulement dans le temps, mais aussi dans le même segment rachidien, aggravant les déformations (
Cimentoplastie percutanée contre la douleur et les déséquilibres rachidiens
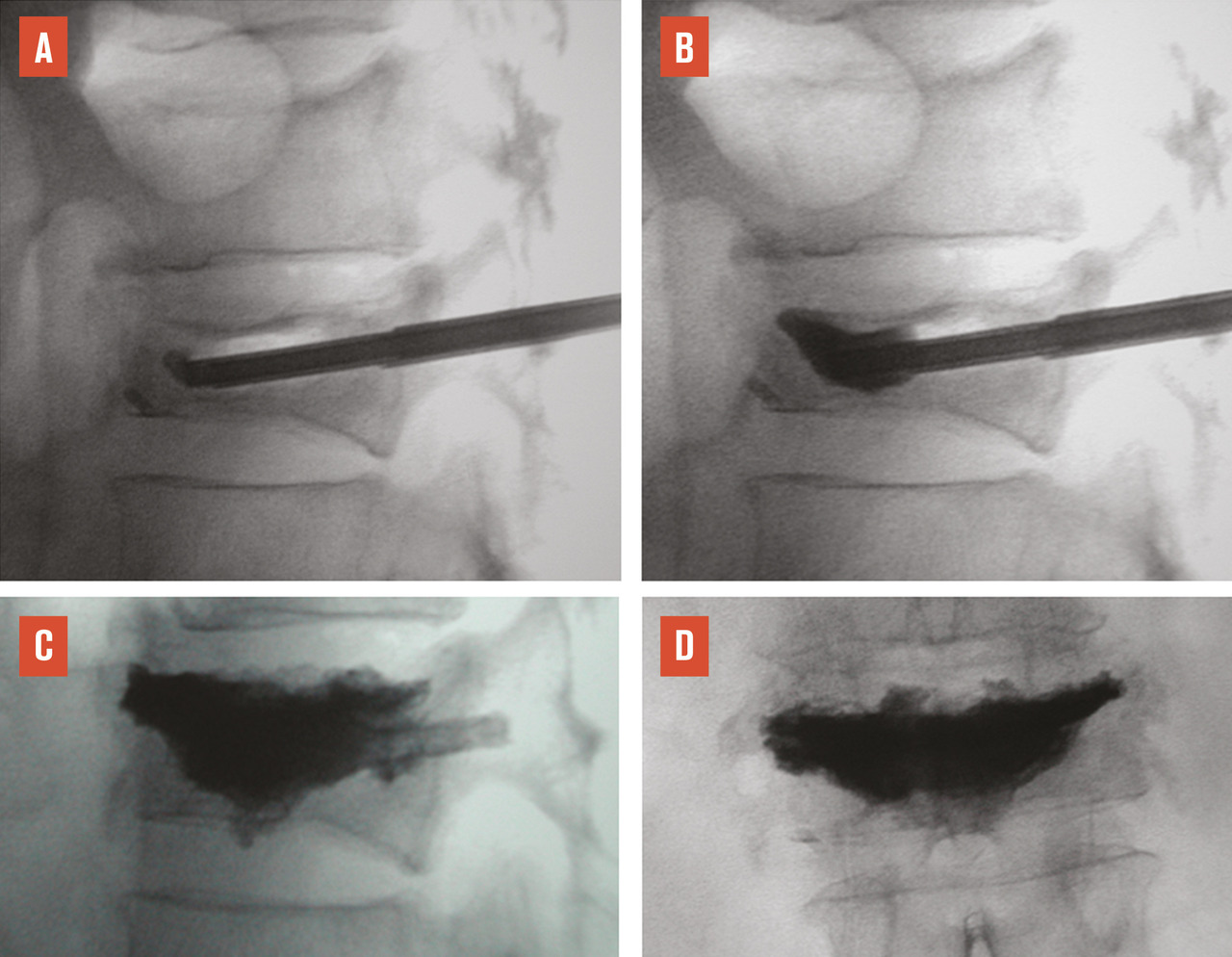
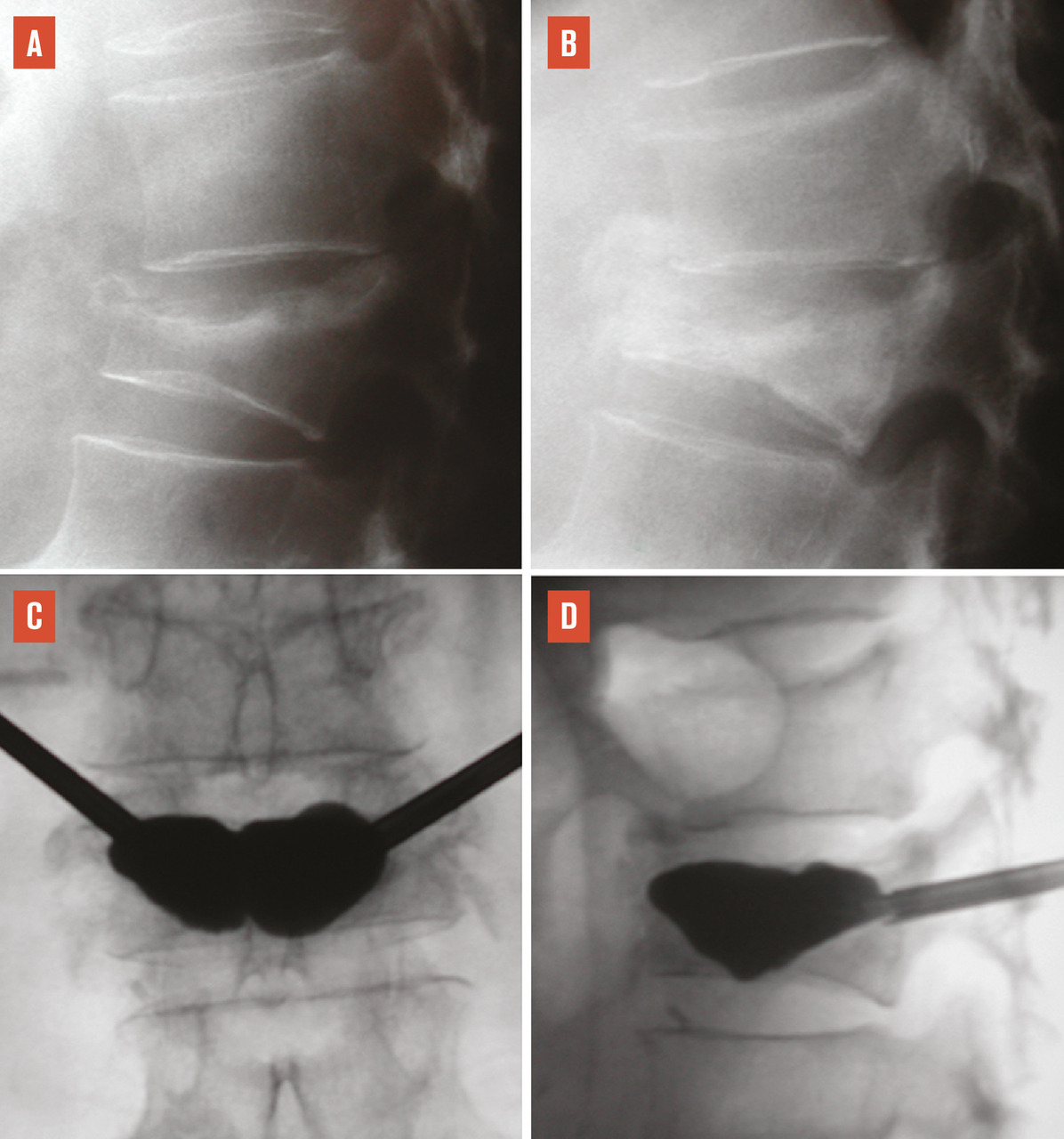
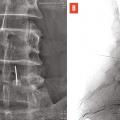
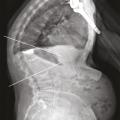
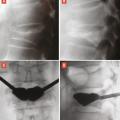
L’objectif d’une cimentoplastie percutanée (vertébroplastie et kyphoplastie à ballonnets) est double : antalgie et lutte contre la cyphose et le déséquilibre rachidiens. La vertébroplastie percutanée (
L’objectif premier de ces deux techniques est antalgique. Consolider le corps vertébral et soulager les patients invalidés par des douleurs, intenses et persistantes, permet leur remise en charge et la prévention des complications du décubitus. Dans les cas favorables, la consolidation de la fracture et la diminution des douleurs permettent au patient de retrouver une mobilité. La consolidation de la fracture joue un rôle particulièrement important dans les fractures pseudarthrosées avec « vide intrasomatique » (
À ce jour, l’efficacité de ces deux techniques sur les douleurs fracturaires n’est pas scientifiquement démontrée. Deux essais multicentriques contrôlés en double insu, publiés en 2009, ont comparé la vertébroplastie percutanée et une procédure de vertébroplastie factice, sans montrer de supériorité de la vertébroplastie sur la douleur.26, 27 Une première explication à cela tient à la difficulté de démontrer l’efficacité sur la douleur d’une technique chirurgicale, en la comparant à une intervention factice, connaissant l’importance de l’effet placebo. Ces deux essais contrôlés comportent aussi un certain nombre de limites méthodologiques : la proportion importante de patients ayant des douleurs depuis plus de 3 mois (après ce délai, la responsabilité d’une fracture dans les dorsalgies devient très incertaine), l’abord unipédiculaire, la faible quantité de ciment injectée, l’absence de groupe contrôle de fractures pris en charge médicalement, le faible seuil minimal d’évaluation de la douleur (EVA) requis comme critère d’inclusion, qui n’était que de 327 ou 4/1026, ce qui ne favorise pas la mise en évidence d’un effet thérapeutique. Enfin, et surtout, la présence d’un signal d’œdème médullaire en IRM, critère majeur de définition du caractère récent d’une fracture vertébrale ostéoporotique et de sa responsabilité dans les douleurs vertébrales, n’était pas systématiquement requis.
Un essai ultérieur, « VAPOUR », lui aussi multicentrique randomisé en double insu, a conclu à la supériorité de la vertébroplastie [quantité moyenne de ciment injectée 7,5 mL (SD 2,8)] par comparaison à une intervention factice, chez 120 patients ayant une ou deux fractures vertébrales de moins de 6 semaines, avec un œdème en IRM et une EVA douleur d’au moins 7/10. Le critère principal était la proportion de patients dont l’EVA douleur était inférieure à 4/10 à J14. En intention de traiter, 44 % des patients du groupe vertébroplastie ont rempli ce critère, contre 21 % du groupe intervention factice.28
Quand elles sont effectuées précocement, la vertébroplastie et la kyphoplastie ont aussi l’intérêt d’empêcher la majoration de la fracture vertébrale. C’est notamment le cas chez les sujets âgés qui font des fractures « nécrotiques », où le processus de réparation est en défaut, et qui peuvent induire une forte cyphose, notamment lorsqu’elles se situent à la charnière thoracolombaire.
Les deux méthodes peuvent entraîner des complications dont certaines sont très graves.29 Ces complications sont cependant devenues assez rares, avec des opérateurs entraînés. La cimentoplastie a été incriminée dans la survenue de fractures des vertèbres adjacentes, mais ce risque ne paraît pas augmenté.
Traiter l’ostéoporose et prévenir les chutes
La vertébroplastie et la kyphoplastie n’évitent pas l’évolution de l’ostéoporose fracturaire, avec de nouvelles fractures, notamment vertébrales, et une aggravation progressive de la cyphose (
Il est aussi essentiel, chez le sujet âgé, de minimiser le risque de chutes, en tâchant de compenser un déficit visuel et un trouble de l’équilibre, en aménageant le domicile et l’environnement de la personne, et en apportant une aide kinésiologique.
Cet article complète le dossier « Vieillissement du Rachis » paru dans le numéro de mai 2021 de La Revue du Praticien.
1. Peul WC, van Houwelingen HC, van den Hout WB, Brand R, Eekhof JA, Tans JT, et al. Surgery versus prolonged conservative treatment for sciatica. N Engl J Med. 2007 May;356(22): 2245-56.
2. Albrecht DS, Ahmed SU, Kettner NW, Borra RJH, Cohen-Adad J, Deng H, et al. Neuroinflammation of the spinal cord and nerve roots in chronic radicular pain patients. Pain. 2018 May;159(5):968-77.
3. Kim WJ, Shin HY, Yoo SH, Park HS. Comparison of epidural spreading patterns and clinical outcomes of transforaminal epidural steroid injection with high-volume injectate via the subpedicular versus the retrodiscal approach. Pain Physician. 2018 May;21(3):269-78.
4. Mandell JC, Czuczman GJ, Gaviola GC, Ghazikhanian V, Cho CH. The lumbar neural foramen and transforaminal epidural steroid injections: an anatomic review with key safety considerations in planning the percutaneous approach. AJR Am J Roentgenol. 2017 Jul;209(1):W26-W35.
5. Murphy DT, Kavanagh EC, Poynton A, Chan VO, Moynagh MR, Eustace S. MR epidurography: distribution of injectate at caudal epidural injection. Skeletal Radiol. 2015 Apr;44(4):565-71.
6. Kennedy DJ, Levin J, Rosenquist R, Singh V, Smith C, Stojanovic MP, et al. Epidural steroid injections are safe and effective: multisociety letter in support of the safety and effectiveness of epidural steroid injections. Pain Med. 2015 May;16(5):833-8.
7. Pinto RZ, Maher CG, Ferreira ML, et al. Epidural corticosteroid injections in the management of sciatica: a systematic review and meta-analysis. Ann Intern Med. 2012 Dec;157(12):865-77.
8. Oliveira CB, Maher CG, Ferreira ML, Hancock MJ, Oliveira VC, McLachlan AJ, et al. Epidural corticosteroid injections for lumbosacral radicular pain. Cochrane Database Syst Rev. 2020 Apr 9;4(4):CD013577.
9. Parlier-Cuau C, Wybier M, Nizard R, Champsaur P, Le Hir P, Laredo JD. Symptomatic lumbar facet joint synovial cysts: clinical assessment of facet joint steroid injection after 1 and 6 months and long-term follow-up in 30 patients. Radiology. 1999 Feb;210(2):509-13.
10. Carette S, Marcoux S, Truchon R, Grondin C, Gagnon J, Allard Y, et al. A controlled trial of corticosteroid injections into facet joints for chronic low back pain. N Engl J Med. 1991 Oct;325(14):1002-7.
11. Lilius G, Laasonen EM, Myllynen P, Harilainen A, Grönlund G. Lumbar facet joint syndrome. A randomised clinical trial. J Bone Joint Surg Br. 1989 Aug;71(4):681-4.
12. Nguyen C, Boutron I, Baron G, Sanchez K, Palazzo C, Benchimol R, et al. Intradiscal glucocorticoid injection for patients with chronic low back pain associated with active discopathy: A Randomized Trial. Ann Intern Med. 2017 Apr;166(8):547-56.
13. Steffens D, Hancock MJ, Pereira LSM, Kent PM, Latimer J, Maher CG. Do MRI findings identify patients with low back pain or sciatica who respond better to particular interventions? A systematic review. Eur Spine J. 2016 Apr;25(4):1170-87.
14. Wybier M, Gaudart S, Petrover D, Houdart E, Laredo JD. Paraplegia complicating selective steroid injections of the lumbar spine. Report of five cases and review of the literature. Eur Radiol. 2010 Jan;20(1):181-9.
15. Laemmel E, Segal N, Mirshahi M, Azzazene D, Le Marchand S, Wybier M, et al. Deleterious Effects of intra-arterial administration of particulate steroids on microvascular perfusion in a mouse model. Radiology. 2016 Jun;279(3):731-40.
16. Laredo JD, Laemmel E, Vicaut E. Serious neurological events complicating epidural injections of glucocorticoid suspensions: evidence for a direct effect of some particulate steroids on red blood cells. RMD Open. 2016 Sep 22;2(2):e000320.
17. Marty M, Bard H, Rozenberg S, Baudens G, Chevalier X, Bardin T, et al. Préconisations pour la réalisation des infiltrations épidurales rachidiennes de corticostéroïdes élaborées sous l’égide de la section « rachis » reconnue par la Société française de rhumatologie et par la section « imagerie et rhumatologie interventionnelle » de la Société française de rhumatologie. Rev Rhum. 2018 Oct;85(5): 420-7.
18. FDA. Epidural Steroid Injections (ESI) and the risk of serious neurologic adverse reactions. Meeting BDAaADPAC. 2014.
19. Cotten A, Drapé JL, Sans N, Feydy A, Bartoli JM, Meder JF. Société d’imagerie musculosquelettique (SIMS), Fédération de radiologie interventionnelle (FRI), and Société française de radiologie (SFR) recommendations for epidural and transforaminal corticosteroid injections. Diagn Interv Imaging. 2018 Apr;99(4):219-24.
20. Bensler S, Sutter R, Pfirrmann CWA, Peterson CK. Particulate versus non-particulate corticosteroids for transforaminal nerve root blocks: comparison of outcomes in 494 patients with lumbar radiculopathy. Eur Radiol. 2018 Mar;28(3):946-52.
21. Laredo JD, Orcel P. Vertébroplastie et cyphoplastie dans les fractures vertébrales ostéoporotiques. Bull Acad Natle Méd. 2017 Fev;201(1-3):381-404.
22. Roux C, Fechtenbaum J, Kolta S, Said-Nahal R, Briot K, Benhamou CL. Prospective assessment of thoracic kyphosis in postmenopausal women with osteoporosis. J Bone Miner Res. 2010 Feb;25(2):362-8.
23. Edidin AA, Ong KL, Lau E, Kurtz SM. Mortality risk for operated and non-operated vertebral fracture patients in the U.S. medicare population. J Bone Miner Res. 2011 Jul;26(7):1617-26.
24. Lindsay R, Silverman SL, Cooper C, et al. Risk of new vertebral fracture in the year following a fracture. JAMA. 2001 Jan;285(3):320-3.
25. Kanis JA, Johnell O, Oden A, Johansson H, McCloskey E. FRAX and the assessment of fracture probability in men and women from the UK. Osteoporos Int. 2008 Apr;19(4):385-97.
26. Buchbinder R, Osborne RH, Ebeling PR, Wark JD, Mitchell P, Wriedt C, et al. A randomized trial of vertebroplasty for painful osteoporotic vertebral fractures. N Engl J Med. 2009 Aug;361(6):557-68.
27. Kallmes DF, Comstock BA, Heagerty PJ, Turner JA, Wilson DJ, Diamond TH, et al. A randomized trial of vertebroplasty for osteoporotic spinal fractures. N Engl J Med. 2009 Aug;361(6): 569-79.
28. Clark W, Bird P, Gonski P, Diamond TH, Smerdely P, McNeil HP, et al. Safety and efficacy of vertebroplasty for acute painful osteoporotic fractures (VAPOUR): a multicentre, randomised, double-blind, placebo-controlled trial. Lancet. 2016 Oct;388(10052):1408-16.
29. Laredo JD, Hamze B. Complications of percutaneous vertebroplasty and their prevention. Skeletal Radiol. 2004 Sep;33(9):493-505.