L’avènement des thérapies ciblées (inhibiteurs de tyrosine kinase et antiangiogéniques) a permis l’amélioration de la prise en charge et du pronostic des patients atteints de cancers, au prix cependant d’une majoration des effets indésirables, notamment cardiaques et vasculaires. Avant l’initiation de toute chimiothérapie, 20 à 30 % des patients atteints de cancer peuvent être hypertendus. Les anti-vascular endothelial growth factor (VEGF) et les inhibiteurs de tyrosine kinase sont les deux principales classes thérapeutiques pouvant entraîner ou déstabiliser une hypertension artérielle. L’incidence et la gravité de l’hypertension induite par les antiangiogéniques varient en fonction de la définition de l’hypertension retenue, de la molécule considérée, de la posologie administrée et de la population considérée.1 L’hypertension secondaire à l’administration d’une thérapie ciblée peut s’accompagner d’une atteinte rénale se manifestant par une protéinurie et/ou une micro-angiopathie thrombotique qui en font la sévérité.2 La prise en charge de cette hypertension ne diffère pas de celle proposée pour les patients indemnes de cancer. Elle repose sur l’adoption de règles hygiénodiététiques, la prescription d’un traitement antihypertenseur et, en dernier recours, à la modulation de la posologie de la thérapie ciblée.3, 4
Incidence de l’hypertension sous anti-angiogéniques
L’hypertension artérielle secondaire à l’administration d’un traitement antiangiogénique est considérée comme un effet de classe, dont l’incidence varie de 20 à 90 % en fonction de la molécule, de la posologie et des modalités de surveillance de la pression artérielle (mesure en cabinet, automesure ou mesure ambulatoire) [v . tableau ].5
L’hypertension artérielle apparaît précocement, en règle générale dans la semaine suivant l’initiation du traitement ; elle concerne à la fois la pression systolique et la diastolique et est résolutive dans les 15 jours qui suivent l’interruption du traitement antiangiogénique. Elle s’accompagne, plus rarement, d’une atteinte rénale se manifestant par une dégradation de la fonction rénale, une protéinurie de débit variable parfois aggravée par l’hypertension, ou d’une micro-angiopathie thrombotique.3
Une méta-analyse portant sur près de 20 000 patients traités par bévacizumab a montré que le risque de développer une hypertension était, pour ces patients, multiplié par 4 (risque relatif [RR] : 4,73 ; intervalle de confiance [IC] à 95 % : 4,15-5,39 [p < 0,001]).6
Une méta-analyse de 71 essais incluant tous les antiangiogéniques, quels que soient leurs mécanismes d’action, a montré que près de 2,4 % des patients pouvaient développer une atteinte rénale avec une protéinurie significative.7
L’hypertension artérielle apparaît précocement, en règle générale dans la semaine suivant l’initiation du traitement ; elle concerne à la fois la pression systolique et la diastolique et est résolutive dans les 15 jours qui suivent l’interruption du traitement antiangiogénique. Elle s’accompagne, plus rarement, d’une atteinte rénale se manifestant par une dégradation de la fonction rénale, une protéinurie de débit variable parfois aggravée par l’hypertension, ou d’une micro-angiopathie thrombotique.3
Une méta-analyse portant sur près de 20 000 patients traités par bévacizumab a montré que le risque de développer une hypertension était, pour ces patients, multiplié par 4 (risque relatif [RR] : 4,73 ; intervalle de confiance [IC] à 95 % : 4,15-5,39 [p < 0,001]).6
Une méta-analyse de 71 essais incluant tous les antiangiogéniques, quels que soient leurs mécanismes d’action, a montré que près de 2,4 % des patients pouvaient développer une atteinte rénale avec une protéinurie significative.7
Prise en charge de l’hypertension induite par les antiangiogéniques
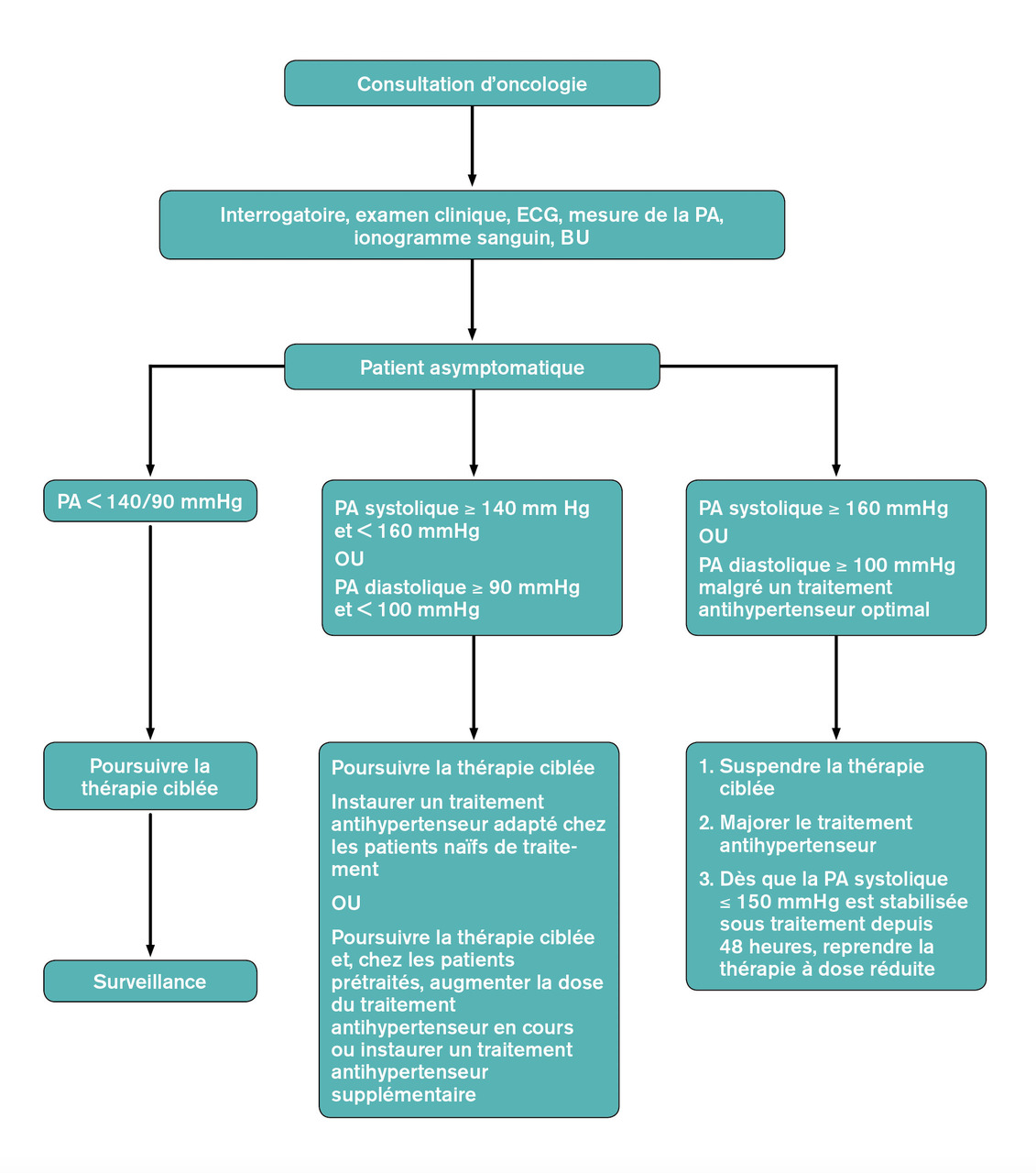
Il n’existe à l’heure actuelle aucune recommandation spécifique décrivant la prise en charge de l’hypertension induite par les traitements anticancéreux. Les propositions de prise en charge sont le reflet de consensus professionnels s’appuyant sur un faible niveau de preuve (v. figure).3, 4
Évaluation avant l’administration d’un traitement antiangiogénique
Le bilan cardiovasculaire avant l’initiation d’une chimiothérapie pouvant entraîner une hypertension est, en règle générale, réalisé par l’oncologue en charge du patient et doit comporter un examen clinique, un relevé des symptômes cardiaques (dyspnée, angor, palpitations, syncope), une mesure de la pression artérielle, une bandelette urinaire, une protéinurie des 24 heures et un dosage sanguin de la créatininémie. Au terme de cette première évaluation, il est important et possible de distinguer les patients qui peuvent débuter, d’emblée et sans retard, la chimiothérapie envisagée de ceux qui doivent être dirigés vers une consultation de cardio-oncologie.
La thérapie ciblée peut être débutée sans évaluation supplémentaire, et notamment sans avis cardiologique préalable, si le patient est asymptomatique sur le plan cardiologique, que la pression artérielle mesurée est normale ou contrôlée sous traitement antihypertenseur, et qu’il n’existe pas d’atteinte rénale définie par un débit de filtration glomérulaire (DFG) inférieur à 30 mL/min/1,73m² et par une protéinurie des 24 heures >0,3 g/j. Les patients devront être suivis de manière régulière lors des consultations d’oncologie et éventuellement être dirigés vers un cardio-oncologue en cas d’hypertension de novo, d’une déstabilisation d’une hypertension déjà connue ou en cas d’apparition de symptômes.
Il n’y a pas lieu de contre-indiquer l’administration d’un traitement antiangiogénique en raison d’une hypertension asymptomatique découverte avant ou le jour de l’administration du traitement.
Avant l’initiation de la thérapie ciblée, les patients symptomatiques au plan cardiovasculaire, avec ou sans cardiopathie structurale, doivent bénéficier d’une consultation de cardiologie (idéalement au sein d’une structure de cardio-oncologie) avec pour objectif de préciser et prendre en charge les symptômes afin d’introduire rapidement la thérapie ciblée après prise en charge et optimisation des traitements.
La thérapie ciblée peut être débutée sans évaluation supplémentaire, et notamment sans avis cardiologique préalable, si le patient est asymptomatique sur le plan cardiologique, que la pression artérielle mesurée est normale ou contrôlée sous traitement antihypertenseur, et qu’il n’existe pas d’atteinte rénale définie par un débit de filtration glomérulaire (DFG) inférieur à 30 mL/min/1,73m² et par une protéinurie des 24 heures >0,3 g/j. Les patients devront être suivis de manière régulière lors des consultations d’oncologie et éventuellement être dirigés vers un cardio-oncologue en cas d’hypertension de novo, d’une déstabilisation d’une hypertension déjà connue ou en cas d’apparition de symptômes.
Il n’y a pas lieu de contre-indiquer l’administration d’un traitement antiangiogénique en raison d’une hypertension asymptomatique découverte avant ou le jour de l’administration du traitement.
Avant l’initiation de la thérapie ciblée, les patients symptomatiques au plan cardiovasculaire, avec ou sans cardiopathie structurale, doivent bénéficier d’une consultation de cardiologie (idéalement au sein d’une structure de cardio-oncologie) avec pour objectif de préciser et prendre en charge les symptômes afin d’introduire rapidement la thérapie ciblée après prise en charge et optimisation des traitements.
Comment surveiller les patients au décours de l’instauration de la thérapie ciblée ?
La mesure de la pression artérielle doit être réalisée avant initiation de la thérapie ciblée, puis toutes les semaines pendant 4 semaines, puis tous les mois et selon les recommandations de la Haute Autorité de santé (HAS) [automesure, mesure ambulatoire de la pression artérielle (MAPA), mesure en cabinet] (v. figure).
En cas d’hypertension documentée, un traitement antihypertenseur doit être instauré, fondé sur les recommandations de la Haute Autorité de santé. Certains traitements dont les inhibiteurs calciques bradycardisants ne doivent pas être prescrits en raison du risque d’inter- actions médicamenteuses avec le CYP3A4 dont nombre de thérapies ciblées sont le substrat.
L’administration de la thérapie ciblée est interrompue et contre-indiquée pour les patients développant une hypertension symptomatique (hypertension maligne, encéphalopathie hypertensive, insuffisance cardiaque, accident vasculaire cérébral, angor instable) ou une protéinurie supérieure à 3 g/24 heures ou un débit de filtration glomérulaire inférieur à 30 mL/min/m².
En cas d’hypertension documentée, un traitement antihypertenseur doit être instauré, fondé sur les recommandations de la Haute Autorité de santé. Certains traitements dont les inhibiteurs calciques bradycardisants ne doivent pas être prescrits en raison du risque d’inter- actions médicamenteuses avec le CYP3A4 dont nombre de thérapies ciblées sont le substrat.
L’administration de la thérapie ciblée est interrompue et contre-indiquée pour les patients développant une hypertension symptomatique (hypertension maligne, encéphalopathie hypertensive, insuffisance cardiaque, accident vasculaire cérébral, angor instable) ou une protéinurie supérieure à 3 g/24 heures ou un débit de filtration glomérulaire inférieur à 30 mL/min/m².
Surveiller et adapter
L’hypertension artérielle secondaire à l’administration d’une thérapie ciblée est un effet de classe fréquemment observé qui peut apparaître dès la 1re semaine de traitement chez les patients atteints de cancer. Sa prise en charge repose sur l’instauration d’un traitement médicamenteux dans la majorité des cas, en évitant les classes thérapeutiques qui peuvent interférer avec le CYP3A4.
L’hypertension artérielle secondaire à l’administration d’une thérapie ciblée peut se compliquer plus rarement d’une atteinte rénale, avec altération de la fonction rénale, protéinurie ou bien microangiopathie thrombotique. Une surveillance régulière de la pression artérielle, ainsi qu’une adaptation du traitement antihypertenseur permet, dans la majorité des cas, de contrôler l’hypertension artérielle sans avoir recours à une modulation de la posologie de la thérapie ciblée.
L’hypertension artérielle secondaire à l’administration d’une thérapie ciblée peut se compliquer plus rarement d’une atteinte rénale, avec altération de la fonction rénale, protéinurie ou bien microangiopathie thrombotique. Une surveillance régulière de la pression artérielle, ainsi qu’une adaptation du traitement antihypertenseur permet, dans la majorité des cas, de contrôler l’hypertension artérielle sans avoir recours à une modulation de la posologie de la thérapie ciblée.
Références
1. Nazer B, Humphreys BD, Moslehi J. Effects of novel angiogenesis inhibitors for the treatment of cancer on the cardiovascular system: focus on hypertension. Circulation 2011;124:1687-91.
2. Izzedine H, Perazella MA. Anticancer drug-induced acute kidney injury. Kidney Int Rep 2017;2:504-14.
3. Izzedine H, Ederhy S, Goldwasser F, et al. Management of hypertension in angiogenesis inhibitor-treated patients. Ann Oncol 2009;20:807-15.
4. Halimi JM, Azizi M, Bobrie G, et al. Vascular and renal effects of anti-angiogenic therapy. Nephrol Ther 2008;4:602-15.
5. Pandey AK, Singhi EK, Arroyo JP, et al. Mechanisms of VEGF (vascular endothelial growth factor) inhibitor-associated hypertension and vascular disease. Hypertension 2018;71:e1-e8.
6. Totzeck M, Mincu RI, Mrotzek S, Schadendorf D, Rassaf T. Cardiovascular diseases in patients receiving small molecules with anti-vascular endothelial growth factor activity: a meta-analysis of approximately 29,000 cancer patients. Eur J Prev Cardiol 2018;25:482-94.
7. Totzeck M, Mincu RI, Rassaf T. Cardiovascular adverse events in patients with cancer treated with bevacizumab: a meta-analysis of more than 20 000 patients. J Am Heart Assoc 2017;6:e006278.
2. Izzedine H, Perazella MA. Anticancer drug-induced acute kidney injury. Kidney Int Rep 2017;2:504-14.
3. Izzedine H, Ederhy S, Goldwasser F, et al. Management of hypertension in angiogenesis inhibitor-treated patients. Ann Oncol 2009;20:807-15.
4. Halimi JM, Azizi M, Bobrie G, et al. Vascular and renal effects of anti-angiogenic therapy. Nephrol Ther 2008;4:602-15.
5. Pandey AK, Singhi EK, Arroyo JP, et al. Mechanisms of VEGF (vascular endothelial growth factor) inhibitor-associated hypertension and vascular disease. Hypertension 2018;71:e1-e8.
6. Totzeck M, Mincu RI, Mrotzek S, Schadendorf D, Rassaf T. Cardiovascular diseases in patients receiving small molecules with anti-vascular endothelial growth factor activity: a meta-analysis of approximately 29,000 cancer patients. Eur J Prev Cardiol 2018;25:482-94.
7. Totzeck M, Mincu RI, Rassaf T. Cardiovascular adverse events in patients with cancer treated with bevacizumab: a meta-analysis of more than 20 000 patients. J Am Heart Assoc 2017;6:e006278.