DIAGNOSTIQUER une thrombose veineuse profonde et une embolie pulmonaire.
IDENTIFIER les situations d’urgence et PLANIFIER leur prise en charge.
ARGUMENTER l’attitude thérapeutique et PLANIFIER le suivi du patient.
CONNAÎTRE les indications et les limites d’un bilan de thrombophilie.
Introduction
L’objectif de cette question est de savoir diagnostiquer une MTEV et d’argumenter la prise en charge thérapeutique et étiologique. La problématique des thromboses veineuses superficielles et des TVP de localisations dites atypiques (membre supérieur, cérébrales, digestives, rénales …) ne seront pas abordées dans ce chapitre.
Épidémiologie et facteurs de risque de MTEV
En plus de l’âge et de l’obésité, les principaux facteurs de risque cliniques de MTEV sont résumés dans le
En l’absence de facteurs de risque majeurs transitoires ou persistants identifiés, on parle de maladie non provoquée.
Stratégie diagnostique de la MTEV
Signes cliniques de TVP et d’EP
Les principaux signes de TVP sont la présence d’un œdème (mesuré comparativement au membre controlatéral), blanc, avec perte du ballotement du mollet et d’autant plus proximal que la TVP est extensive. La TVP peut se manifester par une douleur majorée à la pression du mollet et à la dorsiflexion (signe de Homans) ou par une dilatation d’une veine non variqueuse.
Le caractère brutal et unilatéral des signes constitue des éléments cruciaux d’orientation diagnostique.
Les principaux signes cliniques d’EP sont la présence d’une tachycardie (pouvant s’accompagner d’arythmie), d’une douleur thoracique (de type pleural), d’une dyspnée (fréquence respiratoire ≥ 20/min) et d’une hémoptysie. La survenue d’une syncope, d’une hypotension ou d’un choc cardiogénique sont des signes témoignant de la gravité de l’EP.
Il n’existe aucun signe pathognomonique de TVP et d’EP. Pris séparément, chaque signe clinique est fréquent en dehors de tout contexte de MTEV, et donc est peu sensible et peu spécifique. Aussi, un diagnostic, positif ou négatif, ne peut être posé à partir de la seule clinique.
Enfin, toute fièvre traînante ou tachycardie inexpliquée chez un patient ayant des facteurs de risque de MTEV doit faire évoquer le diagnostic.
Examens complémentaires
Principaux examens complémentaires de la MTEV
Électrocardiogramme : il peut être normal. En cas d’EP, on peut retrouver une tachycardie sinusale, une arythmie complète par fibrillation auriculaire ou des signes de cœur droit aigu (rotation axiale droite par dilatation des cavités droites avec aspect S1Q3(T3) [onde S en D1, onde Q en D3 et ondes T négatives en antérieur], bloc de branche droit complet ou non) témoignant d’une dilatation du ventricule droit.La comparaison avec des électrocardiogrammes antérieurs, s'ils sont disponibles, est une aide précieuse pour éliminer les diagnostics différentiels en présence d’une douleur thoracique.
D-dimères : ils sont les produits de dégradation de la fibrine et sont augmentés en présence d’un thrombus. Leur valeur prédictive négative est supérieure à 98 % en cas d’EP ou de TVP proximale ; cela permet d’exclure le diagnostic de MTEV en cas de négativité des D-dimères (lorsque ceux-ci sont mesurés avec une technique dite ultrasensible) et de probabilité clinique faible ou intermédiaire. Les D-dimères manquent de spécificité et sont élevés dans de nombreuses autres situations cliniques telles que l’âge (augmentent avec l’âge), la grossesse, le cancer, les infections, l’inflammation, la chirurgie récente… Cependant, la négativité de leur dosage garde la même valeur d’exclusion dans ces situations cliniques. Un seuil ajusté à l’âge peut être utilisé, uniquement en cas de suspicion d’EP au-delà de 50 ans, avec un seuil maximal égal à âge ×10.
Écho-Doppler veineux des membres inférieurs : il constitue l’examen de référence pour diagnostiquer les TVP. C’est un examen non invasif qui a une sensibilité et une spécificité > 95 % pour le diagnostic des TVP proximales et dont les performances sont moindres pour diagnostiquer les TVP distales. Il doit être réalisé en cas de D-dimères élevés ou de score de probabilité clinique élevée ou probable de TVP. L’ensemble du réseau veineux profond, les crosses saphéniennes et toute veine superficielle suspecte de thrombose sont explorés morphologiquement par échographie de compression veineuse. Le diagnostic de TVP est posé en cas d’impossibilité de compression de la veine sur le tissu adjacent. En effet, le thrombus récent est anéchogène, et une veine non thrombosée est normalement compressible. Le caractère hyperéchogène d’un thrombus traduit son ancienneté. L’écho-Doppler veineux permet donc d’affirmer ou d’exclure un diagnostic de TVP. Il est aussi utile chez le patient suspect d’EP chez qui l’on ne souhaite pas ou ne peut pas réaliser d’examen diagnostique spécifique (irradiation chez la femme enceinte, insuffisance rénale et angioscanner…) : la présence d’une TVP proximale permet de poser le diagnostic d’EP en cas de suspicion d’EP et autorise à surseoir la réalisation de tout autre examen. Enfin, il n’est pas rare que l’écho-Doppler permette de poser un diagnostic différentiel : rupture de kyste poplité, hématome…
Angioscanner thoracique : examen diagnostique de référence en cas de suspicion d’EP. À réaliser en cas de D-dimères élevés ou de score de probabilité clinique élevée/probable. En pratique, lorsqu’il est réalisé et interprété dans de bonnes conditions, il permet d’affirmer ou d’exclure le diagnostic d’EP. Une embolie pulmonaire se manifeste par un « défect endovasculaire » responsable d’une image hypodense au sein du produit de contraste hyperdense dans l’arbre vasculaire. Ses deux principales contre-indications sont l’allergie aux produits de contraste iodés et l’insuffisance rénale sévère. L’angioscanner présente le double intérêt de pouvoir poser ou exclure le diagnostic d’embolie pulmonaire et de rechercher des diagnostics différentiels.
Scintigraphie de ventilation-perfusion : cet examen consiste à faire inhaler un gaz radioactif au patient (scintigraphie de ventilation) et à injecter des macro-agrégats d’albumine radiomarqués (scintigraphie de perfusion). En cas d’EP, on retrouvera un « mismatch » c’est-à-dire une discordance avec la scintigraphie de perfusion pathologique (= thrombus artériel pulmonaire) dans un territoire normoventilé (absence d’anomalie à la scintigraphie de ventilation). Une scintigraphie ventilation/perfusion normale exclut le diagnostic d’EP, et une forte probabilité scintigraphique confirme le diagnostic d’EP. Cependant, dans de nombreux cas (jusqu’à 40 %), la scintigraphie est non conclusive (probabilité scintigraphique faible ou intermédiaire d’EP). Cet examen ne doit pas être privilégié en cas de pathologie respiratoire aiguë (pneumopathie…) ou chronique (bronchopneumopathie chronique obstructive [BPCO]…) en raison de la probabilité importante que cet examen soit non conclusif. En revanche, étant moins irradiant que l’angioscanner thoracique, la scintigraphie peut/doit être proposée, si disponible, chez le sujet jeune ou la femme enceinte.
Échographie cardiaque transthoracique (ETT) : en cas de suspicion d’EP, elle recherche des signes de cœur pulmonaire aigu avec notamment une dilatation des cavités droites, une dysfonction ventriculaire droite, la visualisation d’un septum paradoxal ou d’un thrombus dans les cavités cardiaques droites. Elle permet de dépister une hypertension pulmonaire. Sa normalité n’exclut pas le diagnostic d’EP. L’ETT est utile, en urgence, au lit du patient en cas de suspicion d’EP grave chez un patient instable qui ne peut être transporté en radiologie : la présence de signes droits aigus et l’élimination de diagnostics différentiels (dissection aortique, tamponnade…) permet de poser le diagnostic d’EP et autorisent la réalisation d’un traitement fibrinolytique sans délai.
Autres examens complémentaires
Gaz du sang : hypoxémie secondaire à un effet espace mort initial (zones non perfusées mais ventilées), un effet shunt (bronchoconstriction réflexe avec zones non ventilées mais perfusées avec classiquement un tableau d’hypoxie-hypocapnie calculé par PaO2 + PaCO2 < 120 mmHg). Une hypoxémie < 60 mmHg témoigne de la sévérité de l’EP. Les gaz du sang ne doivent pas être systématiquement réalisés et peuvent même être dangereux en cas de nécessité de thrombolyse ultérieure.Troponine et brain natriuretic peptide (BNP) : leur élévation témoigne d’un retentissement cardiaque de l’EP et est un marqueur de sévérité. Le dosage doit être réalisé en cas de score sPESI ≥ 1 afin d’estimer le pronostic.
Radio de thorax : devant un tableau respiratoire aigu, sa normalité est évocatrice du diagnostic d’EP. On peut dans certains cas observer une ascension des coupoles diaphragmatiques, une atélectasie, un épanchement pleural, une opacité pulmonaire à base triangulaire (infarctus pulmonaire), une hyperclarté parenchymateuse par défaut de vascularisation (signe de Westermarck), un élargissement des artères pulmonaires. Cet examen ne permet en aucun cas de diagnostiquer une EP à lui seul.
Angioscanner veineux des membres inférieurs : en cas de suspicion de TVP, et d’impossibilité de réaliser un écho-Doppler veineux (patient plâtré…) ou de doute diagnostique persistant après écho-Doppler veineux (patient obèse, TVP iliaque ou cave suspendue…), l’angioscanner veineux peut permettre de poser le diagnostic de TVP.
La phlébographie et l’angiographie pulmonaire : ces examens ne sont plus réalisés en routine clinique pour le diagnostic d’EP et TVP en raison de leur caractère invasif.
L’angio-IRM pulmonaire est en cours d’évaluation, mais actuellement non recommandée comme test diagnostique de l’EP. L’IRM pourrait revêtir un intérêt particulier en cas de suspicion de récidive de MTEV pour différencier un thrombus récent d’un thrombus ancien.
Stratégies diagnostiques
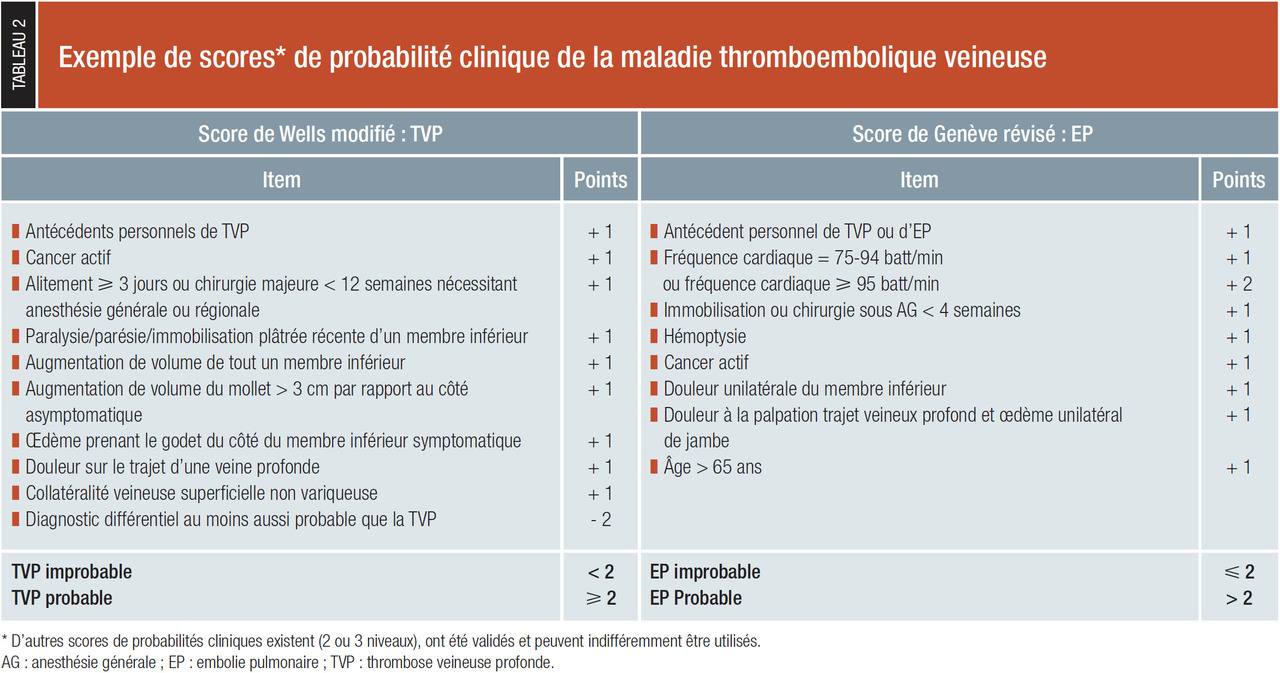
Estimation de la probabilité clinique d’EP ou de TVP (tableau 2)
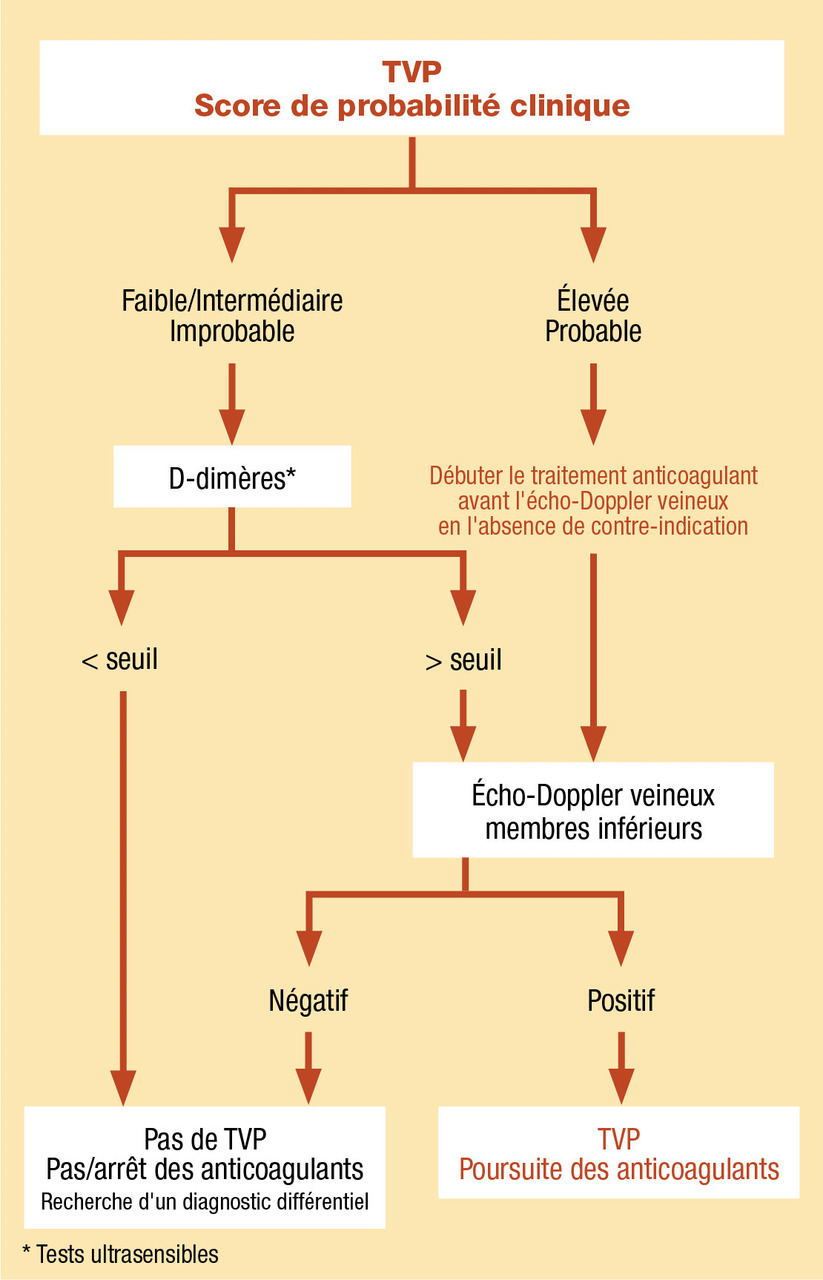
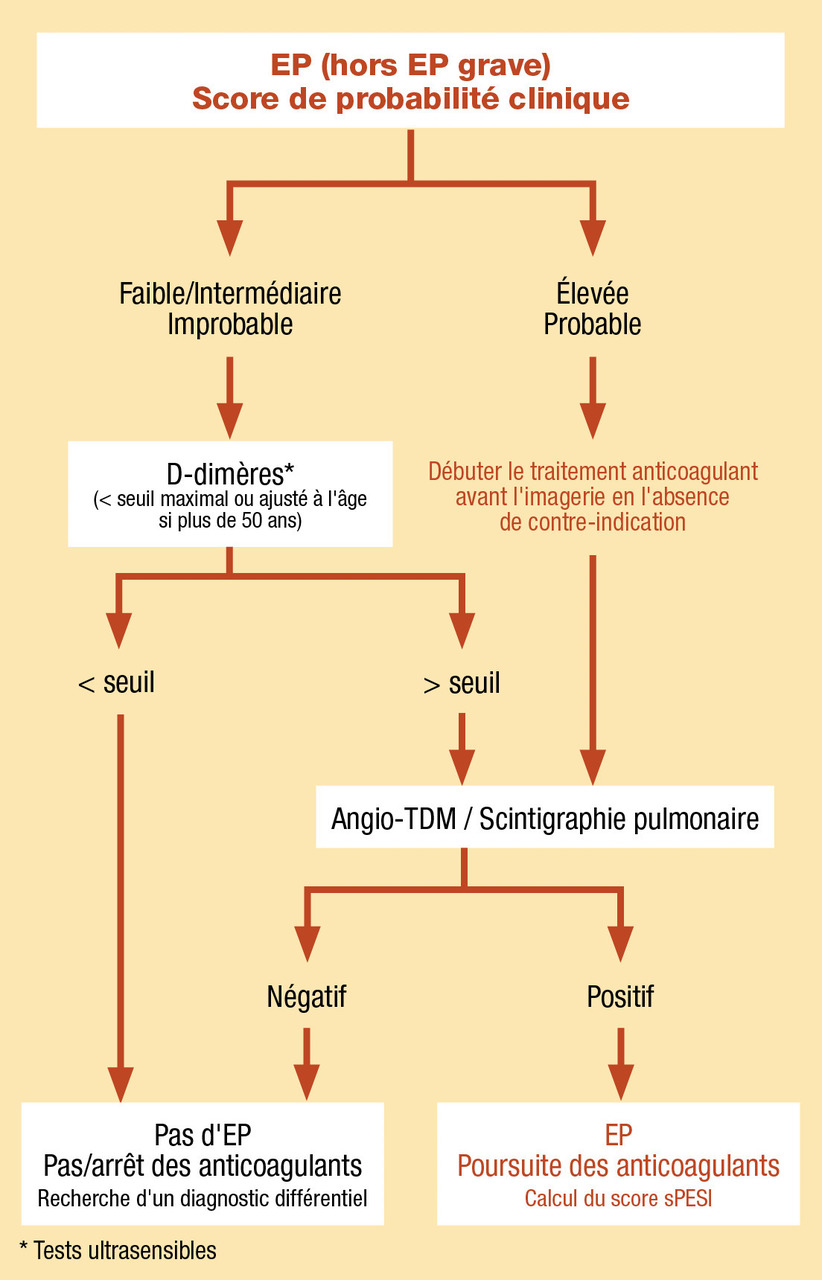
Il s’agit du risque a priori de MTEV, estimé à partir de scores de probabilité clinique, intégrant des éléments d’anamnèse et d’examen clinique. Ces scores catégorisent le risque de MTEV en niveaux faible, intermédiaire ou élevé (score à 3 niveaux) ou improbable ou probable (score à 2 niveaux). Ils peuvent être utilisés indifféremment. Les scores les plus fréquemment utilisés en France sont le score de Wells dans la TVP et le score de Genève dans l’EP. À noter que l’estimation clinique empirique de la probabilité de MTEV est au moins aussi efficace que l’estimation via les scores lorsqu’elle est réalisée par des praticiens expérimentés.Réalisation d’examens complémentaires (fig. 1 et 2)
Probabilité clinique faible/intermédiaire ou improbable : dosage des D-dimères par technique ultrasensible qui, en cas de négativité (i.e. valeur inférieure au seuil de positivité), exclut le diagnostic de MTEV. Si les D-dimères sont élevées il faut alors confirmer le diagnostic avec des examens complémentaires d’imagerie.Probabilité clinique forte ou probable : réalisation d’examens d’imagerie d’emblée pour confirmer ou exclure le diagnostic. Il s’agit en cas de suspicion de TVP, d’un écho-Doppler veineux des membres inférieurs et en cas de suspicion d’EP, d’un angioscanner thoracique ou d’une scintigraphie pulmonaire de ventilation-perfusion. En l’absence de risque hémorragique et de contre-indication, il est préférable de débuter le traitement anticoagulant à dose curative avant même la réalisation de ces examens.
Cas particuliers des femmes enceintes
Les D-dimères gardent leur intérêt au cours de la grossesse mais sont de moins en moins rentables en raison de leur augmentation naturelle au fur et à mesure de l’avancée de la grossesse. Si une imagerie est nécessaire en cas de suspicion d’EP, il faut réaliser en première intention un écho-Doppler veineux des membres inférieurs à la recherche d’une TVP proximale et privilégier une scintigraphie de ventilation-perfusion si une imagerie thoracique est nécessaire.Reconnaître la gravité d’une MTEV
Gravité de l’EP : une EP grave est définie sur la base de critères hémodynamiques par la survenue d’un choc cardiogénique ou d’une hypotension (définie par une pression artérielle [PA] < 90 mmHg de systolique ou une chute de plus de 40 mmHg de la PA systolique pendant plus de 15 minutes sans autre cause retrouvée). Le diagnostic repose sur la réalisation d’un angioscanner en urgence si l’état hémodynamique le permet ; sinon, une échographie cardiaque transthoracique est faite au lit du patient afin de rechercher des arguments pour un cœur droit aigu. Si le diagnostic d’EP est retenu, une thrombolyse systémique ou in situ ou une embolectomie (en cas de contre-indication absolue à une fibrinolyse ou si échec de celle-ci) en urgence est nécessaire. En l’absence d’argument pour une EP grave, les investigations doivent être poussées, à la recherche d’une étiologie alternative.
Diagnostics différentiels
EP : selon le contexte et les facteurs de risque, devant une douleur thoracique ou devant une dyspnée, on peut évoquer une cause cardiaque (syndrome coronaire aigu, péricardite, insuffisance cardiaque…) ou pulmonaire (pneumopathie, pneumothorax…), ou une dissection aortique (v. item 228).
Prise en charge thérapeutique
Évaluation du pronostic des EP (tableau 3)
L’EP à bas risque est définie par un sPESI égal à 0. La mortalité à 30 jours est faible, de l’ordre de 1 %.
L’EP de gravité intermédiaire est définie par un sPESI ≥ 1. La mortalité à 30 jours est > 10 %. Elle est subdivisée en deux sous-groupes : les EP de gravité intermédiaire haute s’il existe des signes biologiques (NT-proBNP et/ou troponine élevés) ET des signes d’imagerie (angioscanner ou échographie transthoracique) de dysfonction ventriculaire droite et de gravité intermédiaire basse dans les autres cas.
Lieu de la prise en charge initiale
L’hospitalisation des TVP proximales est nécessaire en cas de survenue malgré un traitement anticoagulant curatif bien conduit ou une suspicion de thrombopénie induite par les héparines (TIH), d’une TVP bilatérale, d’un syndrome obstructif sévère ou de phlegmatia coerulea, de présence d’un risque hémorragique majeur ou de comorbidités importantes (insuffisance rénale sévère, néoplasie…), d’un contexte psychosocial défavorable (dont absence de couverture médicale ou impossibilité de se procurer les traitements anticoagulants, absence d’adhésion du patient ou support familial, éloignement d’un centre de soins ou impossibilité d’organiser un suivi [filière de soins]…).
Le traitement ambulatoire des EP est possible dans le cas des EP hémodynamiquement stables dont le diagnostic a été confirmé et à faible risque de décès tel que défini, par exemple, par un sPESI égal à 0 (
Dans tous les cas, un bilan initial minimal incluant le dosage de la créatininémie, l'hémogramme, l’hémostase et un bilan hépatique est indiqué.
Prescription du traitement anticoagulant (v. item 326)
Anticoagulants oraux directs (AOD)
Ce sont des traitements oraux, et l’on distingue les « -XABan » comprenant l’apixaban, l’edoxaban et le rivaroxaban qui sont des anti-Xa et les « -GATRan » représentés par le dabigatran qui est un anti-IIa. Ils ont tous la particularité de ne pas nécessiter une surveillance biologique de l’hémostase. Les seuls actuellement disponibles en France, ayant une autorisation de mise sur le marché (AMM) et un prix de remboursement dans le traitement curatif de la MTEV, sont le rivaroxaban et l’apixaban. Ils sont tous rapidement efficaces (entre 1 et 4 heures) et sont aussi efficaces que les antagonistes de la vitamine K (AVK) en termes de traitement de la MTEV, de prévention de la récidive et sont associés à un risque hémorragique équivalent ou moindre (notamment moins d’hémorragies graves, intracrâniennes). Les traitements par rivaroxaban et apixaban peuvent être débutés dès le premier jour tandis que l’edoxaban et le dabigatran ne peuvent être initiés qu’après une phase initiale d’au moins 5 jours de traitement par héparine. Les schémas thérapeutiques usuels dans le traitement de la MTEV pour le rivaroxaban et l’apixaban sont les suivants :– rivaroxaban : 15 mg deux fois par jour les 21 premiers jours, puis 20 mg une fois par jour ;
– apixaban : 10 mg deux fois par jour pendant 7 jours, puis 5 mg deux fois par jour.
Les principales précautions d’emploi des anticoagulants oraux directs sont rénales, hépatiques et médicamenteuses. Ils ne doivent pas être prescrits pour un débit de filtration glomérulaire (DFG) < 30 mL/min (estimé par la formule de Cockcroft-Gault) pour le rivaroxaban et pour un DFG < 25 mL/min pour l’apixaban. Certains médicaments (certains antiprotéases, antifongiques azolés, antiépileptiques et antibiotiques essentiellement) sont susceptibles d’interagir avec les anticoagulants oraux directs.
Héparine de bas poids moléculaire (HBPM) relais AVK
Jusqu’à très récemment il s’agissait du schéma classique. À l’inverse de la fibrillation auriculaire, les AVK ne peuvent pas être instaurés directement sans utilisation concomitante d’HBPM en raison de la nécessité pour le patient d’être immédiatement anticoagulé efficacement et du sur-risque thrombotique lié à la diminution initiale des protéines C et S.Initiation du traitement par HBPM : en l’absence d’insuffisance rénale sévère (DFG < 30 mL/min) et après contrôle plaquettaire initial, une HBPM dont la posologie varie de 171 à 200 UI/kg/j en une ou deux injections quotidiennes selon la molécule est administrée par voie sous-cutanée. La surveillance de l’hémostase (activité anti-Xa, 4 heures après l’injection) est inutile dans la plupart des cas mais peut être réalisée en cas de poids extrême, d’insuffisance rénale modérée ou d’accident hémorragique. La surveillance des plaquettes devra être adaptée au niveau de risque du patient et est nécessaire en cas de contexte chirurgical et de cancer à raison de 2 ou 3 fois par semaine pendant les premières semaines. Les HBPM disponibles en France sont l’énoxaparine (AMM : TVP-EP), la tinzaparine (AMM : TVP/EP), la nadroparine (AMM : TVP), la daltéparine (AMM : TVP). Le fondaparinux (AMM : TVP-EP), anti-Xa injectable, peut aussi être utilisé aux posologies de 5 mg, 7,5 mg ou 10 mg en fonction du poids et ne nécessite pas de surveillance plaquettaire.
Relais AVK : sauf cas particulier, il doit être débuté dès le premier jour et impose une surveillance rapprochée de l’hémostase (dosagede l’international normalized ratio, [INR]) tout au long du traitement. Les HBPM peuvent être interrompues après 5 jours de traitement AVK minimum, dès l’obtention de 2 INR successifs > 2 à 24 heures d’intervalle. La cible d’INR est de 2,5 (INR 2 à 3). L’INR doit être surveillé 72 heures après toute modification posologique et au moins une fois par mois chez les patients bien équilibrés. L’AVK le plus utilisé en France et dans le monde est la warfarine. Les AVK ont comme principal avantage de pouvoir être utilisés quelle que soit la fonction rénale mais présentent le désavantage d’avoir de nombreuses interactions médicamenteuses.
Héparines non fractionnées (HNF) relais AVK
Ce schéma thérapeutique n’est plus guère utilisé que dans des conditions particulières d’insuffisance rénale sévère contre-indiquant les HBPM et les anticoagulants oraux directs, de nécessité de fibrinolyser (i.e. EP grave ou instable) ou en cas de risque hémorragique important en raison de leur demi-vie courte.HNF : après un bolus initial de 80 UI/kg en intraveineuse lente, une perfusion continue à une posologie initiale de 18 UI/kg/h est débutée. La surveillance doit être réalisée 6 heures après l’initiation, 4-6 heures après chaque changement de posologie et au moins 1 fois par jour par la mesure du temps de céphaline activée (TCA) [l’objectif usuel est un ratio entre 2-3]. À noter qu’en cas d’allongement spontané du TCA (comme dans le cas d’un anticoagulant circulant lupique), la mesure de l’anti-Xa doit être privilégiée. Une surveillance plaquettaire bihebdomadaire pendant les 30 premiers jours est obligatoire puis régulièrement si le traitement est prolongé. Les HNF peuvent aussi être prescrites par voie sous-cutanée (calciparine) à la même posologie et réparties en 2 ou 3 injections en fonction de la dose.
Relais AVK : à effectuer selon même modalités d’introduction et de surveillance que le relais HBPM-AVK.
Cas particuliers
MTEV et cancer : en raison d’un plus grand risque de récidive de MTEV sous AVK chez le patient ayant un cancer, il était recommandé de traiter initialement les patients 3 à 6 mois par HBPM. Les récentes données sur les anticoagulants oraux directs dans le cancer suggèrent que les anticoagulants oraux directs (apixaban, édoxaban, rivaroxaban) sont au moins aussi efficaces que les HBPM mais seraient associés à un sur-risque hémorragique, notamment en cas de tumeurs digestives ou urologiques. En pratique, le choix de la molécule dans ce contexte (HBPM vs AOD) doit être effectué en tenant compte de la préférence du patient, du risque hémorragique et des possibles interactions médicamenteuses entre anticoagulants oraux directs avec les chimiothérapies et les immunothérapies (aucune interaction avec les HBPM).MTEV et grossesse : en pratique, seules les héparines peuvent être utilisées au cours de la grossesse (les AVK ne peuvent être utilisés qu’exceptionnellement en cas d’indication formelle comme les valves cardiaques mécaniques à [très] haut risque…). Pour l’allaitement, les héparines et les AVK (excepté la fluindione) sont les seuls autorisés. Les anticoagulants oraux directs sont formellement contre-indiqués.
MTEV et contre-indication absolue aux anticoagulants : ne pas introduire de traitement anticoagulant tant que la contre-indication absolue est présente. Cette situation peut nécessiter la pose d’un filtre cave temporaire en cas de TVP proximale récente. Le filtre cave pourra être retiré une fois la contre-indication à l’anticoagulation terminée.
Récidive ou extension de MTEV malgré un traitement anticoagulant bien conduit : s’assurer de la bonne prise du traitement, de sa bonne équilibration, de l’absence d’interaction médicamenteuse et, en cas de traitement héparinique, de l’absence de thrombopénie induite à l’héparine (TIH). Les principales causes d’échec d’un traitement anticoagulant bien conduit sont le cancer et le syndrome des antiphospholipides, qu’il faut éliminer. L’attitude thérapeutique pratique, lorsque la MTEV survient sous AVK ou sous anticoagulants oraux directs, est de remplacer ces traitements par un traitement par HBPM. Si la MTEV survient sous HBPM, on augmentera sa posologie de 20 % (et on passe à un schéma en 2 injections par jour plutôt qu’une fois par jour). En dernier recours, on peut discuter la pose d’un filtre cave.
Durée du traitement anticoagulant
En pratique, il est acquis que :
- MTEV avec facteur favorisant transitoire majeur : traitement de 3 mois ;
- MTEV non provoquée/idiopathique : durée non limitée de traitement avec réévaluation régulière du rapport bénéfice-risque du traitement. Des scores de risque de récidive ont été développés pour identifier, au sein des MTEV non provoquées, les populations qui pourraient interrompre le traitement anticoagulant après un premier épisode de MTEV. Le plus connu de ces scores est le score HERDOO2 où en pratique les femmes jeunes (< 65 ans), non obèses (IMC < 30 kg/m2), avec D-dimères négatifs sous traitement anticoagulant (< 250 µg/L en technique VIDAS) et sans insuffisance veineuse significative sont à faible risque de récidive, alors que les hommes et les femmes n’ayant pas au moins 2 de ces critères sont à haut risque de récidive. Dans la pratique, ces scores sont utilisés au cas par cas. Dans cette situation clinique, s’il est décidé de prolonger le traitement anticoagulant au-delà de 6 mois, des études suggèrent que l’utilisation d’anticoagulants oraux directs à dose réduite (rivaroxaban 10 mg une fois par jour ou apixaban 2,5 mg deux fois par jour) présente une efficacité clinique équivalente aux anticoagulants oraux directs à dose thérapeutique habituelle. La décision de diminuer la dose d’anticoagulants oraux directs doit être prise au cas par cas d’un commun accord avec le patient et en l’absence de très haut risque de récidive ;
- MTEV non provoquée récidivante : traitement d’une durée non limitée avec réévaluation régulière du rapport bénéfice-risque ;
- MTEV et cancer : en pratique, le traitement anticoagulant doit être poursuivi tant que le cancer est considéré comme actif (c’est-à-dire s’il a été diagnostiqué ou traité dans les 6 derniers mois, s’il est en cours de traitement ou non considéré comme en rémission complète). Le risque hémorragique doit être pris en compte dans le choix de la molécule ;
- MTEV et syndrome des antiphospholipides (SAPL) : indication à un traitement prolongé par antivitamine-K avec INR cible entre 2 et 3 en l’absence de récidive thrombotique sous traitement. Les anticoagulants oraux directs sont de facto contre-indiqués dans cette situation (contre-indication absolue en cas de triple positivité ou d’antécédents thrombotiques artériels) ;
- EP compliquée d’une hypertension pulmonaire thromboembolique chronique : traitement non limité avec réévaluation régulière du rapport bénéfice-risque du traitement.
Cas particulier des TVP distales
Elles représentent un cas particulier où la durée mais aussi la nécessité de traiter par anticoagulants sont débattues. Classiquement, une TVP distale provoquée par un facteur favorisant transitoire fort peut être traitée 6 semaines et dans les autres cas 3 mois. En cas de TVP distale isolée et de contre-indication à un traitement anticoagulant, on réalise une simple surveillance échographique de la thrombose à 1 semaine pour s’assurer de l’absence d’extension aux veines proximales.Cas particulier de la MTEV pendant la grossesse et le post-partum
La grossesse constitue un facteur de risque de thrombose transitoire majeur. Si la thrombose intervient durant la grossesse, il est recommandé de traiter la patiente pendant toute la grossesse (en raison de l’augmentation progressive du risque de thrombose) et dans les 6 semaines du post-partum, avec une durée minimale de traitement de 3 mois. En cas de thrombose dans le post-partum, la durée de traitement est de 3 mois.Autres traitements
Compression élastique
En cas de TVP proximale, le port de chaussettes de compression élastique de classe III (20-36 mmHg) pendant 2 ans pour prévenir le syndrome post-thrombotique a longtemps été recommandé, mais son efficacité est désormais débattue. Après un diagnostic de TVP, l’utilisation de la compression est suggérée pour soulager les symptômes aigus et est recommandée pour traiter toute manifestation d’insuffisance veineuse chronique (IVC) avérée. L’usage de la compression sur le long terme (> 6 mois) pour prévenir le syndrome post-thrombotique n’est plus systématique. En cas de syndrome post-thrombotique avéré, la compression prolongée constitue, comme pour toute IVC, la base du traitement.Fibrinolyse
Traitement prescrit en complément du traitement anticoagulant, par voie intraveineuse ou par cathétérisation in situ pour limiter le risque hémorragique. Du fait du risque hémorragique important, elle doit être réservée aux situations de péril vital (EP grave) ou de sauvetage de membre (phlegmatia coerulea). Son administration doit se faire sous surveillance médicale rapprochée et par une équipe spécialisée.Filtre cave
Déployé dans la veine cave inférieure par radiologie interventionnelle, ces filtres ont pour vocation d’arrêter la migration des thrombus des membres inférieurs vers les artères pulmonaires. Leur efficacité n’est pas absolue, ils bloquent les embols de grosse taille mais ne traitent pas les EP déjà constituées et exposent à un risque accru de TVP par la suite. Ils sont indiqués en cas de contre-indication absolue au traitement anticoagulant en cas de TVP proximale récente (et dans une moindre mesure en cas d’échec du traitement anticoagulant). Les nouvelles générations de filtres caves dits temporaires peuvent être retirés une fois le risque hémorragique passé.Contraception
Même si la MTEV est survenue en dehors de toute prise d’estroprogestatifs, l’utilisation ultérieure de ceux-ci est contre-indiquée. Ils pourront être remplacés par une contraception progestative seule ou un dispositif implantable.Traitement symptomatique
Éducation thérapeutique
Bilan étiologique
Recherche de néoplasie
Le cancer est un facteur de risque de MTEV, et la MTEV peut être le premier signe d’un cancer. Aussi, en cas de MTEV non provoquée par un facteur transitoire majeur, il est légitime de proposer en plus du bilan standard préthérapeutique et de l’examen clinique un complément d’examens adapté au patient qui correspond à la mise à jour des dépistages néoplasiques recommandés par les autorités (frottis pour l’ensemble des femmes et mammographie pour les femmes de plus de 50 ans, toucher rectal et PSA pour les hommes de pluq de 50 ans, dépistage du cancer colorectal chez les hommes et les femmes de plus de 50 ans…) ainsi qu’un hémogramme et une calcémie. La réalisation d’examens d’imagerie comme une tomodensitométrie thoraco-abdomino-pelvienne ou un TEP-scan n’est pas systématique et doit être décidée au cas par cas avec le patient et en fonction de l’examen clinique. Elle doit être systématique en cas de MTEV idiopathique avec récidives rapprochées.Indications et limites d’un bilan de thrombophilie en contexte de MTEV
La recherche d’une thrombophilie biologique constitutionnelle ou acquise doit se faire idéalement en dehors de tout traitement anticoagulant et en dehors de la phase aiguë de la MTEV. Elle comprend la recherche des thrombophilies constitutionnelles fréquentes (mutations du facteur II et du facteur V), ou plus rares avec les dosages de l’antithrombine III, la protéine C, la protéine S. La principale thrombophilie acquise est le syndrome des antiphospholipides (SAPL) : anticoagulant circulant lupique, anticorps anticardiolipines et anti-bêta-2 GP1. Le dosage du taux d’homocystéine plasmatique, du taux de facteur VIII et la recherche d’une hémoglobinurie paroxystique nocturne ne font pas partie du bilan « classique » de thrombophilie et doivent être réservés à des équipes spécialisées et à des situations cliniques précises.La recherche d’une thrombophilie constitutionnelle est coûteuse et ses indications discutées. Il est néanmoins communément admis qu’elle ne doit pas être réalisée en cas de premier épisode de MTEV (TVP proximale ou EP), provoquée ou non, chez le sujet de plus de 50 ans. Dans les autres situations cliniques, sa réalisation doit être décidée au cas par cas après discussion avec le patient.
Il est suggéré de rechercher un SAPL chez le patient de moins de 50 ans en cas de premier épisode de MTEV non provoquée (TVP proximale ou EP), de MTEV récidivante ou de siège inhabituel (thrombose veineuse du membre supérieur, digestive, cérébrale…). La recherche doit être systématique en cas d’association d’une MTEV à une nécrose cutanée ou d’antécédent de pathologie vasculo-placentaire. En pratique, la découverte d’une thrombophilie faiblement thrombogène (mutation hétérozygote des facteurs II ou V) n’a aucun impact sur la prise en charge thérapeutique. À l’inverse, la découverte d’un déficit en antithrombine ou d’un SAPL (qui doit être confirmé par un deuxième dosage à 3 mois) impose le maintien du traitement anticoagulant au long cours.
Syndrome de Cockett
Le syndrome de Cockett (encore appelé syndrome de de May-Thurner) est dû à la compression de la veine iliaque commune gauche entre l’artère iliaque primitive droite et le rachis lombaire. Sa physiopathologie est mal connue mais peut être responsable de TVP proximales ilio-fémorales gauches par hyperplasie intimale en raison des contraintes mécaniques liées à cette pince ou lors de la grossesse en raison d’une modification transitoire des rapports anatomiques. Son diagnostic reste difficile en pratique quotidienne, et son traitement peut nécessiter une angioplastie stenting en complément du traitement anticoagulant.Suivi
En cas d’EP, en raison du caractère irradiant des examens, aucune imagerie de référence de suivi n’est nécessaire. En revanche, une dyspnée d’effort persistant après au moins 3 mois de traitement anticoagulant doit faire réaliser un bilan étiologique comprenant la recherche d’une hypertension pulmonaire thromboembolique chronique.
Conclusion
POINTS FORTS À RETENIR
La MTEV est une maladie fréquente, chronique et grave.
Les formes graves de MTEV doivent être identifiées rapidement car elles nécessitent une prise en charge et une surveillance urgente et spécialisée.
Devant toute suspicion de TVP ou d’EP, la démarche diagnostique repose sur l’évaluation première de la probabilité clinique.
En cas de probabilité clinique faible/intermédiaire ou improbable, il faut doser les D-dimères dont la négativité (i.e. inférieurs au seuil maximal) exclut le diagnostic.
En cas de probabilité clinique élevée ou probable ou de D-dimères positifs/élevés, il faut réaliser un examen d’imagerie pour confirmer ou exclure le diagnostic : écho-Doppler veineux des membres inférieurs en cas de suspicion de TVP ; angioscanner thoracique ou scintigraphie pulmonaire de ventilation-perfusion en cas d’EP. Le traitement anticoagulant doit alors être débuté avant même la réalisation de ces examens.
En règle générale, le traitement initial des TVP est ambulatoire et celui des EP est hospitalier.
Le traitement de l’EP et de la TVP repose sur l’utilisation d’anticoagulants à dose curative dont la durée et la molécule dépendent des circonstances déclenchantes et du terrain.
L’examen clinique est la clé du bilan étiologique d’une MTEV.
Outre la récidive de MTEV, les complications à long terme de la MTEV sont le syndrome post-thrombotique en cas de TVP et le cœur pulmonaire chronique post-embolique en cas d’EP. Ils doivent être évoqués en présence d’une symptomatologie compatible.
Message de l'auteur
Il existe de nombreuses situations cliniques susceptibles d’être évaluées à l’examen, mais chaque dossier devrait avoir des questions de stratégie diagnostique puis de prise en charge thérapeutique.
Les questions de stratégie diagnostique seront celles où l’on vous demandera de hiérarchiser les examens diagnostiques en fonction du contexte clinique. Il faudra donc être vigilant sur la probabilité de MTEV mais aussi sur les indications et les contre-indications des examens.
Les questions de prise en charge thérapeutique seront celles où il ne faudra pas omettre de prescrire des anticoagulants, de bien choisir la molécule (attention à la fonction rénale !). Concernant la durée du traitement anticoagulant, il est peu probable que vous soyez interrogés sur des situations non consensuelles. On devrait vous interroger sur un premier épisode de TVP proximale/EP et facteur transitoire majeur, un cancer ou une récidive d’une MTEV non provoquée.
Les complications de la MTEV peuvent faire l’objet de questions dans les dossiers et sont abordées dans d’autres chapitres : accident des anticoagulants (item 326), syndrome post-thrombotique (item 225) et hypertension pulmonaire thromboembolique chronique (item 222).
Dossiers types
– Patient hospitalisé avec ou sans prévention de la MTEV qui a des signes de TVP ou d’EP.
– Jeune femme prenant une contraception estroprogestative et qui fait une MTEV.
– 1er épisode ou récidive de MTEV non provoquée.
– Patient avec altération de l’état général, découverte d'un cancer et de signes de MTEV.

 Encadrés
Encadrés