Les thyroïdites auto-immunes sont les affections les plus fréquentes de la glande thyroïde. Elles sont liées à une dysrégulation du système immunitaire : activation du processus auto-immun au cours duquel se produit une infiltration lymphoplasmocytaire de la thyroïde entraînant l’apparition d’anticorps antithyroïdiens (antithyroperoxydase, antithyroglobuline, antirécepteur de la thyréostimuline [TSH]), une lyse des cellules folliculaires puis une fibrose. Affections auto-immunes à médiation cellulaire spécifique d’organe, elles peuvent induire, à la suite d’une phase de thyrotoxicose inconstante, une diminution des capacités sécrétoires des cellules folliculaires, responsable, à terme, d’une insuffisance thyroïdienne plus ou moins importante et le plus souvent définitive.
Fréquentes, surtout chez les femmes en post-ménopause
Les thyroïdites auto-immunes sont très fréquentes (0,3 à 1,5 pour 1 000 personnes), surtout chez les femmes (sex ratio 7 à 10/1). Apparaissant classiquement après la puberté, elles s’améliorent transitoirement au cours de la grossesse, du fait de la tolérance immunologique gravidique, avec un rebond en post-partum ; leur incidence augmente en période post-ménopausique.
La prévalence des thyroïdites auto-immunes varie selon l’ethnie et le contexte (apports iodés, tabagisme). Leur fréquence s’accroît avec l’âge, mais une diminution de la fréquence des anticorps antithyroïdiens chez les centenaires est constatée.1
Elles sont la cause la plus fréquente d’hypothyroïdie dans le monde, avec une hétérogénéité géographique : fréquence accrue dans les pays où l’apport iodé est suffisant.
Seuls 20 à 30 % des patients avec une thyroïdite auto-immune ont une insuffisance thyroïdienne primitive nécessitant un traitement substitutif par lévothyroxine. Enfin, 20 % des patients ont une atteinte auto-immune d’autres organes (hépatite auto-immune, gastrite auto-immune, myasthénie, syndrome de Gougerot-Sjögren, maladie cœliaque, lupus érythémateux disséminé…) ou d’autres glandes endocrines dans le cadre des syndromes polyglandulaires auto-immuns (
- polyendocrinopathie auto-immune de type 1 (ou syndrome APECED), affection génétique rare (1 à 9 cas par million d’habitants) débutant dans l’enfance ou l’adolescence, liée à des mutations du gène AIRE (21q22.3) ;
- polyendocrinopathie auto-immune de type 2 (ou syndrome de Schmidt), maladie polygénique à transmission autosomique dominante plus fréquente, au cours de laquelle les thyroïdites auto-immunes sont souvent associées à une insuffisance surrénalienne et à un diabète de type 1 ;
- IPEX syndrome (immune dysregulation, polyendocrinopathy, enteropathy, X-linked), affection rare et héréditaire liée à des mutations du gène Forhead box P3 (FOXP3) situé sur le chromosome X.
Trois facteurs en jeu dans l’activation du processus auto-immun
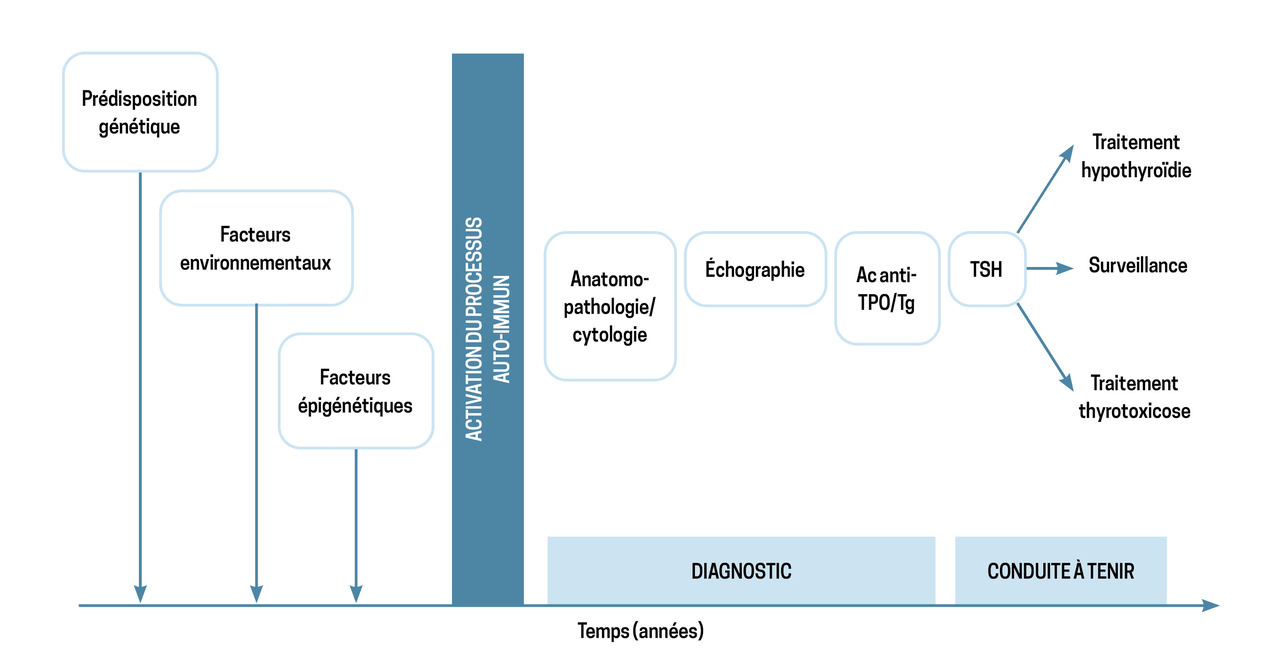
L’histoire naturelle des thyroïdites auto-immunes met en jeu trois facteurs (
- une prédisposition ou susceptibilité génétique (polymorphismes des gènes HLA ou CTLA-4 ou des sélénoprotéines, inactivation du chromosome X) mise en évidence dans les études épidémiologiques sur la fréquence des thyroïdites auto-immunes chez les jumeaux homo- ou hétérozygotes, et la fréquence des anticorps antithyroïdiens chez les apparentés des patients ayant une thyroïdite auto-immune ;
- des facteurs environnementaux comme un déficit en sélénium, une surcharge iodée, une intoxication tabagique, une infection bactérienne ou virale, une exposition à des produits chimiques (phtalates) ou à une irradiation (fréquence des thyroïdites auto-immunes après l’accident de la centrale nucléaire de Tchernobyl), une modification du microbiote… ;
- des facteurs épigénétiques avec modifications des histones et de la méthylation des antigènes thyroïdiens (thyroglobuline, thyroperoxydase, récepteur de la TSH).
Infiltration lymphoplasmocytaire, thyrotoxicose, puis atrophie
Connaître les mécanismes physiopathologiques des thyroïdites auto-immunes permet d’en comprendre les éléments nécessaires au diagnostic.
Anatomopathologie et dosage des anticorps anti-TPO pour poser le diagnostic
Chez les personnes prédisposées, les facteurs environnementaux et épigénétiques induisent une rupture de la tolérance immunologique et une activation du processus auto-immun. S’ensuit une infiltration lymphoplasmocytaire du tissu thyroïdien objectivée par l’anatomopathologie après chirurgie thyroïdienne ou sur un prélèvement cytologique après ponction thyroïdienne, par l’échographie (diminution de l’échogénicité du tissu thyroïdien, un parenchyme thyroïdien hétérogène avec des micronodules et parfois une hypervascularisation), par prélèvement sanguin révélant l’apparition d’anticorps antithyroïdiens (le plus souvent il s’agit d’anticorps antithyroperoxydase [Ac anti-TPO] ou antithyroglobuline [Ac anti-Tg], plus rarement d’anticorps antirécepteur de la TSH).
Hypothyroïdie ou Thyrotoxicose : ça s’explique !
Sur le plan fonctionnel, à la phase aiguë d’une thyroïdite auto-immune, la libération de cytokines et de chémokines entraîne une lyse des cellules folliculaires responsable du relargage des hormones thyroïdiennes préformées et d’une thyrotoxicose, avant l’apparition d’une fibrose et d’une atrophie du corps thyroïde causant une diminution des capacités sécrétoires thyroïdiennes et une hypothyroïdie modérée ou clinique, le plus souvent définitive.Si la présence des anticorps anti-TPO et anti-Tg n’a pas de conséquence sur le plan fonctionnel, les anticorps antirécepteur de la TSH peuvent, eux, être stimulants et entraîner une hyperthyroïdie auto-immune (maladie de Basedow), ou bloquants et être responsables d’une hypothyroïdie périphérique.
En pratique : du diagnostic au traitement
Chez les patients avec une thyroïdite auto-immune, l’examen de la région cervicale antérieure peut être normal ou mettre en évidence une hyperplasie du corps thyroïde ou un goitre ferme, symétrique, non douloureux, hétérogène ou rarement nodulaire, avec présence d’adénopathies dans le cadre d’une thyroïdite d’Hashimoto.
Orienté par l’examen clinique, le diagnostic d’un dysfonctionnement thyroïdien repose en première intention sur le dosage de la TSH ; l’importance du dysfonctionnement est, elle, évaluée par la concentration de la thyroxine libre (T4l).
Le dosage des anticorps anti-TPO est le plus sensible pour le diagnostic des thyroïdites auto-immunes. En revanche, il n’a aucun intérêt au cours de la surveillance.
Une thyrotoxicose doit faire réaliser un bilan – qui, sur le plan clinique, consiste en une palpation cervicale antérieure, sur le plan biologique en un dosage des anticorps antirécepteur de la TSH, et sur le plan morphologique en une échographie thyroïdienne avec doppler ou scintigraphie thyroïdienne – permettant de différencier un épisode de thyroïdite auto-immune – qui impose un traitement symptomatique par bêtabloquants – d’une hyperthyroïdie dans le cadre d’une maladie de Basedow – qui justifie un traitement médical par antithyroïdiens de synthèse ou, très rarement, un traitement radical chirurgical ou radio-isotopique.
Le traitement d’une hypothyroïdie repose sur la lévothyroxine dont les modalités de prescription sont fonction de l’importance de l’insuffisance thyroïdienne (clinique ou subclinique) et du profil des patients (âge, grossesse, comorbidités…).
Situations particulières : thyroïdites auto-immunes...
... et grossesse
Les thyroïdites auto-immunes sont fréquentes chez les femmes en âge de procréer.
Une étude a révélé un lien significatif entre la présence des anticorps antithyroïdiens (Ac anti-TPO, Ac anti-Tg) et la survenue de fausses couches spontanées, précoces et récidivantes.5 Alors que les données les plus anciennes suggéraient une diminution de ces fausses couches spontanées au cours d’un traitement par lévothyroxine chez les femmes euthyroïdiennes ayant une thyroïdite chronique, des études récentes montrent à l’inverse que ce traitement ne diminue pas le risque de fausse couche et n’augmente pas le nombre de grossesses à terme.6,7
Une diminution de la réponse de la thyroxine à l’hormone de croissance placentaire (hCG) a été observée chez les patientes ayant des anticorps anti-TPO,8 plaidant en faveur d’une diminution de la réserve fonctionnelle thyroïdienne et justifiant ainsi une surveillance de la TSH et une adaptation de l’hormonothérapie par lévothyroxine au cours de la grossesse chez les femmes qui ont une thyroïdite auto-immune.
La thyroïdite silencieuse du post-partum – forme clinique de la thyroïdite auto-immune après une grossesse ou un avortement – survient chez 50 % des femmes ayant des anticorps antithyroïdiens au cours du premier trimestre de la grossesse. Elle est plus fréquente lorsque ces patientes sont suivies pour une autre maladie auto-immune, comme un diabète de type 1. Une étude a montré l’intérêt d’un traitement par sélénium au cours de la grossesse pour prévenir les épisodes de thyroïdite du post-partum.9 La surveillance de la fonction thyroïdienne au décours d’un épisode de thyroïdite silencieuse du post-partum est indispensable afin d’adapter l’hormonothérapie thyroïdienne après l’accouchement, et afin de dépister l’apparition d’une hypothyroïdie définitive (20 à 30 % des patientes). La thyroïdite silencieuse du post-partum récidive après les grossesses ultérieures.
… et médicaments
La présence d’une thyroïdite auto-immune peut augmenter la fréquence des effets secondaires thyroïdiens et modifier la prise en charge des patients traités par différents médicaments.
Ainsi, au cours d’un traitement par amiodarone, l’apparition d’une hypothyroïdie lésionnelle est plus fréquente chez les patients ayant une thyroïdite auto-immune. Cette situation impose la mise en place d’un traitement substitutif par lévothyroxine du fait de l’évolution possible vers une forme définitive ; le traitement par amiodarone peut alors être poursuivi.
Un traitement par lithium peut exacerber une auto-immunité antithyroïdienne et imposer un traitement par lévothyroxine en cas d’insuffisance thyroïdienne. Cette dernière n’est pas une contre-indication à la poursuite du traitement par lithium.
Un traitement par interféron alpha peut révéler ou induire trois types de dysrégulation thyroïdienne :
- une thyroïdite auto-immune avec une insuffisance thyroïdienne, rarement définitive après l’arrêt du traitement par interféron alpha ;
- une thyrotoxicose ;
- une hyperthyroïdie basedowienne.
Cela justifie la réalisation d’un bilan thyroïdien (dosages de la TSH et des Ac anti-TPO) avant l’instauration de l’interféron alpha, et la surveillance fonctionnelle (dosage de la TSH) au cours du traitement.
Au cours des traitements par inhibiteurs des points de contrôle immunitaire (anti-CTLA-4, anti-PD-1, anti-PD-L1) ou par anticorps anti-CD52, les thyroïdites auto-immunes peuvent être responsables de dysfonctionnements thyroïdiens (thyrotoxicose, hypothyroïdie) plus ou moins précoces et d’évolution variable, justifiant une surveillance de la TSH.
… et cancer thyroïdien différencié
Une thyroïdite auto-immune (présence d’anticorps antithyroïdiens ou d’une infiltration lymphocytaire du tissu thyroïdien) est fréquente chez les patients ayant un cancer thyroïdien différencié, et en particulier un cancer papillaire de la thyroïde. Sa présence diminuerait l’incidence et la sévérité du cancer papillaire lorsqu’elle le précède, suggérant un rôle du système auto-immun dans la pathogénie de ce cancer, comme rapporté dans les travaux récents de F. Pani.10
Que dire à vos patients ?
Les thyroïdites auto-immunes sont fréquentes surtout chez la femme en post-ménopause.
Le diagnostic repose sur la présence des anticorps antithyroperoxydase, qu’il est en revanche inutile de surveiller au cours de l’évolution.
La prise en charge consiste essentiellement en une correction du dysfonctionnement thyroïdien, en particulier une hypothyroïdie, par un traitement substitutif le plus souvent définitif.
1. Mariotti S, Sansoni P, Barbesino G, et al. Thyroid and other organ-specific autoantibodies in healthy centenarians. Lancet 1992;339(8808):1506-8.
2. Sperling MA, Angelousi A, Yau M. Autoimmune Polyglandular Syndromes. 2021. In: Feingold KR, Anawalt B, Boyce A, et al (ed.). Endotext [Internet]. South Dartmouth: MDText.com, Inc.; 2000.
3. Ralli M, Angeletti D, Fiore M, et al. Hashimoto’s thyroiditis: An update on pathogenic mechanisms, diagnostic protocols, therapeutic strategies, and potential malignant transformation. Autoimmun Rev 2020;19(10):102649.
4. Klubo-Gwiezdzinska J, Wartofsky L. Hashimoto thyroiditis: an evidence-based guide to etiology, diagnosis and treatment. Pol Arch Intern Med 2022;132(3):16222.
5. Poppe K, Velkeniers B, Glinoer D. The role of thyroid autoimmunity in fertility and pregnancy. Nat Clin Pract Endocrinol Metab 2008;4(7):394-405.
6. Dhillon-Smith RK, Middleton LJ, Sunner KK, et al. Levothyroxine in women with thyroid peroxidase antibodies before conception. N Engl J Med 2019;380(14):1316-25.
7. Van Dijk MM, Vissenberg R, Fliers E, et al. Levothyroxine in euthyroid thyroid peroxidase antibody positive women with recurrent pregnancy loss (T4LIFE trial): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Diabetes Endocrinol 2022;10(5):322-9.
8. Korevaar TIM, Medici M, Visser TJ, et al. Thyroid disease in pregnancy: new insights in diagnosis and clinical management. Nat Rev Endocrinol 2017;13(10):610-22.
9. Negro R, Greco G, Mangieri T, et al. The influence of selenium supplementation on postpartum thyroid status in pregnant women with thyroid peroxidase autoantibodies. J Clin Endocrinol Metab 2007;92(4):1263-8.
10. Pani F, Yasuda Y, Di Dalmazi G, et al. Pre-existing thyroiditis ameliorates papillary thyroid cancer: insights from a new mouse model. Endocrinology 2021;162(10):bqab144.

 Encadrés
Encadrés