Cette technique d’imagerie qui explore le sein en 3 dimensions date d’il y a plus de 10 ans. Aujourd’hui, elle est utilisée en pratique clinique quotidienne dans plusieurs dizaines de centres en France, sous l’impulsion en particulier d’un constructeur. Quel intérêt en dépistage du cancer du sein ?
Faire mieux que la mammographie
La mammographie, pivot du diagnostic en sénologie, n’a que des performances moyennes dans le dépistage. D’une part, sa sensibilité est autour de 75 %. En effet, la tumeur peut prendre l’aspect d’une masse, de microcalcifications, d’une distorsion architecturale ou d’une asymétrie de densité et c’est dans ces 2 derniers cas que le diagnostic est le plus difficile. Par ailleurs, même si la spécificité est relativement bonne, supérieure à 90 % (moins d’1 patiente sur 10 est reconvoquée à tort pour un faux diagnostic positif), le risque cumulé de faux positifs après 10 mammographies approche 50 % (soit 1 patiente sur 2 au cours de son suivi). Les conséquences sont multiples : économiques, angoisse générée chez les patientes, manque d’observance des femmes cibles. Aujourd’hui, l’approche numérique augmente la sensibilité et/ou la spécificité de l’examen : détection assistée par ordinateur (CAD), angiomammographie numérique, tomosynthèse.
Comment ça marche ?
Obtenue à partir d’un ensemble de projections d’images acquises sous différents angles de vue, elle permet de visualiser les tissus mammaires entrant dans la composition d’un plan de reconstruction donné (pas de superposition des coupes adjacentes).
Cette technique a deux avantages théoriques : elle permet d’une part de s’affranchir au moins partiellement des structures parenchymateuses de voisi- nage siégeant au contact d’un cancer et pouvant gêner potentiellement sa visualisation ; d’autre part, de négativer les phénomènes de convergence engendrés par la superposition de plusieurs structures mammaires normales qui ne sont pas dans le même plan, potentiellement à l’origine de faux positifs. Ainsi, elle devrait augmenter la performance diag- nostique en mammographie.
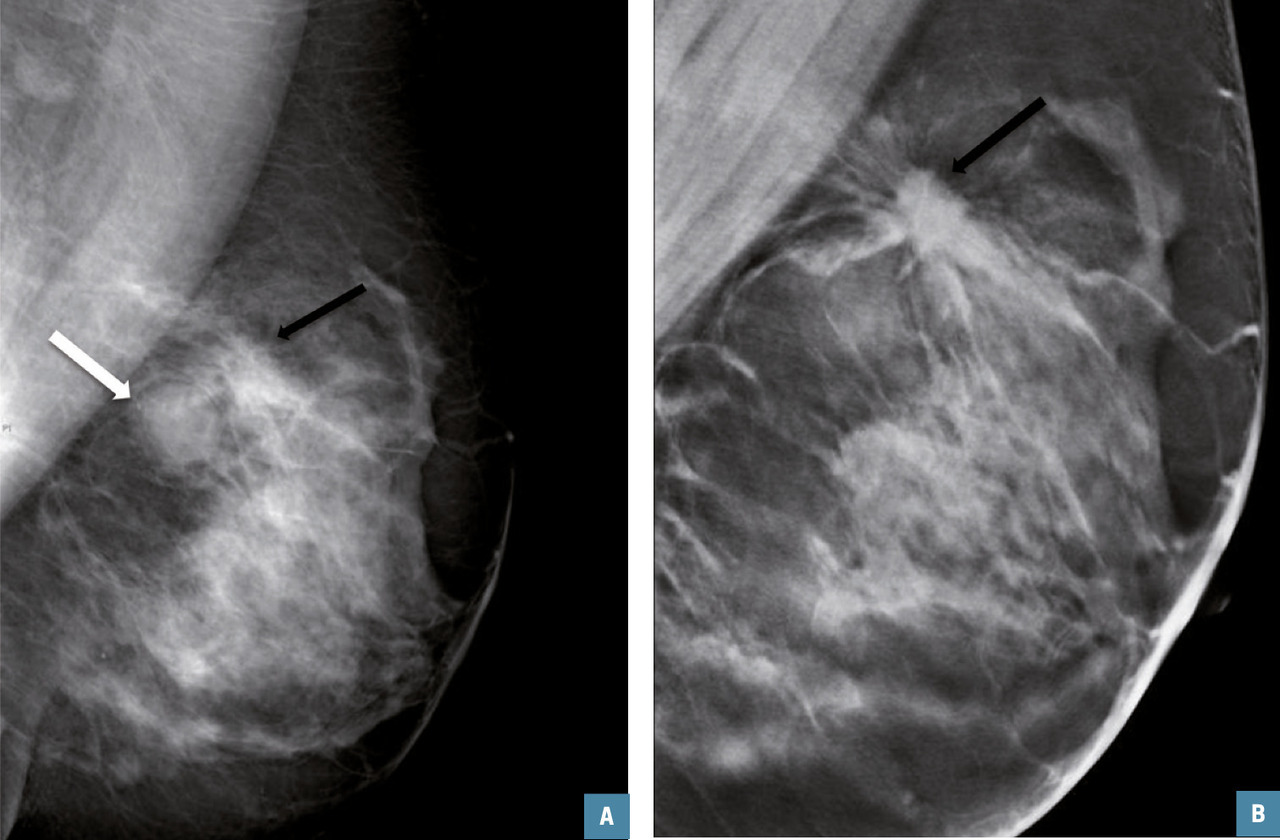
De plus, si cette technique a peu d’intérêt dans l’identification et la caractérisation d’un foyer de microcalcifications, elle permet de mieux évaluer les contours d’une lésion potentielle et d’individualiser une distorsion architecturale. En revanche, elle fournit peu d’arguments spécifiques quant au caractère malin (carcinome canalaire invasif, tubuleux) ou bénin (cicatrice radiaire et surtout postopératoire) de cette dernière.
Dans les asymétries de densité, on peut identifier des signes associés de distorsion architecturale (spicules épais et courts sans centre dense ou alors de petite taille) orientant vers la malignité.
Cette technique a deux avantages théoriques : elle permet d’une part de s’affranchir au moins partiellement des structures parenchymateuses de voisi- nage siégeant au contact d’un cancer et pouvant gêner potentiellement sa visualisation ; d’autre part, de négativer les phénomènes de convergence engendrés par la superposition de plusieurs structures mammaires normales qui ne sont pas dans le même plan, potentiellement à l’origine de faux positifs. Ainsi, elle devrait augmenter la performance diag- nostique en mammographie.
De plus, si cette technique a peu d’intérêt dans l’identification et la caractérisation d’un foyer de microcalcifications, elle permet de mieux évaluer les contours d’une lésion potentielle et d’individualiser une distorsion architecturale. En revanche, elle fournit peu d’arguments spécifiques quant au caractère malin (carcinome canalaire invasif, tubuleux) ou bénin (cicatrice radiaire et surtout postopératoire) de cette dernière.
Dans les asymétries de densité, on peut identifier des signes associés de distorsion architecturale (spicules épais et courts sans centre dense ou alors de petite taille) orientant vers la malignité.
Quelles performances ?
Plusieurs travaux ont été publiés depuis 5 ans. Les études européennes ont évalué l’apport de la tomosynthèse (3D) en plus de la mammographie (2D), les patientes étant leur propre témoin (analyse des performances intrinsèques du test et de l’apport de la 3D sur une même population) ;1 à l’inverse, les essais nord-américains ont comparé de façon observationnelle les résultats de 2 stratégies de dépistage, l’une classique utilisant la 2D, l’autre employant 2D + 3D, dans deux populations différentes.2
Les résultats publiés sont globalement concordants : augmentation de la sensibilité et de la spécificité, baisse du taux de rappel et augmentation de la valeur prédictive positive, permettant ainsi d’atteindre les ambitieuses recommandations européennes des programmes de dépistage visant un taux de cancer du sein ≥ 6 ‰ et de rappel < 7 %. Schématiquement, grâce à l’ajout de la 3D : pour 1 000 patientes consécutives vues en dépistage dans les expériences européennes, 2 à 3 auront un diagnostic de cancer et 10 auront un test négativé à juste titre ; dans les études nord-américaines, multicentriques, 1 à 2 patientes sur 1 000 auront un cancer diagnostiqué et 15 à 30 un test négativé à juste titre. La différence entre ces 2 séries est en partie due à des politiques différentes de dépistage (en Amérique du Nord, le taux de rappel accepté est plus élevé après mammographie 2D ; la 3D a donc une moindre valeur ajoutée en termes de sensibilité, mais a un intérêt pour limiter les faux positifs).
Les résultats publiés sont globalement concordants : augmentation de la sensibilité et de la spécificité, baisse du taux de rappel et augmentation de la valeur prédictive positive, permettant ainsi d’atteindre les ambitieuses recommandations européennes des programmes de dépistage visant un taux de cancer du sein ≥ 6 ‰ et de rappel < 7 %. Schématiquement, grâce à l’ajout de la 3D : pour 1 000 patientes consécutives vues en dépistage dans les expériences européennes, 2 à 3 auront un diagnostic de cancer et 10 auront un test négativé à juste titre ; dans les études nord-américaines, multicentriques, 1 à 2 patientes sur 1 000 auront un cancer diagnostiqué et 15 à 30 un test négativé à juste titre. La différence entre ces 2 séries est en partie due à des politiques différentes de dépistage (en Amérique du Nord, le taux de rappel accepté est plus élevé après mammographie 2D ; la 3D a donc une moindre valeur ajoutée en termes de sensibilité, mais a un intérêt pour limiter les faux positifs).
Rôle dans le dépistage de masse organisé ?
Aujourd’hui, la tomosynthèse est recommandée devant une anomalie mammographique au même titre que les clichés complémentaires (nouvelles incidences, clichés comprimés, focalisés). Elle n’est pas indiquée de façon systématique en complément (ou en remplacement) de la mammographie classique.
Comment expliquer cette place en 2e intention alors qu’elle a montré un apport à la fois en sensibilité (augmentation du nombre de cancers détectés) et en spécificité (diminution des faux positifs et du taux de rappel) ?
– « La tomosynthèse entraîne une augmentation de l’irradiation non acceptable dans une politique de santé publique, en l’absence d’amélioration démontrée du pronostic du cancer du sein ». En effet, il est nécessaire de doubler la dose de rayons X pour obtenir les clichés en 3D sur les coupes de mammographie. Toutefois, on peut aujourd’hui reconstruire un cliché 2D à partir d’une acquisition 3D (imagerie 2D dite synthétique) ; la lecture a la même performance que celle 2D + 3D, avec une exposition aux rayons X égale à celle de la mammographie numérique classique.1, 3
– « Il n’y a pas de contrôle de qualité permettant de l’inclure dans une politique de dépistage de masse organisé ». L’adoption par la France du protocole européen de contrôle qualité est longue et chaotique. Parmi les nombreuses raisons, rappelons que plusieurs types de tomosynthèses existent, avec aujourd’hui 5 constructeurs sur le marché, même si la très grande majorité des publications ont été réalisées par un seul d’entre eux.
– « Les travaux portant sur la tomosynthèse ne tiennent pas compte de l’échographie ». En effet, cette dernière a une place importante en France, mais aussi dans d’autres pays francophones, comme la Belgique ou la Suisse : elle est réalisée chez 30 % des patientes dépistées dans le cadre du DMO, et ce taux est vraisemblablement supérieur dans le dépistage sur prescription individuelle.
– « Il n’y a pas d’études démontrant l’apport de la tomosynthèse sur le taux de cancer d’intervalle et encore moins sur une éventuelle réduction de la mortalité du cancer du sein».
Cette critique est pertinente : le taux de cancers d’intervalle (apparaissant entre 2 mammographies) est un critère important pour juger l’efficacité d’un dépistage.
Ces cancers ont des caractéristiques épidémiologiques et biologiques particulières : ils surviennent plus fréquemment chez les femmes jeunes, sont plus souvent de grade élevé et triple négatifs, de moins bon pronostic que ceux détectés par la mammographie.
La seule étude récente4 n’a pas mis en évidence de bénéfice de la tomosynthèse en termes de diminution de leur fréquence. Si les tumeurs détectées par cet examen sont dans la grande majorité invasives, de taille moyenne, centi- métriques, la plupart ont des critères anatomopathologiques (grade, index de prolifération, récepteurs hormonaux) de bon pronostic.
Comment expliquer cette place en 2e intention alors qu’elle a montré un apport à la fois en sensibilité (augmentation du nombre de cancers détectés) et en spécificité (diminution des faux positifs et du taux de rappel) ?
– « La tomosynthèse entraîne une augmentation de l’irradiation non acceptable dans une politique de santé publique, en l’absence d’amélioration démontrée du pronostic du cancer du sein ». En effet, il est nécessaire de doubler la dose de rayons X pour obtenir les clichés en 3D sur les coupes de mammographie. Toutefois, on peut aujourd’hui reconstruire un cliché 2D à partir d’une acquisition 3D (imagerie 2D dite synthétique) ; la lecture a la même performance que celle 2D + 3D, avec une exposition aux rayons X égale à celle de la mammographie numérique classique.1, 3
– « Il n’y a pas de contrôle de qualité permettant de l’inclure dans une politique de dépistage de masse organisé ». L’adoption par la France du protocole européen de contrôle qualité est longue et chaotique. Parmi les nombreuses raisons, rappelons que plusieurs types de tomosynthèses existent, avec aujourd’hui 5 constructeurs sur le marché, même si la très grande majorité des publications ont été réalisées par un seul d’entre eux.
– « Les travaux portant sur la tomosynthèse ne tiennent pas compte de l’échographie ». En effet, cette dernière a une place importante en France, mais aussi dans d’autres pays francophones, comme la Belgique ou la Suisse : elle est réalisée chez 30 % des patientes dépistées dans le cadre du DMO, et ce taux est vraisemblablement supérieur dans le dépistage sur prescription individuelle.
– « Il n’y a pas d’études démontrant l’apport de la tomosynthèse sur le taux de cancer d’intervalle et encore moins sur une éventuelle réduction de la mortalité du cancer du sein».
Cette critique est pertinente : le taux de cancers d’intervalle (apparaissant entre 2 mammographies) est un critère important pour juger l’efficacité d’un dépistage.
Ces cancers ont des caractéristiques épidémiologiques et biologiques particulières : ils surviennent plus fréquemment chez les femmes jeunes, sont plus souvent de grade élevé et triple négatifs, de moins bon pronostic que ceux détectés par la mammographie.
La seule étude récente4 n’a pas mis en évidence de bénéfice de la tomosynthèse en termes de diminution de leur fréquence. Si les tumeurs détectées par cet examen sont dans la grande majorité invasives, de taille moyenne, centi- métriques, la plupart ont des critères anatomopathologiques (grade, index de prolifération, récepteurs hormonaux) de bon pronostic.
Références
1. Bernardi D, Macaskill P, Pellegrini M, et al. Breast cancer screening with tomosynthesis (3D mammography) with acquired or synthetic 2D mammography compared with 2D mammography alone (STORM-2): a population-based prospective study. Lancet Oncol 2016;17:1105-13.
2. Friedewald SM, Rafferty EA, Rose SL, et al. Breast cancer screening using tomosynthesis in combination with digital mammography. JAMA 2014;311:2499-507.
3. Freer PE, Riegert J, Eisenmenger L, et al. Clinical implementation of synthesized mammography with digital breast tomosynthesis in a routine clinical practice. Breast Cancer Res Treat 2017;166:501-9.
4. Skaane P, Sebuødegård S, Bandos AI, et al .Performance of breast cancer screening using digital breast tomosynthesis: results from the prospective population-based Oslo Tomosynthesis Screening Trial. Breast Cancer Res Treat 2018;169:489-96.
2. Friedewald SM, Rafferty EA, Rose SL, et al. Breast cancer screening using tomosynthesis in combination with digital mammography. JAMA 2014;311:2499-507.
3. Freer PE, Riegert J, Eisenmenger L, et al. Clinical implementation of synthesized mammography with digital breast tomosynthesis in a routine clinical practice. Breast Cancer Res Treat 2017;166:501-9.
4. Skaane P, Sebuødegård S, Bandos AI, et al .Performance of breast cancer screening using digital breast tomosynthesis: results from the prospective population-based Oslo Tomosynthesis Screening Trial. Breast Cancer Res Treat 2018;169:489-96.