Anticancéreux. Fréquents, variés, visibles, les effets indésirables dermatologiques des anticancéreux sont d’autant plus délicats à gérer que la poursuite du traitement s’impose dans la plupart des cas.
Toxicité liée à la chimiothérapie
Toxicité cutanée
Érythème toxique à la chimiothérapie
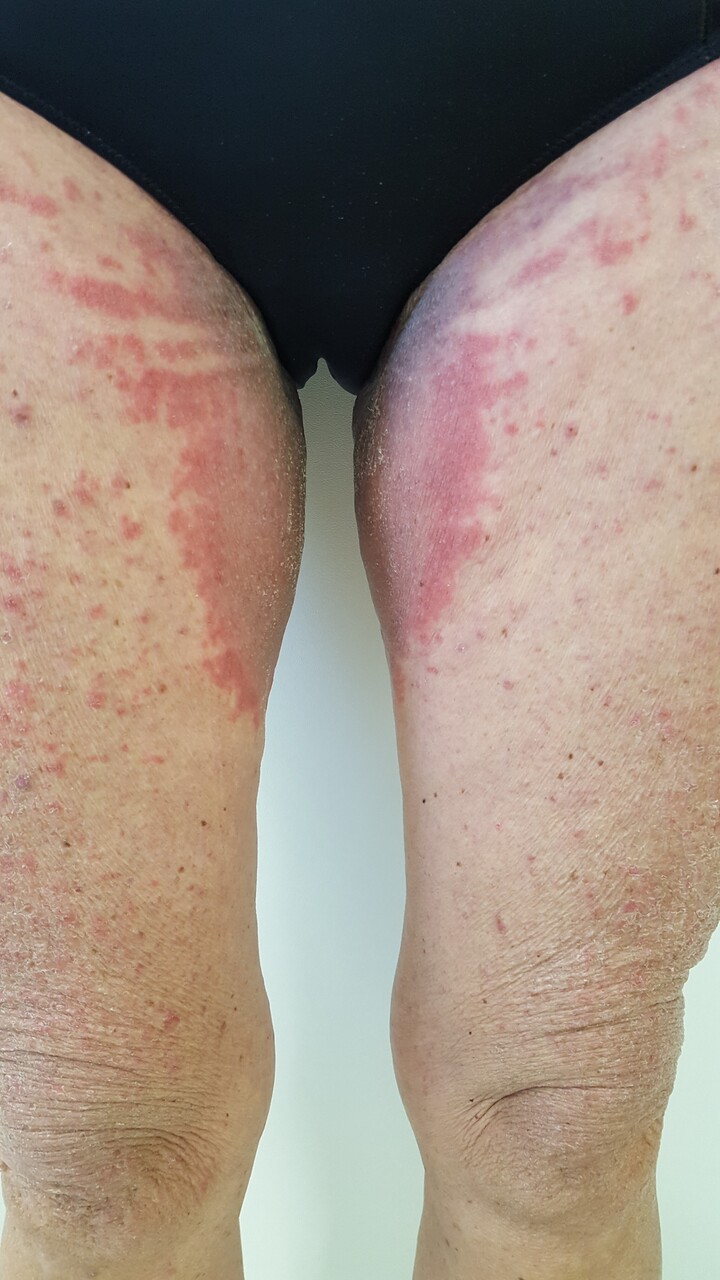
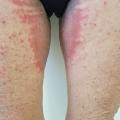
Ce terme « ombrelle » n’a été que récemment proposé.1 Il permet d’englober sous une même entité une réaction cutanée assez caractéristique de la chimiothérapie, mais décrite jusqu’ici avec un verbatim très varié : malignant intertrigo, intertrigo dermatitis, intertriginous eruption of chemotherapy, intertrigo like eruption associated with chemotherapy… Les principales molécules inductrices d’érythème toxique sont les taxanes (docétaxel, paclitaxel), la cytarabine, le busulfan, la dactinomycine ou la doxorubine pégylée.
Il correspond au développement, 8 à 21 jours après le traitement, d’un érythème inflammatoire dans les zones de friction et d’hypersudation, principalement les régions axillaires et inguinales (
Il peut survenir dès le premier cycle et s’associer à un décollement bulleux dans les formes sévères, avec un aspect de « pseudo-Lyell ». Il prend une distribution bilatérale, volontiers symétrique, et s’associe à une sensation de prurit ou de cuisson.
L’érythème toxique à la chimiothérapie n’est pas d’origine allergique mais est plus sûrement lié à l’excrétion privilégiée de certaines chimiothérapies par les glandes eccrines, induisant un phénomène directement toxique sur les kératinocytes et les annexes dans les zones particulièrement concernées par l’hypersudation ou les contacts répétés. L’évolution se fait vers la desquamation, et une hyperpigmentation séquellaire s’installe, pouvant perdurer de nombreux mois.
Il est cependant capital de retenir que toute éruption survenant sous chimiothérapie n’est pas nécessairement un érythème toxique.1, 2 Il faut donc garder ses réflexes de clinicien et savoir évoquer – entre autres – une véritable réaction immuno-allergique (penser aux médicaments associés), une infection opportuniste (plus fréquente dans ce contexte) ou d’autres réactions spécifiques (lupus induit, inflammation de kératose actinique, dermatose neutrophilique, pseudocellulite…).
Syndrome main-pied
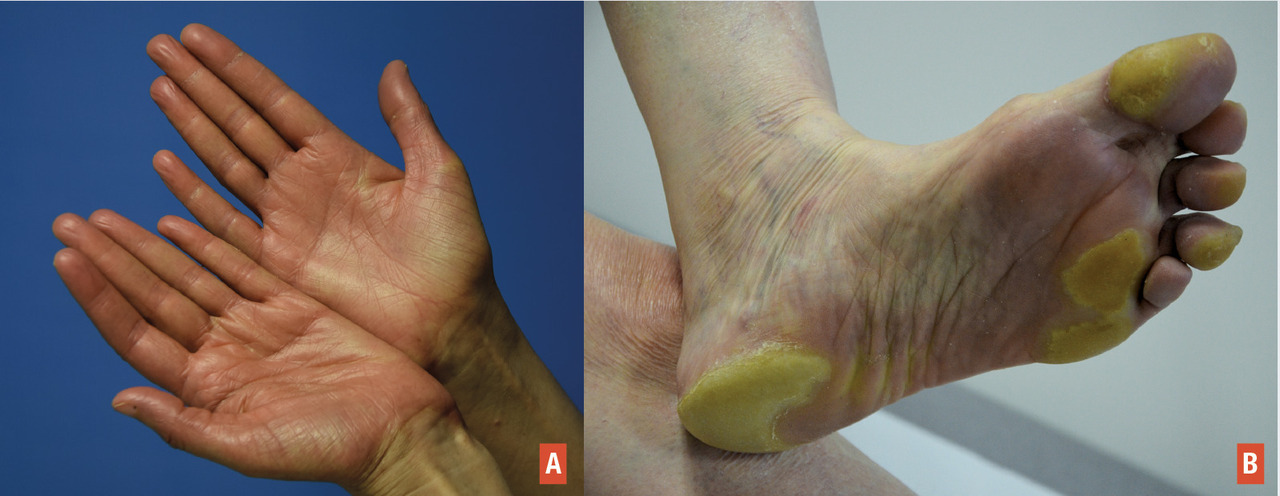
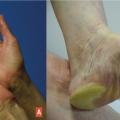
Il correspond à l’atteinte inflammatoire bilatérale des paumes des mains et/ou des plantes des pieds survenant avec certaines chimiothérapies, notamment la capécitabine (50 % des cas) et la doxorubicine liposomale (30 %). De nombreuses autres molécules peuvent induire un syndrome mains-pieds, toutefois avec une incidence nettement plus faible :2 étoposide, taxanes (formes inversées surtout), méthotrexate, cytarabine… Depuis sa description initiale, ce syndrome a été rapporté avec une terminologie assez variée : érythrodysesthésie palmo-plantaire, érythème acral, réaction de Burgdorf… En fait, ce syndrome main-pied doit être à notre sens intégré au cadre nosologique de l’érythème toxique à la chimiothérapie décrit précédemment, avec une prise en charge similaire.
Les lésions se développent progressivement, souvent précédées par des prodromes. L’atteinte typique correspond à un érythème inflammatoire diffus palmo-plantaire (
Le traitement repose sur des traitements antalgiques et anti-inflammatoires topiques ou systémiques : patch de lidocaïne, clobétasol en topique, émollients…Dans notre expérience, les anti-COX-2 de type célécoxib apparaissent les plus efficaces dans ce contexte. Dans tous les cas, l’éducation du patient est fondamentale (mesures de refroidissement*, éviter les traumatismes répétés, porter des chaussures adaptées…). De mécanisme dose-dépendant, la modulation de la dose prescrite peut aussi être utile et doit être discutée avec l’oncologue en fonction du pronostic et de la réponse thérapeutique.
Toxicité muqueuse (mucite)
La mucite3 correspond aux phénomènes inflammatoires muqueux induits par la chimiothérapie, pouvant se développer de la bouche à l’anus. Même si les mécanismes physiopathologiques reposent sur des interactions complexes entre épithélium et chorion, on peut considérer – de façon simplifiée – qu’elle est avant tout la conséquence de l’effet toxique direct de la chimiothérapie sur les cellules épithéliales.3
Elle apparaît quelques jours après le premier ou les premiers cycles de traitement. De nombreuses molécules cytotoxiques peuvent induire une mucite, notamment les agents alkylants (sels de platine, cyclophosphamide...) et les antimétabolites (méthotrexate, fluoro-uracile, cytarabine…). Les lésions sont plus fréquentes et plus sévères en cas d’association de molécules ou de schéma thérapeutique d’intensification (80% en cas de conditionnement pour allogreffe de moelle). Les lésions sont initialement érythémateuses puis ulcérées, devenant progressivement confluentes avec formation d’une pseudomembrane (fibrine et débris épithéliaux). La gêne fonctionnelle peut être majeure et s’associer à une perte de poids significative avec malnutrition. Il est fondamental de noter que la mucite chimio-induite ne se développe que sur la muqueuse non kératinisée (palais mou, face ventrale de la langue, plancher buccal, muqueuses jugales). Une atteinte associée de la muqueuse kératinisée doit faire remettre en question le diagnostic et faire évoquer une infection opportuniste associée, notamment une réactivation virale herpétique, fréquente dans ce contexte.
La prise en charge est avant tout symptomatique. Des mesures préventives doivent d’abord être mises en place, comprenant entre autres une éducation à l’hygiène buccodentaire par des équipes spécialisées, un traitement des foyers infectieux dentaires ou parodontaux préexistants, l’utilisation pluriquotidienne de bains de bouche avec du bicarbonate. Le traitement des lésions actives repose, en fonction des situations, sur l’utilisation des dermocorticoïdes et de la photomodulation (longueur d’onde entre 630 et 830 nm) et, si nécessaire, sur une mise au repos alimentaire (avec gastrostomie et accompagnement nutritionnel) et/ou une concession des doses utilisées. La prise en charge antalgique est aussi fondamentale.
Elle apparaît quelques jours après le premier ou les premiers cycles de traitement. De nombreuses molécules cytotoxiques peuvent induire une mucite, notamment les agents alkylants (sels de platine, cyclophosphamide...) et les antimétabolites (méthotrexate, fluoro-uracile, cytarabine…). Les lésions sont plus fréquentes et plus sévères en cas d’association de molécules ou de schéma thérapeutique d’intensification (80% en cas de conditionnement pour allogreffe de moelle). Les lésions sont initialement érythémateuses puis ulcérées, devenant progressivement confluentes avec formation d’une pseudomembrane (fibrine et débris épithéliaux). La gêne fonctionnelle peut être majeure et s’associer à une perte de poids significative avec malnutrition. Il est fondamental de noter que la mucite chimio-induite ne se développe que sur la muqueuse non kératinisée (palais mou, face ventrale de la langue, plancher buccal, muqueuses jugales). Une atteinte associée de la muqueuse kératinisée doit faire remettre en question le diagnostic et faire évoquer une infection opportuniste associée, notamment une réactivation virale herpétique, fréquente dans ce contexte.
La prise en charge est avant tout symptomatique. Des mesures préventives doivent d’abord être mises en place, comprenant entre autres une éducation à l’hygiène buccodentaire par des équipes spécialisées, un traitement des foyers infectieux dentaires ou parodontaux préexistants, l’utilisation pluriquotidienne de bains de bouche avec du bicarbonate. Le traitement des lésions actives repose, en fonction des situations, sur l’utilisation des dermocorticoïdes et de la photomodulation (longueur d’onde entre 630 et 830 nm) et, si nécessaire, sur une mise au repos alimentaire (avec gastrostomie et accompagnement nutritionnel) et/ou une concession des doses utilisées. La prise en charge antalgique est aussi fondamentale.
Toxicité unguéale
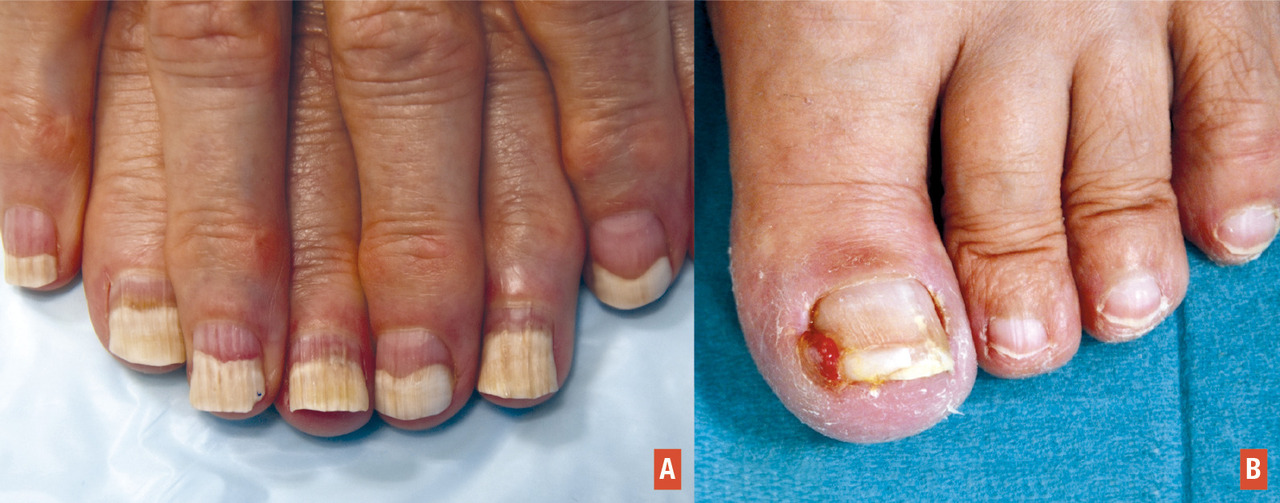
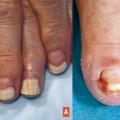
Elle est avant tout la conséquence de l’effet cytotoxique direct de la chimiothérapie sur les cellules matricielles et de la tablette.2 De très fréquentes modifications peuvent apparaître avec de nombreuses molécules, qui n’ont souvent qu’un impact cosmétique : lignes de Beau (sillon transversal sur la tablette, correspondant à l’arrêt transitoire de la prolifération des kératinocytes matriciels), onychomadèse (forme extrême de ligne de Beau), ongles fragiles, modifications pigmentaires (mélanonychies, leuconychies)…
L’onycholyse (décollement de la tablette du lit de l’ongle sous-jacent) est la toxicité la plus sévère (
Toxicité sur les follicules pileux
Alopécie aiguë
Il s’agit probablement de la toxicité la plus représentative de la maladie cancéreuse.2 Son impact psychosocial peut être majeur du fait de la composante esthétique, voire symbolique, de la chevelure.Elle correspond à un mécanisme assez brutal d’effluvium anagène induisant une alopécie diffuse non cicatricielle. Son développement dépend du type de schéma thérapeutique et des doses prescrites. Elle est particulièrement fréquente avec les taxanes, le cyclophosphamide, l’étoposide, la doxorubicine, l’irinotécan…
Sa survenue et sa prise en charge doivent être discutées et anticipées avec le patient, par exemple en se coupant/rasant les cheveux en amont, ou par le port de prothèses capillaires ou de turbans adaptés. De plus, il est maintenant bien établi que l’utilisation systématique d’un casque réfrigérant avec certaines classes thérapeutiques (taxanes avant tout) permet de limiter la chute, même si sa tolérance reste parfois difficile. Enfin, l’application topique de minoxidil 2% peut permettre de stimuler la repousse.
Les cheveux changent souvent d’aspect au moment de la repousse (2/3 des cas), que ce soit au niveau de leur forme (plus frisés surtout) et de leur couleur (aspect « poivre et sel »).
Alopécie permanente
Il s’agit d’une complication beaucoup moins bien individualisée par les patients ou les praticiens, mais qui peut être dramatique. Elle se définit par une repousse incomplète des cheveux ou des poils (notamment cils et sourcils) 6 à 12 mois après la chimiothérapie. Elle est probablement la conséquence de dégâts irréversibles sur les cellules souches folliculaires, avec miniaturisation des follicules pileux. Son incidence réelle reste à déterminer.Elle concerne surtout les taxanes (docétaxel et dans une moindre mesure paclitaxel) lors de la prise en charge d’un cancer du sein en situation adjuvante.2 Des tableaux similaires peuvent aussi s’observer avec le thiotépa et/ou le busulfan, notamment chez l’enfant. L’alopécie prédomine souvent sur les zones androgénogénétiques (vertex, frontal) mais peut être très sévère et diffuse. L’hormonothérapie (antiaromatases, tamoxifène) souvent prescrite dans ce contexte peut aggraver l’alopécie. La prise en charge thérapeutique est très difficile. Un accompagnement psychologique peut être nécessaire.
Toxicité liée aux thérapies ciblées
Les toxicités dermatologiques des thérapies ciblées sont extrêmement fréquentes et doivent parfois être plus considérées comme un effet attendu du traitement qu’un véritable effet indésirable. Elles sont avant tout secondaires à l’inhibition de cibles communes entre la cellule tumorale et la peau. Par exemple, le récepteur à l’EGFR (epidermal growth factor), qui est une cible majeure en oncologie, joue aussi un rôle fondamental dans l’homéostasie épidermique. Son inhibition à visée thérapeutique s’associe donc à une toxicité dermatologique très fréquente.
Toxicité cutanée
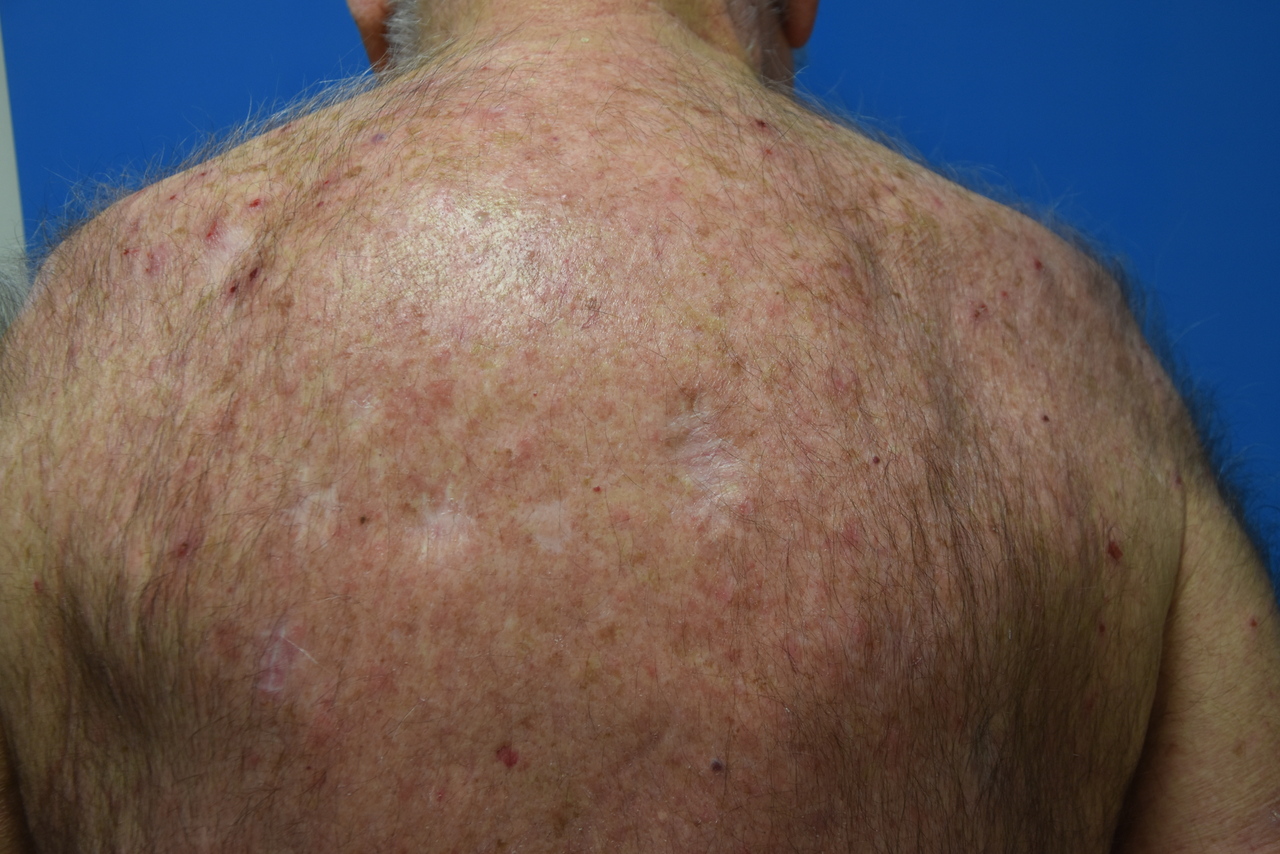
Éruption acnéiforme4
Il s’agit d’une toxicité fréquente et très caractéristique des thérapies ciblées inhibant les récepteurs HER, et plus spécifiquement le récepteur EGFR (ou HER1) [Les lésions apparaissent assez précocement, classiquement au cours du premier mois. Elles prédominent sur les zones riches en glandes sébacées (cuir chevelu, visage, torse). Il s’agit de papules et pustules/nodules centrées sur le follicule pileux, donnant un aspect acnéiforme. Il ne s’y associe en revanche pas les lésions rétentionnelles habituelles de l’acné (microkystes, points noirs). Un prurit peut être au premier plan, pouvant favoriser une surinfection secondaire à Staphylococcus aureus de lésions initialement stériles. Cette éruption acnéiforme peut s’associer aux autres toxicités dermatologiques des inhibiteurs HER : modifications des cheveux et poils, xérose sévère, fissures, paronychies et granulomes pyogéniques (v. infra).
L’amélioration, voire la régression spontanée, est la règle après quelques semaines. Une prise en charge préventive ou curative par tétracyclines per os peut cependant être initialement utile afin d’améliorer la qualité de vie du patient et limiter les interruptions du traitement. L’adjonction de dermo-corticoïdes, d’antibiotiques locaux (clindamycine) et d’une photoprotection adaptée peuvent être aussi nécessaires.
Les inhibiteurs MEK (tramétinib, cobimétinib), et dans une moindre mesure les inhibiteurs mTOR (évérolimus, temsirolimus), peuvent aussi induire une éruption acnéiforme similaire (
Syndrome main-pied
Le développement d’un syndrome main-pied est aussi fréquent avec certaines thérapies ciblées inhibant à la fois les récepteurs PDGF (platelet derived growth factor) et VEGF (vascular endothelial growth factor) [sunitinib, axitinib, cabozantinib, régorafénib, sorafénib] ou la voie BRAF (dabrafénib, vémurafénib) [Si l’atteinte est aussi bilatérale et peut concerner à la fois les paumes et les plantes (plus fréquemment), ce syndrome main-pied diffère clairement de celui induit par la chimiothérapie (
Les lésions sont strictement localisées sur les zones d’appui ou de contact (talons, palette métatarsienne, articulations interphalangiennes…) et prennent un aspect hyperkératosique et inflammatoire bien circonscrit et très caractéristique (
La prise en charge se rapproche de celle décrite avec la chimiothérapie. Un traitement spécifique des zones hyperkératosiques et l’éducation du patient sont ici particulièrement importants.
Toxicité muqueuse (stomatite)
Les atteintes endobuccales3 associées aux thérapies ciblées diffèrent de celles observées avec la chimiothérapie. Même si elles se développent aussi quasi exclusivement sur la muqueuse non kératinisée, elles sont en règle générale plus limitées et se présentent sous la forme d’ulcérations aphtoïdes bien circonscrites. L’impact fonctionnel peut cependant être parfois majeur et nécessiter l’arrêt du traitement inducteur. Ces ulcérations sont surtout fréquentes avec les inhibiteurs mTOR (35-55 % des patients traités), représentant la toxicité la plus limitante de cette classe thérapeutique. Elles sont plus rarement observées avec les inhibiteurs multikinase antiangiogéniques ou les inhibiteurs HER. La prise en charge se rapproche de la mucite chimio-induite.
Parfois, la symptomatologie se résume à une dysesthésie buccale et/ou un énanthème diffus avec dysgueusie.
Parfois, la symptomatologie se résume à une dysesthésie buccale et/ou un énanthème diffus avec dysgueusie.
Toxicité unguéale
Contrairement à la chimiothérapie, les principales toxicités des thérapies ciblées sur l’ongle4 concernent les régions périunguéales, sous la forme de paronychies (inflammation périunguéale) et de granulomes pyogéniques (fig. 3B ) [apparition d’un tissu de granulation avec aspect de pseudo-ongle incarné, après incarnation de la tablette unguéale dans le rebord latéral).
Elles s’observent principalement avec les inhibiteurs HER (incidence de 15 à 20%) et dans une moindre mesure avec les anti-MEK et les inhibiteurs de mTOR. Les lésions apparaissent progressivement, souvent après plusieurs semaines de traitement, et ne régressent pas spontanément.
Une prise en charge adaptée est nécessaire, visant notamment à corriger la courbure de la tablette (« taping », accompagnement podologique) et à éviter les traumatismes. Les dermocorticoïdes ou le nitrate d’argent peuvent être utiles pour réduire le bourgeon charnu.
Un traitement chirurgical est parfois nécessaire (curetage, matricectomie ± phénolisation associée).
Elles s’observent principalement avec les inhibiteurs HER (incidence de 15 à 20%) et dans une moindre mesure avec les anti-MEK et les inhibiteurs de mTOR. Les lésions apparaissent progressivement, souvent après plusieurs semaines de traitement, et ne régressent pas spontanément.
Une prise en charge adaptée est nécessaire, visant notamment à corriger la courbure de la tablette (« taping », accompagnement podologique) et à éviter les traumatismes. Les dermocorticoïdes ou le nitrate d’argent peuvent être utiles pour réduire le bourgeon charnu.
Un traitement chirurgical est parfois nécessaire (curetage, matricectomie ± phénolisation associée).
Toxicité sur les follicules pileux
On n’observe pas, en règle générale, les alopécies complètes propres à la chimiothérapie. De nombreuses modifications, parfois très caractéristiques, peuvent toutefois être notées.4 Citons ici les plus représentatives :
– inhibiteurs HER : alopécie progressive, modérée ; cheveux devenant plus frisés, plus secs, plus cassants ; hypertrichose et trichomégalie caractéristique (allongement des cils) ;
– inhibiteurs BRAF (monothérapie) : alopécie initiale, régressive pendant le traitement ; cheveux plus frisés, plus soyeux ;
– inhibiteurs de KIT (sunitinib, pazopanib, cabozantinib) : dépigmentation caractéristique des cheveux et poils ;
– inhibiteurs Hedgehog (vismodégib) : alopécie sévère et persistante.
– inhibiteurs HER : alopécie progressive, modérée ; cheveux devenant plus frisés, plus secs, plus cassants ; hypertrichose et trichomégalie caractéristique (allongement des cils) ;
– inhibiteurs BRAF (monothérapie) : alopécie initiale, régressive pendant le traitement ; cheveux plus frisés, plus soyeux ;
– inhibiteurs de KIT (sunitinib, pazopanib, cabozantinib) : dépigmentation caractéristique des cheveux et poils ;
– inhibiteurs Hedgehog (vismodégib) : alopécie sévère et persistante.
Toxicité liée à l’immunothérapie
La toxicité dermatologique des anticorps monoclonaux ciblant PD-1 (programmed cell death protein 1), son ligand (PD-L1) ou CTLA-4 (cytotoxic T lymphocyte-associated antigen 4) représente un des plus fréquents effets indésirables immunologiques (immune-related adverse events) des inhibiteurs de checkpoints immunologiques.5 Elle reste le plus souvent d’intensité légère à modérée, permettant en règle générale la poursuite du traitement avec des mesures symptomatiques. Elle peut cependant être parfois sévère ou grave, notamment en cas d’association de molécules.
Toxicité cutanée
Exanthème maculo-papuleux et prurit
Il concerne plus de 15 % des patients avec les anti-PD-1. Les lésions sont volontiers eczématiformes et non spécifiques (Le visage est classiquement respecté. Le prurit est souvent au premier plan. Une biopsie cutanée est nécessaire en cas de forme atypique, persistante ou sévère, notamment pour éliminer une dermatose plus spécifique possible avec ces traitements (v. infra). Le traitement repose sur les dermocorticoïdes et les émollients.
Réaction lichénoïde
Il s’agit du deuxième type d’atteinte cutanée, en termes de fréquence. Le diagnostic n’est cependant fait qu’après l’examen histologique. Les formes palmoplantaires sont possibles, tout comme l’atteinte des muqueuses génitales ou buccales.Psoriasis induit
Il s’agit d’un effet indésirable bien individualisé. Il peut s’agir d’une réactivation d’un psoriasis préexistant ou du déclenchement de novo d’une maladie psoriasique.Dermatoses auto-immunes
La survenue d’une maladie auto-immune dermatologique peut parfois s’observer dans ce contexte. Le tableau le plus caractéristique est le déclenchement d’une pemphigoïde bulleuse.Réactions vitiligoïdes
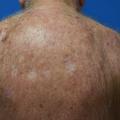
Elles sont plus fréquentes avec les anti-PD-1 (8 % environ). Surtout, elles ne s’observent que chez les patients traités pour un mélanome. Une dépigmentation des poils et cheveux peut s’y associer.Toxicité muqueuse
L’incidence des toxicités endobuccales des inhibiteurs de checkpoints immunologiques reste à déterminer. Le développement de réactions lichénoïdes n’est cependant pas rare en pratique clinique, que ce soit sous forme d’un réseau réticulé ou de lésions ulcérées. Une atteinte génitale de même type est aussi possible. La survenue d’une xérostomie est aussi fréquente.
Toxicité sur les follicules pileux
Une réaction auto-immune de type pelade peut parfois apparaître, qui peut être de type universalis, notamment avec l’ipilimumab.
Références
1. Sibaud V. Toxic erythema of chemotherapy. Ann Dermatol Venereol 2015;142:81-4.
2. Sibaud V, Lebœuf NR, Roche H, et al. Dermatological adverse events with taxane chemotherapy. Eur J Dermatol 2016;26:427-43.
3. Vigarios E, Epstein JB, Sibaud V. Oral mucosal changes induced by anticancer targeted therapies and immune checkpoint inhibitors. Support Care Cancer 2017;25:1713-39.
4. Lacouture ME, Sibaud V. Toxic side effects of targeted and immunotherapies affecting the skin, oral mucosa, hair and nails. Am J Clin Dermatol 2018;19:31-9.
5. Sibaud V. Dermatologic reactions to immune checkpoint inhibitors: skin toxicities and immunotherapy. Am J Clin Dermatol 2018;19:345-61.
2. Sibaud V, Lebœuf NR, Roche H, et al. Dermatological adverse events with taxane chemotherapy. Eur J Dermatol 2016;26:427-43.
3. Vigarios E, Epstein JB, Sibaud V. Oral mucosal changes induced by anticancer targeted therapies and immune checkpoint inhibitors. Support Care Cancer 2017;25:1713-39.
4. Lacouture ME, Sibaud V. Toxic side effects of targeted and immunotherapies affecting the skin, oral mucosa, hair and nails. Am J Clin Dermatol 2018;19:31-9.
5. Sibaud V. Dermatologic reactions to immune checkpoint inhibitors: skin toxicities and immunotherapy. Am J Clin Dermatol 2018;19:345-61.