Les toxicités rénales des traitements du cancer sont multiples. Elles diffèrent par leur mode de révélation clinique (élévation de la créatinine et/ou autres anomalies), leur caractère aigu ou chronique, leur mécanisme (dépendantes de la dose pour certaines, immuno-allergiques pour d’autres), le compartiment rénal atteint, leur caractère réversible ou non, le pronostic rénal.1 Le champ des atteintes rénales toxiques continue de s’étendre avec la généralisation des thérapies ciblées et de l’immunothérapie.2, 3
La connaissance des toxicités observables permet d’affiner le bilan préthérapeutique, avec la mise en œuvre de mesures prophylactiques (si elles existent) et la recherche d’une atteinte rénale préexistant à l’introduction des anticancéreux (par exemple, recherche basale de protéinurie avant la prescription d’un anti-vascular endothelial growth factor [VEGF]) et de cibler la surveillance clinique et paraclinique une fois le traitement débuté.
Certaines comorbidités sous-jacentes majorent le risque de toxicité rénale et doivent être identifiées en amont. Parmi celles-ci, la présence d’une pathologie chronique connue pour augmenter le risque d’insuffisance rénale aiguë, par exemple : insuffisance rénale chronique sous-jacente, insuffisance cardiaque, cirrhose, diabète… ; certains patients cumulant volontiers les facteurs de risque et étant donc particulièrement à risque. Près de 60 % des patients de cancérologie ont une forme de maladie rénale indépendante du traitement reçu. Il peut s’agir des effets directs du processus néoplasique comme dans le myélome multiple, ou dans certaines hémopathies avec infiltration parenchymateuse par les cellules tumorales, d’une réduction néphronique dans le cadre de cancers de la sphère urologique (néphrectomie +/- complète) ainsi que l’existence d’une stomie digestive majorant le risque d’hypovolémie.
Enfin, le rôle des comédications usuelles ne doit pas être négligé, en tout premier lieu l’utilisation de bloqueurs du système rénine-angiotensine (inhibiteurs de l’enzyme de conversion [IEC], antagonistes des récepteurs de l’angiotensine II [ARA2], antialdostérone), d’agents néphrotoxiques au long cours (anti-inflammatoires non stéroïdiens [AINS], ténofovir en cas d’infection par le virus de l’immunodéficience humaine [VIH] ou celui de l’hépatite B [VHB]) ou encore l’utilisation de molécules potentiellement inductrices d’atteintes immunoallergiques et fréquemment prescrites (inhibiteurs de la pompe à protons [IPP], allopurinol, certains antibiotiques).
Les toxicités rénales sont extrêmement variables, et il est possible d’observer pour une même classe thérapeutique des atteintes affectant différents compartiments rénaux. De même, dans le cadre d’une polychimiothérapie peuvent s’observer plusieurs toxicités rénales simultanées. Schématiquement, on peut distinguer les toxicités non nécessairement associées initialement à une insuffisance rénale et qui vont se manifester par une hypertension artérielle (v . p. 212 ) des troubles hydro-électrolytiques ou des anomalies urinaires.
La connaissance des toxicités observables permet d’affiner le bilan préthérapeutique, avec la mise en œuvre de mesures prophylactiques (si elles existent) et la recherche d’une atteinte rénale préexistant à l’introduction des anticancéreux (par exemple, recherche basale de protéinurie avant la prescription d’un anti-vascular endothelial growth factor [VEGF]) et de cibler la surveillance clinique et paraclinique une fois le traitement débuté.
Certaines comorbidités sous-jacentes majorent le risque de toxicité rénale et doivent être identifiées en amont. Parmi celles-ci, la présence d’une pathologie chronique connue pour augmenter le risque d’insuffisance rénale aiguë, par exemple : insuffisance rénale chronique sous-jacente, insuffisance cardiaque, cirrhose, diabète… ; certains patients cumulant volontiers les facteurs de risque et étant donc particulièrement à risque. Près de 60 % des patients de cancérologie ont une forme de maladie rénale indépendante du traitement reçu. Il peut s’agir des effets directs du processus néoplasique comme dans le myélome multiple, ou dans certaines hémopathies avec infiltration parenchymateuse par les cellules tumorales, d’une réduction néphronique dans le cadre de cancers de la sphère urologique (néphrectomie +/- complète) ainsi que l’existence d’une stomie digestive majorant le risque d’hypovolémie.
Enfin, le rôle des comédications usuelles ne doit pas être négligé, en tout premier lieu l’utilisation de bloqueurs du système rénine-angiotensine (inhibiteurs de l’enzyme de conversion [IEC], antagonistes des récepteurs de l’angiotensine II [ARA2], antialdostérone), d’agents néphrotoxiques au long cours (anti-inflammatoires non stéroïdiens [AINS], ténofovir en cas d’infection par le virus de l’immunodéficience humaine [VIH] ou celui de l’hépatite B [VHB]) ou encore l’utilisation de molécules potentiellement inductrices d’atteintes immunoallergiques et fréquemment prescrites (inhibiteurs de la pompe à protons [IPP], allopurinol, certains antibiotiques).
Les toxicités rénales sont extrêmement variables, et il est possible d’observer pour une même classe thérapeutique des atteintes affectant différents compartiments rénaux. De même, dans le cadre d’une polychimiothérapie peuvent s’observer plusieurs toxicités rénales simultanées. Schématiquement, on peut distinguer les toxicités non nécessairement associées initialement à une insuffisance rénale et qui vont se manifester par une hypertension artérielle (
Troubles hydroélectrolytiques
Ils sont principalement représentés (tableau 1 ) par des pertes ioniques rénales par tubulopathie et à un moindre degré par des hyponatrémies de mécanismes variés pouvant inclure une sécrétion inappropriée d’hormone antidiurétique.4, 5 Le pronostic vital peut être engagé par des complications cardiaques rythmiques ou des complications neurologiques. Les antériorités biologiques et l’évolutivité de la tumeur sont à prendre en compte afin de ne pas méconnaître des manifestations liées à la pathologie traitée (hypercalcémie en rapport avec des métastases osseuses, sécrétion inappropriée d’hormone antidiurétique paranéoplasique, syndrome de lyse tumorale, etc.), de même que l’existence de troubles digestifs (parfois liés aux anticancéreux) et la présence de comédications pouvant occasionner des troubles hydro-électrolytiques, tout particulièrement chez le sujet âgé polymédiqué (diurétiques hypokaliémiants, défaut d’absorption digestive du magnésium sous IPP).
L’existence d’une hypomagnésémie ne doit pas être méconnue, puisqu’elle est susceptible d’induire secondairement d’autres anomalies biologiques (hypokaliémie par induction de kaliurèse, hypocalcémie par hypoparathyroïdie). La démarche étiologique passe par l’étude du comportement rénal pour un ion donné, par la réalisation simultanée d’examens sanguins et urinaires avant de débuter toute supplémentation. Toutefois, certaines pertes rénales ne sont pas nécessairement en rapport avec une tubulopathie toxique (kaliurèse induite par les vomissements, diabète phosphaté induit par la parathormone).
L’existence d’une hypomagnésémie ne doit pas être méconnue, puisqu’elle est susceptible d’induire secondairement d’autres anomalies biologiques (hypokaliémie par induction de kaliurèse, hypocalcémie par hypoparathyroïdie). La démarche étiologique passe par l’étude du comportement rénal pour un ion donné, par la réalisation simultanée d’examens sanguins et urinaires avant de débuter toute supplémentation. Toutefois, certaines pertes rénales ne sont pas nécessairement en rapport avec une tubulopathie toxique (kaliurèse induite par les vomissements, diabète phosphaté induit par la parathormone).
Anomalies urinaires
La bandelette urinaire permet de dépister rapidement certaines anomalies (tableau 2 ), en particulier une protéinurie évocatrice d’une toxicité glomérulaire (albuminurie). Du fait de la fréquence des faux positifs, toute anomalie détectée à la bandelette urinaire nécessite d’être confirmée et quantifiée en laboratoire par un rapport protéine/créatinine urinaire.
En cas de documentation d’une protéinurie sur échantillon d’urine, il est utile de réaliser un dosage conjoint d’albuminurie ou une électrophorèse des protéines urinaires (une protéinurie glomérulaire est constituée de plus de 50 % d’albumine). La recherche d’une hypoalbuminémie dans le cadre d’un syndrome néphrotique s’impose en cas de protéinurie sévère (> 300 mg/mmol) et/ou de syndrome œdémateux clinique.
En cas de documentation d’une protéinurie sur échantillon d’urine, il est utile de réaliser un dosage conjoint d’albuminurie ou une électrophorèse des protéines urinaires (une protéinurie glomérulaire est constituée de plus de 50 % d’albumine). La recherche d’une hypoalbuminémie dans le cadre d’un syndrome néphrotique s’impose en cas de protéinurie sévère (> 300 mg/mmol) et/ou de syndrome œdémateux clinique.
Atteintes rénales fonctionnelles
Les insuffisances rénales aiguës fonctionnelles représentent la cause la plus fréquente d’élévation de la créatinine intra- et extrahospitalière. L’anamnèse est souvent évocatrice (troubles digestifs, comédications compromettant l’hémodynamique intrarénale, par exemple par IEC et diurétiques). On ne constate pas d’hypertension artérielle, ni de protéinurie ou d’anomalies du sédiment urinaire. L’analyse de l’ionogramme urinaire documente un profil fonctionnel (rapport Na(u)/K(u) < 1 ; fraction excrétée de Na < 1 %). L’évolution est rapidement favorable après correction de la volémie par un soluté salé ; en cas de prolongation de l’hypoperfusion, l’évolution peut se faire vers une nécrose tubulaire aiguë dont la récupération sera plus lente.
Les molécules le plus souvent impliquées incluent les chimiothérapies classiques émétisantes (cisplatine, cyclophosphamide, etc.) ainsi que les produits inducteurs de diarrhées (fluoro-uracile, irinotécan, inhibiteurs de tyrosine kinase, en particulier ceux ciblant l’epidermal growth factor receptor [EGFR], immunothérapies). Plus rarement ont été décrites des insuffisances rénales fonctionnelles associées à des tableaux d’hypovolémie efficace sur fuite capillaire massive après administration d’interleukine 2 ou de cellules CAR-T.
Les molécules le plus souvent impliquées incluent les chimiothérapies classiques émétisantes (cisplatine, cyclophosphamide, etc.) ainsi que les produits inducteurs de diarrhées (fluoro-uracile, irinotécan, inhibiteurs de tyrosine kinase, en particulier ceux ciblant l’epidermal growth factor receptor [EGFR], immunothérapies). Plus rarement ont été décrites des insuffisances rénales fonctionnelles associées à des tableaux d’hypovolémie efficace sur fuite capillaire massive après administration d’interleukine 2 ou de cellules CAR-T.
Atteintes rénales glomérulaires et microvasculaires
La présence d’une protéinurie majoritairement constituée d’albumine est constante et peut s’associer à une élévation de la créatinine, une hypertension artérielle, une hématurie ou un syndrome néphrotique. Une microangiopathie thrombotique biologique (anémie hémolytique mécanique et thrombopénie) est systématiquement à rechercher. Dans la plupart des cas (hormis en cas de protéinurie isolée non massive sous anti-VEGF), la réalisation d’une biopsie rénale est souhaitable.
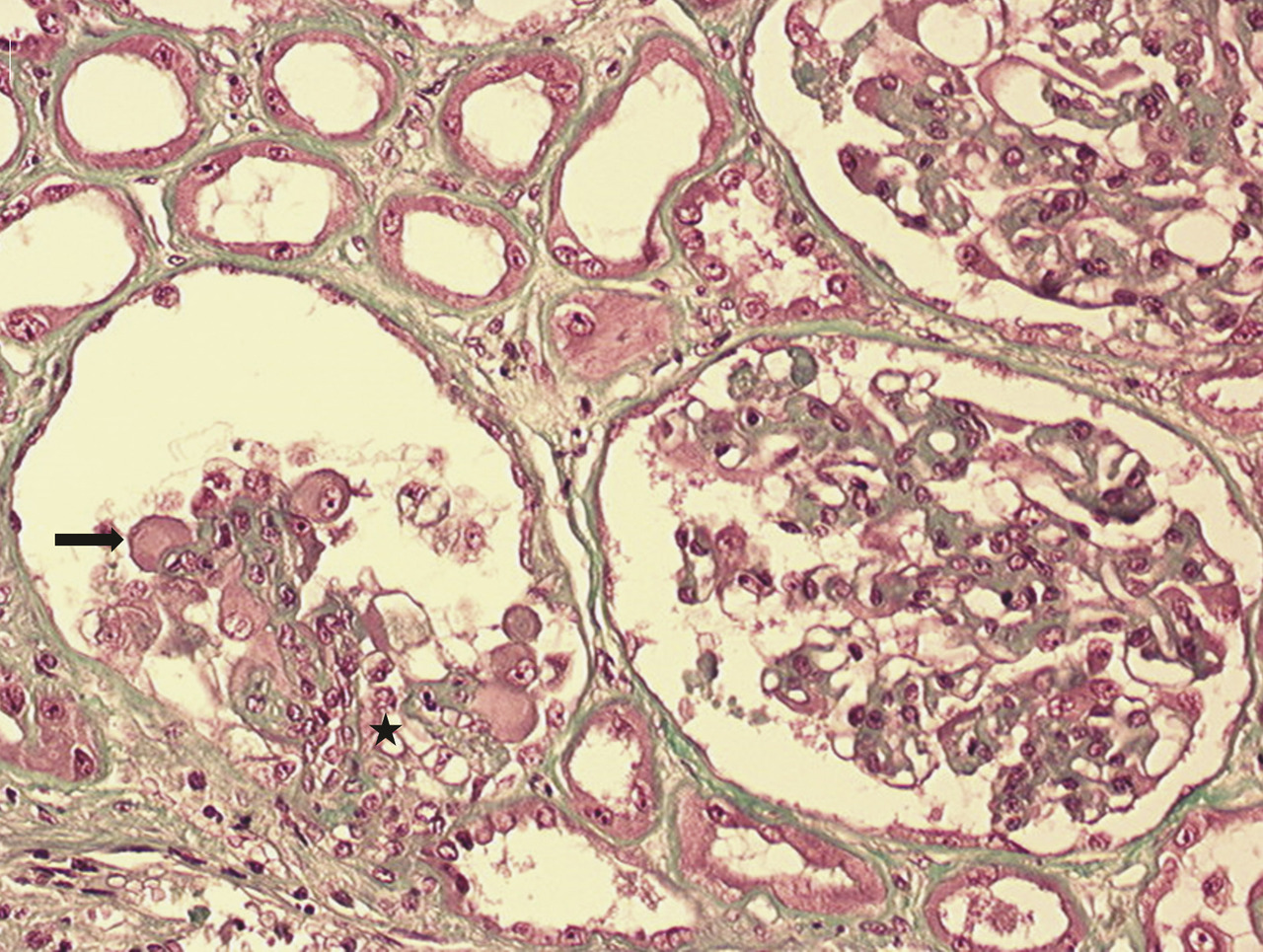
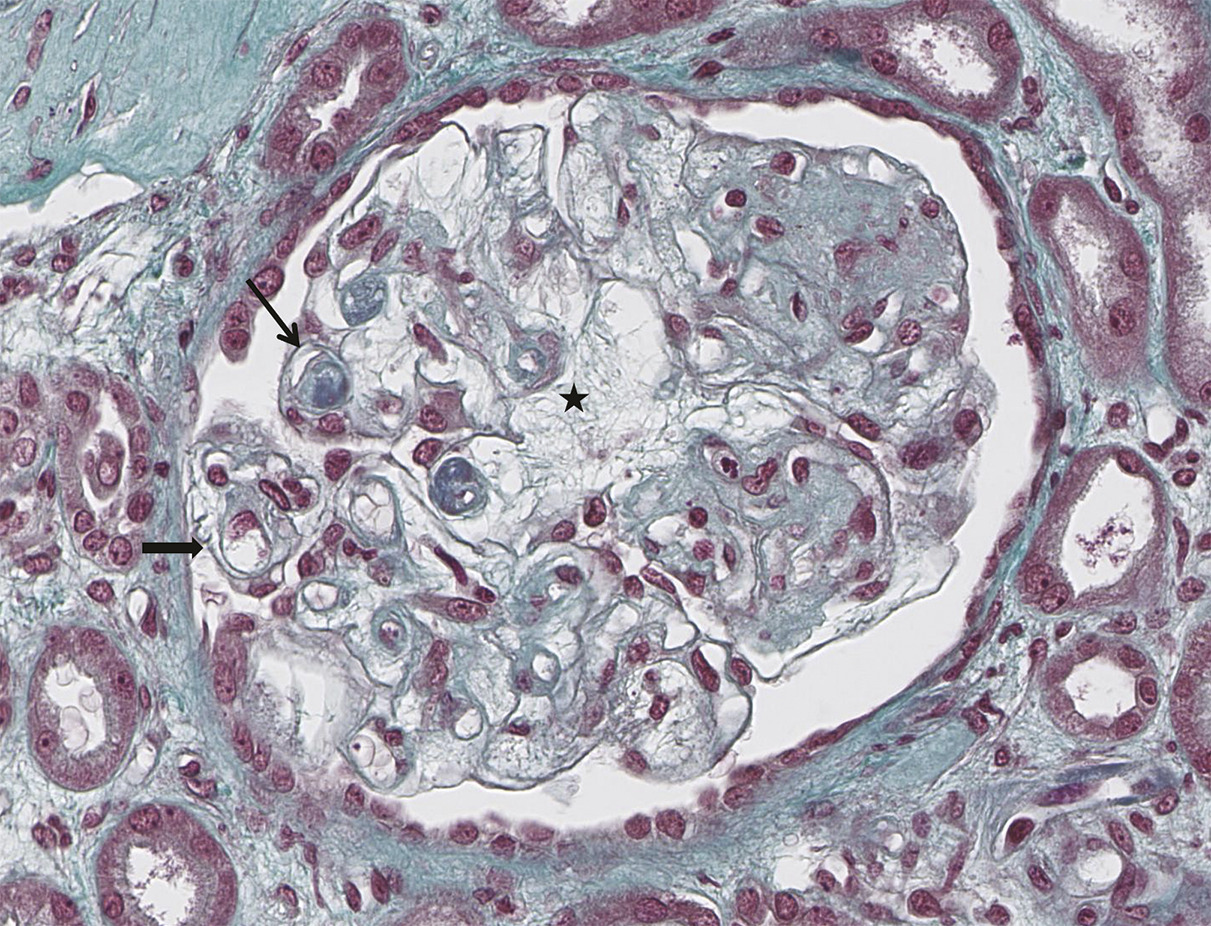
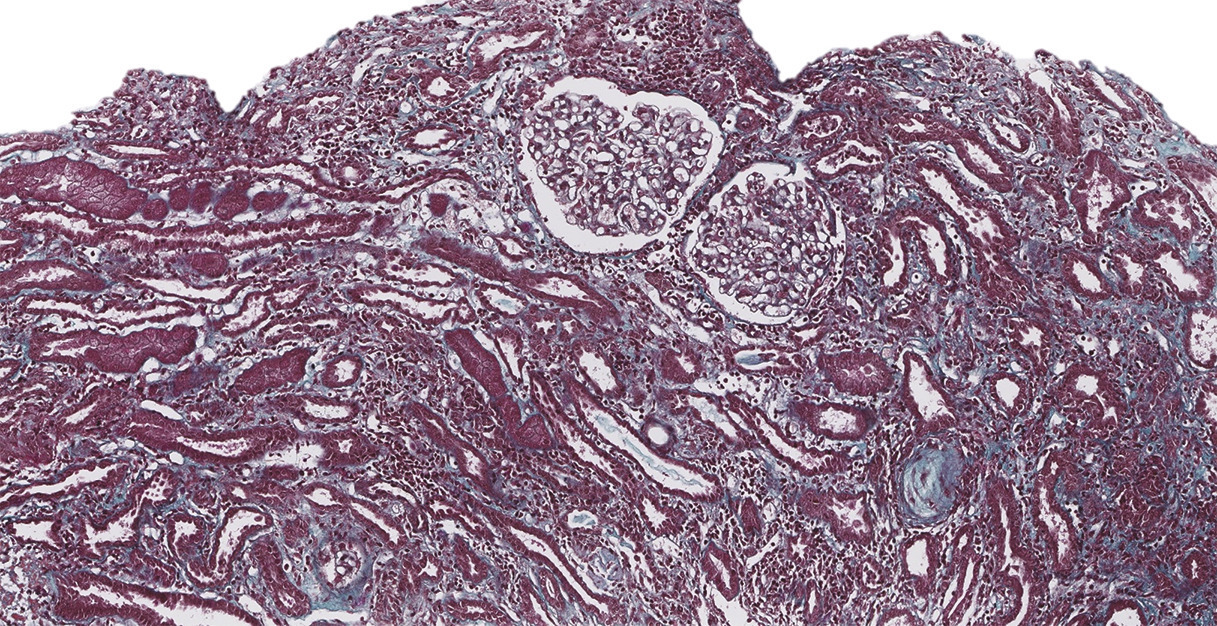
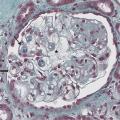
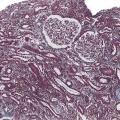
Les atteintes histologiques les plus fréquemment retrouvées incluent (fig. 1 à 3 ) :
– des lésions glomérulaires minimes ou de hyalinose segmentaire ou focale, observables sous interféron, bisphosphonate (pamidronate), antityrosine kinase ciblant VEGF (sorafénib), inhibiteur mTOR (sirolimus), très rarement sous immunothérapie ;
– des lésions de microangiopathie thrombotique (parfois sans microangiopathie thrombotique biologique) observables sous antiangiogéniques (anti-VEGF, antityrosine kinase ciblant VEGF), gemcitabine ou mitomycine C (mécanisme cumulatif souvent irréversible), interféron, irradiation rénale dans le cadre d’une irradiation corporelle totale (conditionnement avant auto- ou allogreffe) ;
– des lésions de glomérulonéphrite pseudolupique, glomérulonéphrite extramembraneuses ou pauci-immunes décrites de façon ponctuelle dans quelques cas cliniques sous immunothérapie.
Les atteintes histologiques les plus fréquemment retrouvées incluent (
– des lésions glomérulaires minimes ou de hyalinose segmentaire ou focale, observables sous interféron, bisphosphonate (pamidronate), antityrosine kinase ciblant VEGF (sorafénib), inhibiteur mTOR (sirolimus), très rarement sous immunothérapie ;
– des lésions de microangiopathie thrombotique (parfois sans microangiopathie thrombotique biologique) observables sous antiangiogéniques (anti-VEGF, antityrosine kinase ciblant VEGF), gemcitabine ou mitomycine C (mécanisme cumulatif souvent irréversible), interféron, irradiation rénale dans le cadre d’une irradiation corporelle totale (conditionnement avant auto- ou allogreffe) ;
– des lésions de glomérulonéphrite pseudolupique, glomérulonéphrite extramembraneuses ou pauci-immunes décrites de façon ponctuelle dans quelques cas cliniques sous immunothérapie.
Atteintes rénales tubulaires
Ces atteintes associent à des niveaux divers troubles hydroélectrolytiques et insuffisance rénale aiguë, avec absence de protéinurie glomérulaire ou d’anomalies du sédiment urinaire. Le profil urinaire n’est habituellement pas fonctionnel, et une biopsie rénale est rarement indiquée en l’absence de lésions histologiques spécifiques ; cet examen peut parfois être utile à visée pronostique (évaluation de la fibrose rénale résiduelle). La récupération de la fonction rénale n’est pas systématique, et son niveau dépendra du terrain sous-jacent (fonction rénale préalable, comorbidités à risque), de la sévérité et de la répétition des épisodes d’insuffisance rénale aiguë.
On peut distinguer parmi ces atteintes :
– les nécroses tubulaires aiguës faisant suite à des troubles digestifs prolongés (v. supra) ;
– les nécroses tubulaires aiguës toxiques après administration de pémétrexed, de bisphosphonate (zolédronate), d’inhibiteurs de tyrosine kinase ciblant BCR-ABL (imatinib, etc.) ou de sels de platine ; parmi les sels de platine, le cisplatine est la molécule avec le plus fort potentiel néphrotoxique, dépendant de la dose.6 L’atteinte la plus courante est une insuffisance rénale aiguë à diurèse conservée, de sévérité d’autant plus importante qu’il existe des facteurs d’agressions rénales concomitantes (v. supra). Il s’agit d’un effet toxique direct sur les cellules tubulaires distales et proximales par l’existence de transporteurs tubulaires augmentant la concentration du cisplatine en intracellulaire, provoquant ainsi une nécrose des cellules et une inflammation locale, sans précipitation dans la lumière tubulaire. Il existe donc une augmentation brutale de la créatinine dans la semaine suivant l’administration du cisplatine accompagnée d’une protéinurie tubulaire (moins de 1 g/j) sans hématurie. On note également fréquemment des signes d’atteinte tubulaire comme l’hypomagnésémie avec hypocalcémie secondaire, témoignant de l’atteinte du tubule distale. En cas d’atteinte proximale, une hypophosphorémie et une hypokaliémie peuvent également être présentes. À l’arrêt du cisplatine, la récupération de la fonction rénale ne se fait pas toujours ad integrum. Les autres sels de platine (carboplatine, oxaliplatine) ont l’avantage d’être moins néphrotoxiques mais sont moins efficaces dans certains cancers, comme celui du poumon. En cas d’utilisation du cisplatine chez un patient ayant une insuffisance rénale préexistante, il faut réduire la dose administrée, en maintenant une hydratation suffisante et en réduisant au minimum les autres facteurs aggravants (arrêt des médicaments néphrotoxiques, éviter les injections d’iode) ;
– la précipitation intratubulaire de méthotrexate haute dose (v . p. 216 ) ;
– la tubulopathie proximale (syndrome de Fanconi +/- complet) post-ifosfamide (avec risque de tubulopathie permanente) ;
– les pertes rénales de magnésium sous thérapies ciblant l’EGFR (cétuximab, etc.) et sels de platine.7
On peut distinguer parmi ces atteintes :
– les nécroses tubulaires aiguës faisant suite à des troubles digestifs prolongés (v. supra) ;
– les nécroses tubulaires aiguës toxiques après administration de pémétrexed, de bisphosphonate (zolédronate), d’inhibiteurs de tyrosine kinase ciblant BCR-ABL (imatinib, etc.) ou de sels de platine ; parmi les sels de platine, le cisplatine est la molécule avec le plus fort potentiel néphrotoxique, dépendant de la dose.6 L’atteinte la plus courante est une insuffisance rénale aiguë à diurèse conservée, de sévérité d’autant plus importante qu’il existe des facteurs d’agressions rénales concomitantes (v. supra). Il s’agit d’un effet toxique direct sur les cellules tubulaires distales et proximales par l’existence de transporteurs tubulaires augmentant la concentration du cisplatine en intracellulaire, provoquant ainsi une nécrose des cellules et une inflammation locale, sans précipitation dans la lumière tubulaire. Il existe donc une augmentation brutale de la créatinine dans la semaine suivant l’administration du cisplatine accompagnée d’une protéinurie tubulaire (moins de 1 g/j) sans hématurie. On note également fréquemment des signes d’atteinte tubulaire comme l’hypomagnésémie avec hypocalcémie secondaire, témoignant de l’atteinte du tubule distale. En cas d’atteinte proximale, une hypophosphorémie et une hypokaliémie peuvent également être présentes. À l’arrêt du cisplatine, la récupération de la fonction rénale ne se fait pas toujours ad integrum. Les autres sels de platine (carboplatine, oxaliplatine) ont l’avantage d’être moins néphrotoxiques mais sont moins efficaces dans certains cancers, comme celui du poumon. En cas d’utilisation du cisplatine chez un patient ayant une insuffisance rénale préexistante, il faut réduire la dose administrée, en maintenant une hydratation suffisante et en réduisant au minimum les autres facteurs aggravants (arrêt des médicaments néphrotoxiques, éviter les injections d’iode) ;
– la précipitation intratubulaire de méthotrexate haute dose (
– la tubulopathie proximale (syndrome de Fanconi +/- complet) post-ifosfamide (avec risque de tubulopathie permanente) ;
– les pertes rénales de magnésium sous thérapies ciblant l’EGFR (cétuximab, etc.) et sels de platine.7
Atteintes rénales interstitielles
Les néphrites immuno-allergiques associent de manière très inconstante une insuffisance rénale aiguë de profil non fonctionnel de sévérité variable, une hyperéosinophilie et des anomalies du sédiment urinaire (leucocyturie avec éosinophilurie). Devant ce profil biologique aspécifique, la réalisation d’une biopsie rénale doit systématiquement s’envisager, à la recherche d’un infiltrat interstitiel +/- granulomateux caractéristique, en particulier pour le diagnostic différentiel avec les autres atteintes, dont la nécrose tubulaire aiguë.8
Non rapportées avec les chimiothérapies standard, elles complètent le spectre des atteintes rénales décrites depuis l’émergence des traitements de la famille des immunothérapies (anticorps anti-PD-1, anti-PD-L1 ou anti-CTLA4) et de leurs effets indésirables dysimmunitaires liés à l’hyperactivation lymphocytaire. Regroupés sous le terme d’immune-related adverse events (iRAE), tous les organes sont concernés à des fréquences et avec des sévérités variables.9, 10
Rare dans les premières études de phase III, l’incidence de l’insuffisance rénale aiguë sous mono-immunothérapie s’est élevée de 2 % à environ 17 % dans les dernières études en vie réelle publiées à ce jour, avec néanmoins seulement 3,5 % en moyenne d’insuffisances rénales aiguës formellement attribuables à l’immunothérapie. Une insuffisance rénale aiguë de sévérité modérée (stade 1 dans la majorité des cas), associée à une leucocyturie aseptique et un ou plusieurs iRAE extrarénaux (dans environ 50 % des cas) au cours de la première année de traitement, est évocatrice. L’apparition de troubles ioniques (en particulier une acidose métabolique d’origine rénale) sous interféron sans élévation de la créatinine peut également révéler ce type d’atteinte. La confirmation diagnostique repose sur la présence d’un infiltrat lymphocytaire à la biopsie rénale.
Une telle toxicité implique un arrêt de l’immunothérapie mais aussi des traitements classiquement impliqués dans les néphrites immunoallergiques (IPP, Fluidione (Previscan), certains antibiotiques), potentiellement responsable du tableau par une rupture de tolérance, une corticothérapie dont la dose reste à ce jour non consensuelle et dépendante des pratiques de chaque équipe (dans la littérature entre 0,5 et 2 mg/kg/j) permettant l’obtention d’une rémission complète dans 1 cas sur 2, partielle dans 1 cas sur 3. La reprise ultérieure d’une immunothérapie doit se discuter de façon collégiale entre oncologue et néphrologue en fonction des alternatives thérapeutiques et du rapport bénéfice-risque sur les deux versants.11
Non rapportées avec les chimiothérapies standard, elles complètent le spectre des atteintes rénales décrites depuis l’émergence des traitements de la famille des immunothérapies (anticorps anti-PD-1, anti-PD-L1 ou anti-CTLA4) et de leurs effets indésirables dysimmunitaires liés à l’hyperactivation lymphocytaire. Regroupés sous le terme d’immune-related adverse events (iRAE), tous les organes sont concernés à des fréquences et avec des sévérités variables.9, 10
Rare dans les premières études de phase III, l’incidence de l’insuffisance rénale aiguë sous mono-immunothérapie s’est élevée de 2 % à environ 17 % dans les dernières études en vie réelle publiées à ce jour, avec néanmoins seulement 3,5 % en moyenne d’insuffisances rénales aiguës formellement attribuables à l’immunothérapie. Une insuffisance rénale aiguë de sévérité modérée (stade 1 dans la majorité des cas), associée à une leucocyturie aseptique et un ou plusieurs iRAE extrarénaux (dans environ 50 % des cas) au cours de la première année de traitement, est évocatrice. L’apparition de troubles ioniques (en particulier une acidose métabolique d’origine rénale) sous interféron sans élévation de la créatinine peut également révéler ce type d’atteinte. La confirmation diagnostique repose sur la présence d’un infiltrat lymphocytaire à la biopsie rénale.
Une telle toxicité implique un arrêt de l’immunothérapie mais aussi des traitements classiquement impliqués dans les néphrites immunoallergiques (IPP, Fluidione (Previscan), certains antibiotiques), potentiellement responsable du tableau par une rupture de tolérance, une corticothérapie dont la dose reste à ce jour non consensuelle et dépendante des pratiques de chaque équipe (dans la littérature entre 0,5 et 2 mg/kg/j) permettant l’obtention d’une rémission complète dans 1 cas sur 2, partielle dans 1 cas sur 3. La reprise ultérieure d’une immunothérapie doit se discuter de façon collégiale entre oncologue et néphrologue en fonction des alternatives thérapeutiques et du rapport bénéfice-risque sur les deux versants.11
Conclusion
De multiples types de toxicité rénale sont observables sous anticancéreux, incluant des tubulopathies mais également des atteintes glomérulaires, microvasculaires ou interstitielles. Le spectre des toxicités rénales a été modifié et enrichi par l’apparition des thérapies ciblées et plus récemment des immunothérapies. La prévention et l’identification précoce des toxicités rénales sont primordiales afin d’optimiser la survie rénale mais également oncologique.
Références
1. Perazella MA. Onco-nephrology: renal toxicities of chemotherapeutic agents. Clin J Am Soc Nephrol 2012;7:1713-21.
2. Jhaveri KD, Shah HH, Calderon K, Campenot ES, Radhakrishnan J. Glomerular diseases seen with cancer and chemotherapy: a narrative review. Kidney Int 2013;84:34-44.
3. Jhaveri KD, Wanchoo R, Sakhiya V, Ross DW, Fishbane S. Adverse renal effects of novel molecular oncologic targeted therapies: a narrative review. Kidney Int Rep 2016;2:108-23.
4. Liamis G, Filippatos TD, Elisaf MS. Electrolyte disorders associated with the use of anticancer drugs. Eur J Pharmacol 2016;777:78-87.
5. Workeneh BT, Jhaveri KD, Rondon-Berrios H. Hyponatremia in the cancer patient. Kidney Int 2020;98:870-82.
6. Launey-Vacher V. Prevention of cisplatin nephrotoxicity: state of the art and recommandations from the European Society of Clinical Pharmacy Special Interest Group on Cancer Care. 2008 May. Cancer Chemoter Pharmacol 2008;61;903-9.
7. Izzedine H, Perazella MA. Adverse kidney effects of epidermal growth factor receptor inhibitors. Nephrol Dial Transplant 2017;32:1089-97.
8. Perazella MA, Moeckel GW. Nephrotoxicity from chemotherapeutic agents: clinical manifestations, pathobiology, and prevention/therapy. Semin Nephrol 2010;30:570-81.
9. Herrmann SM, Perazella MA. Immune checkpoint inhibitors and immune-related adverse renal events. Kidney Int Rep 2020;5:1139-48.
10. Meraz-Muñoz A, Amir E, Ng P, et al. Acute kidney injury associated with immune checkpoint inhibitor therapy: incidence, risk factors and outcomes. J Immunother Cancer 2020;8:e000467.
11. Cortazar FB, Kibbelaar ZA, Glezerman IG, et al. Clinical features and outcomes of immune checkpoint inhibitor-associated AKI: a multicenter study. J Am Soc Nephrol 2020;31:435-46.
2. Jhaveri KD, Shah HH, Calderon K, Campenot ES, Radhakrishnan J. Glomerular diseases seen with cancer and chemotherapy: a narrative review. Kidney Int 2013;84:34-44.
3. Jhaveri KD, Wanchoo R, Sakhiya V, Ross DW, Fishbane S. Adverse renal effects of novel molecular oncologic targeted therapies: a narrative review. Kidney Int Rep 2016;2:108-23.
4. Liamis G, Filippatos TD, Elisaf MS. Electrolyte disorders associated with the use of anticancer drugs. Eur J Pharmacol 2016;777:78-87.
5. Workeneh BT, Jhaveri KD, Rondon-Berrios H. Hyponatremia in the cancer patient. Kidney Int 2020;98:870-82.
6. Launey-Vacher V. Prevention of cisplatin nephrotoxicity: state of the art and recommandations from the European Society of Clinical Pharmacy Special Interest Group on Cancer Care. 2008 May. Cancer Chemoter Pharmacol 2008;61;903-9.
7. Izzedine H, Perazella MA. Adverse kidney effects of epidermal growth factor receptor inhibitors. Nephrol Dial Transplant 2017;32:1089-97.
8. Perazella MA, Moeckel GW. Nephrotoxicity from chemotherapeutic agents: clinical manifestations, pathobiology, and prevention/therapy. Semin Nephrol 2010;30:570-81.
9. Herrmann SM, Perazella MA. Immune checkpoint inhibitors and immune-related adverse renal events. Kidney Int Rep 2020;5:1139-48.
10. Meraz-Muñoz A, Amir E, Ng P, et al. Acute kidney injury associated with immune checkpoint inhibitor therapy: incidence, risk factors and outcomes. J Immunother Cancer 2020;8:e000467.
11. Cortazar FB, Kibbelaar ZA, Glezerman IG, et al. Clinical features and outcomes of immune checkpoint inhibitor-associated AKI: a multicenter study. J Am Soc Nephrol 2020;31:435-46.