Le traitement curatif de l’adénocarcinome du pancréas (ADCP), envisageable seulement en l’absence de métastases à distance, a longtemps reposé sur la seule chirurgie, jusqu’ici rarement possible du fait d’une fréquente extension locorégionale et/ou métastatique. Elle a maintenant des indications très codifiées et vise une résection R0 (complète avec des berges saines) à laquelle on associe le plus souvent une chimiothérapie adjuvante mais aussi « d’induction » pour améliorer la faisabilité et la qualité de l’exérèse.
Sélection des malades
Bilan d’extension
Une imagerie performante limite le risque de découverte peropératoire de métastases, qui altère l’état général et retarde la chimiothérapie, diminuant in fine la survie. La précision de la tomodensitométrie (TDM ou scanner) pour le diagnostic de résécabilité est de 85-90 %, si elle est faite :
– avec une technique spécifique (acquisitions multiphasiques) ;
– avant toute prothèse biliaire (pour éviter des lésions de pancréatite faussant l’évaluation) ;
– récemment (< 4 semaines) ;
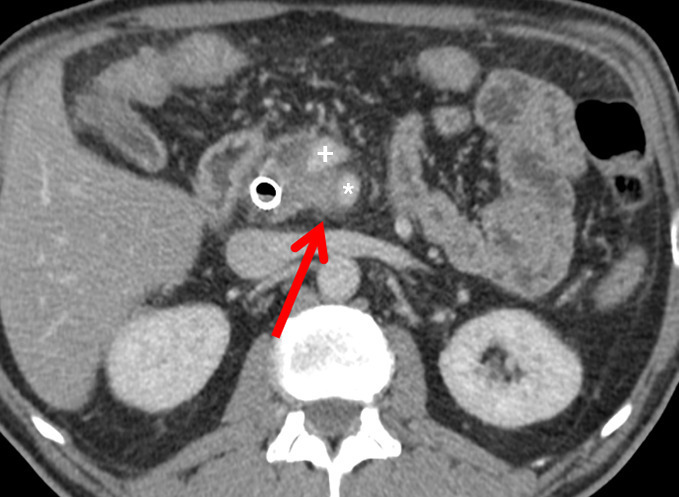
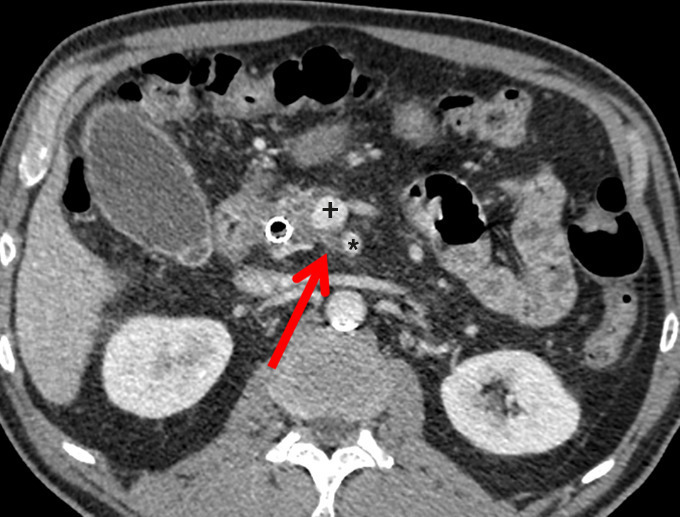
– en analysant les éventuels contacts avec les vaisseaux (tronc cœliaque [TC] et ses branches, artère et veine mésentériques supérieures [AMS-VMS], veine porte [VP]) ;
– en incluant des coupes thoraciques.
Le scanner seul peine à détecter les métastases hépatiques (localisation la plus fréquente) de petite taille. Cela explique le risque d’environ 15 % de laparotomie non thérapeutique. L’IRM hépatique avec diffusion est utile pour caractériser toute lésion atypique et découvrir des métastases occultes chez environ 10 % des malades sans lésion visible en TDM. Chaque lésion suspecte du foie doit être biopsiée pour obtenir la preuve du caractère métastatique de l’ADCP.
Une extension ganglionnaire à distance (latéro-aortique, de pronostic équivalent à celui des métastases) ou péritonéale, compliquant respectivement 10-15 % et 5 % des ADCP semblant résécables, est difficile à détecter en TDM et en tomographie par émission de positons au 18-flurodésoxyglucose (TEP-FDG). Un CA 19-9 > 100-150 U/mL (ictère et diabète absents ou traités) est prédictif de métastases, parfois invisibles. Dans ces cas, une laparoscopie permet de découvrir et de biopsier des métastases hépatiques, péritonéales ou ganglionnaires sans les inconvénients d’une laparotomie.
Au terme de ce bilan préthérapeutique, l’ADCP non métastatique doit être classé lors d’une réunion de concertation pluridisciplinaire : résécable, de résécabilité limitée (borderline resectable), ou localement avancé. Cette classification repose surtout sur des critères « anatomiques » (
Évaluation de l’état général et des comorbidités
L’ADCP est fréquent chez les personnes âgées et la morbi-mortalité des pancréatectomies est élevée.
Leurs indications (surtout la duodéno- pancréatectomie céphalique) doivent donc être limitées après 75-80 ans et tenir compte des comorbidités (antécédents cardiovasculaires, insuffisance rénale ou hépatopathie chronique). Des scores permettent de prédire la mortalité à J90. Si elle dépasse 10 %, la chirurgie est évitée, malgré le mauvais pronostic de l’ADCP. En effet, la morbidité postopératoire est importante, limitant les possibilités de CT adjuvante et altérant la qualité de vie.
Pris isolément, l’âge n’est pas une contre-indication mais impose une évaluation oncogériatrique. Renutrition, correction d’une insuffisance exocrine et équilibration d’un diabète sont nécessaires.
Traitement chirurgical
Il a pour but l’exérèse complète d’une tumeur localisée, avec des marges supérieures à 1 mm (résection R0). La survie médiane est alors de 30-40 mois. La plus importante au plan pronostique est la marge rétrovasculaire, ou lame rétroporte (tissu graisseux, lymphatique et nerveux, située en arrière de la VMS et la VP et au contact de l’AMS ;
L’exérèse est sans intérêt lorsqu’elle macroscopiquement incomplète (R2), ou s’il y a des métastases (hépatiques, péritonéales ou ganglionnaires à distance), car elle n’améliore pas le pronostic par rapport à une CT exclusive (médiane de survie ≈ 12 mois).
Souvent, elle est macroscopiquement complète, mais avec une distance entre lame rétroporte et tumeur < 1 mm (R1). La survie est alors peu différente de celle obtenue avec une marge de 0 mm. Ce résultat imparfait, difficilement prévisible, est acceptable : survie à 5 ans de 10 à 15 %.
Techniques
La duodéno-pancréatectomie céphalique (DPC) est indiquée pour les tumeurs céphaliques (80 % des cas) : on résèque la tête du pancréas, la voie biliaire principale, la vésicule et le cadre duodénal (± le pylore). La continuité est rétablie par 3 anastomoses : pancréatico-jéjunale, hépatico-jéjunale et gastro-jéjunale. La mortalité à J90 de la DPC est, y compris dans des centres à forte activité, de 4 à 5 % et la morbidité d’environ 50 % (dont des fistules pancréatiques dans 15-20 % des cas, une gastroparésie pour 10 à 15 %). La laparoscopie n’améliore pas les résultats.
À distance, les risques de diabète et d’insuffisance exocrine de novo sont respectivement de 15-20 % et 50 %.
La pancréatectomie gauche, en règle avec splénectomie (SPG), est le traitement des tumeurs corporéo-caudales.Cette technique est assortie d’une mortalité à J90 de 2 à 4 %. Le risque de fistule pancréatique est de 20 % et celui de diabète de novo de 20 à 25 %. Elle peut être effectuée par laparoscopie : la durée de récupération est alors moindre qu’après laparotomie.
La duodéno-pancréatectomie totale est exceptionnellement indiquée.
En cas d’extension tumorale artérielle et/ou veineuse, une résection vasculaire peut compléter toutes ces interventions afin d’obtenir une exérèse R0. Les pancréatectomies avec ablation artérielle sont habituellement contre-indiquées du fait de leur mortalité excessive. En revanche, celles avec résection veineuse sont souvent réalisées dans les centres expérimentés avec un faible sur-risque de morbi- mortalité.
Indications opératoires
Tumeurs résécables d’emblée. L’intervention est une DPC ou une pancréatectomie gauche avec splénectomie, accompagnée d’une lymphadénectomie. Les complications postopératoires doivent être dépistées et traitées (fistule pancréatique, hémorragie par érosion vasculaire, sepsis, gastroparésie) car elles sont un facteur indépendant de mauvais pronostic. Les ADCP réséqués s’accompagnent 3 fois sur 4 d’une extension ganglionnaire, indication claire à une CT adjuvante. Elle est toutefois impossible pour un quart des patients.
Ce point et les fréquentes récidives métastatiques précoces militent en faveur d’une CT néo-adjuvante systématique dont l’intérêt, suggéré par certaines études, est en cours d’évaluation dans plusieurs essais thérapeutiques.
Tumeurs de résécabilité limite (borderline) :
• en cas d’ADCP borderline artériel, le traitement « d’induction » (cf. infra) est toujours recommandé, plutôt qu’une résection d’emblée compte tenu de la mortalité (> 10 %) et de l’absence de bénéfice carcinologique ;
• en cas d’ADCP borderline veineux, on débute aussi par une induction, même si l’intervention ne pose pas de problème technique. En effet, les pancréatectomies avec résection veineuse d’emblée ont un plus mauvais pronostic en raison de la fréquence élevée des R1 par extension tumorale dans la lame rétroporte. Selon plusieurs études dans cette indication (dont 1 essai randomisé), la survie après résection est meilleure après induction qu’après chirurgie d’emblée.
Le traitement d’induction comprend, après biopsie positive et éventuel drainage biliaire, une CT systémique, éventuellement suivie d’une radio-chimiothérapie (RCT), pour « stériliser » la tumeur au contact des artères et transformer un ADCP borderline en tumeur résécable avec des marges saines. L’association FOLFIRINOX (5-fluoro-uracile [5FU] + irinotécan + oxaliplatine) permet des taux de résécabilité secondaire de 60-65 %. La RCT, qui succède obligatoirement à la CT, est discutée. Elle améliorerait le taux de résection R0 et la survie à distance.
Évaluer la résécabilité secondaire d’une tumeur borderline après CT RCT peut être difficile et repose sur un faisceau d’arguments cliniques (disparition des douleurs cœliaques, reprise de poids), biologiques (baisse du CA 19-9 sérique) et radiologiques (réduction même partielle du contact tumeur-axe vasculaire, diminution même modérée du diamètre tumoral ;
Le terme « borderline » peut aussi s’appliquer au cas d’opérabilité « limite » (grand âge, comorbidités) ou de suspicion de métastases (nodule hépatique non caractérisable, CA 19-9 > 300 UI/L sans ictère). Une CT « néo-adjuvante » est alors justifiée pour se laisser le temps de traiter les comorbidités corrigeables.
Tumeurs localement avancées. Initialement non résécables, elles peuvent le devenir après une CT, parfois prolongée (résécabilité secondaire : 20- 25 % après FOLFIRINOX). Il est souvent difficile d’évaluer la réponse tumorale sur la seule TDM et c’est sur le même faisceau d’arguments cliniques, biologiques, TDM et IRM qu’on juge de l’intérêt d’une intervention.
Prise en charge postopératoire
La chirurgie curative comprend la résection des tissus lymphatiques et nerveux péri-artériels avec un risque de lymphorrhée, de diarrhée motrice et de dénutrition.
Le dépistage et le traitement de l’insuffisance exocrine et endocrine sont nécessaires pour améliorer l’état général et la tolérance à la CT adjuvante. Il faut prendre en charge une éventuelle diarrhée motrice si les extraits pancréatiques ne sont pas efficaces.
La CT adjuvante améliore significativement la survie et doit être faite chaque fois que possible. L’association FOLFIRINOX est le standard en cas de bon état général. Autres options : monochimiothérapie par gemcitabine ou 5FU ou l’association gemcitabine + capécitabine. La CT à débuter dans les 12 semaines postopératoires, dure 6 mois.
Ictère et cancer du pancréas
Le drainage biliaire préopératoire a des indications réduites (possibles complications graves : pancréatite nécrosante retardant voire contre-indiquant la chirurgie) et il augmente le risque d’infections postopératoires. à l’inverse, une prothèse biliaire et le délai (1 mois) nécessaire à la régression de l’ictère ne diminuent pas la survie après résection.
Ce drainage est indiqué en cas de bilirubine > 200-250 µmol/L, d’angiocholite, d’ictère avec insuffisance rénale ou de chirurgie « différée » (bilan d’opérabilité, renutrition, CT préopératoire). La voie d’abord rétrograde est la moins morbide. Brossage cytologique et biopsie peuvent confirmer le diagnostic.
En cas d’échec, un drainage sous écho-endoscopie semble préférable à la voie percutanée.
1. Dallongeville A, Corno L, Silvera S, Boulay-Coletta I, Zins M. Initial diagnosis and staging of pancreatic cancer including main differentials. Semin Ultrasound CT MR 2019;40:436-68.
2. Lambert A, Schwarz L, Borbath I, et al. An update on treatment options for pancreatic adeno- carcinoma. Ther Adv Med Oncol 2019 Sep 25;11: 1758835919875568.
3. Farges O, Bendersky N, Truant S, Delpero JR, Pruvot FR, Sauvanet A. The theory and practice of pancreatic surgery in France. Ann Surg 2017;266:797-804.
4. Sauvanet A, Boher JM, Paye F, et al; French Association of Surgery. Severe Jaundice Increases Early Severe Morbidity and Decreases Long-Term Survival after Pancreaticoduodenectomy for Pancreatic Adenocarcinoma. J Am Coll Surg 2015;221:380-9.
5. INCa. Conduite à tenir chez les patients atteints d’adénocarcinome du pancréas. Synthèse. Septembre 2019. https://bit.ly/3evD2Nb

 Encadrés
Encadrés