Les progrès thérapeutiques permettent d’espérer une amélioration significative du pronostic visuel des patients, à condition toutefois que les moyens humains et matériels suivent…
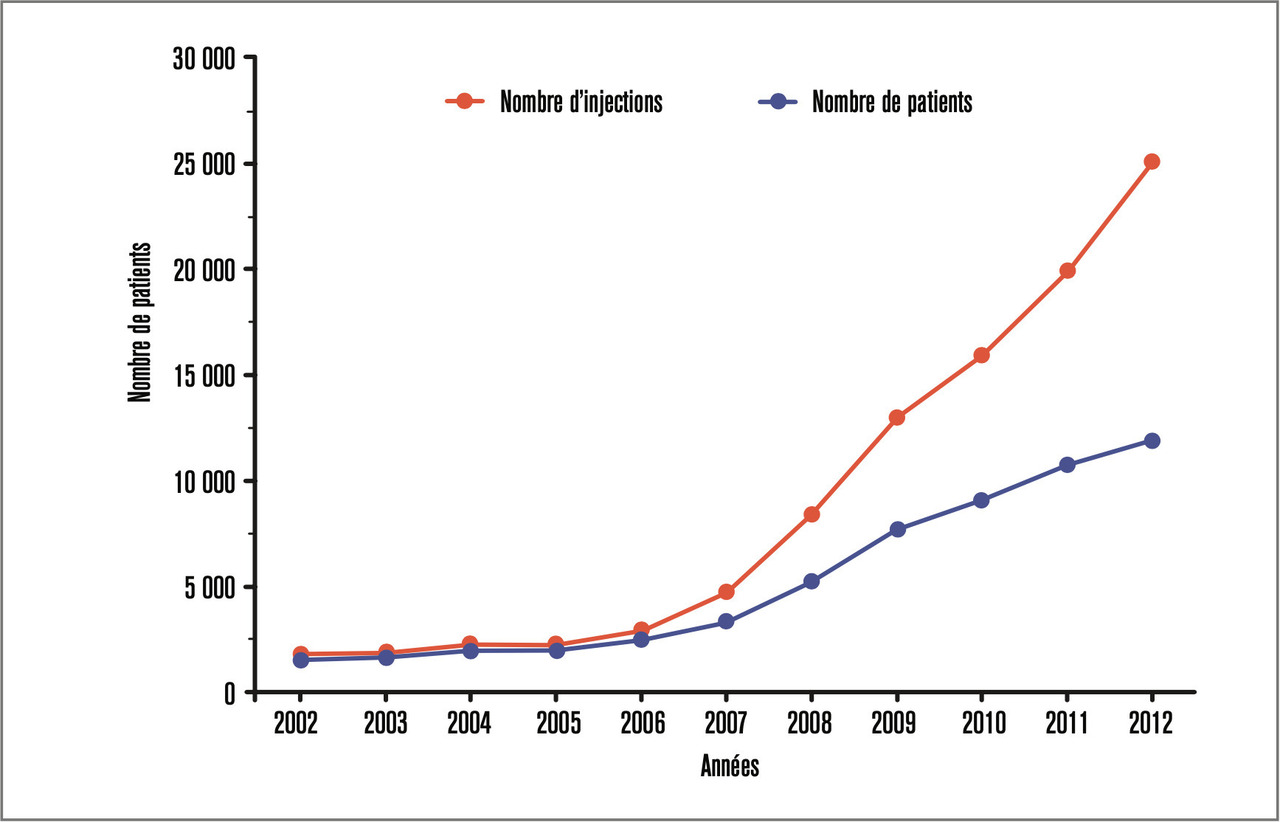
La rétinopathie diabétique représente encore aujourd’hui la principale cause de baisse de vision dans la population active des pays développés.1 Deux complications rétiniennes dues au diabète sont à l’origine de ces baisses de vision : la survenue de néovaisseaux prérétiniens et l’œdème maculaire diabétique. Si le laser a permis à partir des années 1960 de réduire les complications liées au néovaisseaux rétiniens, les injections intravitréennes d’anti-vascular endothelial growth factor (anti-VEGF) ou de corticoïdes ont modifié, depuis une dizaine d’années, le pronostic de l’œdème maculaire diabétique : les injections intravitréennes, répétées bien souvent pendant plusieurs années, ayant pris une place primordiale en ophtalmologie, dans le traitement des pathologies œdémateuses de la rétine centrale dite maculaire (l’œdème maculaire diabétique mais aussi les occlusions veineuses et la dégénérescence liée à l’âge) [fig. 1].
L’avènement des anti-VEGF…
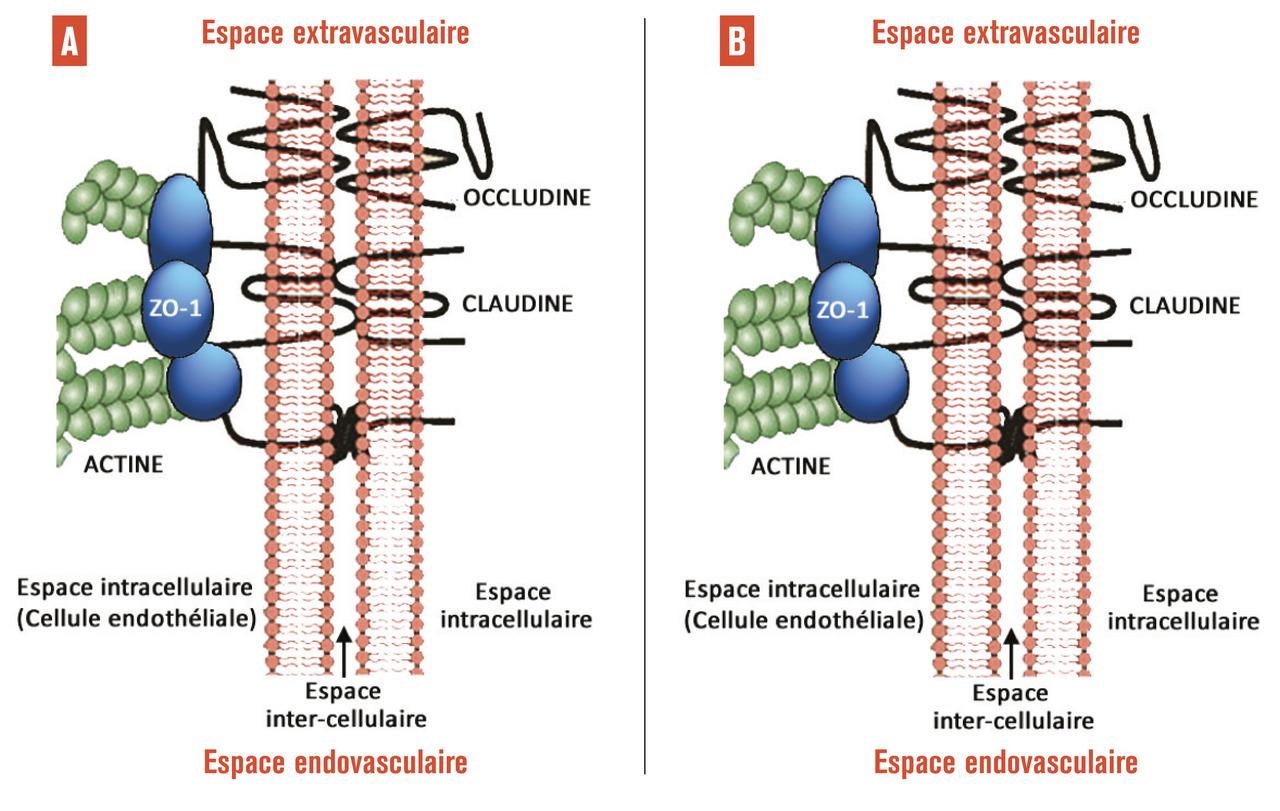
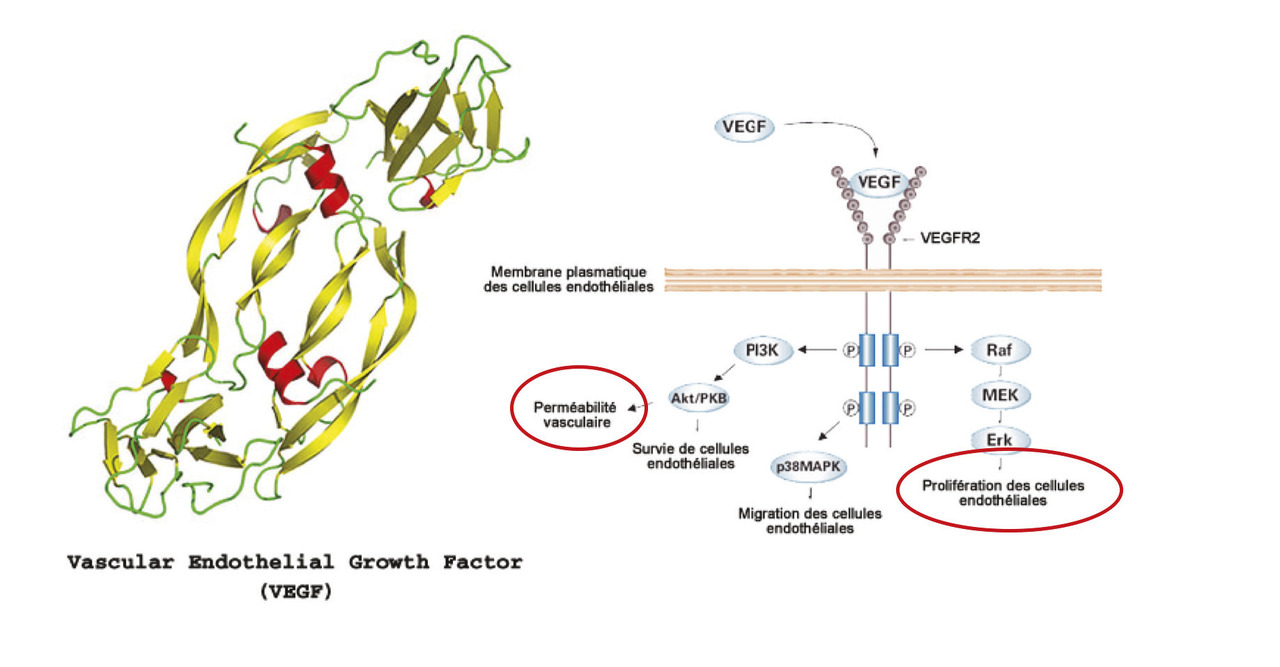
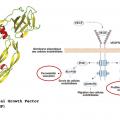
Jusqu’à il y a encore quelques années, le laser maculaire appelé « grid maculaire » restait le traitement de première intention dans la prise en charge de l’œdème maculaire diabétique. Le laser ne permettait toutefois que de diminuer la baisse de vision dans 50 % des cas à 3 ans.2 Avant les années 2000, l’œdème maculaire diabétique était diagnostiqué au fond d’œil grâce à une cotation semi-quantitative de l’épaisseur de la rétine maculaire. Cette « quantification » était très dépendante de l’opérateur, et la mise au point de la tomographie en cohérence optique (OCT)3 a été une révolution dans ce domaine. L’OCT permet de quantifier objectivement l’épaisseur rétinienne et de voir les kystes intrarétiniens de manière fiable et non invasive. Elle permet de découvrir et de surveiller l’œdème, et surtout de constater sa disparition après des injections intravitréennes d’anti-VEGF de corticoïdes.Depuis 2005 les anti-VEGF sont apparus dans le traitement de la dégénérescence maculaire liée à l’âge (DMLA),4 l’extension de leur autorisation de mise sur le marché (AMM) quelques années plus tard pour l’œdème maculaire diabétique a été permise grâce aux résultats de grandes études internationales de phase III comme Restore5 ou Rise and Ride,6 qui ont montré une augmentation significative de la vision chez plus de 50 % des patients après des injections intravitréennes mensuelles de Lucentis. Les anti-VEGF et dans une moindre mesure les corticoïdes intravitréens sont ainsi devenus le traitement de première intention dans l’œdème maculaire diabétique. Ils agissent tous deux sur l’imperméabilité des capillaires rétiniens, en contrôlant entre autres l’expression des protéines de jonction entre les cellules endothéliales de ces capillaires (fig. 2).7 Outre cet effet anti-œdémateux, les anti-VEGF permettent de contrôler la prolifération néovasculaire. Le VEGF est en effet une protéine permettant le développement vasculaire normal et conditionne via son récepteur membranaire la prolifération endothéliale (fig. 3).8 Malgré cet effet, le laser garde aujourd’hui sa place dans le traitement de la rétinopathie diabétique proliférante. En effet lorsque des néovaisseaux apparaissent, la photocoagulation panrétinienne est indiquée en première intention… Cependant, une étude récente réalisée aux États-Unis sur 2 ans montre que les injections intravitréennes répétées d’anti-VEGF permettent de conserver la vision aussi bien que la photocoagulation panrétinienne.9 Cette étude, appelée Protocole S, est intéressante car elle montre que l’on pourrait éventuellement se passer du laser qui a l’inconvénient, pour permettre la survie de la rétine centrale, de détruire la rétine périphérique en diminuant ses besoins en oxygène, ce qui diminue la production oculaire de VEGF. Préserver la rétine périphérique est donc une avancée thérapeutique.Ces résultats posent dans le même temps des questions sur la faisabilité d’un tel traitement. En effet, les injections intravitréennes mensuelles ou presque chez les patients atteints de rétinopathie diabétique proliférante devraient se faire sur une période très longue, peut-être à vie, puisque la maladie n’est pas « guérissable », seule la néovascularisation est empêchée. Outre la tolérance d’un tel traitement au long cours, le coût pour la société est énorme comparé au laser, qui est un traitement efficace, définitif, rapide et peu cher. La Food and Drug Administration n’a pas retenu, à la suite de cette étude, l’indication des anti-VEGF pour le traitement des néovaisseaux de la rétinopathie diabétique proliférante, mais elle recommande d’ores et déjà leur utilisation dans le traitement de cette forme de rétinopathie lorsqu’elle est associée à un œdème maculaire. On comprend que les anti-VEGF sont un progrès dans la prise en charge des complications de la rétinopathie diabétique, mais leur mode d’administration et leur coût constituent indéniablement une limite à leur utilisation.
… mais des résistances au traitement
Un autre enjeu du traitement de l’œdème maculaire diabétique est la systématisation du mode d’administration des injections intravitréennes et le choix de la ou des molécules injectées. Actuellement, des questions restent sans réponse, bien que les résultats de ces traitements intravitréens aient modifié considérablement le pronostic visuel des patients atteints d’œdème maculaire diabétique, les études montrent que tous les patients ne sont pas « répondeurs » au traitement. Le changement d’une molécule vers une autre ne semble pas modifier profondément les résultats chez ces patients. On ne sait pas aujourd’hui si un traitement est plus efficace que l’autre ; il existe deux molécules différentes d’anti-VEGF et un implant à libération prolongée de dexaméthasone qui ont l’AMM dans l’œdème maculaire diabétique. Des études comparatives ont été réalisées mais restent peu nombreuses et difficiles à interpréter.10, 11On peut estimer qu’environ 40 % des patients traités ont des résultats visuels décevants (c’est-à-dire moins de 2 lignes de gain visuel), quel que soit le traitement proposé. Les mécanismes de résistance au traitement ne sont pas compris et il se peut que tous les œdèmes maculaires diabétiques n’aient pas la même physiopathologie, et une meilleure compréhension des mécanismes aboutissant à l’œdème maculaire diabétique permettrait probablement de chercher des solutions thérapeutiques alternatives. Bien sûr, certaines molécules sont déjà en cours d’essai, mais aucune ne semble changer totalement la donne comme l’ont fait les anti-VEGF ou les corticoïdes ces dernières années. Si le choix du traitement reste ouvert, on ne sait pas non plus aujourd’hui quel est le meilleur moment pour débuter ce traitement. Pendant longtemps, les traitements des œdèmes étaient réservés aux yeux ayant une vision inférieure à 5/10e, or les résultats des grandes études sur les anti-VEGF ou les corticoïdes ont montré que la prise en charge précoce des œdèmes maculaires diabétiques améliorait le pronostic final, et de nombreux experts proposent le traitement dès que la baisse de la vision est détectable, même faiblement. Cette attitude est très certainement bénéfique pour la vision des patients car l’œdème traité « tôt » semble mieux répondre au traitement, et on imagine que la souffrance du tissu rétinien est moindre en l’absence d’œdème maculaire. Cela pose néanmoins la question de la tolérance aux traitements car la durée de traitement s’allonge et les indications des injections intravitréennes se multiplient. De même, l’observance des traitements pourrait pâtir d’un essoufflement de patients devant revenir très régulièrement pendant des mois, voire des années, pour des injections oculaires angoissantes et pour leurs visites de contrôle. Nul doute qu’une autre galénique est attendue pour faciliter le traitement au long cours de la rétinopathie diabétique et de ses complications.Enfin, maintenant que l’on traite mieux l’œdème maculaire diabétique au long cours, grâce aux injections intravitréennes, on note que chez certains patients, sans ou avec œdème maculaire diabétique (traité et guéri), la rétine maculaire tend à s’atrophier avec le temps, avec une réduction sensible de l’épaisseur de la rétine et une baisse de la vision. Cette dégénérescence neuronale de la rétine n’est pas actuellement accessible à un traitement. Elle survient souvent après de longues années d’évolution de la rétinopathie, et la cause n’est pas connue. Elle pourrait être due à des facteurs inflammatoires et/ou à une ischémie rétinienne chronique.12, 13 La survenue d’une ischémie maculaire aiguë provoque aussi une dégénérescence de la neurorétine avec un pronostic visuel sombre. Comme dans la DMLA, on arrive dans le diabète à traiter la composante œdémateuse de la maculopathie, mais nous restons impuissants face à l’atrophie du tissu rétinien survenant souvent en cas d’œdème maculaire diabétique chronique. La recherche dans la lutte contre l’atrophie maculaire reste pour l’instant décevante.
ENJEU DE SANTÉ PUBLIQUE
Le traitement de la rétinopathie diabétique a beaucoup changé ces dernières années. Le suivi angiographique et le traitement par laser sont en train de céder le pas au suivi par OCT et aux injections intravitréennes d’anti-VEGF ou de corticoïdes. C’est déjà le cas pour la prise en charge de l’œdème maculaire diabétique, et ce pourrait être aussi celui de l’ischémie rétinienne périphérique et des néovaisseaux rétiniens. Ce changement de paradigme porte un réel espoir d’amélioration du pronostic visuel chez les patients diabétiques mais pose un problème important en termes de capacité démographique médicale, de coût de la santé et de la tolérance des patients face à ces nouveaux traitements.
Références
1. Cheung N, Mitchell P, Wong TY. Diabetic retinopathy. Lancet 2010;376:124-36.
2. Early Treatment Diabetic Retinopathy Study research group. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-806.
3. Virgili G, Menchini F, Dimastrogiovanni AF, et al. Optical coherence tomography versus stereoscopic fundus photography or biomicroscopy for diagnosing diabetic macular edema: a systematic review. Invest Ophthalmol Vis Sci 2007;48:4963-73.
4. Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006;355:1419-31.
5. Mitchell P, Bandello F, Schmidt-Erfurth U, et al. The RESTORE study: ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology 2011;118:615-25.
6. Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab for diabetic macular edema: results from 2 phase III randomized trials: RISE and RIDE. Ophthalmology 2012;119:789-801.
7. Antonetti DA, Barber AJ, Khin S, Lieth E, Tarbell JM, Gardner TW. Vascular permeability in experimental diabetes is associated with reduced endothelial occludin content: vascular endothelial growth factor decreases occludin in retinal endothelial cells. Penn State Retina Research Group. Diabetes 1998;47:1953-9.
8. Ng YS, Krilleke D, Shima DT. VEGF function in vascular pathogenesis. Exp Cell Res 2006;312:527-37.
9. Writing Committee for the Diabetic Retinopathy Clinical Research Network, Gross JG, Glassman AR, Jampol LM, et al. Panretinal photocoagulation vs intravitreous ranibizumab for proliferative diabetic retinopathy: a randomized clinical trial. JAMA 2015;314:2137-46.
10. Wells JA, Glassman AR, Ayala AR, et al. Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema: two-year results from a comparative effectiveness randomized clinical trial. Ophthalmology 2016;123:1351-9.
11. Gillies MC, Lim LL, Campain A, et al. A randomized clinical trial of intravitreal bevacizumab versus intravitreal dexamethasone for diabetic macular edema: the BEVORDEX study. Ophthalmology 2014;121:2473-81.
12. Barber AJ, Lieth E, Khin SA, Antonetti DA, Buchanan AG, Gardner TW. Neural apoptosis in the retina during experimental and human diabetes. Early onset and effect of insulin. J Clin Invest 1998;102:783-91.
13. Feit-Leichman RA, Kinouchi R, Takeda M, et al. Vascular damage in a mouse model of diabetic retinopathy: relation to neuronal and glial changes. Invest Ophthalmol Vis Sci 2005;46:4281-7.
2. Early Treatment Diabetic Retinopathy Study research group. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-806.
3. Virgili G, Menchini F, Dimastrogiovanni AF, et al. Optical coherence tomography versus stereoscopic fundus photography or biomicroscopy for diagnosing diabetic macular edema: a systematic review. Invest Ophthalmol Vis Sci 2007;48:4963-73.
4. Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006;355:1419-31.
5. Mitchell P, Bandello F, Schmidt-Erfurth U, et al. The RESTORE study: ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology 2011;118:615-25.
6. Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab for diabetic macular edema: results from 2 phase III randomized trials: RISE and RIDE. Ophthalmology 2012;119:789-801.
7. Antonetti DA, Barber AJ, Khin S, Lieth E, Tarbell JM, Gardner TW. Vascular permeability in experimental diabetes is associated with reduced endothelial occludin content: vascular endothelial growth factor decreases occludin in retinal endothelial cells. Penn State Retina Research Group. Diabetes 1998;47:1953-9.
8. Ng YS, Krilleke D, Shima DT. VEGF function in vascular pathogenesis. Exp Cell Res 2006;312:527-37.
9. Writing Committee for the Diabetic Retinopathy Clinical Research Network, Gross JG, Glassman AR, Jampol LM, et al. Panretinal photocoagulation vs intravitreous ranibizumab for proliferative diabetic retinopathy: a randomized clinical trial. JAMA 2015;314:2137-46.
10. Wells JA, Glassman AR, Ayala AR, et al. Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema: two-year results from a comparative effectiveness randomized clinical trial. Ophthalmology 2016;123:1351-9.
11. Gillies MC, Lim LL, Campain A, et al. A randomized clinical trial of intravitreal bevacizumab versus intravitreal dexamethasone for diabetic macular edema: the BEVORDEX study. Ophthalmology 2014;121:2473-81.
12. Barber AJ, Lieth E, Khin SA, Antonetti DA, Buchanan AG, Gardner TW. Neural apoptosis in the retina during experimental and human diabetes. Early onset and effect of insulin. J Clin Invest 1998;102:783-91.
13. Feit-Leichman RA, Kinouchi R, Takeda M, et al. Vascular damage in a mouse model of diabetic retinopathy: relation to neuronal and glial changes. Invest Ophthalmol Vis Sci 2005;46:4281-7.