L’insuffisance cardiaque à fraction d’éjection préservée (ICFEP) bénéficie de nouvelles recommandations diagnostiques, attribuant notamment un rôle fondamental à l’échocardiographie. Il s’agit, non pas d’une maladie, mais d’un syndrome regroupant différents phénotypes justifiant des stratégies thérapeutiques adaptées. Des classes thérapeutiques émergent agissant par de nouvelles voies.
L’insuffisance cardiaque à fraction d’éjection préservée (ICFEP) est un syndrome qui n’a pas encore livré tous ses secrets1-4 même si les travaux sont nombreux. Il n’y a pas, à ce jour, de traitement recommandé hormis les diurétiques contre la congestion et les médicaments antihypertenseurs pour contrôler la pression artérielle systémique.5
De nouvelles recommandations diagnostiques font évoluer la pratique
La Heart Failure Association de l’European Society of Cardiology6, 7 a publié de nouvelles recommandations diagnostiques. Et des études randomisées sont en train de révolutionner la pratique.
En effet, le diagnostic positif reste parfois difficile car l’ICFEP n’est pas une maladie mais un syndrome regroupant différents phénotypes justifiant sans doute des stratégies thérapeutiques différentes.8, 9
Une physiopathologie encore à élucider
La physiopathologie de l’ICFEP n’est pas encore parfaitement éclaircie, mais l’hypothèse d’un couplage ventriculo-artériel défavorable est notamment évoquée. Que ce soit au niveau de l’arbre artériel systémique ou pulmonaire selon les phénotypes, il semble exister des résistances anormalement élevées. Celles-ci, qu’elles soient liées ou non à un processus inflammatoire complexe, participent à une postcharge anormalement élevée qui altère les fonctions ventriculaires et atriales (prévalence élevée de la fibrillation atriale).20, 21 Récemment, une attention particulière a été portée sur les conséquences et sur l’implication de l’oreillette gauche dans l’expression clinique de l’ICFEP.22
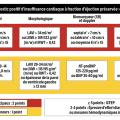
Améliorer la spécificité des critères diagnostiques
Historiquement, le test de confirmation diagnostique retenu comme gold standard est le cathétérisme droit de repos et d’effort. En pratique, cet examen est néanmoins difficile d’accès et invasif. Il n’est donc utilisé que dans les cas complexes et litigieux.
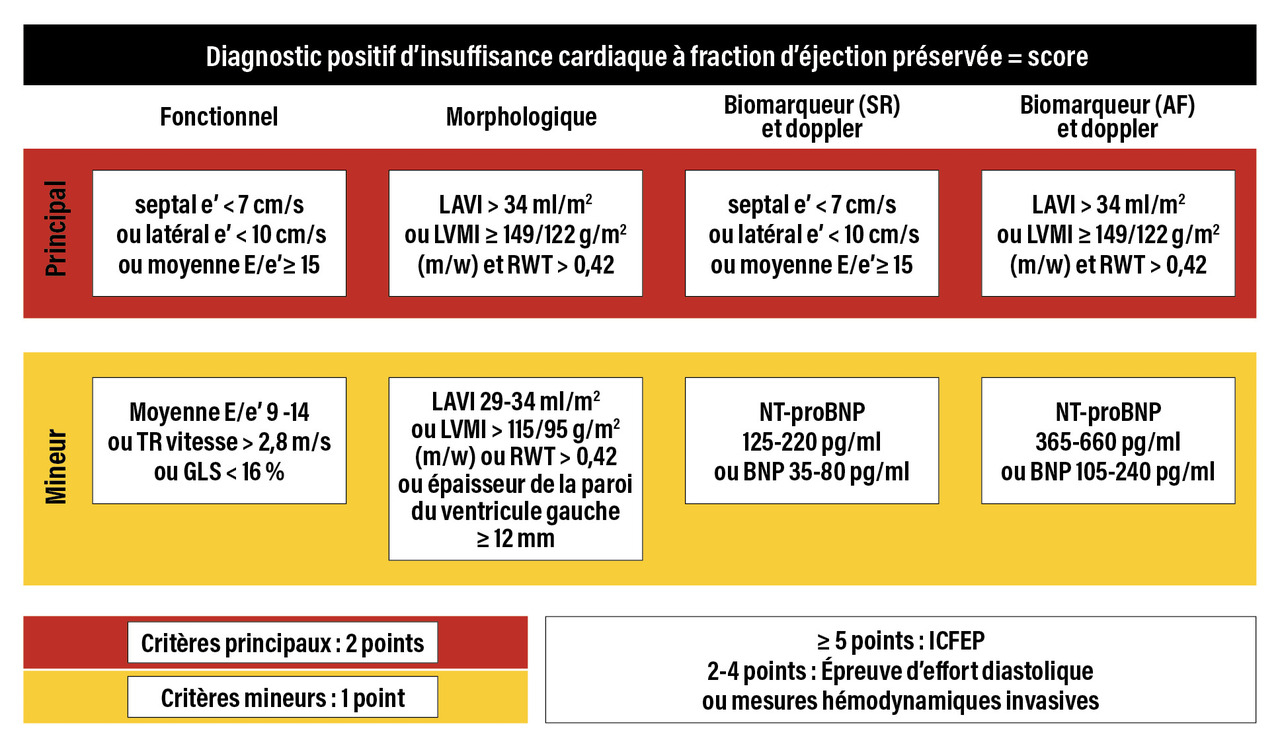
Dans les essais cliniques récents (
– une fraction d’éjection préservée (FEVG ≥ 50 %) ;
– une hypertrophie ventriculaire gauche ;
– une augmentation des pressions de remplissage (importance de la taille de l’oreillette gauche dont le volume normal est inférieur à 34 mL/m2)23
– la présence de symptômes ou de signes d’insuffisance cardiaque certifiés par un dosage de peptides natriurétiques.
Les définitions actuelles, telles celles des recommandations de l’European Society of Cardiology (ESC), sont simples et pratiques. Il faudrait sans doute cependant travailler à augmenter la spécificité de ces critères pour ne pas inclure à tort des patients non insuffisants cardiaques, ce qui fut certainement le cas dans les grandes études randomisées comme I-Preserve ou TOPCAT.12, 24, 25
Dans cet objectif, plusieurs approches se font jour (
Peut-on compter sur les biomarqueurs pour mieux sélectionner les patients ?
Il n’existe pas de preuve claire à ce jour de l’intérêt de cette démarche, du moins pas en utilisant un biomarqueur unique.
Le strain atrial a-t-il une place ?
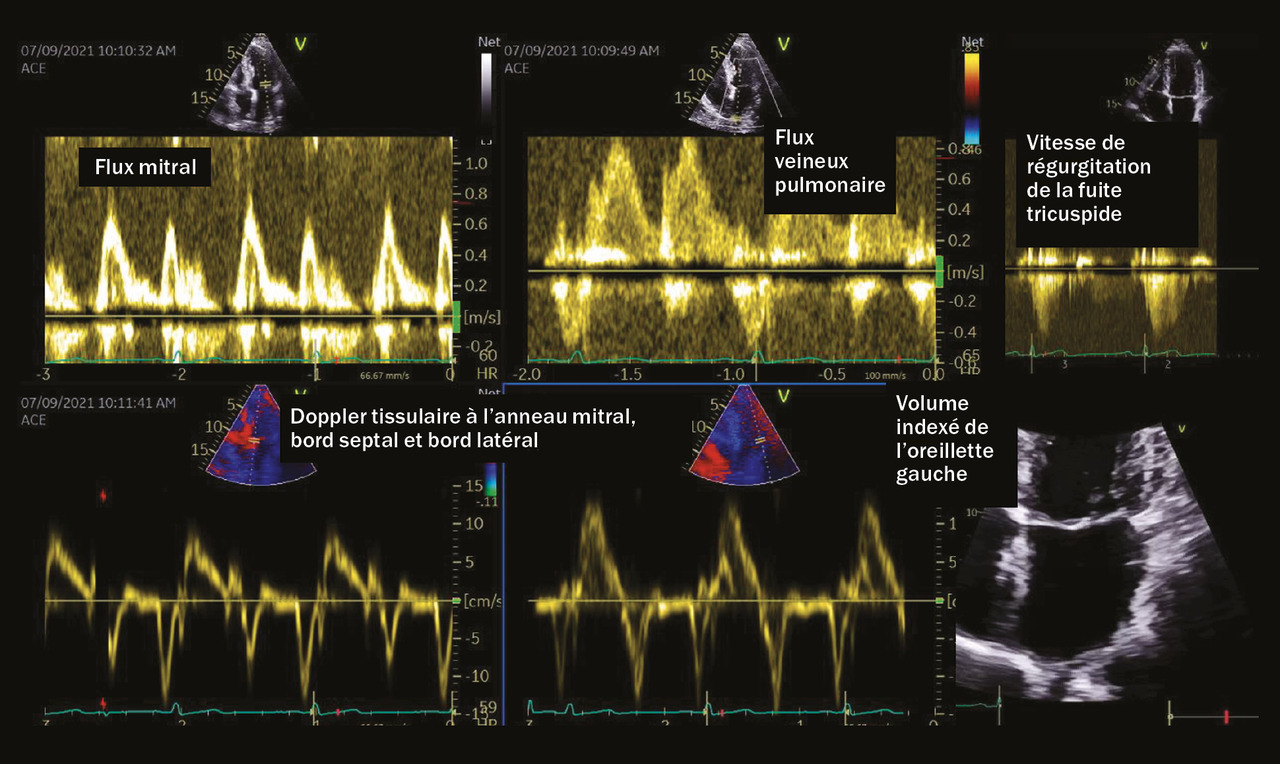
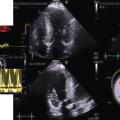
Lors de l’échocardiographie transthoracique, l’évaluation du strain (capacité de déformation myocardique) atrial s’avère désormais encouragée par les dernières recommandations ; elle permet d’améliorer la performance de l’échocardiographie, examen fondamental pour le diagnostic positif et phénotypique de l’insuffisance cardiaque à fraction d’éjection préservée. (
Qu’en est-il du test dynamique ?
La réalisation d’un test dynamique semble très prometteuse. En effet, les ventricules gauche et droit font face à une postcharge élevée au repos mais c’est bien dans les conditions de stress que l’équilibre est rompu et que le patient manifeste des signes d’insuffisance cardiaque droite, gauche ou mixte selon les phénotypes.27, 28 Effectuer un test d’effort sous-maximal permettrait donc de mettre en évidence une absence d’adaptation au stress : absence de réserve contractile mais aussi sans doute de capacité de relaxation (e’ en Doppler tissulaire). Cette trop grande rigidité et cette absence d’adaptation aux changements de conditions de charge expliqueraient certainement les symptômes et permettraient de distinguer l’insuffisant cardiaque à fraction d’éjection préservée du patient âgé hypertendu avec remodelage ventriculaire gauche concentrique.
Plusieurs travaux ont été menés dans ce sens. Récemment, il a même été proposé une méthode standardisée pour effectuer cette échocardiographie d’effort sous-maximale afin de tester le patient ICFEP.29
Dans la pratique clinique, on observe que les ventricules, rigides, ne s’adaptent pas à l’augmentation de la postcharge liée à l’effort et que plusieurs signes apparaissent, dès les premiers coups de pédale :
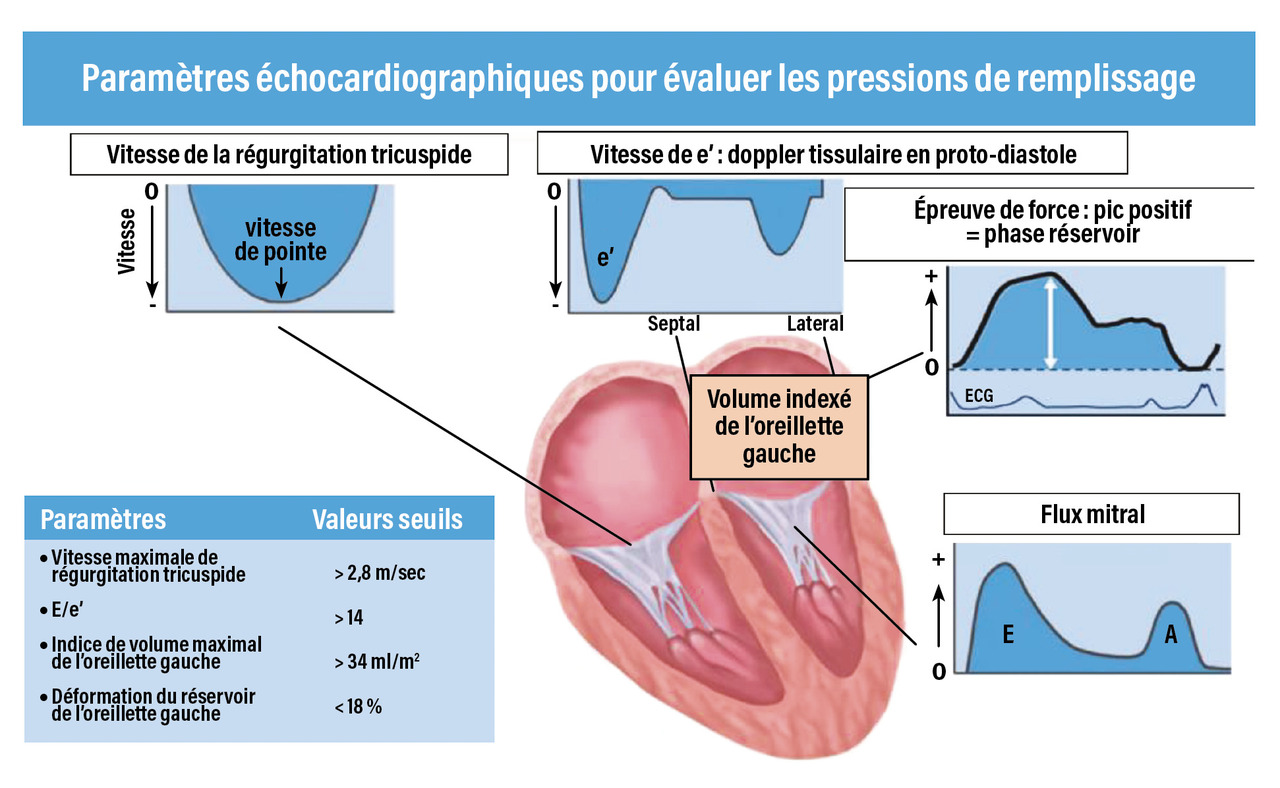
– une fuite tricuspide avec une augmentation des pressions pulmonaires estimées (au-delà de 60 mmHg en moins de 4 à 5 minutes) ;
– une absence d’augmentation de S’ et e’ tel qu’enregistré à l’anneau mitral (en Doppler tissulaire pulsé) avec, de fait, une augmentation rapide du rapport E/e’ ; une fuite mitrale est aussi possible (
– une absence d’augmentation du débit cardiaque, du volume d’éjection systolique comme du strain global longitudinal.30, 31
Il semble donc très pertinent d’utiliser l’échocardiographie d’effort en cas de doute diagnostique.
Cependant, les critères qui permettront de distinguer l’ICFEP du sujet âgé hypertendu, dyspnéique car « bronchopathe » (par exemple) ou, plus difficile encore, dyspnéique car uniquement en surcharge pondérale ne sont pas clairement énoncés à l’heure actuelle.
Valvulopathie : un risque de confusion diagnostique
La découverte d’une valvulopathie dans le contexte d’une ICFEP est un souci diagnostique.
La fuite mitrale est en effet le plus souvent secondaire et très dépendante de la charge.
La sténose aortique est, quant à elle, souvent dite « à bas débit paradoxal », c’est-à-dire à bas gradient, bas débit, mais à fraction d’éjection préservée.32, 33
S’aider de l’intelligence artificielle pour évaluer le pronostic individuel ?
Le phénomapping est une approche nouvelle utilisant « la puissance de calcul » d’outils informatiques. Elle permettrait de s’appuyer sur l’ensemble des données cliniques et paracliniques recueillies chez les patients pour identifier des paramètres communs à différents types d’ICFEP répondant à un pronostic proche et justifiant peut-être des attitudes thérapeutiques identiques.9 Ainsi, Mele et al.34 considèrent plusieurs paramètres :
– l’élévation ou non des pressions de remplissage (Vmax de la fuite tricuspide supérieure à 2,8 m/s, E/e’, volume de l’oreillette gauche) ;
– la qualité du volume d’éjection systolique (stroke volume inférieur ou égal à 30 mL/m2 ou préservé) ;
– la fonction du ventricule droit avec TAPSE (tricuspid annular plane systolic excursion) [inférieur ou égal à 17 mm pour définir la dysfonction].
Il est ainsi possible de distinguer quatre sous-groupes ayant des pronostics démontrés significativement différents par les auteurs.34, 35
Le cas particulier de l’amylose à transthyrétine
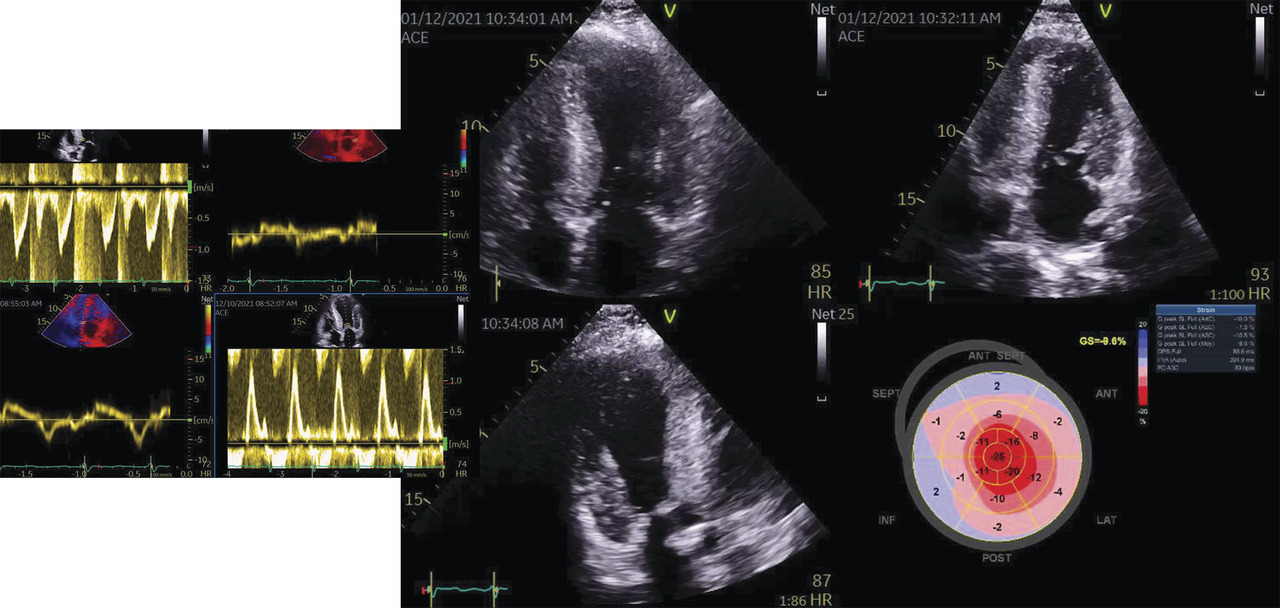
Il existe aussi des formes particulières d’ICFEP et en particulier celle de l’amylose à transthyrétine (TTR) qui est retrouvée dans 13 % des cas de patients ayant une ICFEP. Son diagnostic est important car un traitement spécifique est possible. Il faut rechercher un strain en cocarde (
Vers un traitement validé ?
Y aura-t-il une place pour un traitement uniformément validé de ce syndrome ?
Une étude un peu décevante…
L’étude PARAGON testant le valsartan 160 mg versus le sacubitril-valsartan 200 mg deux fois par jour,10 confirme les espoirs déçus des études précédentes.11, 12 Des signaux en faveur de la molécule testée ont été observés, mais la différence entre les deux groupes est non significative et n’autorise donc pas une large prescription pour les patients répondant aux critères d’inclusion de PARAGON (
...Mais de nouvelles molécules s’imposent
De nouvelles classes thérapeutiques émergent dans l’insuffisance cardiaque systolique agissant par des voies différentes tels le vericiguat, stimulateur de la guanylate cyclase soluble (sGC)13 ou les inhibiteurs des cotransporteurs sodium-glucose de type 2 (iSGLT2)14 [dapagliflozine, empagliflozine].
L’étude EMPEROR-Preserved,15 essai de phase 3 en double aveugle, a comparé l’effet de l’empagliflozine versus placebo chez des patients avec insuffisance cardiaque à fraction d’éjection du ventricule gauche (FEVG) préservée et modérément altérée (supérieure à 40 %). 5 988 patients ont été recrutés ; le critère de jugement principal était composite : mortalité cardiovasculaire ou hospitalisation pour insuffisance cardiaque. Seuls 13,8 % des patients du groupe empagliflozine ont présenté un événement contre 17,1 % dans le groupe placebo (hazard ratio [HR] : 0,79 ; intervalle de confiance à 95 % [IC : 95 %] : 0,69-0,9 ; p < 0,001) avec un effet principalement sur la diminution des hospitalisations, que le patient soit diabétique ou non.
Une deuxième étude portant sur la dapagliflozine, DELIVER, basée sur le même schéma, confirme ce résultat positif.16, 17 Les résultats obtenus avec la dapagliflozine confirment et imposent cette classe thérapeutique comme un pilier de la prise en charge de toute insuffisance cardiaque.
Des études différenciant les phénotypes sont nécessaires
Pour autant, les études sont basées sur l’inclusion large de patients appartenant à différents phénotypes (sur la base des critères des guidelines). Aucune étude thérapeutique n’a, à ce jour, été conduite sur la base d’une caractérisation phénotypique précise. De nouvelles classes devraient ainsi être testées pour répondre à des anomalies propres à certains phénotypes comme celui avec atteinte ventriculaire droite prédominante.
Ne pas négliger la prévention !
Même si la prescription d’iSGLT2 devient incontournable,17 il est nécessaire d’insister sur les mesures de prévention : contrôle des facteurs de risque, activité physique et hygiène de vie restent les meilleurs moyens de prévenir l’apparition des symptômes.18, 19
Personnaliser le traitement est un enjeu majeur
L’insuffisance cardiaque à fraction d’éjection préservée (ICFEP) doit être précisément diagnostiquée mais sans doute aussi phénotypée. Il n’y avait jusqu’à il y a peu, aucun traitement validé (sauf pour l’amylose TTR). Nul doute que des traitements spécifiques verront le jour sous peu et que l’avènement des iSGLT2 dans cette indication vont impacter positivement la vie des patients. Le développement de traitements ciblant les atteintes prédominantes du cœur droit et d’autres visant les conditions de charges et l’atteinte du cœur gauche (pas seulement le ventricule, mais aussi l’oreillette) est nécessaire. D’autres molécules sont encore à l’étude…38
Pour la pratique
Il est essentiel de repérer les patients souffrant d’insuffisance cardiaque à fraction d’éjection préservée (ICFEP). Il s’agit souvent de femmes, âgées, hypertendues et en fibrillation atriale. La surcharge pondérale est fréquente, de même que l’insuffisance rénale.
Outre le contrôle de la volémie et de la pression artérielle de ces patients, il faut éviter que leur fréquence cardiaque soit trop basse si le volume d’éjection systolique est altéré (un essai clinique testant l’impact du retrait du bêtabloquant est en cours).
L’éducation des patients est primordiale pour le contrôle des apports sodés, la surveillance du poids, la pratique d’une activité physique ; lorsqu’elle est possible, la mise en place d’une rééducation est utile.19, 39 Enfin, il ne faut pas hésiter à utiliser la télésurveillance, surtout chez les sujets les plus isolés ou fragiles, en vue de diminuer le risque de décompensation.
Le traitement de l’ICFEP « reposait » auparavant principalement sur la gestion de la surcharge volémique en fonction des constatations cliniques et échographiques. Il faut désormais savoir ne pas se limiter à la simple action des diurétiques de l’anse et faire bénéficier les patients de l’ensemble du panel thérapeutique à action déplétive avec notamment les principe actifs anti-aldostérone. Aujourd’hui, les iSGLT2, la télésurveillance, l’implication des professionnels de santé paramédicaux doivent permettre d’améliorer le pronostic vital et fonctionnel et de diminuer la fréquence des hospitalisations.
1. Franssen C, Chen S, Hamdani N, Paulus WJ. From comorbidities to heart failure with preserved ejection fraction: A story of oxidative stress. Heart. 2016 Feb 15;102(4):320-30.
2. Paulus WJ, van Heerebeek L. Ancient gunpowder and novel insights team up against heart failure with preserved ejection fraction. J Am Coll Cardiol. 2015;66(15):1683-6.
3. Ferrari R, Böhm M, Cleland JG, Paulus WJS, Pieske B, Rapezzi C, et al. Heart failure with preserved ejection fraction: Uncertainties and dilemmas. Eur J Heart Fail. 2015;17(7):665-71.
4. Senni M, Paulus WJ, Gavazzi A, Fraser AG, Díez J, Solomon SD, et al. New strategies for heart failure with preserved ejection fraction: The importance of targeted therapies for heart failure phenotypes. Eur Heart J. 2014;35(40):2797-815.
5. McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Böhm M, Dickstein K, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The task force for the diagnosis and treatment of acute and chronic heart failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2012;33(14):1787-847.
6. Adamo M, Pagnesi M, Popolo Rubbio A, Branca L, Grasso C, Denti P, et al. Predictors of optimal procedural result after transcatheter edge-to-edge mitral valve repair in secondary mitral regurgitation. Catheter Cardiovasc Interv. 2022;99(5):1626-35.
7. Authors/Task Force M, McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution -of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2022;24(1):4-131.
8. Shah AM, Solomon SD. Phenotypic and pathophysiological heterogeneity in heart failure with preserved ejection fraction. Eur Heart J. 2012;33(14):1716-7.
9. Shah SJ, Katz DH, Selvaraj S, Burke MA, Yancy CW, Gheorghiade M, et al. Phenomapping for novel classification of heart failure with preserved ejection fraction. Circulation. 2015;131(3):269-79.
10. Feldman AM, Haller JA, DeKosky ST. Valsartan/sacubitril for heart failure: reconciling disparities between preclinical and clinical investigations. JAMA 2016;315(1):25-6.
11. Solomon SD, McMurray JJV, Anand IS, Junbo G, Lam CSP, Maggioni AP, et al. Angiotensin-neprilysin inhibition in heart failure with preserved ejection fraction. N Engl J Med. 2019;381(17):1609-20.
12. Massie BM, Carson PE, McMurray JJ, Komajda M, McKelvie R, Zile MR, et al. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med. 2008;359(23):2456-67.
13. Butler J, Anstrom KJ, Armstrong PW, Group VS. Comparing the benefit of novel therapies across clinical trials: Insights from the VICTORIA Trial. Circulation. 2020;142(8):717-9.
14. Verma S. The DAPA-HF trial marks the beginning of a new era in the treatment of heart failure with reduced ejection fraction. Cardiovasc Res. 2020;116(1):e8-e10.
15. Anker SD, Butler J, Filippatos G, Ferreira JP, Bocchi E, Böhm M, et al. Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med 2021;385(16):1451-61.
16. Butler J, Anker SD, Filippatos G, Usman MS, Ferreira JP, Zannad F, et al. Sodium glucose co-transporter inhibitors and heart failure outcomes across different patient populations. Eur Heart J. 2021;42(48):4887-90.
17. Thorvaldsen T, Ferrannini G, Mellbin L, Benson L, Cosentino F, McMurray JJV, et al. Eligibility for dapagliflozin and empagliflozin in a real-world heart failure population. J Card Fail. 2022;28(7):1050-62.
18. Borlaug BA. Evaluation and management of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2020;17(9):559-73.
19. Shah SJ, Borlaug BA, Kitzman DW, McCulloch AD, Blaxall BC, Agarwal R, et al. Research priorities for heart failure with preserved ejection fraction: National Heart, Lung, and Blood Institute Working Group Summary. Circulation. 2020;141(12):1001-26.
20. Donal E, Lund LH, Oger E, Hage C, Persson H, Reynaud A, et al. New echocardiographic predictors of clinical outcome in patients presenting with heart failure and a preserved left ventricular ejection fraction: A subanalysis of the Ka (Karolinska) Ren (Rennes) Study. Eur J Heart Fail. 2015;17(7):680-8.
21. Lund LH, Donal E, Oger E, Hage C, Persson H, Haugen-Löfman I, et al. Association between cardiovascular vs. non-cardiovascular co-morbidities and outcomes in heart failure with preserved ejection fraction. Eur J Heart Fail. 2014;16(9):992-1001.
22. Morris DA, Belyavskiy E, Aravind-Kumar R, Kropf M, Frydas A, Braunauer K, et al. Potential usefulness and clinical relevance of adding left atrial strain to left atrial volume index in the detection of left ventricular diastolic dysfunction. JACC Cardiovasc Imaging. 2018 ;11(10):1405-15.
23. Shah AM, Lam CS. Function over form? Assessing the left atrium in heart failure. Eur Heart J. 2015;36(12):711-4.
24. Pfeffer MA, Claggett B, Assmann SF, Boineau R, Anand IS, Clausell N, et al. Regional variation in patients and outcomes in the treatment of preserved cardiac function heart failure with an aldosterone antagonist (TOPCAT) trial. Circulation. 2015;131(1):34-42.
25. Pitt B, Pfeffer MA, Assmann SF, Boineau R, Anand IS, Claggett B, et al., Spironolactone for heart failure with preserved ejection fraction. N Engl J Med. 2014;370(15):1383-92.
26. Smiseth OA, Morris DA, Cardim N, Cikes M, Delgado V, Donal E, et al. Multimodality imaging in patients with heart failure and preserved ejection fraction: An expert consensus document of the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2022;23(2):e34-e61.
27. Erdei T, Smiseth OA, Marino P, Fraser AG. A systematic review of diastolic stress tests in heart failure with preserved ejection fraction, with proposals from the EU-FP7 MEDIA study group. Eur J Heart Fail. 2014;16(12):1345-61.
28. Donal E, Lund LH, Oger E, Reynaud A, Schell F, Persson H, et al. Value of exercise echocardiography in heart failure with preserved ejection fraction: A substudy from the KaRen study. Eur Heart J Cardiovasc Imaging. 2016;17(1):106-13.
29. Pieske B, Tschope C, de Boer RA, Fraser AG, Anker SD, Donal E, et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: A consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J. 2019;40(40):3297-317.
30. Sanderson JE. Exercise echocardiography and the diagnosis of heart failure with a normal ejection fraction. Heart. 2010;96(13):997-8.
31. Tan YT, Wenzelburger F, Lee E, Heatlie G, Leyva F, Patel K, et al. The pathophysiology of heart failure with normal ejection fraction: Exercise echocardiography reveals complex abnormalities of both systolic and diastolic ventricular function involving torsion, untwist, and longitudinal motion. J Am Coll Cardiol. 2009;54(1):36-46.
32. Clavel MA, Magne J, Pibarot P. Low-gradient aortic stenosis. Eur Heart J. 2016;37(34):2645-57.
33. Galli E, Le Ven F, Coisne A, Sportouch C, Le Tourneau T, Bernard A, et al. Rational and design of the ROTAS study: a randomized study for the optimal treatment of symptomatic patients with low-gradient severe aortic valve stenosis and preserved left ventricular ejection fraction. Eur Heart J Cardiovasc Imaging. 2021;22;22(2):229-35.
34. Mele D, Pestelli G, Dini FL, Molin DD, Smarrazzo V, Trevisan F, et al. Novel echocardiographic approach to hemodynamic phenotypes predicts outcome of patients hospitalized with heart failure. Circ Cardiovasc Imaging. 2020;13(4):e009939.
35. Mele D, Pestelli G, Molin DD, Trevisan F, Smarrazzo V, Luisi GA, et al. Echocardiographic evaluation of left ventricular output in patients with heart failure: A per-beat or per-minute approach? J Am Soc Echocardiogr. 2020;33(2):135-47.e3.
36. van den Berg MP, Mulder BA, Klaassen SHC, Maass AH, van Veldhuisen DJ, van der Meer P, et al. Heart failure with preserved ejection fraction, atrial fibrillation, and the role of senile amyloidosis. Eur Heart J. 2019;40(16):1287-93.
37. Gonzalez-Lopez E, Gallego-Delgado M, Guzzo-Merello G, de Haro-Del Moral FJ, Cobo-Marcos M, Robles C, et al. Wild-type transthyretin amyloidosis as a cause of heart failure with preserved ejection fraction. Eur Heart J. 2015;36(38):2585-94.
38. Shah AM, Mann DL. In search of new therapeutic targets and strategies for heart failure: Recent advances in basic science. Lancet. 2011;378(9792):704-12.
39. Shah SJ, Kitzman DW, Borlaug BA, van Heerebeek L, Zile MR, Kass DA, et al. Phenotype-specific treatment of heart failure with preserved ejection fraction: A multiorgan roadmap. Circulation. 2016;134(1):73-90.

 Encadrés
Encadrés