objectifs
Décrire les principes et risques des traitements en cancérologie (voir item 326). Justifier l’utilité d’une concertation pluridisciplinaire. Connaître les objectifs du dispositif d’annonce et de la mise en place d’un programme personnalisé des soins.
Les trois principales modalités de traitement anticancéreux sont la chirurgie, la radiothérapie, et les traitements médicaux que sont l’hormonothérapie, la chimiothérapie et l’immunothérapie. Leurs utilisations seules ou en combinaison vont dépendre du stade de la maladie qui peut être localisé, localement avancé ou métastatique, ainsi que du primitif concerné.
Chirurgie
Elle fut longtemps le seul traitement curatif du cancer.
Objectifs
Les objectifs de la chirurgie sont multiples : thérapeutique, diagnostique, de stadification
Diagnostic
Le seul diagnostic de cancer est histologique. L’abord chirurgical reste nécessaire lorsque les biopsies ne sont pas réalisables en endoscopie ou radioguidées, ou dans les situations où la lésion doit être retirée dans son intégralité (les tumeurs ovariennes, par exemple). Les biopsies doivent permettre le diagnostic de cancer et la réalisation de techniques complémentaires (immuno-histochimie, biologie moléculaire…). Les informations concernant l’orientation de la pièce et la localisation doivent être fournies au pathologiste. Des précautions strictes doivent être prises pour éviter tout risque de dissémination.
Pronostic/extension
L’extension de la tumeur doit parfois être confirmée histologiquement (atteinte ganglionnaire, péritonéale, par exemple) avec un impact sur le pronostic et l’indication des traitements adjuvants.
Thérapeutique
La chirurgie peut intervenir dans plusieurs situations thérapeutiques distinctes :
traitement radical du cancer primitif et évaluation de l’extension loco-régionale ;
résection de lésions métastatiques avec un objectif curatif (localisation pulmonaire des sarcomes, lésions hépatiques de cancer colique) ;
gestion des urgences oncologiques (compression médullaire, occlusion, hémorragie) ;
chirurgie palliative en cas de douleurs ou afin d’améliorer la qualité de vie (symphyse pleurale) ;
chirurgie de reconstruction et de réhabilitation.
Prévention
Lorsque le risque de développer un cancer est majeur, une chirurgie préventive peut être proposée. C’est le cas de prédispositions génétiques au cancer (ovariectomie en cas de mutation de BRCA1 ou BRCA2, discussion de colectomie totale en cas de polypose colique familiale).
Principes généraux
Déterminant de qualité corrélé à la survie du patient
L’expérience du chirurgien et son activité influencent significativement le pronostic du patient. Pour ces raisons, l’activité chirurgicale est soumise à autorisation avec seuil d’activité.
La qualité de la résection : elle est définie sur l’existence d’un envahissement de la marge de résection chirurgicale. L’exérèse est considérée R0 en cas de marges saines ; R1 lorsqu’elle est macroscopiquement complète mais avec envahissement microscopique d’une des marges ; R2 en cas de résidu tumoral macroscopique.
Principes généraux du geste opératoire
Il existe plusieurs temps :
temps exploratoire, pour confirmer le caractère localisé (éliminer une atteinte pleurale ou péritonéale macroscopique, par exemple) ;
exérèse monobloc de la tumeur avec prise de marge de sécurité et protection du site opératoire pour éviter la dissémination ;
éventuellement examen extemporané pour confirmer le caractère tumoral si les gestes diagnostique et thérapeutique sont réalisés dans le même temps ;
curage ganglionnaire du territoire de drainage dans la plupart des cas.
Évolutions récentes
Parmi les évolutions récentes de la chirurgie, on peut citer :
àla multimodalité. L’association à un traitement par chimiothérapie, radiothérapie ou les deux. Un traitement médical préopératoire permet de sélectionner les malades bénéficiant d’un traitement chirurgical, de rendre possibles des chirurgies conservatrices (tumorectomie versus mammectomie dans le sein, conservation sphinctérienne dans le rectum, par exemple), et surtout d’évaluer la sensibilité de la tumeur à un traitement par chimiothérapie sur une tumeur en place ;
l’évolution des techniques chirurgicales. Parmi elles, la cœlioscopie – son utilisation permet de diminuer la morbi-mortalité – et le ganglion sentinelle. Cette technique consiste à repérer le premier relais ganglionnaire de drainage en injectant une substance radioactive et/ou un colorant au niveau du site tumoral. L’examen histologique du ganglion identifié permet de limiter les curages extensifs aux situations où ce ganglion est envahi.
Radiothérapie
La radiothérapie consiste à utiliser des radiations ionisantes pour détruire les cellules tumorales. Il s’agit d’un traitement localisé du cancer, ne traitant qu’une zone tumorale limitée et définie. La radiothérapie vise à détruire les cellules cancéreuses mais peut aussi altérer les tissus sains placés dans le faisceau de rayons. La radiothérapie est utilisée pour environ 85 % des patients cancéreux traités en France, soit environ 300 000 nouveaux patients par an.
Principes
La dose absorbée est la quantité d’énergie absorbée par unité de masse du tissu irradié. Son unité de mesure est le gray (Gy), qui correspond à un joule absorbé dans un kilogramme de matière.
La radiothérapie délivre aux tissus traversés une dose totale, exprimée en Gy, réalisée en un certain nombre de séances délivrant chaque jour une partie de dose totale, la dose par séance. Le nombre de séances d’irradiation réalisées pour atteindre la dose totale correspond au fractionnement. L’étalement correspond à la période séparant la première de la dernière séance de radiothérapie.
L’efficacité biologique de l’irradiation dépend de ces trois paramètres, dose totale, fractionnement et étalement.
Deux particules différentes sont utilisées en pratique courante lors des irradiations médicales, les photons et les électrons. Les photons sont des particules pénétrant loin sous la peau et permettant de traiter des tumeurs profondes (thorax, abdomen, petit bassin) sans irradier de façon importante la peau. Les électrons sont destinés à traiter les tumeurs plus superficielles, proches de la peau.
À côté de ces deux particules classiques, les protons sont également utilisés au sein de services très spécialisés pour des indications très précises de tumeurs rares, par exemple de la base du crâne ou des yeux.
Toxicités
Les tissus sains normaux qui entourent les tissus cancéreux réagissent à la radiothérapie de deux façons selon le moment où surviennent ces réactions. Il existe ainsi des tissus à réaction précoce ou tardive.
Les tissus à réaction précoce : les cellules normales de ces tissus se multiplient physiologiquement rapidement. Ces tissus – la peau, les muqueuses de la sphère ORL, du tube digestif – réagissent pendant l’irradiation ou immédiatement après sous la forme d’une destruction des cellules normales provoquant une ulcération du tissu. Ces réactions aiguës disparaissent en quelques jours à quelques semaines après la radiothérapie pour ne laisser que de rares séquelles, en général bénignes.
Les tissus à réaction tardive : ces tissus – l’os, les muscles, le foie, les reins, les tissus nerveux – ne présentent pas de réaction visible au cours de l’irradiation, mais des réactions tardives plusieurs mois ou années après la radiothérapie laissant des séquelles définitives. Cette toxicité tardive constitue le facteur limitant de la dose totale possible en radiothérapie.
Mode d’action
Dans les tissus traversés, photons ou électrons créent des ionisations, provoquant des ruptures des liaisons normales existantes entre les atomes. Ces ruptures de liaison modifient la forme de la molécule. Lorsque ces modifications intéressent l’ADN, cela peut aboutir à la mort immédiate ou différée de la cellule. Les cellules, saines ou tumorales, incluses dans les faisceaux de radiothérapie ont donc trois possibilités selon l’existence ou non de réparations des altérations de l’ADN chromosomique :
réparations impossibles qui aboutissent à la mort des cellules de façon souvent différée ;
réparations complètes laissant en place des cellules vivantes qui vont continuer à se multiplier ;
réparations incomplètes laissant en vie et en croissance des cellules porteuses de mutations génétiques non mortelles.
La probabilité de stérilisation tumorale est pratiquement nulle tant que la dose totale délivrée aux tissus cancéreux n’atteint pas une valeur minimale. Cette valeur minimale dépend du type de cancer. Elle est par exemple de l’ordre de 30 Gy pour certaines tumeurs du testicule, 35 Gy pour une maladie de Hodgkin et de 65 à 75 Gy pour les tumeurs de la sphère ORL, les tumeurs bronchiques ou prostatiques.
L’efficacité de l’irradiation diminue s’il existe une augmentation de l’intervalle entre les séances d’irradiation. En effet, une multiplication des cellules cancéreuses et une réparation des lésions sub-létales se produiront dans cette période d’arrêt de traitement, diminuant dès lors l’efficacité de la radiothérapie. Tout arrêt transitoire de la radiothérapie au-delà de quelques jours réduit donc l’efficacité des soins en permettant aux cellules cancéreuses de se remultiplier. La moindre capacité de réparation de l’ADN par les cellules tumorales comparativement aux cellules saines les rend plus sensibles à la multiplication des séances de rayonnement. C'est ce qu'on appelle l'effet différentiel.
Objectifs
La radiothérapie peut être utilisée à visée curative ou à visée palliative :
en situation curative, l’objectif est le contrôle définitif du cancer inclus dans les faisceaux de radiothérapie avec un respect des tissus sains. Il s’agit, en règle générale, d’une radiothérapie longue, sur plusieurs semaines, réalisée à un niveau de dose totale importante de l’ordre de 46 à 70 Gy délivrée sous forme de séances quotidiennes de 1,8 Gy à 2 Gy par séance sur une période de 5 à 7 semaines ;
en situation palliative, l’objectif est de contrôler des symptômes gênant la qualité de vie du patient mais sans espoir de guérison. Ces symptômes peuvent être des douleurs, des saignements, des compressions de tissus sains, par exemple de la moelle épinière, de la trachée, de gros vaisseaux du thorax. Il s’agit de traitements courts, sur quelques jours, avec des doses par séance élevées allant de 3 à 8 Gy, avec des doses totales délivrées limitées entre 8 et 30 Gy.
Modalités
La radiothérapie peut être utilisée :
seule en cas de cancer très radiosensible et confinée à une zone très précise de l’organisme ;
en association avec la chirurgie : en préopératoire pour diminuer la taille de la tumeur ou en postopératoire pour augmenter le contrôle local du cancer, en détruisant les éventuelles cellules tumorales restantes ;
en association à la chimiothérapie : soit après une chimiothérapie pour augmenter le contrôle loco-régional au niveau du site tumoral initial, soit en même temps (concomitant) pour potentialiser au maximum les effets des deux traitements.
Modalités pratiques
Comment se passe en pratique une irradiation ?
La simulation (le centrage) : le volume tumoral visible et ses extensions probables, ainsi que les tissus sains voisins, vont être repérés à l’aide d’un simulateur scanner. Ce repérage permet de définir les faisceaux de radiothérapie puis de calculer la dose reçue par chaque point des tissus sains et cancéreux.
Cette dosimétrie permet de calculer les faisceaux de radiothérapie et le temps de l’irradiation nécessaire pour distribuer à la tumeur la dose prescrite tout en respectant la dose aux tissus sains.
La séance : elle dure quelques minutes en reproduisant les conditions définies au centrage, y compris en utilisant des dispositifs de contention pour reproduire parfaitement la position définie alors.
Des contrôles des faisceaux sont faits régulièrement sous forme de clichés ou de coupe scanner pour valider le parfait positionnement des faisceaux.
Pendant toute la durée de l’irradiation, les patients sont surveillés de façon quotidienne par les techniciens de la radiothérapie et de façon hebdomadaire par le radiothérapeute responsable du traitement, ce qui permettra de vérifier la régression tumorale s’il existe une cible mesurable et surtout la tolérance du traitement.
Dans tous les cas, les patients ne sont pas radioactifs après une séance de radiothérapie.
Modalités techniques de traitement
Radiothérapie externe : la source de rayonnement est à l’extérieur du patient. Plusieurs modalités peuvent être utilisées :
conformationelle : un contourage de la tumeur, des organes cibles et des zones saines radiosensibles est réalisé à l’aide d’une imagerie scanographique dédiée ;
stéréotaxie : technique visant à faire converger de nombreux faisceaux dans une zone de l’ordre du cm3 avec une précision millimétrique. Les traitements sont peu fractionnés : en une à quelques séances avec des doses élevées.
Curiethérapie (brachythérapie) : irradiation par mise en place locale d’un corps radioactif. Les éléments les plus utilisés sont l’iridium 192 et l’iode 125. Les principales indications sont les cancers du col utérin et de la prostate.
Irradiation métabolique : utilisation d’un radio-isotope, par exemple à tropisme osseux ou marquant un traceur osseux. L’objectif est le traitement des localisations métastatiques osseuses symptomatiques, classiquement dans le cadre des cancers de la prostate. Le strontium 89 et le phosphore 32 sont les plus utilisés.
Traitement médicamenteux du cancer
On distingue classiquement :
la chimiothérapie (agents cytotoxiques) ;
l’hormonothérapie ;
les thérapeutiques dites ciblées ;
l’immunothérapie.
En France, seuls les médecins titulaires d’un diplôme d’études spécialisées (DES) en oncologie médicale ou hématologie ou d’un diplôme d’études spécialisées complémentaires (DESC) de cancérologie sont autorisés à prescrire ces traitements.
Chimiothérapie (agents cytotoxiques)
Principes d’action
L’instabilité génétique fait partie des caractéristiques propres aux cellules tumorales. Elle est source de mutations qui peuvent conduire à une altération des systèmes de réparation de l’ADN et de l’apoptose ou encore favoriser la prolifération et la survie.
La sensibilité des cellules tumorales à la chimiothérapie est en partie expliquée par :
leurs difficultés à réparer les altérations de l’ADN induites par la chimiothérapie ;
leurs taux de divisions souvent plus élevés que pour le tissu sain dont elles dérivent.
Principes d’administration
Concernant les protocoles de chimiothérapie, les principes sont les suivants :
association de cytotoxiques. L’histoire de la chimiothérapie anticancéreuse repose sur les associations de drogues ou polychimiothérapies. En théorie, ces associations sont plus efficaces en termes de réponse, en permettant de contourner les problématiques d’hétérogénéité tumorale et de résistance. En multipliant le nombre de drogues, on augmente aussi les toxicités ;
répétition des séances. Elle est fondée sur l’effet différentiel, le délai entre chaque chimiothérapie étant fait pour recouvrer des toxicités, en particulier hématologiques ;
durée de traitement. Elle est déterminée par les toxicités et la durée nécessaire à l’obtention d’une réponse ;
dose-intensité. Pour la plupart des tumeurs, une diminution de dose de chimiothérapie par unité de temps conduit à une diminution d’efficacité.
Classification des anticancéreux cytotoxiques
Les cytotoxiques vont être divisés en fonction de la cible et de la période de sensibilité (drogues « cycle-indépendantes », « cycle- dépendantes » voire « phase-dépendantes »).
ADN tumoral
Le traitement peut agir par :
ajout d’un groupement soit par ajout d’un groupe alkyl (alkylant, cyclophosphamide par exemple), soit par sels de platine (cisplatine, par exemple) ;
inducteur ou stabilisateur des agents de cassures de l’ADN : les topoïsomérases induisant des lésions simple brin (topo I, irinotécan, par exemple) ou double brin (topo II, anthracycline, par exemple) que les inhibiteurs de topoïsomérase stabilisent ;
inhibiteur de la synthèse des acides nucléiques : antimétabolites par inhibition de synthèse des bases : antifolate (méthotrexate) ou par analogues non fonctionnels antipuriques et antipyrimidiques (gemcitabine, 5-FU, fludarabine).
Fuseau mitotique
Il peut s’agir d’inhibiteur de la polymérisation des microtubules (vinca-alcaloïdes, vincristine par exemple) ou d’inhibiteur de la dépolymérisation des microtubules (taxanes, docétaxel par exemple).
Mécanisme de résistance
La résistance aux traitements est malheureusement toujours une réalité dans le traitement médical des cancers. Elle peut être primaire ou secondaire, induite par une sélection de clones résistants.
On peut distinguer plusieurs mécanismes :
liés au patient. Mécanismes essentiellement liés à une diminution des concentrations actives de la drogue : pharmacogénomique individuelle modifiant le métabolisme « normal » de la drogue, interactions médicamenteuses, barrières physiologiques telles que les jonctions serrées de la barrière hémato- encéphalique ;
liés à la tumeur. Mécanismes multifactoriels, avec une résistance d’emblée ou acquise, et dépassent le cadre de cet article.
Indications
Ce sont :
les maladies macrométastatiques ;
l’association à un traitement local pour permettre la chirurgie, ou à visée d’épargne fonctionnelle ;
le complément de traitement après traitement local pour traiter la maladie micrométastatique ;
certaines tumeurs ne relevant que de la chimiothérapie (hémopathies malignes).
Objectif
Il est :
curatif. L’objectif est d’éradiquer la maladie micrométastatique, plus difficilement macrométastatique ;
palliatif. Dès lors qu’il n’est plus possible d’éradiquer la maladie, on est dans une situation palliative où l’objectif est d’obtenir un contrôle durable de la maladie. Les lignes successives de chimiothérapie permettent alors d’améliorer la survie de quelques mois à plusieurs années et d’améliorer la qualité de vie en contrôlant les symptômes liés au cancer.
Complications
Elles dépendent du protocole de chimiothérapie, de l’état général et des comorbidités du patient. On sépare classiquement les effets précoces (immédiats et < 1 mois), souvent réversibles, et les complications différées, parfois définitives.
Les toxicités sont gradées de I à IV dans le système CTCAE (Common Terminology Criteria for Adverse Events), les toxicités de grades I et II étant minimes à modérées, de grade III sévères et nécessitant l’hospitalisation, de grade IV mettant en jeu le pronostic vital
Aiguës (< 1 mois)
La majorité des agents de chimiothérapie sont actifs sur les cellules en division. Les toxicités sont donc d’autant plus marquées pour les cellules saines qu’elles se divisent rapidement, comme les cellules des muqueuses et les cellules hématopoïétiques.
Allergie. Les réactions allergiques ou d’hypersensibilité sont plus fréquentes avec certaines drogues, parfois létales en cas de choc anaphylactique (Paclitaxel, oxaliplatine).
Hématologiques. Les trois lignées sont concernées : il faut attendre entre 7 et 15 jours pour qu’apparaissent les cytopénies, reflet de mort des cellules en développement au moment de la chimiothérapie. La durée des cytopénies est variable selon le type de chimiothérapie et des facteurs de risque liés au malade (traitement antérieur, envahissement médullaire, âge, état général). Concernant la neutropénie, elle est généralement courte (< 5 jours) avec les chimiothérapies de cancers solides mais peut atteindre plusieurs semaines en cas de leucémie aiguë (en rapport avec l’envahissement médullaire et la toxicité hématologique majeure des protocoles). La durée de la neutropénie peut être raccourcie par l’utilisation de facteurs de croissance granulocytaires. L’hyperthermie du neutropénique constitue une urgence thérapeutique, avec des infections plus sévères, rapidement évolutives et pouvant faire intervenir des germes opportunistes, particulièrement en cas d’infection prolongée (fungique).
Concernant les thrombopénies, elles peuvent nécessiter des transfusions, le seuil étant dépendant du risque de saignement, de la nécessité éventuelle d’un geste ou d’une anticoagulation.
L’anémie peut elle aussi nécessiter des transfusions. Il existe des facteurs de croissance, les érythropoïétines (EPO) peuvent être utilisées chez les patients atteints de tumeurs solides avancées en cours de chimiothérapie.
Vomissements. Ils peuvent être immédiats, retardés ou anticipatoires. En fonction du pouvoir/risque émétisant, différents antiémétiques peuvent être utilisés.
Il existe plusieurs classes médicamenteuses avec, dans l’ordre d’utilisation croissante :
les corticoïdes ;
les neuroleptiques (métoclopramide [Primpéran], halopéridol [Haldol]) ;
les sétrons (antagonistes des récepteurs 5-HT3, ondansétron [Zophren], granisétron [Kytril]) ;
les antagonistes du récepteur NK1 (aprépitant [Emend]).
Cutanées et phanères. L’alopécie n’est pas systématique et est souvent réversible. Les agents les plus alopéciants sont les taxanes, les anthracyclines et les alkylants.
Chroniques (> 1 mois)
Ce sont, en particulier :
la toxicité neurologique (neuropathie périphérique définitive [paclitaxel, sels de platine, vinca-alcaloïde], ototoxicité [cisplatine]) ;
la toxicité hématologique (potentiel leucémogène des alkylants et des anthracyclines) ;
la toxicité néphrologique (toxicité du cisplatine, pouvant être aiguë, avec une atteinte tubulaire, diminuée par une hyperhydratation encadrant l’administration de la drogue et chronique avec l’accumulation des doses) ;
la toxicité cardiaque (insuffisance cardiaque, en particulier avec les anthracyclines. Elle peut être prévenue en évitant d’atteindre les doses cumulatives).
Complication liée à l’abord veineux
Certaines chimiothérapies ont un potentiel vésicant (anthracycline, vinca-alcaloïde) et doivent être administrées exclusivement à l’aide d’une voie centrale afin de limiter ce risque.
En cas d’extravasation, le potentiel vésicant doit être évalué en urgence et peut nécessiter une prise en charge chirurgicale.
La chambre implantable est, de par les manipulations répétées, à risque d’infection.
La présence d’un corps étranger intravasculaire peut aussi se compliquer de thrombose.
Soins de support
La prise en charge symptomatique a permis d’améliorer considérablement la tolérance et donc la dose délivrée et l’efficacité des chimiothérapies.
Les soins de support ont aussi pour objectif l’amélioration de la qualité de vie, essentielle dans le cadre des soins palliatifs pour les pathologies incurables.
Leur champ d’application est vaste : prise en charge de la douleur, de la dyspnée à la prise en charge des toxicités prévisibles de la chimiothérapie comme les vomissements, ou encore une dimension psychologique avec l’altération de la perception de soi à la suite des traitements.
Thérapies ciblées
La meilleure compréhension des mécanismes de la cancérogenèse a permis d’identifier des anomalies moléculaires impliquées dans la progression tumorale. Les traitements visant à contrer les conséquences de ces anomalies sont appelés « thérapies ciblées ».
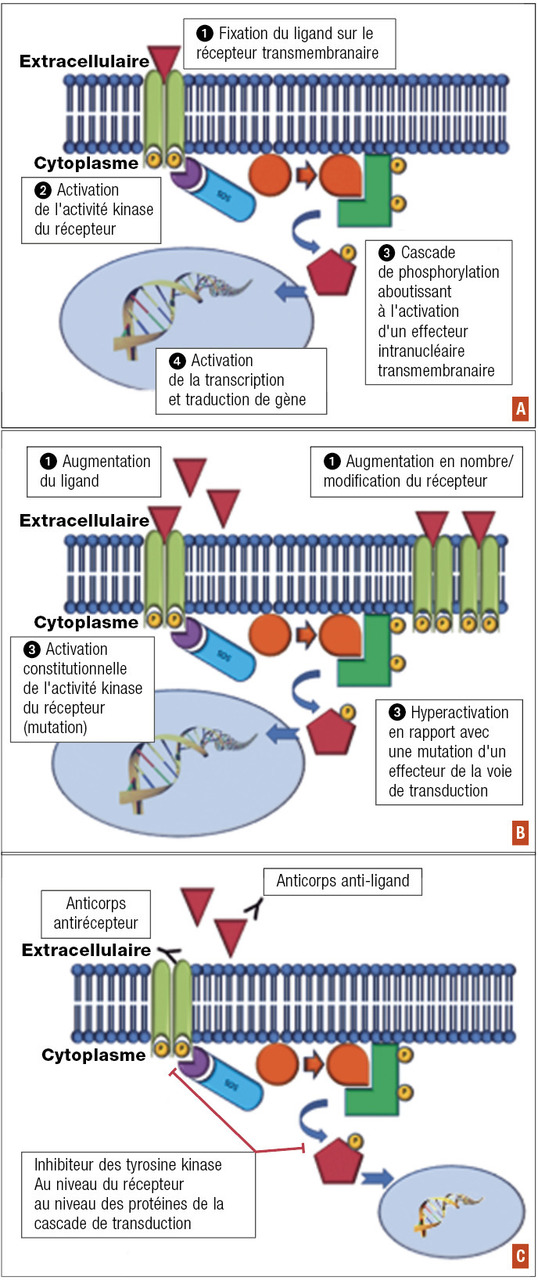
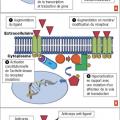
Schématiquement, la transduction du signal fait intervenir un ligand (facteur de croissance, par exemple), un récepteur et un effecteur secondaire
L’activation d’une voie de l’oncogenèse va pouvoir se situer à chaque niveau
Dans certains cas, l’anomalie moléculaire est aussi un facteur prédictif de réponse à un traitement ciblant cette anomalie. C’est ainsi qu’on parle de thérapie ciblée (fig. 1C) : par exemple, la surexpression d’HER2 liée à l’amplification du gène HER2 dans le cancer du sein, et la réponse aux anticorps monoclonaux anti-HER2.
Un point important à souligner : ces anomalies ne sont pas nécessairement spécifiques d’un type de cancer, et l’on va de plus en plus s’orienter vers des traitements en fonction d’anomalies moléculaires et non du site primitif où se développe la tumeur : ainsi la surexpression d’HER2, retrouvée dans 15 % des cancers du sein, peut se voir aussi dans les cancers gastriques, et se traduit par la même efficacité des anticorps anti-HER2.
Deux familles de traitements peuvent être utilisées pour cibler ces anomalies moléculaires : les anticorps monoclonaux et les inhibiteurs de tyrosine kinase.
Les anticorps monoclonaux (-ab) sont des molécules de haut poids moléculaire qui ciblent le ligand ou la partie extracellulaire du récepteur membranaire. Elles peuvent être en partie ou totalement humanisées (-umab) ou utiliser une base animale (-imab). Un anticorps peut être associé à une molécule de chimiothérapie qui en facilite la délivrance au niveau des cellules surexprimant l’antigène cible (anticorps anti-HER2 [trastuzumab] et emtansine [poison du fuseau] dans le cancer du sein).
Les inhibiteurs de tyrosine kinase (TKI) sont des molécules de bas poids moléculaire. Elles pénètrent à l’intérieur de la cellule, ciblant la partie intracellulaire du récepteur ou d’autres protéines intracellulaires.
Traitements focaux autres que la chirurgie et la radiothérapie
Radiofréquence
La radiofréquence est un traitement qui détruit la tumeur par la chaleur. Elle est réalisée sous contrôle radiologique avec utilisation de sondes percutanées qui vont générer une hyperthermie au sein de la tumeur ciblée. Cette technique a été validée dans le traitement des métastases hépatiques mais peut être utilisée dans d’autres localisations.
Cryothérapie
L’objectif est de provoquer mort cellulaire par congélation brutale des cellules par une sonde refroidie à l’argon. Cette technique est principalement utilisée dans le traitement des cancers primitifs du rein, mais peut s’appliquer à de nombreuses localisations, notamment métastatiques.
Traitement hormonal
Certaines cellules cancéreuses sont dépendantes de signaux de croissance hormonaux.
Il existe deux principaux moyens de supprimer ce signal : soit en bloquant la production, soit en bloquant la fixation de l’hormone sur son récepteur.
Les deux cancers les plus fréquents, le cancer de la prostate et le cancer du sein, sont des cancers hormonodépendants.
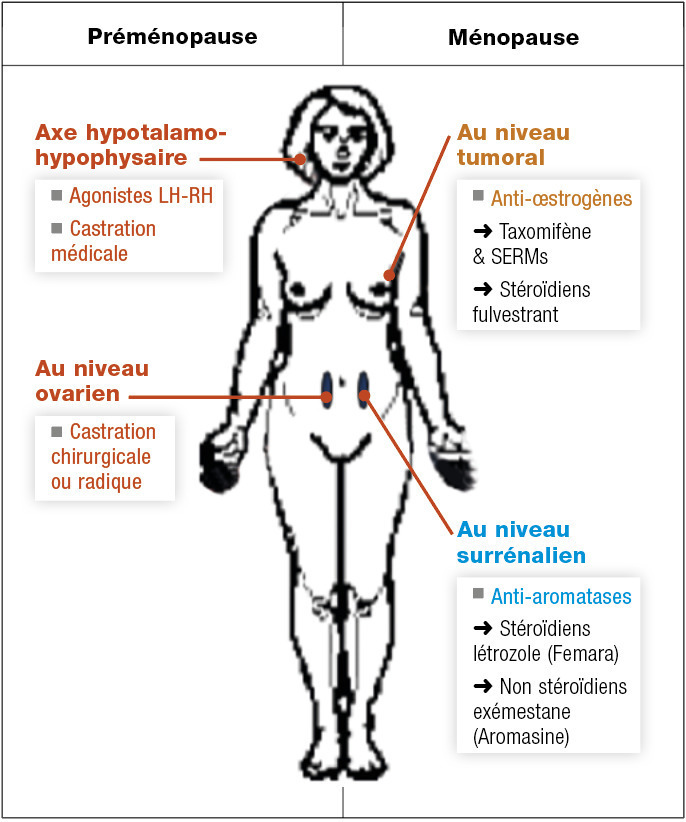
Sein
Point majeur, l’efficacité des traitements hormonaux peut être prédite par l’expression des récepteurs hormonaux au niveau tumoral (notamment des récepteurs à l’estradiol).
Blocage de la production œstrogénique
Avant la ménopause, la production est essentiellement ovarienne, elle est ensuite assurée par la conversion périphérique des androgènes en estrone par les aromatases surrénaliennes.
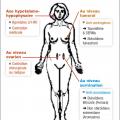
En cas de production ovarienne, un traitement radical par ovariectomie ou irradiation est envisageable, rapide, peu coûteux et irréversible. La castration chimique est basée sur l’utilisation d’agonistes de la LH-RH (goséréline, leuproréline) qui suppriment la production ovarienne d’œstrogènes en supprimant la production cyclique de LH-RH. L’effet est rapide, en quelques semaines, l’administration sous-cutanée ou intramusculaire est faite tous les 1 à 3 mois, les effets secondaires sont identiques à la ménopause.
Après la ménopause, les androgènes de production surrénalienne peuvent être transformés en œstrogènes par des aromatases. Ces aromatases sont produites dans les cellules adipeuses. Dans cette situation, le blocage chimique est obtenu par les anti-aromatases (létrozole, anastrozole, exémestane). L’administration se fait par voie orale. Les effets secondaires doivent être anticipés et prévenus (ostéoporose par dépistage et biphosphonate, arthralgies).
Blocage de la fixation aux récepteurs œstrogéniques
Les anti-œstrogènes peuvent être utilisés quel que soit le statut ménopausique. Certains ont un effet agoniste partiel sur des tissus normaux autres que les cellules cancéreuses, ce qui limite leur action ostéoporotique mais majore le risque de cancer de l’endomètre et majore le risque thromboembolique (tamoxifène per os). D’autres ont un effet antagoniste pur (fulvestrant intramusculaire).
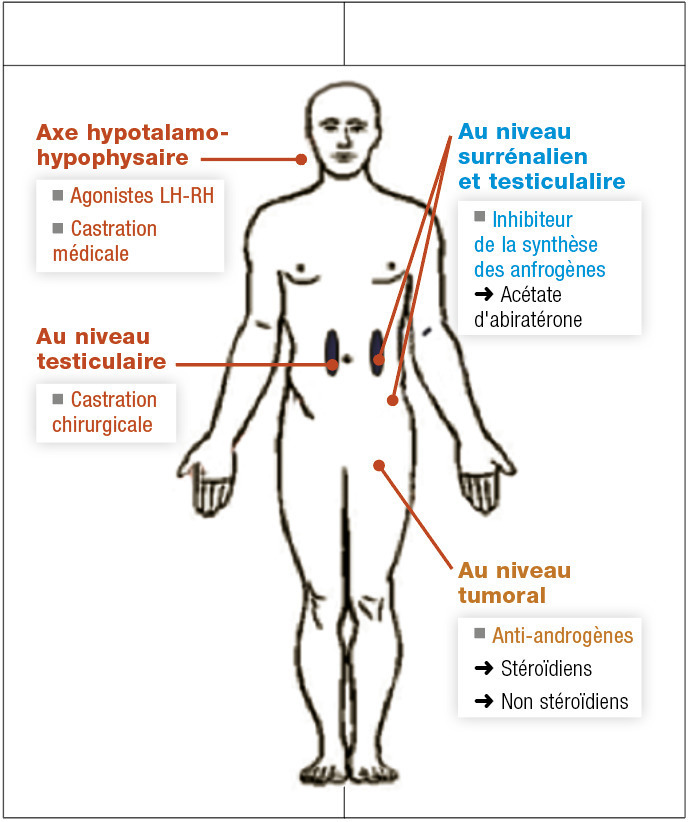
Prostate
La grande majorité des cancers de la prostate sont hormono-sensibles (85 %), et on ne connaît pas de biomarqueur prédictif de la réponse au traitement.
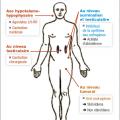
Blocage de la production androgénique
La production est majoritairement testiculaire. Les options sont donc la castration chirurgicale (pulpectomie). Les méthodes médicamenteuses utilisent les agonistes de la LH-RH (goséréline, leuproréline). Ils sont associés durant les premières semaines à un anti-androgène pour éviter la remontée initiale de la testostérone liée à l’action de la LH-RH (effet flare-up). L’efficacité est rapide, en quelques semaines, les effets secondaires dominés par les troubles de la libido et les bouffées de chaleur. L’acétate d’abiratérone est une nouvelle hormonothérapie, inhibant la synthèse des androgènes en inhibant le complexe CYP-17 testiculaire et surrénalien.
Blocage de la fixation sur les récepteurs aux androgènes
Ces médicaments sont stéroïdiens (acétate de cyprotérone) ou non (bicalutamide). L’enzalutamide est une hormonothérapie de nouvelle génération qui inhibe la liaison des androgènes à leur récepteur, là sans effet agoniste.
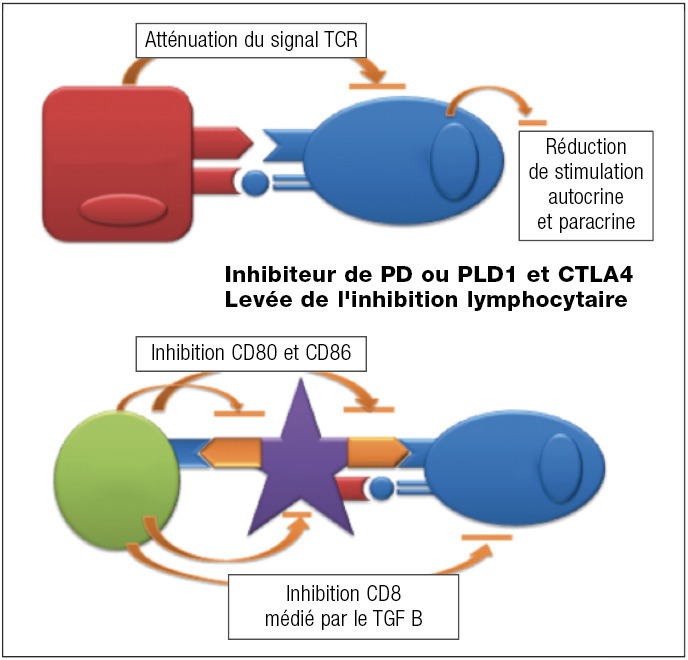
Immunothérapie (fig. 4)
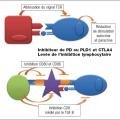
Il existe plusieurs types de traitements utilisant le système immunitaire comme base. Les résultats les plus probants ont été obtenus en ciblant l’immunité adaptative.
Les cellules tumorales ont pour caractéristique de pouvoir échapper au système immunitaire du patient, induisant une tolérance immune en particulier vis-à-vis des lymphocytes effecteurs. La levée des signaux inhibiteurs par des anticorps permet de réactiver l’immunité antitumorale et d’obtenir un contrôle du cancer. Les effets secondaires sont différents de ceux des cytotoxiques, en rapport avec une activation inadaptée du système immunitaire conduisant au développement de pathologies immunologiques (thyroïdite, hypophyse, colite inflammatoire, pneumopathie inflammatoire). Elles sont actuellement validées dans de nombreux organes (mélanomes, poumons) dans les stades métastatiques et en développement précoce.
Les principaux traitements sont les suivants :
inhibiteur de CTLA4 (ipilimumab) ;
anticorps anti-PD1 (nivolumab, pembrolizumab) ;
anticorps anti-PDL1 (atézolizumab).
Information du malade et bonnes pratiques en cancérologie
Les 4 dispositifs suivants ont été indiqués dans les Plans cancer successifs :
le dispositif d’annonce ;
la concertation pluridisciplinaire et le respect des référentiels de bonne pratique ;
la remise d’un programme personnalisé de soins ;
l’accès aux innovations et à la recherche clinique.
Dispositif d’annonce
Modalités
Il s’articule autour de 4 temps :
un temps médical, avec annonce du diagnostic et proposition de traitement avec plan personnalisé de soins ;
un temps d’accompagnement soignant qui sert à informer le patient sur ses droits et sur les associations de patients existantes ; il est à l’idéal réalisé par une infirmière de consultation d’annonce ;
un temps de soutien fondé sur l’accompagnement social et l’accès à des soins complémentaires (psychologue, kinésithérapeute, nutritionniste) ;
un temps d’interaction avec la médecine de ville. Cette coordination avec le médecin traitant doit être débutée le plus tôt possible, le médecin traitant étant en charge de rédiger la demande de 100 % (exonération du ticket modérateur).
Temps médical
L’information du malade est incontournable et encadrée par les codes de déontologie et différentes dispositions légales. Le code de déontologie précise que le médecin doit au patient une « information loyale, claire et appropriée sur son état, ses investigations et les soins ».
L’information peut être également donnée à la personne de confiance (famille ou proches). La désignation d’une telle personne doit être recherchée auprès du patient. Elle est nécessaire afin de discuter avec le patient les actes diagnostiques et thérapeutiques proposés en améliorant sa participation active aux décisions.
Les propositions diagnostiques et thérapeutiques doivent aborder les objectifs recherchés et les effets secondaires même exceptionnels. Les alternatives, lorsqu’il en existe, doivent être évoquées afin de discuter au mieux le rapport bénéfice-risque. Le médecin doit s’assurer de la compréhension de l’information. Lors des échanges, l’information orale prime et ne saurait être remplacée par une documentation écrite exclusive. La documentation doit constituer un support, synthétique, validé par les sociétés savantes et idéalement discuté avec les associations de patients.
L’information délivrée doit être colligée dans le dossier afin de favoriser la continuité des soins au sein de l’équipe.
En fonction des circonstances, lors des consultations l’avis du patient et d’éventuelles directives anticipées doivent être disponibles pour l’équipe soignante.
Concertation pluridisciplinaire et respect des référentiels de bonne pratique
Les propositions thérapeutiques doivent être définies lors de la réunion de concertation pluridisciplinaire (RCP). Une RCP à visée diagnostique ou thérapeutique doit se faire en présence d’au moins 3 médecins de spécialités différentes permettant d’avoir un avis pertinent sur toutes les procédures envisagées.
Elle se fonde sur l’application de référentiels de bonne pratique et ne doit pas retarder le traitement en cas de traitement d’urgence.
Le compte-rendu doit être intégré au dossier et transmis aux différents correspondants dont le médecin traitant du patient.
Remise d’un programme personnalisé de soins
Le programme personnalisé de soins (PPS) reprend les différents éléments de diagnostic, les traitements et un calendrier des étapes thérapeutiques et de surveillance. Il doit être communiqué au médecin traitant.
Accès aux soins complémentaires et d’accompagnement
Quels que soient le stade et le pronostic de la maladie, la mise en place de soins de support doit être optimale afin d’améliorer la tolérance aux traitements et in fine la qualité de vie des patients.
Cela peut faire intervenir différents professionnels de santé, médicaux ou non, et concerne particulièrement le soutien psychologique, social, le traitement de la douleur, la gestion des handicaps.
Les soins de support peuvent être dispensés en intra- ou extrahospitalier avec intervention dans ce cas des médecins traitants et d’un réseau coordonnateur.
Les décisions de traitement de cancer doivent faire l’objet d’une RCP et être évaluées aux regards de référentiels.
Les modalités de traitements et leur association (multi-modalité) vont dépendre du caractère localisé, localement avancé ou métastatique.
Les traitements peuvent avoir un objectif « curatif » (guérison) ou « palliatif » (amélioration de la survie et de la qualité de vie, de quelques mois à plusieurs années).
Les traitements anticancéreux ont des effets immédiats et retardés dont l’importance relative dépend du pronostic.
Mais aussi :
Neutropénie fébrile : recommandations de l’IDSA, 2010.
http://cid.oxfordjournals.org/content/52/4/e56.full
Recommandations en onco-urologie 2013 du CCAFU : cancer de la prostate.
http://www.dl-protect.com/3AD00B21
POINTS FORTS À RETENIR
Les décisions de traitement de cancer doivent faire l’objet d’une RCP et être évaluées aux regards de référentiels.
Les modalités de traitements et leur association (multi-modalité) vont dépendre du caractère localisé, localement avancé ou métastatique.
Les traitements peuvent avoir un objectif « curatif » (guérison) ou « palliatif » (amélioration de la survie et de la qualité de vie, de quelques mois à plusieurs années).
Les traitements anticancéreux ont des effets immédiats et retardés dont l’importance relative dépend du pronostic.
Neutropénie fébrile : recommandations de l’IDSA, 2010.http://cid.oxfordjournals.org/content/52/4/e56.fullRecommandations en onco-urologie 2013 du CCAFU : cancer de la prostate.http://www.dl-protect.com/3AD00B21

 Encadrés
Encadrés