Une évaluation cardiovasculaire doit être faite avant d’instaurer une thérapie antinéoplasique potentiellement cardiotoxique, puis poursuivie chez tous les sujets à risque. L’objectif est d’en limiter l’impact sur le pronostic global des patients.
La cardio-oncologie est une nouvelle spécialité interdisciplinaire ayant pour double objectif la prise en charge des complications CV des anticancéreux et aussi des patients ayant une cardiopathie antérieure, pour un traitement optimal de leur néoplasie. Les premières observations de victimes d’insuffisance cardiaque (IC) après traitement par anthracyclines ont été rapportées dans les années 70. Le terme de cardio-oncologie n’apparaît qu’en 1996. C’est l’équipe italienne de Daniela Cardinale qui a jeté les bases de cette nouvelle spécialité et en a publié les premiers grands travaux. Son développement s’est ensuite accéléré, avec l’émergence des nouvelles thérapies ciblées. Ainsi, plusieurs unités cliniques dédiées ont été créées en France, dont la première à Marseille en 2015. En parallèle, la naissance en 2009 d’une société savante internationale, d’un journal spécialisé, de sessions dédiées dans les congrès de cardiologie et d’oncologie, et l’explosion des publications traduisent l’importance croissante de ce domaine. Depuis 2019, sous l’égide de la SFC, le Cercle decardio-oncologie veille au développement de cette spécialité en France et coordonne des travaux nationaux.
Malgré tout cela, la surveillance CV de ces patients à risque est encore à améliorer. De nouvelles recommandations sont disponibles (ECS 20161 et guidelines 2020 de l’ESMO)2 mais ne sont pas encore connues par tous. C’est pourquoi nos efforts doivent se poursuivre !
En effet, il s’agit d’une nouvelle population pour les cardiologues, souvent jeune, complexe, ayant des atteintes multi-organes de pathogénie différente.
Malgré tout cela, la surveillance CV de ces patients à risque est encore à améliorer. De nouvelles recommandations sont disponibles (ECS 20161 et guidelines 2020 de l’ESMO)2 mais ne sont pas encore connues par tous. C’est pourquoi nos efforts doivent se poursuivre !
En effet, il s’agit d’une nouvelle population pour les cardiologues, souvent jeune, complexe, ayant des atteintes multi-organes de pathogénie différente.
Deux types de cardiotoxicité
La prise en charge des patients atteints de cancers a connu ces dernières années de nombreux progrès, avec notamment l’avènement des thérapies ciblées et les immunothérapies améliorant la survie au prix d’une majoration des effets indésirables.
Les complications CV liées aux prises en charge oncologiques peuvent être multiples (dysfonction systolique du ventricule gauche [VG], myocardite aiguë, HTA, allongement de l’intervalle QT, thrombose artérielle ou veineuse, ischémie aiguë), de fréquence et de mécanismes variables selon la molécule administrée.2
Deux grandes classes de toxicité myocardique sont décrites (type 1 et 2). Les anthracyclines peuvent entraîner une dysfonction systolique du VG, qui est considérée dans la majorité des cas comme dépendante de la dose, c’est dire cumulative et en général irréversible (de type 1).
Les thérapies ciblées donnent des effets secondaires, dont la prévalence, les facteurs de risque, la prise en charge et la prévention sont moins bien établis. Elles peuvent provoquer une dysfonction systolique du VG, qui ne semble pas dépendre de la dose. Elle est, en général, réversible à l’arrêt du traitement et/ou à l’instauration d’un cardioprotecteur adapté (toxicité de type 2).1 Au niveau vasculaire, ces thérapies, notamment les anti-angiogéniques, induisent souvent une HTA.
à cette classification, s’ajoutent les nouvelles toxicités telles que les myocardites aiguës sous immunothérapies rendant cette distinction entre type 1 et 2 plus difficile.
Les complications CV liées aux prises en charge oncologiques peuvent être multiples (dysfonction systolique du ventricule gauche [VG], myocardite aiguë, HTA, allongement de l’intervalle QT, thrombose artérielle ou veineuse, ischémie aiguë), de fréquence et de mécanismes variables selon la molécule administrée.2
Deux grandes classes de toxicité myocardique sont décrites (type 1 et 2). Les anthracyclines peuvent entraîner une dysfonction systolique du VG, qui est considérée dans la majorité des cas comme dépendante de la dose, c’est dire cumulative et en général irréversible (de type 1).
Les thérapies ciblées donnent des effets secondaires, dont la prévalence, les facteurs de risque, la prise en charge et la prévention sont moins bien établis. Elles peuvent provoquer une dysfonction systolique du VG, qui ne semble pas dépendre de la dose. Elle est, en général, réversible à l’arrêt du traitement et/ou à l’instauration d’un cardioprotecteur adapté (toxicité de type 2).1 Au niveau vasculaire, ces thérapies, notamment les anti-angiogéniques, induisent souvent une HTA.
à cette classification, s’ajoutent les nouvelles toxicités telles que les myocardites aiguës sous immunothérapies rendant cette distinction entre type 1 et 2 plus difficile.
Dysfonction du VG : qui incriminer ?
De nombreux agents anticancéreux peuvent entraîner une dysfonction systolique du VG ou un épisode d’IC symptomatique (tableau 1 ). Leur fréquence varie selon la molécule, le mode d’administration, la population considérée, les traitements associés et les modalités de dépistage.1 Cette définition repose avant tout sur la fraction d’éjection ventriculaire gauche (FEVG) : une diminution de 10 % ET une Fevg < 50 % (ESC 2016) ou une baisse absolue de 20 % (ESMO 2020).
L’échographie cardiaque par voie transthoracique est donc l’examen de première intention. Dans cette situation, il arrive souvent que les patients soient asymptomatiques, justifiant un dépistage systématique. Le diagnostic d’IC est clinique. Le dosage des peptides natriurétiques peut être utile pour infirmer le diagnostic mais, étant variable en cas de cancer, il n’est pas utilisé pour évaluer cette toxicité.
Les anthracyclines, les alkylants, les antimétabolites, les antimicrotubules, les anti-HER2, les inhibiteurs des tyrosine kinases et du protéasome sont les principaux pourvoyeurs de dysfonction systolique du VG avec ou sans symptômes.
Pour les anthracyclines, le principal mécanisme est la génération et la majoration du stress oxydatif. La cardiotoxicité varie beaucoup avec la population et le schéma d’administration de la chimiothérapie.3
Selon une méta-analyse chez 23 000 patients traités par anthracyclines, l’incidence de la dysfonction VG asymptomatique était de 18 % (symptomatique : 6 %).3 La dose cumulée reçue est le principal facteur de toxicité et joue un rôle déterminant dans l’apparition d’une forme symptomatique : l’incidence serait de 3 % en dessous de 400 mg/m², de 7 % à la posologie de 550 mg/m² et de 18 % à 700 mg/m². Une réactualisation de ces données fait état de valeurs plus élevées, respectivement de 5 %, 26 % et 48 %.
Les principaux facteurs de cette toxicité sont : âge (< 15 ans, > 65 ans), sexe féminin, coadministration de trastuzumab, irradiation médiastinale préalable, HTA, antécédent de cardiopathie ischémique ou valvulaire, valeurs extrêmes de l’IMC (basse et élevée).2
Le trastuzumab est un anticorps monoclonal dirigé contre le récepteur HER2 surexprimé dans près de 25 % des cancers du sein. Il est impliqué dans la prolifération cellulaire et la survie des cardio- myocytes. En situation métastatique, il réduit la mortalité à 1 an de 33 % et le taux de récidive de 50 %.L’incidence de la toxicité cardiaque varie selon le stade du cancer (métastatique ou sous traitement adjuvant) et les modalités d’administration : 4,1 % sous trastuzumab sans anthracyclines et 27 % lorsqu’il est prescrit simultanément à ces dernières et au cyclophosphamide.1 À la différence de celle liée aux anthracyclines, elle est en règle générale réversible à l’arrêt de la chimiothérapie, sensible à l’introduction d’un cardioprotecteur (IEC et/ou bêtabloquant), ce qui autorise la reprise du traitement pour certains cas (asymptomatiques et FEVG > 40 %).
Les inhibiteurs de tyrosine kinase (sunitinib, sorafénib) et les anticorps monoclonaux dirigés contre le vascular endothelial growth factor (VEGF) circulant ou les récepteurs anti-VEGF (anti-angiogéniques) peuvent aussi entraîner une IC ou une dysfonction systolique du VG. La fréquence reste faible, avec cependant un odds ratio de 1,35 comparativement à une population ne recevant pas de bévacizumab.Chez des patients ayant un cancer rénal, 13 % traités par sunitinib ont eu un épisode d’IC considéré comme sévère dans 3 % des cas ; ce taux est de 4 % sous sorafénib (dont 1 % de formes jugées graves). 6 Leur toxicité principale est l’HTA (jusqu’à 50%).
Les inhibiteurs du protéasome (carfilzomib, bortézomib) bloquent la prolifération cellulaire, entraînent une apoptose à l’origine de l’effet carcinologique, notamment dans le myélome multiple : sous carfilzomib, 7 % des sujets peuvent faire une dysfonction systolique du VG, 1,5 % un arrêt cardiaque et 0,8 % un infarctus du myocarde. Cette toxicité ne semble pas liée à la dose cumulée, elle est le plus souvent réversible à l’arrêt de la chimiothérapie et sensible à un traitement par IEC et bêtabloquant.1
Les nouvelles immunothérapies, prescrites dans le mélanome ou le cancer pulmonaire, mais gagnant de plus en plus d’indications, ont des effets indésirables potentiels, notamment auto-immuns : myosites, uvéites, thyroïdites, colites parfois sévères. La principale complication cardiaque est la myocardite, aiguë dont l’incidence est faible : 0,19 % selon la littérature (ensemble des phases 3), 0,27 % dans les bases de pharmacovigilance de l’industrie pharmaceutique et plutot de l’ordre de 1 % selon les registres récents. Deux unités de cardio-oncologie (à Paris, hôpital Saint-Antoine, et à Marseille) ayant colligé 30 cas de toxicité liée à une immunothérapie, en ont identifié les principales caractéristiques.4
Les myocardites aiguës surviennent en général dans les 3 premiers mois d’administration et peuvent se manifester de façon atypique ; elles peuvent évoluer rapidement vers le choc cardiogénique et le décès dans 25 à 50 % des cas.4 Le diagnostic repose sur une identification précoce des patients par le dosage de la troponine, une échographie et une IRM cardiaques (un rehaussement tardif épicardique étant évocateur ; mais absent dans 50 % des cas). La prise en charge est urgente : bolus de corticoïdes fortes doses et, dans les formes fulminantes avec choc, assistance circulatoire.4
L’échographie cardiaque par voie transthoracique est donc l’examen de première intention. Dans cette situation, il arrive souvent que les patients soient asymptomatiques, justifiant un dépistage systématique. Le diagnostic d’IC est clinique. Le dosage des peptides natriurétiques peut être utile pour infirmer le diagnostic mais, étant variable en cas de cancer, il n’est pas utilisé pour évaluer cette toxicité.
Les anthracyclines, les alkylants, les antimétabolites, les antimicrotubules, les anti-HER2, les inhibiteurs des tyrosine kinases et du protéasome sont les principaux pourvoyeurs de dysfonction systolique du VG avec ou sans symptômes.
Pour les anthracyclines, le principal mécanisme est la génération et la majoration du stress oxydatif. La cardiotoxicité varie beaucoup avec la population et le schéma d’administration de la chimiothérapie.3
Selon une méta-analyse chez 23 000 patients traités par anthracyclines, l’incidence de la dysfonction VG asymptomatique était de 18 % (symptomatique : 6 %).3 La dose cumulée reçue est le principal facteur de toxicité et joue un rôle déterminant dans l’apparition d’une forme symptomatique : l’incidence serait de 3 % en dessous de 400 mg/m², de 7 % à la posologie de 550 mg/m² et de 18 % à 700 mg/m². Une réactualisation de ces données fait état de valeurs plus élevées, respectivement de 5 %, 26 % et 48 %.
Les principaux facteurs de cette toxicité sont : âge (< 15 ans, > 65 ans), sexe féminin, coadministration de trastuzumab, irradiation médiastinale préalable, HTA, antécédent de cardiopathie ischémique ou valvulaire, valeurs extrêmes de l’IMC (basse et élevée).2
Le trastuzumab est un anticorps monoclonal dirigé contre le récepteur HER2 surexprimé dans près de 25 % des cancers du sein. Il est impliqué dans la prolifération cellulaire et la survie des cardio- myocytes. En situation métastatique, il réduit la mortalité à 1 an de 33 % et le taux de récidive de 50 %.L’incidence de la toxicité cardiaque varie selon le stade du cancer (métastatique ou sous traitement adjuvant) et les modalités d’administration : 4,1 % sous trastuzumab sans anthracyclines et 27 % lorsqu’il est prescrit simultanément à ces dernières et au cyclophosphamide.1 À la différence de celle liée aux anthracyclines, elle est en règle générale réversible à l’arrêt de la chimiothérapie, sensible à l’introduction d’un cardioprotecteur (IEC et/ou bêtabloquant), ce qui autorise la reprise du traitement pour certains cas (asymptomatiques et FEVG > 40 %).
Les inhibiteurs de tyrosine kinase (sunitinib, sorafénib) et les anticorps monoclonaux dirigés contre le vascular endothelial growth factor (VEGF) circulant ou les récepteurs anti-VEGF (anti-angiogéniques) peuvent aussi entraîner une IC ou une dysfonction systolique du VG. La fréquence reste faible, avec cependant un odds ratio de 1,35 comparativement à une population ne recevant pas de bévacizumab.Chez des patients ayant un cancer rénal, 13 % traités par sunitinib ont eu un épisode d’IC considéré comme sévère dans 3 % des cas ; ce taux est de 4 % sous sorafénib (dont 1 % de formes jugées graves). 6 Leur toxicité principale est l’HTA (jusqu’à 50%).
Les inhibiteurs du protéasome (carfilzomib, bortézomib) bloquent la prolifération cellulaire, entraînent une apoptose à l’origine de l’effet carcinologique, notamment dans le myélome multiple : sous carfilzomib, 7 % des sujets peuvent faire une dysfonction systolique du VG, 1,5 % un arrêt cardiaque et 0,8 % un infarctus du myocarde. Cette toxicité ne semble pas liée à la dose cumulée, elle est le plus souvent réversible à l’arrêt de la chimiothérapie et sensible à un traitement par IEC et bêtabloquant.1
Les nouvelles immunothérapies, prescrites dans le mélanome ou le cancer pulmonaire, mais gagnant de plus en plus d’indications, ont des effets indésirables potentiels, notamment auto-immuns : myosites, uvéites, thyroïdites, colites parfois sévères. La principale complication cardiaque est la myocardite, aiguë dont l’incidence est faible : 0,19 % selon la littérature (ensemble des phases 3), 0,27 % dans les bases de pharmacovigilance de l’industrie pharmaceutique et plutot de l’ordre de 1 % selon les registres récents. Deux unités de cardio-oncologie (à Paris, hôpital Saint-Antoine, et à Marseille) ayant colligé 30 cas de toxicité liée à une immunothérapie, en ont identifié les principales caractéristiques.4
Les myocardites aiguës surviennent en général dans les 3 premiers mois d’administration et peuvent se manifester de façon atypique ; elles peuvent évoluer rapidement vers le choc cardiogénique et le décès dans 25 à 50 % des cas.4 Le diagnostic repose sur une identification précoce des patients par le dosage de la troponine, une échographie et une IRM cardiaques (un rehaussement tardif épicardique étant évocateur ; mais absent dans 50 % des cas). La prise en charge est urgente : bolus de corticoïdes fortes doses et, dans les formes fulminantes avec choc, assistance circulatoire.4
HTA : complication fréquente
Chez les patients atteints de cancer, la prévalence de l’HTA varie de 4 à 61 % (tableau 2 ).1 Les molécules le plus souvent incriminées sont les anti-VEGF (bévacizumab, sunitinib, sorafénib) et les inhibiteurs du protéasome (carfilzomib, bortézomib).1
Les anti-VEGF entraînent une diminution du taux circulant de monoxyde d’azote, une vasoconstriction périphérique par augmentation de concentration sanguine d’endothéline, une élévation des résistances vasculaires périphériques et une raréfaction capillaire. L’HTA s’installe en général précocement, dès le début du traitement, y compris chez des patients jeunes sans facteur de risque CV préalable.
Autres complications : insuffisance rénale et/ou micro- angiopathie thrombotique, protéinurie.
Le diagnostic est fondé, comme dans la prise en charge conventionnelle hors oncologie, sur une PA systolique > 140 mmHg ou diastolique > 90 mmHg lors de 3 mesures consécutives.1 La prise en charge de ces HTA induites n’a pas de spécificité particulière hormis la nécessité de porter attention aux interactions médicamenteuses, en évitant notamment les inhibiteurs du cytochrome P450 (diltiazem et vérapamil).1
Les anti-VEGF entraînent une diminution du taux circulant de monoxyde d’azote, une vasoconstriction périphérique par augmentation de concentration sanguine d’endothéline, une élévation des résistances vasculaires périphériques et une raréfaction capillaire. L’HTA s’installe en général précocement, dès le début du traitement, y compris chez des patients jeunes sans facteur de risque CV préalable.
Autres complications : insuffisance rénale et/ou micro- angiopathie thrombotique, protéinurie.
Le diagnostic est fondé, comme dans la prise en charge conventionnelle hors oncologie, sur une PA systolique > 140 mmHg ou diastolique > 90 mmHg lors de 3 mesures consécutives.1 La prise en charge de ces HTA induites n’a pas de spécificité particulière hormis la nécessité de porter attention aux interactions médicamenteuses, en évitant notamment les inhibiteurs du cytochrome P450 (diltiazem et vérapamil).1
Comment organiser la prise en charge ?
L’âge médian des sujets traités pour un cancer ayant augmenté, l’exposition au traitement potentiellement toxique s’ajoute aux facteurs de risque CV standard dont la prévalence est plus importante dans cette population. Ainsi, le risque d’événements CV peut parfois être plus important que celui de récidive tumorale et atténuant ainsi le bénéfice global attendu à long terme.
Il est donc capital d’organiser spécifiquement le suivi de ces patients.5 Des programmes de surveillance ont ainsi été établis à partir de diverses recommandations,2 même si leur niveau de preuve reste faible.6 Ils doivent être intégrés au parcours de soins des patients dès l’annonce du diagnostic de cancer, et se poursuivre à long terme même après guérison.
Il est donc capital d’organiser spécifiquement le suivi de ces patients.5 Des programmes de surveillance ont ainsi été établis à partir de diverses recommandations,2 même si leur niveau de preuve reste faible.6 Ils doivent être intégrés au parcours de soins des patients dès l’annonce du diagnostic de cancer, et se poursuivre à long terme même après guérison.
Identifier les sujets à risque CV
Récemment, les sociétés savantes européennes et américaines de cardiologie et d’oncologie ont souligné l’importance d’identifier les patients à risque de complications CV dès le diagnostic de cancer. Ce risque dépend tout d’abord du caractère toxique du traitement envisagé mais également de leurs antécédents. Par exemple, l’HTA est la comorbidité la plus fréquente chez les sujets atteints de cancer et peut contribuer à l’apparition d’une IC.7 La probabilité d’avoir une IC sous anthracyclines et trastuzumab est significativement plus élevée en cas d’âge avancé, préexistence d’une artériopathie périphérique ou coronaire, d’un diabète ou d’une HTA.
Ainsi, le risque CV basal doit systématiquement, avant tout traitement, faire l’objet d’une évaluation clinique, d’un ECG, d’une estimation du DFG, d’une mesure du cholestérol sérique, des triglycérides et de la glycémie (fig. 1 ). On peut utiliser certains scores validés comme le HeartScore (https://bit.ly/2R5sn14). Le dépistage d’une protéinurie s’impose lorsque la prescription d’anti-angiogéniques est envisagée.5
Selon les recommandations américaines,6 les schémas thérapeutiques les plus à risque sont :
– de fortes doses d’anthracyclines (> 250 mg/m2 d’équivalent doxorubicine) ou de radiothérapie thoracique (> 30 Gy) ;
– association anthracyclines + radiothérapie thoracique, quelle que soit la dose ;
– anthracyclines + trastuzumab ;
– de faibles doses d’anthracyclines ou trastuzumab associées à au moins 1 des éléments suivants : plus de 2 facteurs de risque CV (tabac, diabète, HTA, dyslipidémie, obésité), âge > 60 ans, cardiopathie sous-jacente.
D’après les guidelines européennes,1c’est le jugement clinique global du médecin qui prime. Cette démarche paraît plus adaptée car elle englobe les nouvelles molécules potentiellement cardiotoxiques, comme certains inhibiteurs des tyrosine kinases, du protéasome, les immunothérapies ou les anti- androgènes. De plus, des toxicités sous faibles doses d’anthracyclines ont été décrites en raison d’une susceptibilité génétique variant d’une personne à l’autre.
Lorsqu’un patient est considéré à risque à l’issue de cette première étape,2 il doit être adressé à un cardiologue pour une évaluation CV plus complète, qui sert ensuite de référence lors du suivi sous traitement. Si possible, il est donc préférable que ce soit le même praticien qui revoie le patient à chaque contrôle. La fonction cardiaque devrait toujours être mesurée de la même façon. Enfin, en amont de la thérapie anticancéreuse, l’optimisation de la prise en charge des facteurs de risque et des comorbidités CV est cruciale.
Ainsi, le risque CV basal doit systématiquement, avant tout traitement, faire l’objet d’une évaluation clinique, d’un ECG, d’une estimation du DFG, d’une mesure du cholestérol sérique, des triglycérides et de la glycémie (
Selon les recommandations américaines,6 les schémas thérapeutiques les plus à risque sont :
– de fortes doses d’anthracyclines (> 250 mg/m2 d’équivalent doxorubicine) ou de radiothérapie thoracique (> 30 Gy) ;
– association anthracyclines + radiothérapie thoracique, quelle que soit la dose ;
– anthracyclines + trastuzumab ;
– de faibles doses d’anthracyclines ou trastuzumab associées à au moins 1 des éléments suivants : plus de 2 facteurs de risque CV (tabac, diabète, HTA, dyslipidémie, obésité), âge > 60 ans, cardiopathie sous-jacente.
D’après les guidelines européennes,1c’est le jugement clinique global du médecin qui prime. Cette démarche paraît plus adaptée car elle englobe les nouvelles molécules potentiellement cardiotoxiques, comme certains inhibiteurs des tyrosine kinases, du protéasome, les immunothérapies ou les anti- androgènes. De plus, des toxicités sous faibles doses d’anthracyclines ont été décrites en raison d’une susceptibilité génétique variant d’une personne à l’autre.
Lorsqu’un patient est considéré à risque à l’issue de cette première étape,2 il doit être adressé à un cardiologue pour une évaluation CV plus complète, qui sert ensuite de référence lors du suivi sous traitement. Si possible, il est donc préférable que ce soit le même praticien qui revoie le patient à chaque contrôle. La fonction cardiaque devrait toujours être mesurée de la même façon. Enfin, en amont de la thérapie anticancéreuse, l’optimisation de la prise en charge des facteurs de risque et des comorbidités CV est cruciale.
Quel suivi sous traitement ?
Il est essentiellement défini pour les patients recevant des anthracyclines, certaines thérapies ciblées ou une radiothérapie thoracique, d’autant plus qu’ils ont un risque CV de base augmenté.
Quelle que soit la thérapie anticancéreuse, la surveillance ne doit pas se restreindre à la seule mesure régulière de la fraction d’éjection du ventricule gauche, comme cela a été fait pendant longtemps, car c’est un paramètre tardif de toxicité. En effet, le suivi nécessite une évaluation CV globale régulière au cours des consultations de cardio(onco)logie, soit au minimum : interrogatoire, examen physique, ECG, échographie cardiaque. De plus, mesurer des biomarqueurs cardiaques lors de l’administration de certaines thérapies aurait un intérêt.
Ainsi, doser la troponine avant l’instauration et après chaque injection d’anthracyclines, voire de trastuzumab, si coadministré, est utile pour dépister précocement une toxicité myocardique. En effet, son élévation sous traitement prédirait la baisse future de la FEVG et la survenue d’événements CV. Cette stratégie figure dans les recommandations même si les modalités (type de troponine, moment du prélèvement) restent à préciser.1 Néanmoins, il est important que les mesures soient toujours effectuées par le même laboratoire pour être comparables. En cas d’augmentation des taux, une surveillance rapprochée et un agent cardioprotecteur (IEC, bêtabloquants) peuvent être indiqués.
Au cours des consultations de suivi, il est crucial d’optimiser le traitement des comorbidités et d’encourager une bonne hygiène de vie incluant si possible l’activité physique (fig. 2 ). En cas de suspicion de toxicité, la prise en charge doit être précoce, et une discussion entre oncologues et cardiologues doit déterminer la pertinence de la poursuite ou non de l’anticancéreux. Certains centres commencent à disposer d’équipes de cardio-oncologie dédiées, ce qui facilite le suivi des patients, à partir de protocoles standardisés.5 Par exemple, l’équipe marseille les a mis à disposition pour les médecins, via le site gratuit gmedico.fr.
Quelle que soit la thérapie anticancéreuse, la surveillance ne doit pas se restreindre à la seule mesure régulière de la fraction d’éjection du ventricule gauche, comme cela a été fait pendant longtemps, car c’est un paramètre tardif de toxicité. En effet, le suivi nécessite une évaluation CV globale régulière au cours des consultations de cardio(onco)logie, soit au minimum : interrogatoire, examen physique, ECG, échographie cardiaque. De plus, mesurer des biomarqueurs cardiaques lors de l’administration de certaines thérapies aurait un intérêt.
Ainsi, doser la troponine avant l’instauration et après chaque injection d’anthracyclines, voire de trastuzumab, si coadministré, est utile pour dépister précocement une toxicité myocardique. En effet, son élévation sous traitement prédirait la baisse future de la FEVG et la survenue d’événements CV. Cette stratégie figure dans les recommandations même si les modalités (type de troponine, moment du prélèvement) restent à préciser.1 Néanmoins, il est important que les mesures soient toujours effectuées par le même laboratoire pour être comparables. En cas d’augmentation des taux, une surveillance rapprochée et un agent cardioprotecteur (IEC, bêtabloquants) peuvent être indiqués.
Au cours des consultations de suivi, il est crucial d’optimiser le traitement des comorbidités et d’encourager une bonne hygiène de vie incluant si possible l’activité physique (
Quelle surveillance après ?
Le nombre de patients ayant survécu à un cancer est en constante augmentation. En outre, leur risque d’événements CV est accru car ils ont été exposés au traitement oncologique de façon prolongée.
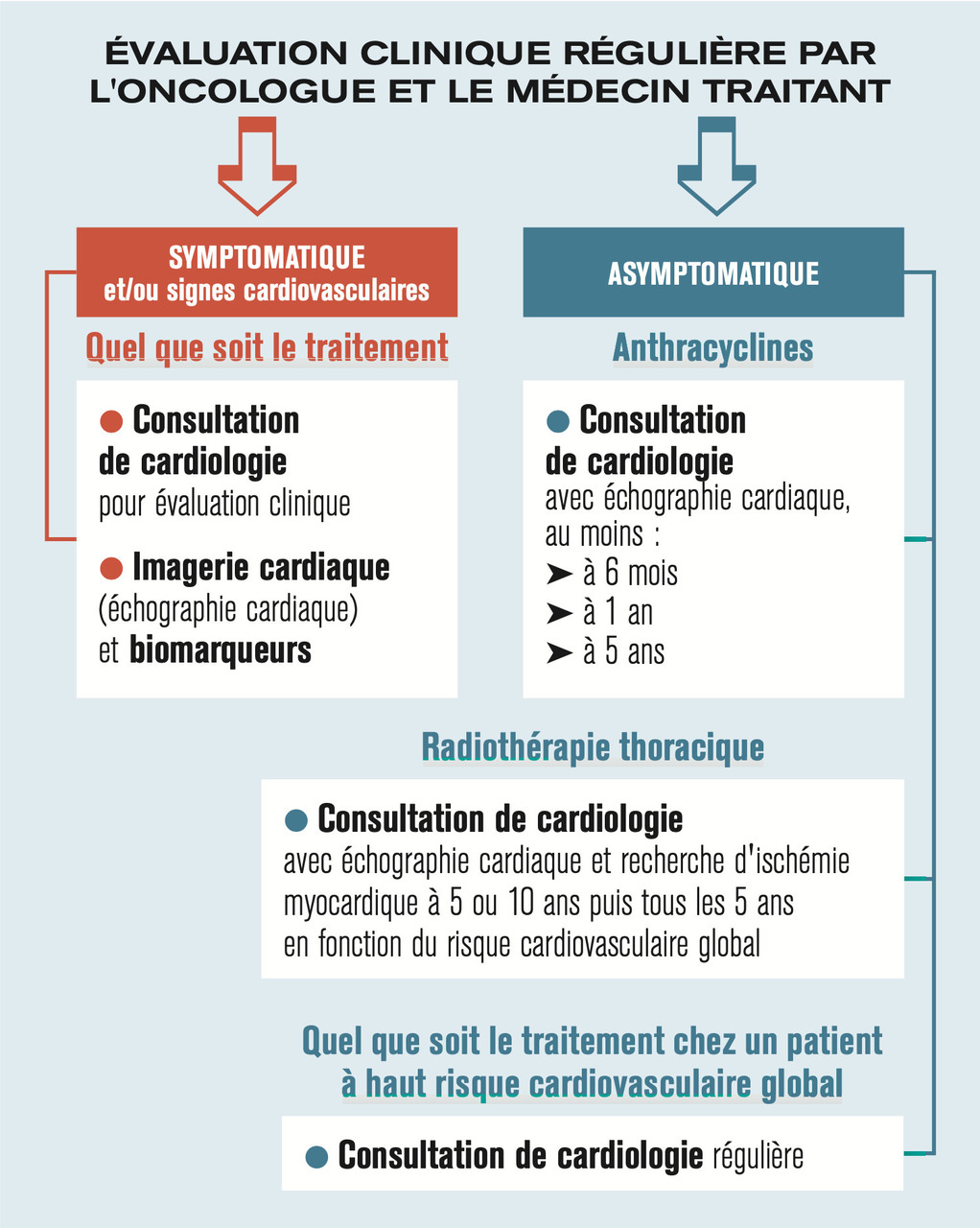
Ce dernier devrait donc être considéré comme un facteur de risque CV supplémentaire, au même titre que l’HTA ou le diabète.8 Ainsi, ces sujets doivent être suivis par leur médecin traitant et leur cardiologue en parallèle du suivi oncologique. Si cette surveillance est surtout précisée pour les patients asymptomatiques ayant bénéficié d’anthracyclines et/ou d’une radiothérapie thoracique (fig. 3 ), il est évident que toute apparition de symptômes et/ou de signes CV doit conduire à une consultation spécialisée quel que soit le traitement préalablement reçu.
Ce dernier devrait donc être considéré comme un facteur de risque CV supplémentaire, au même titre que l’HTA ou le diabète.8 Ainsi, ces sujets doivent être suivis par leur médecin traitant et leur cardiologue en parallèle du suivi oncologique. Si cette surveillance est surtout précisée pour les patients asymptomatiques ayant bénéficié d’anthracyclines et/ou d’une radiothérapie thoracique (
Pour en savoir plus
1. Zamorano JL, Lancellotti P, Rodriguez Muñoz D, et al.; Authors/Task Force Members; ESC Committee for Practice Guidelines (CPG). 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016;37:2768-801.
2. Curigliano G, Lenihan D, Fradley M. Management of Cardiac Disease in Cancer Patients Throughout Oncological Treatment: ESMO Consensus Recommendations. Ann Oncol 2020;31:171-90. 3. Kamai T, Tokura Y, Uematsu T, et al. Elevated serum levels of cardiovascular biomarkers are associated with progression of renal cancer. Open Heart 018;5:e000666.
3. Lotrionte M, Biondi-Zoccai G, Abbate A, et al. Review and meta-analysis of incidence and clinical predictors of anthracycline cardiotoxicity. Am J Cardiol 2013;112:1980-4.
4. Escudier M, Cautela J, Malissen N, et al. Clinical features, management, and outcomes of immune checkpoint inhibitor-related cardiotoxicity. Circulation 2017;136:2085-7.
5. Cautela J, Lalevee N, Ammar C, et al. Management and research in cancer treatment-related cardiovascular toxicity: Challenges and perspectives. Int J Cardiol 2016;224:366-75.
6. Armenian SH, Lacchetti C, Barac A, et al. Prevention and monitoring of cardiac dysfunction in survivors of adult cancers: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol 2017:35:893-911
7. Witteles RM, Bosch X. Myocardial protection during cardiotoxic chemotherapy. Circulation 2015;132:1835-45.
8. Armstrong GT, Oeffinger KC, Chen Y, et al. Modifiable risk factors and major cardiac events among adult survivors of childhood cancer. J Clin Oncol 2013;31:3673-80.
– Ederhy S, et al. Toxicité cardiaque et vasculaire des chimiothérapies. Anthracyclines et trastuzumab premiers responsables. Rev Prat 2018; 68:326-9.
– Thuny F, Cautela J. Toxicité cardiaque et vasculaire des chimiothérapies. Anthracyclines et trastuzumab premiers responsables. Comment organiser la prise en charge cardiovasculaire des patients cancéreux ? Le traitement anticancéreux, un facteur de risque cardiovasculaire supplémentaire. Rev Prat 2018;68:332-5.
2. Curigliano G, Lenihan D, Fradley M. Management of Cardiac Disease in Cancer Patients Throughout Oncological Treatment: ESMO Consensus Recommendations. Ann Oncol 2020;31:171-90. 3. Kamai T, Tokura Y, Uematsu T, et al. Elevated serum levels of cardiovascular biomarkers are associated with progression of renal cancer. Open Heart 018;5:e000666.
3. Lotrionte M, Biondi-Zoccai G, Abbate A, et al. Review and meta-analysis of incidence and clinical predictors of anthracycline cardiotoxicity. Am J Cardiol 2013;112:1980-4.
4. Escudier M, Cautela J, Malissen N, et al. Clinical features, management, and outcomes of immune checkpoint inhibitor-related cardiotoxicity. Circulation 2017;136:2085-7.
5. Cautela J, Lalevee N, Ammar C, et al. Management and research in cancer treatment-related cardiovascular toxicity: Challenges and perspectives. Int J Cardiol 2016;224:366-75.
6. Armenian SH, Lacchetti C, Barac A, et al. Prevention and monitoring of cardiac dysfunction in survivors of adult cancers: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol 2017:35:893-911
7. Witteles RM, Bosch X. Myocardial protection during cardiotoxic chemotherapy. Circulation 2015;132:1835-45.
8. Armstrong GT, Oeffinger KC, Chen Y, et al. Modifiable risk factors and major cardiac events among adult survivors of childhood cancer. J Clin Oncol 2013;31:3673-80.
– Ederhy S, et al. Toxicité cardiaque et vasculaire des chimiothérapies. Anthracyclines et trastuzumab premiers responsables. Rev Prat 2018; 68:326-9.
– Thuny F, Cautela J. Toxicité cardiaque et vasculaire des chimiothérapies. Anthracyclines et trastuzumab premiers responsables. Comment organiser la prise en charge cardiovasculaire des patients cancéreux ? Le traitement anticancéreux, un facteur de risque cardiovasculaire supplémentaire. Rev Prat 2018;68:332-5.