La pénurie de greffons et les effets indésirables des traitements immunosuppresseurs orientent notamment les recherches vers l’ingénierie tissulaire.
Le 3 décembre 1967, le Groote Schuur Hospital du Cap (Afrique du Sud) devenait mondialement célèbre : son chirurgien cardiaque, le Pr Christiaan Barnard, réalisait la première transplantation cardiaque humaine. L’histoire a oublié que, seulement trois jours plus tard, à New York, le Dr Adrian Kantrowitz procédait à la première transplantation cardiaque pédiatrique en implantant le cœur d’un nouveau-né anencéphale chez un nouveau-né de 19 jours porteur d’une anomalie d’Ebstein (malformation de la valve tricuspide). L’enfant ne survécut que quelques heures.
Un engouement planétaire suivit, chaque équipe chirurgicale cherchant à réaliser « sa » transplantation cardiaque. Devant la médiocrité des résultats, la plupart des centres renoncèrent rapidement. La transplantation cardiaque, en particulier chez l’enfant, ne devint une véritable possibilité thérapeutique qu’au début des années 1980, après la découverte de la ciclosporine.
Où en sommes-nous ?
Malgré de notables progrès, certains obstacles doivent encore être surmontés.
Un taux de survie global meilleur que chez l’adulte
La grande majorité des transplantations cardiaques réalisées dans le monde sont compilées dans un registre tenu par l’International Society for Heart and Lung Transplantation.1 Sont considérées comme pédiatriques les transplantations effectuées chez des receveurs de moins de 17 ans.
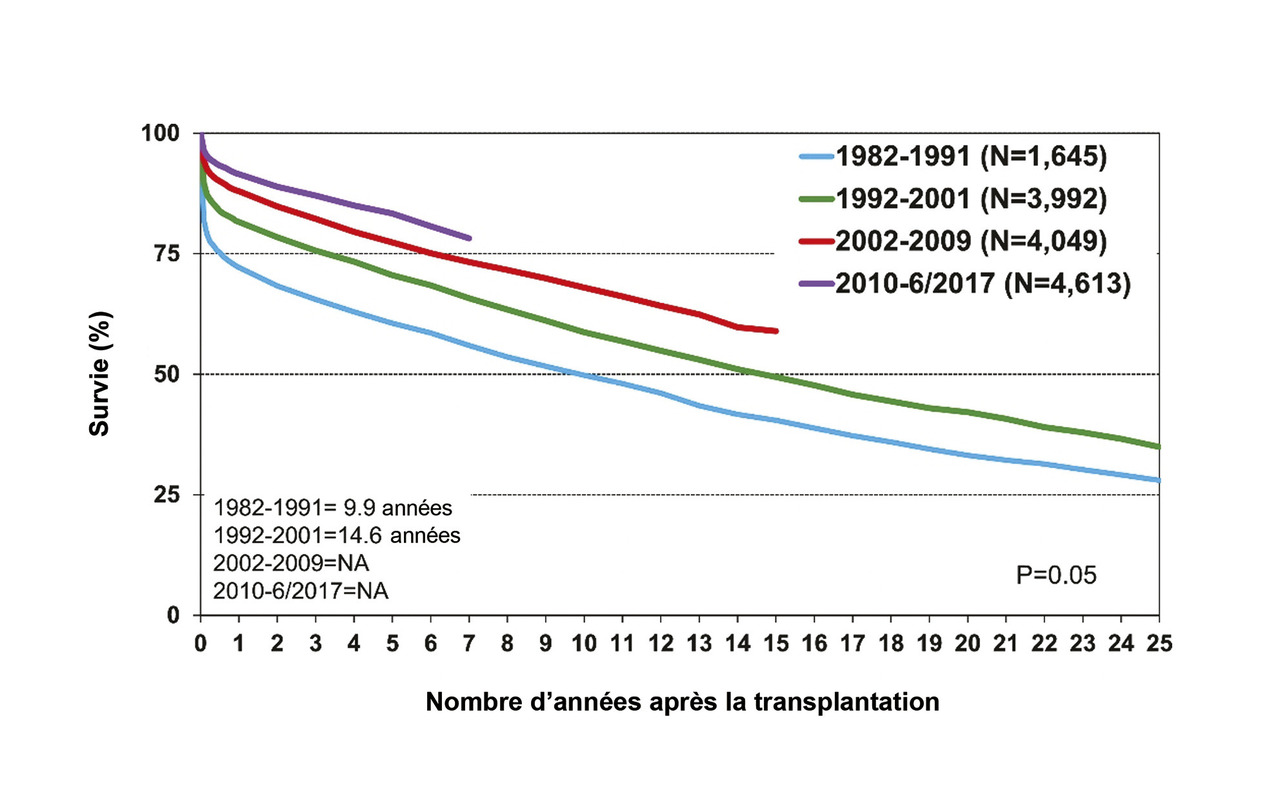
Chaque année, 4 000 à 4 500 transplantations cardiaques sont pratiquées, dont 10 % chez des enfants. Près de la moitié des receveurs pédiatriques sont des nourrissons de moins de 1 an. Les indications varient avec l’âge ; les malformations congénitales constituent l’indication principale chez les nourrissons (57 %) et les myocardiopathies chez les enfants plus âgés. Le taux de survie est globalement meilleur que chez les adultes. La médiane de survie est de dix-huit ans (variant de 24,5 ans pour les nourrissons à 14,3 ans pour les enfants de 11 à 17 ans). La mortalité est maximale durant la première année qui suit la transplantation. Par exemple, 60 % des nourrissons transplantés qui survivent au-delà de la première année sont vivants vingt-cinq ans plus tard. La mortalité initiale a progressivement diminué avec le temps.
Deux problèmes persistent
Malgré ces résultats encourageants, la transplantation cardiaque pédiatrique rencontre deux problèmes persistants.
La morbimortalité tardive reste élevée
La mortalité initiale a beaucoup reculé avec le temps, mais la mortalité tardive reste identique, produisant des courbes de survie pratiquement parallèles (
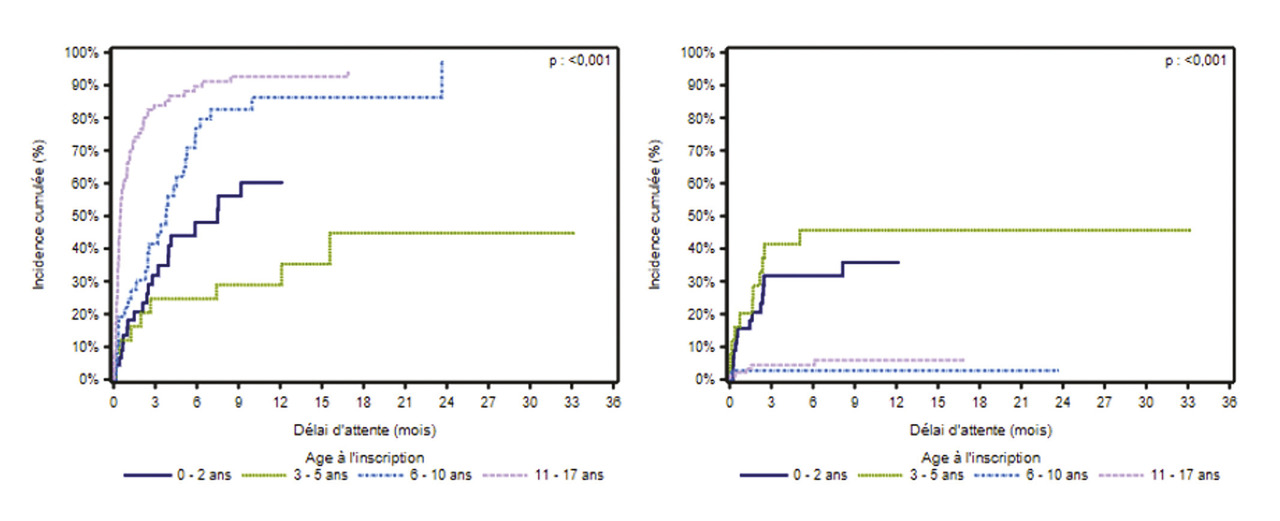
La pénurie de greffons pénalise surtout les plus petits
Selon les données françaises de l’Agence de la biomédecine, parmi 201 enfants inscrits sur la liste d’attente entre 2014 et 2019, les enfants de plus de 5 ans ont presque tous été transplantés, et ont pour la majorité survécu, tandis que les enfants plus jeunes (moins de 5 ans) ont subi une mortalité élevée avant de pouvoir être transplantés (
Quelles perspectives ?
Pour faire de la transplantation cardiaque pédiatrique une véritable alternative thérapeutique, il faudrait à la fois résoudre le problème de la pénurie de greffons et améliorer notablement la survie à long terme.
La solution « évidente » à ce problème est l’évolution vers un cœur artificiel implantable. Chez l’adulte, des progrès récents et constants permettent d’envisager une telle éventualité. Il n’en est pas de même chez l’enfant, car les obstacles technologiques (miniaturisation) et économiques (marché réduit) ne laissent pas entrevoir cette possibilité, du moins à moyen terme. Pour le futur, la transplantation cardiaque pédiatrique s’oriente donc vers deux directions.
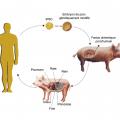
La xénotransplantation n’est pas abandonnée
L’idée n’est pas récente. Dans les années 1960, plusieurs transplantations hépatiques et rénales ont été réalisées en utilisant des organes de chimpanzé. En 1984, Leonard L. Bailey, à Loma Linda (Californie), transplantait un cœur de babouin à un nouveau-né atteint d’hypoplasie du cœur gauche. L’enfant survécu vingt et un jours sans rejet cellulaire décelable. Le programme prévu prit fin devant les protestations éthiques liées à l’utilisation de primates.
Les travaux de recherche se sont cependant poursuivis, centrés sur la transplantation porc-homme et orientés dans trois directions4 :
– les progrès fulgurants des manipulations génétiques ont permis de produire des porcs génétiquement modifiés chez lesquels soit des gènes sont inactivés (knock-out), soit des gènes permettant la production de protéines humaines sont transférés (trangenèse). Ces manipulations permettent de combattre les réactions immunitaires d’origine humorale ;
– de nouvelles drogues immunosuppressives et la mise au point de nouvelles techniques (blocage de la costimulation par anticorps monoclonaux) permettent de combattre de façon très efficace les réactions d’immunité cellulaire ;
– le risque de transmission de maladies liées aux rétrovirus endogènes du porc paraît faible et, surtout, peut être supprimé par une manipulation génétique spécifique.
Ainsi, des survies prolongées sans rejet sévère ont été obtenues après transplantation de cœur de porc chez le babouin, ouvrant la voie à de potentiels essais cliniques chez l’homme.5 Il est probable que des programmes de xénotransplantation débuteront à court terme, dans quelques années, peut-être même quelques mois.*
Une indication privilégiée
La transplantation cardiaque chez le nouveau-né porteur d’hypoplasie du cœur gauche est une cible privilégiée.6 Il s’agit d’une malformation cardiaque fréquente pour laquelle le traitement actuel (intervention de Norwood en période néonatale [qui permet notamment de lever l’obstacle à l’éjection du ventricule gauche], puis procédure de Fontan [dérivation cavopulmonaire]) est très peu satisfaisant à terme. La pénurie extrême de greffons à cet âge rend la possibilité de transplantation cardiaque humaine plus théorique que pratique. Par ailleurs, le nouveau-né est vraisemblablement un receveur immunologiquement privilégié. En effet :
– les anticorps naturels anti-porc sont absents en période néonatale ;
– la thymectomie néonatale diminue l’immunité cellulaire ;
– une éventuelle transplantation thymique associée soulève l’espoir d’induire une véritable tolérance immunitaire.
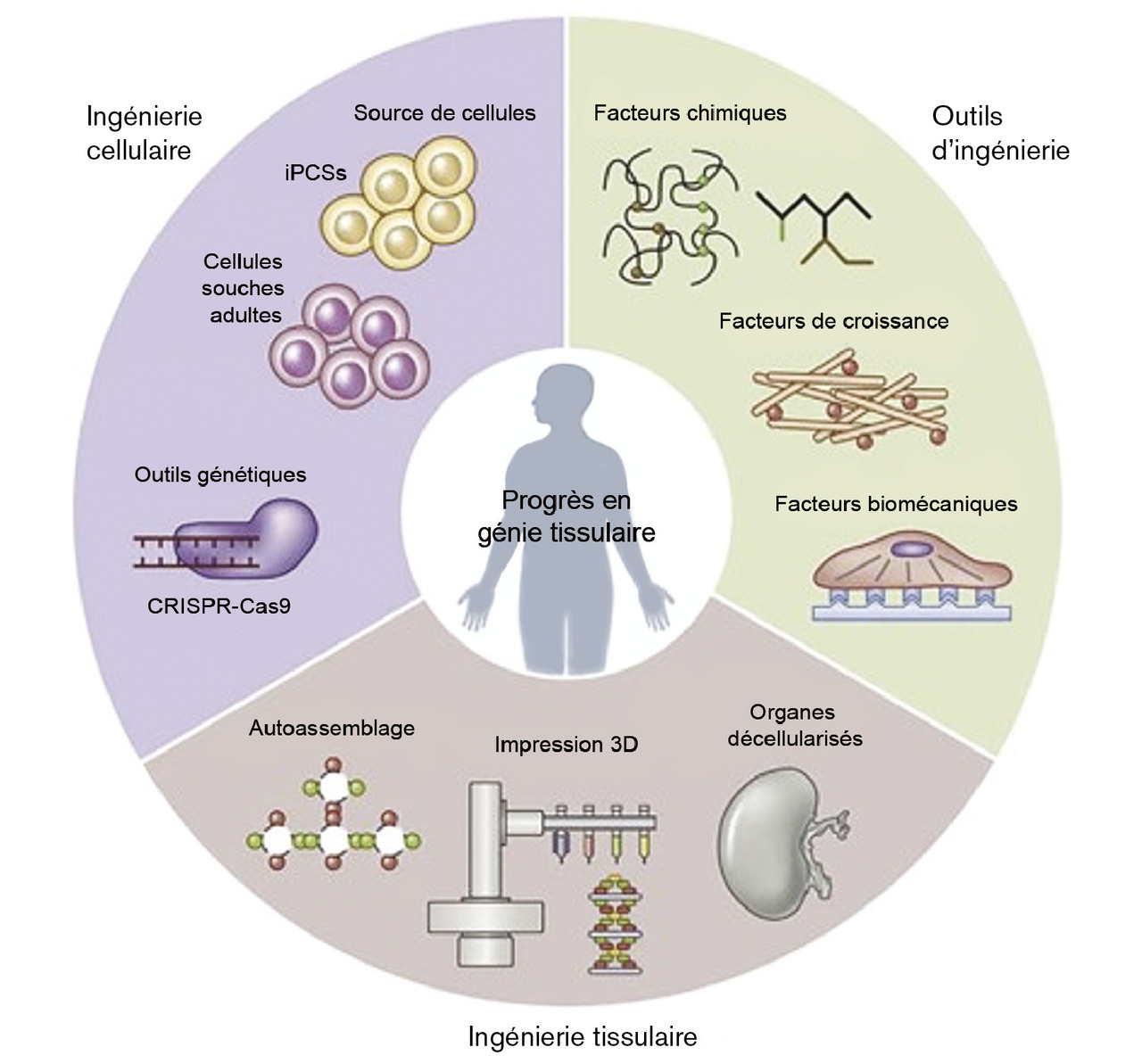
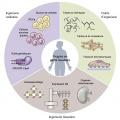
L’ingénierie tissulaire progresse
Les principes généraux de l’ingénierie tissulaire sont simples :
– préparer une « matrice » ;
– ensemencer la matrice avec des cellules souches ou pluripotentes provenant du receveur potentiel ;
– promouvoir le développement cellulaire en contrôlant les facteurs physiques et chimiques d’une croissance cellulaire dirigée ;
– obtenir un tissu, un organoïde ou un organe qui peut être implanté chez le donneur de cellules, sans risque de rejet7 (
De constants progrès sont obtenus dans les différentes phases de ce processus. D’ores et déjà, dans le domaine cardiovasculaire, du péricarde, des vaisseaux sanguins, des valves cardiaques, des patchs myocardiques et, récemment, des cavités ventriculaires fonctionnelles, ont été créés. La création d’un cœur complet, avec ses différentes lignées cellulaires, reste un idéal, mais ne semble pas totalement hors d’atteinte.8 Cette avancée extraordinaire permettrait de résoudre à la fois le problème de la pénurie d’organes et celui des inconvénients du traitement immunosuppresseur.
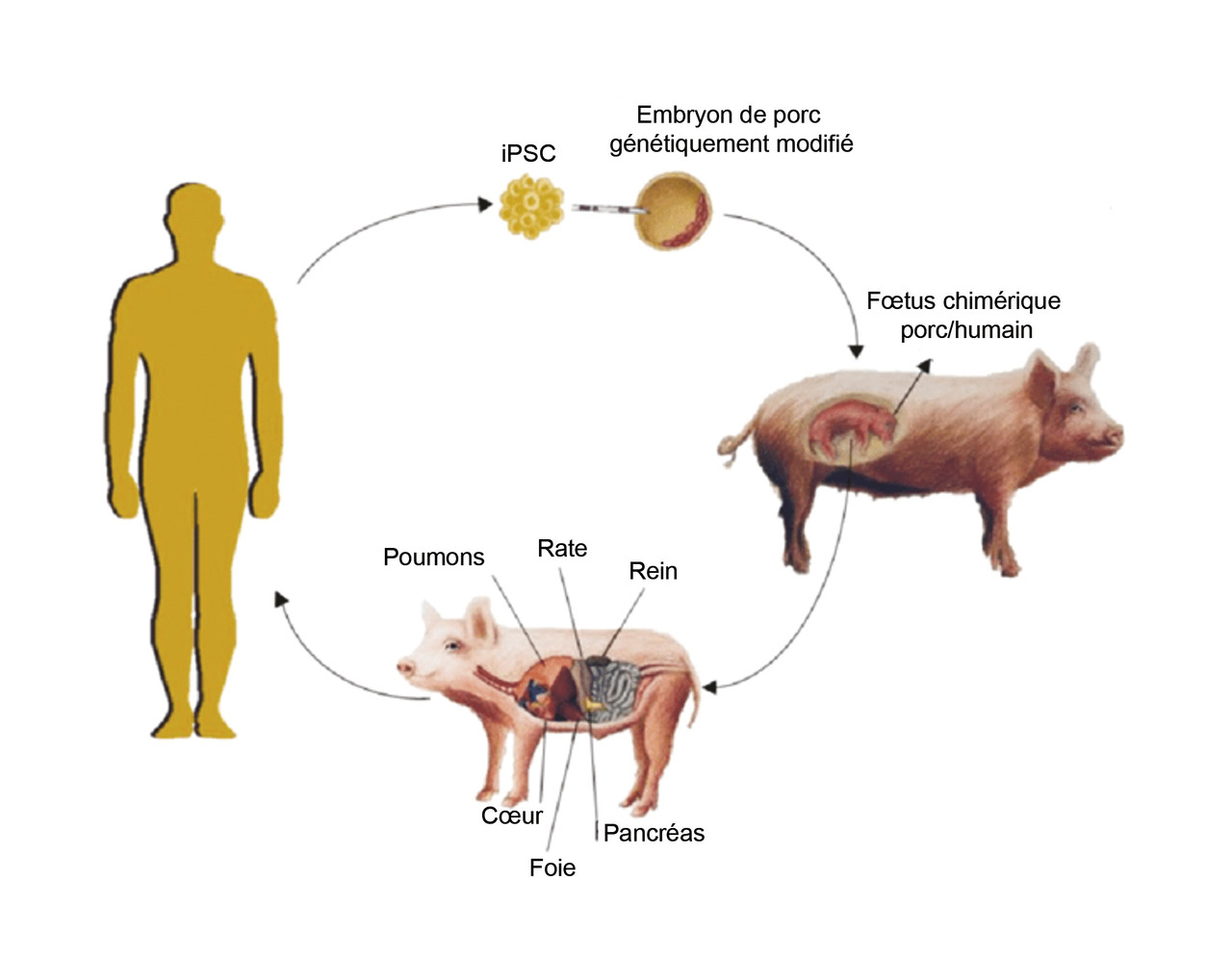
Une autre voie paraît encore plus utopique : la complémentation blastocytaire9 (
De la chirurgie à la médecine régénérative
La transplantation cardiaque pédiatrique, comme les autres transplantations, a évolué en plusieurs étapes.10 Après une phase principalement chirurgicale, durant laquelle les techniques opératoires ont été développées (permettant, en particulier, la transplantation cardiaque dans toutes les situations anatomiques, liées aux malformations congénitales les plus complexes), une phase essentiellement immunologique s’est installée au début des années 1980. Commence actuellement une troisième phase de médecine régénérative, dont la xénotransplantation marque le début. Le développement de l’ingénierie tissulaire laisse entrevoir des possibilités insoupçonnées.
N’oublions pas ce que disait dès 1982 Thomas Starzl, pionnier de la transplantation hépatique : « History tells us that procedures that were inconceivable yesterday, and are barely achievable today, often become routine tomorrow »
* NDLR : L’université du Maryland (Etats-Unis) a annoncé le 10 janvier 2022 avoir réalisé la première greffe de cœur transgénique porcin chez un humain.
1. Rossano JW, Singh TP, Cherikh WS, Chambers DC, Harhay MO, Hayes D Jr, et al. The international thoracic organ transplant registry of the International Society for Heart and Lung Transplantation: twenty-second pediatric heart transplantation report – 2019 ; Focus theme: Donor and recipient size match. J Heart Lung Transplant 2019;38:1028-41.
2. Agence de la biomédecine. Greffe cardiaque pédiatrique [en ligne]. 2020. Disponible sur : https://rams.agence-biomedecine.fr/greffe-cardiaque-pediatrique (tableau PedC3).
3. Almond CSD, Thiagarajan RR, Piercey GE, Gauvreau K, Blume ED, Bastardi HJ, et al. Waiting list mortality among children listed for heart transplantation in the United States. Circulation 2009;119:717-27.
4. Lu T, Yang B, Wang R, Qin C. Xenotransplantation : current status in preclinical research. Front Immunol 2020;10:3060.
5. Längin M, Mayr T, Reichart B, Michel S, Buchholz S, Guethoff S, et al. Consistent success in life-supporting porcine cardiac xenotransplantation. Nature 2018;564:430-3.
6. Cleveland D, Banks CA, Hara H, Carlo WS, Mauchley DC, Cooper DKC. The case for cardiac xenotransplantation in neonates: is now the time to reconsider xenotransplantation for hypoplastic left heart syndrome ? Pediatr Cardiol 2019;40:437-44.
7. Khademhosseini A, Langer R. A decade of progress in tissue engineering. Nat Protoc 2016;11:1775-81.
8. Taylor DA, Parikh RB, Sampaio LC. Bioengineering hearts: simple yet complex. Curr Stem Cell Rep 2017;3:35-44.
9. Crane AT, Aravalli RN, Asakura A, Grande AW, Krishna VD, Carlson DF, et al. Interspecies organogenesis for human transplantation. Cell Transplant 2019;28:1091-105.
10. Orlando G, Murphy SV, Bussolati B, Clancy M, Cravedi P, Migliaccio G, et al. Rethinking regenerative medicine from a transplant perspective (and vice versa). Transplantation 2019;103:237-49.