Pneumologie. La transplantation pulmonaire offre désormais aux patients atteints d’une insuffisance respiratoire chronique très évoluée une réelle espérance de vie proche de la normale, au prix toutefois d’un engagement personnel conséquent et d’un risque de complications encore non négligeable.
Depuis 1983, date de la première transplantation pulmonaire réussie,1 plus de 60 000 greffes pulmonaires ont été réalisées à travers le monde et plus de 4 000 sont effectuées chaque année, comme le rapporte le registre de l’International Society for Heart and Lung Transplantation (ISHLT).2 La situation de la transplantation pulmonaire s’est transformée au fil des années tant en termes de nombre de greffes, de durée d’attente qu’en termes de techniques chirurgicales, de conditions de prélèvements des donneurs, de prise en charge médicale immédiate et à long terme. Ces évolutions s’accompagnent d’une amélioration notable de la survie post-greffe, faisant de la transplantation pulmonaire un traitement reconnu et fondé de toute insuffisance respiratoire chronique non neuromusculaire lorsque le pronostic vital est engagé. L’évaluation par une équipe de greffe fait maintenant partie des recommandations de prise en charge de nombreuses pathologies respiratoires, notamment la bronchopneumopathie chronique obstructive (BPCO) et la fibrose pulmonaire.
Principes et évolution
Les principes fondateurs restent d’actualité, à savoir :
– apporter une solution thérapeutique à un patient atteint d’insuffisance respiratoire chronique sans autre perspective thérapeutique si la mortalité attendue excède 50 % à 2 ans ;
– améliorer la survie ; cela suppose d’intervenir au bon moment de l’histoire de l’insuffisance respiratoire et d’écarter les patients ayant une comorbidité engageant le pronostic vital à court ou moyen terme, ou dont le comportement ne permet pas d’envisager une observance étroite des traitements et de la surveillance de la « maladie chronique » que constitue la greffe ;
– améliorer la qualité de vie après la greffe.
Ces principes avaient conduit initialement à une sélection drastique des candidats. Mais de profonds changements sont intervenus dans l’offre de greffons pulmonaires, notamment en France dans les 10 dernières années :
– une augmentation majeure du nombre de poumons proposés aux équipes de greffe pulmonaire (152 propositions en 2003 à près de 650 en 2016),3 fruit du travail conjoint des équipes de réanimation qui accueillent les donneurs potentiels et de l’Agence de la biomédecine ;
– un élargissement des critères d’acceptabilité des greffons par les équipes de transplantation, amenant à ne plus se limiter aux seuls donneurs dits « idéaux », mais à prélever des donneurs dits « à critères élargis » ;
– la priorisation de l’attribution des greffons en fonction de la gravité des receveurs en attente. Aux États-Unis depuis 2005, le lung allocation score (score LAS) donne un ordre de priorité fondé sur une estimation du risque de décès avant et après la transplantation. En France, il n’y a pas de score d’attribution, mais depuis juillet 2007 le système de priorité nationale dit de « super-urgence » permet un accès prioritaire aux patients à risque de décès imminent répondant à des critères définis ;
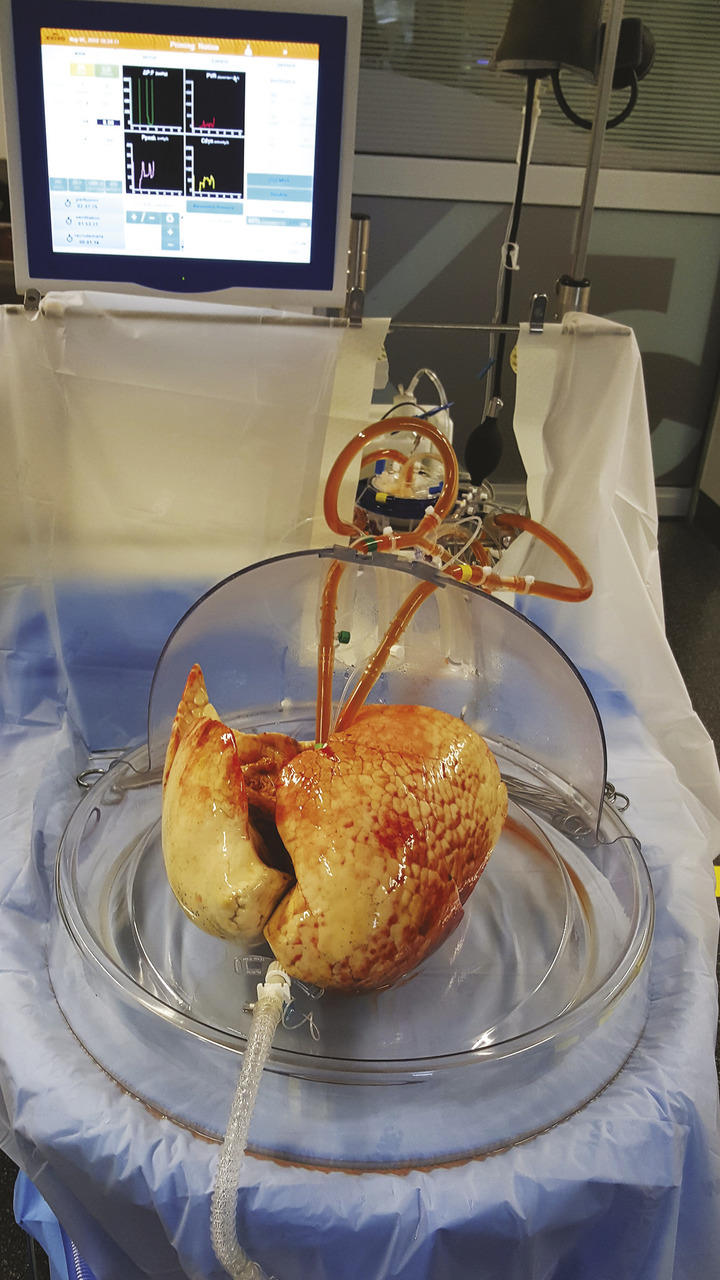
– le recours à une machine de perfusion4 permet d’objectiver la qualité de greffons pulmonaires proposés et d’utiliser des poumons qui auraient été refusés sans cela (v. figure). L’utilisation de cette technique a permis dans notre centre d’augmenter le nombre de greffes réalisées de 20 % avec des résultats identiques à ceux obtenus avec les greffons conventionnels ;5
– le recours à des donneurs en arrêt cardiaque (classe III de la classification de Maastricht)6 devrait apporter en France un incrément de 10 à 15 % de greffes pulmonaires, à l’instar de ce qui est observé dans d’autres pays.7
Le résultat global est une forte progression du nombre annuel de transplantations pulmonaires en France (76 en 2003 à 371 en 2016),3 avec comme corollaire une diminution de la durée médiane d’attente sur liste (11,2 mois en 1999-2002, moins de 3 mois en 2015-2016) et une diminution des deux tiers du nombre des décès sur liste d’attente.
– apporter une solution thérapeutique à un patient atteint d’insuffisance respiratoire chronique sans autre perspective thérapeutique si la mortalité attendue excède 50 % à 2 ans ;
– améliorer la survie ; cela suppose d’intervenir au bon moment de l’histoire de l’insuffisance respiratoire et d’écarter les patients ayant une comorbidité engageant le pronostic vital à court ou moyen terme, ou dont le comportement ne permet pas d’envisager une observance étroite des traitements et de la surveillance de la « maladie chronique » que constitue la greffe ;
– améliorer la qualité de vie après la greffe.
Ces principes avaient conduit initialement à une sélection drastique des candidats. Mais de profonds changements sont intervenus dans l’offre de greffons pulmonaires, notamment en France dans les 10 dernières années :
– une augmentation majeure du nombre de poumons proposés aux équipes de greffe pulmonaire (152 propositions en 2003 à près de 650 en 2016),3 fruit du travail conjoint des équipes de réanimation qui accueillent les donneurs potentiels et de l’Agence de la biomédecine ;
– un élargissement des critères d’acceptabilité des greffons par les équipes de transplantation, amenant à ne plus se limiter aux seuls donneurs dits « idéaux », mais à prélever des donneurs dits « à critères élargis » ;
– la priorisation de l’attribution des greffons en fonction de la gravité des receveurs en attente. Aux États-Unis depuis 2005, le lung allocation score (score LAS) donne un ordre de priorité fondé sur une estimation du risque de décès avant et après la transplantation. En France, il n’y a pas de score d’attribution, mais depuis juillet 2007 le système de priorité nationale dit de « super-urgence » permet un accès prioritaire aux patients à risque de décès imminent répondant à des critères définis ;
– le recours à une machine de perfusion4 permet d’objectiver la qualité de greffons pulmonaires proposés et d’utiliser des poumons qui auraient été refusés sans cela (v. figure). L’utilisation de cette technique a permis dans notre centre d’augmenter le nombre de greffes réalisées de 20 % avec des résultats identiques à ceux obtenus avec les greffons conventionnels ;5
– le recours à des donneurs en arrêt cardiaque (classe III de la classification de Maastricht)6 devrait apporter en France un incrément de 10 à 15 % de greffes pulmonaires, à l’instar de ce qui est observé dans d’autres pays.7
Le résultat global est une forte progression du nombre annuel de transplantations pulmonaires en France (76 en 2003 à 371 en 2016),3 avec comme corollaire une diminution de la durée médiane d’attente sur liste (11,2 mois en 1999-2002, moins de 3 mois en 2015-2016) et une diminution des deux tiers du nombre des décès sur liste d’attente.
Limites et indications
L’augmentation d’activité a permis, en améliorant l’expérience des équipes de transplantation, d’élargir les indications et de repousser les limites des contre-indications.
Les principales contre-indications (tableau 1) sont fondées sur le principe que le receveur ne doit pas avoir d’autre pathologie exposant à un risque vital supérieur à 20 % à 5 ans.8 Ainsi, les infections par le virus de l’immunodéficience humaine (VIH), les virus des hépatites B et C (VHB et VHC) ne sont plus des contre-indications absolues grâce aux nouveaux traitements. Les antécédents de cancer dans les 5 dernières années doivent faire l’objet d’une concertation avec les oncologues pour évaluer le risque de rechute avant d’écarter les patients de la greffe.
L’âge limite des candidats est le critère qui a le plus évolué. Aux États-Unis, la proportion de receveurs transplantés après 65 ans est passée de 7 % en 2003 à presque 30 % en 2016.2 En France, l’évolution est plus lente, mais les patients transplantés après 65 ans représentent 7 % des greffés pulmonaires en 2016.3 De fait, la mucoviscidose qui était longtemps la première cause de greffe pulmonaire en France est repassée en deuxième position après l’emphysème.3
Si les critères positifs et négatifs d’éligibilité d’un candidat à la trans- plantation se sont simplifiés au fil du temps, la décision procède toujours d’une analyse au cas par cas et reste très emprunte de l’expérience de chaque équipe de transplantation.
Les critères par pathologie recommandant une évaluation par une équipe de transplantation, dans les principales indications, sont résumés dans le tableau 2 et sont l’objet d’un consensus de l’International Society for Heart and Lung Trans- plantation (ISHLT).8 Des recommandations pour l’inscription sur la liste ont aussi été émises mais nécessitent d’être aménagées au cas par cas car ils dépendent aussi des particularités du candidat (groupe sanguin, taille, immunisation anti-HLA [human leucocyte antigen]…) et du délai d’attente moyen de l’équipe d’accueil.
Les principales contre-indications (tableau 1) sont fondées sur le principe que le receveur ne doit pas avoir d’autre pathologie exposant à un risque vital supérieur à 20 % à 5 ans.8 Ainsi, les infections par le virus de l’immunodéficience humaine (VIH), les virus des hépatites B et C (VHB et VHC) ne sont plus des contre-indications absolues grâce aux nouveaux traitements. Les antécédents de cancer dans les 5 dernières années doivent faire l’objet d’une concertation avec les oncologues pour évaluer le risque de rechute avant d’écarter les patients de la greffe.
L’âge limite des candidats est le critère qui a le plus évolué. Aux États-Unis, la proportion de receveurs transplantés après 65 ans est passée de 7 % en 2003 à presque 30 % en 2016.2 En France, l’évolution est plus lente, mais les patients transplantés après 65 ans représentent 7 % des greffés pulmonaires en 2016.3 De fait, la mucoviscidose qui était longtemps la première cause de greffe pulmonaire en France est repassée en deuxième position après l’emphysème.3
Si les critères positifs et négatifs d’éligibilité d’un candidat à la trans- plantation se sont simplifiés au fil du temps, la décision procède toujours d’une analyse au cas par cas et reste très emprunte de l’expérience de chaque équipe de transplantation.
Les critères par pathologie recommandant une évaluation par une équipe de transplantation, dans les principales indications, sont résumés dans le tableau 2 et sont l’objet d’un consensus de l’International Society for Heart and Lung Trans- plantation (ISHLT).8 Des recommandations pour l’inscription sur la liste ont aussi été émises mais nécessitent d’être aménagées au cas par cas car ils dépendent aussi des particularités du candidat (groupe sanguin, taille, immunisation anti-HLA [human leucocyte antigen]…) et du délai d’attente moyen de l’équipe d’accueil.
Résultats
La survie actuarielle post-transplantation pulmonaire s’est significativement améliorée depuis les années 1990 et s’élève actuellement à 84 et 57 % à 1 et 5 ans dans le registre inter- national pour les patients transplantés entre 2009 et 2015.2 Les résultats français sont un peu moindres (77 et 56 % de survie à 1 et 5 ans), mais représentent par rapport au début des années 1990 une amélioration majeure de la survie (54 et 31 % à 1 et 5 ans à l’époque).3 Cette amélioration est d’autant plus remarquable que la transplantation s’adresse actuel- lement à une population plus âgée, aux facteurs de comorbidité plus nombreux et, surtout, offre, par la super-urgence, une accessibilité aux patients en situation instable, qui peuvent bénéficier in extremis d’une priorité d’accès. Néanmoins, le pronostic de la transplantation pulmonaire reste toujours inférieur à celui des autres transplantations d’organes solides (cœur ou foie), laissant un vaste champ possible d’amélioration.
La survie varie selon la maladie causale : la mucoviscidose est associée aux meilleurs résultats de survie (63 et 48 % à 5 et 10 ans), devant l’emphysème (54 et 28 %) et la fibrose pulmonaire (50 et 26 %),2 situation similaire en France.3 La question centrale du bénéfice réel de survie que prodigue la transplantation a longtemps été débattue et a fait l’objet de controverses.9, 10 Une analyse récente, fondée sur une méthodologie statistique plus rigoureuse et s’appuyant sur les données américaines depuis l’application du score LAS, montre que ce bénéfice de survie est réel pour toutes les causes, d’importance variable pour chacune d’elles et que ce bénéfice est d’autant plus important et précoce que la valeur du LAS est élevée au moment de la transplantation.11
La transplantation pulmonaire procure également une amélioration spectaculaire de la qualité de vie des patients.12 Cette amélioration est précoce, significative dès les premiers mois et se poursuit dans le temps. Cette amélioration des indices de qualité de vie et de satisfaction des patients vient conforter l’amélioration du potentiel fonctionnel (résultats de spirométrie, de test de marche et d’effort) et permettre aux greffés pulmonaires de retrouver une vie proche de la « normale » : retour à une vie familiale, sociale plus équilibrée, reprise d’une activité professionnelle ou d’un cycle d’études… Elle peut s’altérer à nouveau après plusieurs années, notamment en cas de dysfonction chronique du greffon.13
La survie varie selon la maladie causale : la mucoviscidose est associée aux meilleurs résultats de survie (63 et 48 % à 5 et 10 ans), devant l’emphysème (54 et 28 %) et la fibrose pulmonaire (50 et 26 %),2 situation similaire en France.3 La question centrale du bénéfice réel de survie que prodigue la transplantation a longtemps été débattue et a fait l’objet de controverses.9, 10 Une analyse récente, fondée sur une méthodologie statistique plus rigoureuse et s’appuyant sur les données américaines depuis l’application du score LAS, montre que ce bénéfice de survie est réel pour toutes les causes, d’importance variable pour chacune d’elles et que ce bénéfice est d’autant plus important et précoce que la valeur du LAS est élevée au moment de la transplantation.11
La transplantation pulmonaire procure également une amélioration spectaculaire de la qualité de vie des patients.12 Cette amélioration est précoce, significative dès les premiers mois et se poursuit dans le temps. Cette amélioration des indices de qualité de vie et de satisfaction des patients vient conforter l’amélioration du potentiel fonctionnel (résultats de spirométrie, de test de marche et d’effort) et permettre aux greffés pulmonaires de retrouver une vie proche de la « normale » : retour à une vie familiale, sociale plus équilibrée, reprise d’une activité professionnelle ou d’un cycle d’études… Elle peut s’altérer à nouveau après plusieurs années, notamment en cas de dysfonction chronique du greffon.13
Contraintes et complications
Si la transplantation pulmonaire permet aux patients de revivre et d’envisager des projets d’avenir, l’acte de greffe, en apportant un organe allogénique reconnu comme tel par le système immunitaire du receveur, met en place les conditions d’une maladie chronique : un traitement immunosuppresseur à vie pour contrôler le risque permanent de rejet de la greffe. Ce traitement impose une surveillance ininterrompue de son efficacité, de l’adaptation des doses et de ses toxicités potentielles ou établies. C’est insister sur le rôle actif et décisif du patient lui-même dans la gestion de la transplantation en assurant la surveillance de l’efficacité du traitement (appareil portable de mesure de sa fonction respiratoire quotidienne), le repérage des événements indésirables et leur signalement précoce tout en poursuivant une activité physique et en reprenant une vie normale. Cette charge, qui incombe au patient greffé, est un des éléments majeurs d’information à transmettre lors de la période de préparation à la greffe. Elle justifie un accompagnement tout au long du suivi post-greffe par l’ensemble de l’équipe de transplantation (médecins mais aussi coordinatrices, psychologues, assistante sociale…).
En effet, les complications liées directement à la greffe, à l’immuno- dépression et à la toxicité propre des immunosuppresseurs sont potentiellement nombreuses, très variées. Elles imposent souvent un suivi conjoint par d’autres spécialistes (néphrologues, dermatologues, diabétologues...). En pratique, on distingue les complications en rapport avec l’acte chirurgical de transplantation, survenant plutôt dans les premières semaines, des complications immunologiques (pouvant survenir à tout moment) et des complications générales plus tardives.
En effet, les complications liées directement à la greffe, à l’immuno- dépression et à la toxicité propre des immunosuppresseurs sont potentiellement nombreuses, très variées. Elles imposent souvent un suivi conjoint par d’autres spécialistes (néphrologues, dermatologues, diabétologues...). En pratique, on distingue les complications en rapport avec l’acte chirurgical de transplantation, survenant plutôt dans les premières semaines, des complications immunologiques (pouvant survenir à tout moment) et des complications générales plus tardives.
Complications précoces
La défaillance primaire du greffon, dont la définition consensuelle internationale14 a été précisée récemment,15 est la conséquence de l’ischémie-reperfusion inhérente au prélèvement que peuvent aggraver les conditions opératoires et l’inadéquation donneur-receveur. Sa forme sévère (grade III) survient chez 10 % des transplantés et constitue un facteur de risque majeur de mortalité précoce et de survenue de dysfonction chronique du greffon. Le risque de mortalité de cette complication a nettement diminué depuis le recours précoce aux techniques d’oxygénation membranaire extracorporelle (« ECMO » des Anglo-Saxons).16
L’ischémie bronchique est inhérente à la transplantation pulmonaire car l’acte chirurgical interrompt la circulation artérielle bronchique. Des complications cliniquement patentes justifiant de soins adaptés surviennent chez environ 10 % des transplantés.17, 18 Il s’agit initialement de déhiscence anastomotique qui cicatrise le plus souvent spontanément mais parfois source de fistules bronchiques ou de sténoses anastomotiques cicatricielles. Des sténoses bronchiques plus distales sont aussi possibles, imposant des bronchoscopies interventionnelles volontiers répétées et la mise en place de prothèses bronchiques. Rarement, des sténoses bronchiques étendues non appareillables peuvent conduire à une réapparition précoce de l’insuffisance respiratoire.
Les complications infectieuses précoces sont nettement plus fréquentes après transplantation pulmonaire qu’après les autres transplantations d’organes et sont responsables d’environ 20 % des décès du premier mois2 et d’une forte morbidité. Cela est dû à l’immunosuppression induite, mais surtout à des facteurs propres au poumon : relation directe avec l’environnement extérieur, perte des défenses intrinsèques bronchiques du fait de l’ischémie, de la dénervation et de l’interruption du drainage lymphatique, auxquels s’ajoutent les risques associés à la ventilation assistée et/ou le risque d’inhalation par reflux gastro-œsophagien. Les infections bronchiques et parenchymateuses sont surtout bactériennes et justifient un traitement antibiotique préventif post- opératoire adapté. Les infections mycotiques, aspergillaires notamment, sont favorisées par l’ischémie, voire la nécrose anastomotique et imposent une surveillance étroite ainsi que l’instauration précoce d’un traitement adapté. La pneumocystose et les infections virales par l’herpèsvirus ou le cytomégalovirus font l’objet de traitements préventifs efficaces mais potentiellement toxiques.
L’ischémie bronchique est inhérente à la transplantation pulmonaire car l’acte chirurgical interrompt la circulation artérielle bronchique. Des complications cliniquement patentes justifiant de soins adaptés surviennent chez environ 10 % des transplantés.17, 18 Il s’agit initialement de déhiscence anastomotique qui cicatrise le plus souvent spontanément mais parfois source de fistules bronchiques ou de sténoses anastomotiques cicatricielles. Des sténoses bronchiques plus distales sont aussi possibles, imposant des bronchoscopies interventionnelles volontiers répétées et la mise en place de prothèses bronchiques. Rarement, des sténoses bronchiques étendues non appareillables peuvent conduire à une réapparition précoce de l’insuffisance respiratoire.
Les complications infectieuses précoces sont nettement plus fréquentes après transplantation pulmonaire qu’après les autres transplantations d’organes et sont responsables d’environ 20 % des décès du premier mois2 et d’une forte morbidité. Cela est dû à l’immunosuppression induite, mais surtout à des facteurs propres au poumon : relation directe avec l’environnement extérieur, perte des défenses intrinsèques bronchiques du fait de l’ischémie, de la dénervation et de l’interruption du drainage lymphatique, auxquels s’ajoutent les risques associés à la ventilation assistée et/ou le risque d’inhalation par reflux gastro-œsophagien. Les infections bronchiques et parenchymateuses sont surtout bactériennes et justifient un traitement antibiotique préventif post- opératoire adapté. Les infections mycotiques, aspergillaires notamment, sont favorisées par l’ischémie, voire la nécrose anastomotique et imposent une surveillance étroite ainsi que l’instauration précoce d’un traitement adapté. La pneumocystose et les infections virales par l’herpèsvirus ou le cytomégalovirus font l’objet de traitements préventifs efficaces mais potentiellement toxiques.
Complications immunologiques
Complication inhérente à toute greffe d’organe allogénique, le rejet aigu cellulaire est plus fréquent dans la transplantation pulmonaire que lors des autres transplantations d’organes. Il survient chez 40-50 % des patients au cours de la première année malgré la triple immunosuppression associant anticalcineurines (tacrolimus plus souvent que ciclosporine), antimétabolites (mycophénolate mofétil plus souvent qu’azathioprine) et corticostéroïdes.2 Le rejet est contrôlé dans plus de 95 % des cas par le renforcement du traitement immunosuppresseur (bolus de méthylprednisolone). Malgré cela, il constitue, par sa survenue, sa récurrence ou sa persistance, un facteur essentiel de l’installation de la dysfonction chronique du greffon, alias CLAD (chronic lung allograft dysfunction) des Anglo-Saxons.19, 20
Une meilleure connaissance des mécanismes multiples du rejet a mis en évidence le rôle clé de l’immunité humorale. La mise au point de techniques ultrasensibles de détection en routine des anticorps dirigés contre les épitopes du système HLA du donneur (Luminex) et leur application en transplantation pulmonaire a généré de multiples travaux et permis d’établir un consensus international du diagnostic du rejet humoral.21 Ce rejet humoral survient chez 10-15 % des patients et constitue une menace vitale. Il impose un traitement spécifique associant le plus souvent plasmaphérèses, rituximab et perfusions itératives d’immunoglobulines polyvalentes. Il constitue un facteur majeur de perte du greffon et de survenue de dysfonction chronique du greffon.22 Ces effets délétères du rejet humoral ont incité à rechercher des indices prédictifs de sa survenue pour instituer un traitement préventif.23-25
La dysfonction chronique du greffon, après exclusion de toute autre cause de perte de fonction (sténoses bronchiques, infections…), reste l’écueil essentiel de la transplan- tation pulmonaire et seule la moitié des patients en sont indemnes 5 ans après la greffe. Plusieurs formes cliniques de cette dysfonction sont maintenant reconnues. Une forme est au moins partiellement réversible sous azithromycine et caractérisée par une infiltration à polynucléaires. En cas de perte fonctionnelle non réversible, deux types fonctionnels de dysfonction chronique du greffon sont distingués : le type obstructif, majoritaire (deux tiers des cas) correspondant au syndrome de bronchiolite oblitérante classique, et le type restrictif. Ce dernier dont témoignent des infiltrats parenchymateux rétractiles et des épaissis- sements sous-pleuraux en tomo- densitométrie est en général de survenue plus précoce et d’évolutivité plus rapide que la forme obstructive.26 Il serait plus souvent associé au rejet aigu humoral.22 Globalement, les traitements de la dysfonction chronique du greffon sont au mieux suspensifs, la retransplantation représentant souvent à terme l’option à discuter.
Une meilleure connaissance des mécanismes multiples du rejet a mis en évidence le rôle clé de l’immunité humorale. La mise au point de techniques ultrasensibles de détection en routine des anticorps dirigés contre les épitopes du système HLA du donneur (Luminex) et leur application en transplantation pulmonaire a généré de multiples travaux et permis d’établir un consensus international du diagnostic du rejet humoral.21 Ce rejet humoral survient chez 10-15 % des patients et constitue une menace vitale. Il impose un traitement spécifique associant le plus souvent plasmaphérèses, rituximab et perfusions itératives d’immunoglobulines polyvalentes. Il constitue un facteur majeur de perte du greffon et de survenue de dysfonction chronique du greffon.22 Ces effets délétères du rejet humoral ont incité à rechercher des indices prédictifs de sa survenue pour instituer un traitement préventif.23-25
La dysfonction chronique du greffon, après exclusion de toute autre cause de perte de fonction (sténoses bronchiques, infections…), reste l’écueil essentiel de la transplan- tation pulmonaire et seule la moitié des patients en sont indemnes 5 ans après la greffe. Plusieurs formes cliniques de cette dysfonction sont maintenant reconnues. Une forme est au moins partiellement réversible sous azithromycine et caractérisée par une infiltration à polynucléaires. En cas de perte fonctionnelle non réversible, deux types fonctionnels de dysfonction chronique du greffon sont distingués : le type obstructif, majoritaire (deux tiers des cas) correspondant au syndrome de bronchiolite oblitérante classique, et le type restrictif. Ce dernier dont témoignent des infiltrats parenchymateux rétractiles et des épaissis- sements sous-pleuraux en tomo- densitométrie est en général de survenue plus précoce et d’évolutivité plus rapide que la forme obstructive.26 Il serait plus souvent associé au rejet aigu humoral.22 Globalement, les traitements de la dysfonction chronique du greffon sont au mieux suspensifs, la retransplantation représentant souvent à terme l’option à discuter.
Complications générales
Conséquences de l’immunosuppression induite, les complications prolifératives sont particulièrement fréquentes,2 dominées par les cancers cutanés souvent tardifs et récidivants, les lymphoproliférations induites par le virus d’Epstein-Barr survenant dès les premiers mois et les cancers d’organes solides dont le risque relatif, selon les tumeurs, avoisine 1 à 5 en comparaison à la population générale.27
Les complications métaboliques (dyslipidémies, diabète) et vasculaires (hypertension artérielle), les complications rénales (dont la néphrotoxicité des anticalcineurines) amenant plus de 1 malade sur 10 à la dialyse ou la transplantation rénale après 10 ans de greffe pulmonaire,2 et les compli- cations iatrogènes des traitements immunosuppresseurs imposent un suivi pluridisciplinaire pour tenter de prévenir leur survenue et adapter précocement les thérapeutiques.
Les complications métaboliques (dyslipidémies, diabète) et vasculaires (hypertension artérielle), les complications rénales (dont la néphrotoxicité des anticalcineurines) amenant plus de 1 malade sur 10 à la dialyse ou la transplantation rénale après 10 ans de greffe pulmonaire,2 et les compli- cations iatrogènes des traitements immunosuppresseurs imposent un suivi pluridisciplinaire pour tenter de prévenir leur survenue et adapter précocement les thérapeutiques.
ATTEINDRE LES RÉSULTATS DES AUTRES GREFFES
La transplantation pulmonaire est désormais un traitement reconnu et efficace de l’insuffisance respiratoire chronique très évoluée grâce à l’amélioration substantielle de ses résultats, offrant ainsi aux patients dont la vie est menacée à court terme une réelle espérance de vie proche de la normale, au prix d’un engagement personnel conséquent. Cette amélioration est essentiellement liée aux progrès de la prise en charge périopératoire. Outre le perfectionnement des techniques périopératoires et la recherche de solutions alternatives à l’allogreffe, les efforts de recherche actuels se concentrent sur la prévention et la prise en charge de la dysfonction chronique du greffon et l’optimisation de l’immunosuppression, notamment antihumorale, dans le but à terme d’offrir aux transplantés pulmonaires des résultats similaires à ceux des autres greffes d’organes.
Références
1. Toronto Lung Transplant Group. Unilateral lung transplantation for pulmonary fibrosis. N Engl J Med 1986;314:1140-5.
2. Chambers DC, Yusen RD, Cherikh WS, et al.; International Society for Heart and Lung Transplantation. The Registry of the International Society for Heart and Lung Transplantation: thirty-fourth adult lung and heart-lung transplantation report - 2017; Focus theme: Allograft ischemic time. J Heart Lung Transplant 2017;36:1047-59.
3. Agence de la biomédecine. Le rapport médical et scientifique de l'Agence de la biomédecine 2016. Greffe cardio-pulmonaire et pulmonaire, 2016:1-49. www.agence-biomedecine.fr
4. Cypel M, Yeung JC, Liu M, et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. N Engl J Med 2011;364:1431-40.
5. Sage E, Mussot S, Trebbia G, et al. Lung transplantation from initially rejected donors after ex vivo lung reconditioning: the French experience. Eur J Cardio Thorac Surg 2014;46:794-9.
6. Thuong M, Ruiz A, Evrard P, et al. New classification of donation after circulatory death donors definitions and terminology. Transpl Int 2016;29:749-59.
7. Stern M, Sage E, Roux A. Transplantation pulmonaire et greffons de donneurs décédés après arrêt circulatoire. Courrier Transplant 2015;3:123-6.
8. Weill D, Benden C, Corris PA, et al. A consensus document for the selection of lung transplant candidates: 2014--an update from the Pulmonary Transplantation Council of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2015;34:1-15.
9. Hosenpud JD, Bennett LE, Keck BM, Edwards EB, Novick RJ. Effect of diagnosis on survival benefit of lung transplantation for end-stage lung disease. The Lancet 1998;351:24-7.
10. Liou TG, Adler FR, Cahill BC, et al. Survival effect of lung transplantation among patients with cystic fibrosis. JAMA 2001;286:2683-9.
11. Vock DM, Durheim MT, Tsuang WM, et al. Survival benefit of lung transplantation in the modern era of lung allocation. Ann Am Thorac Soc 2017;14:172-81.
12. Seiler A, Klaghofer R, Ture M, Komossa K, Martin-Soelch C, Jenewein J. A systematic review of health-related quality of life and psychological outcomes after lung transplantation. J Heart Lung Transplant 2016;35:195-202.
13. Singer JP, Katz PP, Soong A, et al. Effect of lung transplantation on health-related quality of life in the era of the lung allocation score: a U.S. Prospective Cohort Study. Am J Transplant 2017;17:1334-45.
14. Christie JD, Carby M, Bag R, Corris P, Hertz M, Weill D; ISHLT Working Group on Primary Lung Graft Dysfunction. Report of the ISHLT working group on primary lung graft dysfunction part II: definition. A consensus statement of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2005;24:1454-9.
15. Snell GI, Yusen RD, Weill D, et al. Report of the ISHLT working group on primary lung graft dysfunction, part I: Definition and grading – A 2016 Consensus Group statement of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2017;36:1097-103.
16. Van Raemdonck D, Hartwig MG, Hertz MI, et al. Report of the ISHLT working group on primary lung graft dysfunction Part IV: Prevention and treatment: A 2016 Consensus Group statement of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2017;36:1121-36.
17. Machuzak M, Santacruz JF, Gildea T, Murthy SC. Airway complications after lung transplantation. Thorac Surg Clin 2015;25:55-75.
18. Mahajan AK, Folch E, Khandhar SJ, et al. The diagnosis and management of airway complications following lung transplantation. Chest 2017;152:627-38.
19. Hopkins PM, Aboyoun CL, Chhajed PN, et al. Association of minimal rejection in lung transplant recipients with obliterative bronchiolitis. Am J Respir Crit Care Med 2004;170:1022-6.
20. Burton CM, Iversen M, Carlsen J, et al. Acute cellular rejection is a risk factor for bronchiolitis obliterans syndrome independent of post-transplant baseline FEV1. J Heart Lung Transplant 2009;28:888-93.
21. Levine DJ, Glanville AR, Aboyoun C, et al. Antibody-mediated rejection of the lung: A consensus report of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2016;35:397-406.
22. Roux A, Bendib Le Lan I, Holifanjaniaina S, et al.; Foch Lung Transplantation Group. Antibody-mediated rejection in lung transplantation: clinical outcomes and donor-specific antibody characteristics. Am J Transplant 2016;16:1216-28.
23. Tikkanen JM, Singer LG, Kim SJ, et al. De novo DQ donor-specific antibodies are associated with chronic lung allograft dysfunction after lung transplantation. Am J Respir Crit Care Med 2016;194:596-606.
24. Visentin J, Chartier A, Massara L, et al. Lung intragraft donor-specific antibodies as a risk factor for graft loss. J Heart Lung Transplant 2016;35:1418-26.
25. Roux A, Bendib Le Lan I, Holifanjaniaina S, et al. Characteristics of donor-specific antibodies associated with antibody-mediated rejection in lung transplantation. Front Med (Lausanne) 2017;4:155.
26. Verleden SE, Vos R, Vanaudenaerde BM, Verleden GM. Chronic lung allograft dysfunction phenotypes and treatment. J Thorac Dis 2017;9:2650-9.
27. Magruder JT, Crawford TC, Grimm JC, et al. Risk Factors for De Novo Malignancy Following Lung Transplantation. Am J Transplant 2017;17:227-38.
2. Chambers DC, Yusen RD, Cherikh WS, et al.; International Society for Heart and Lung Transplantation. The Registry of the International Society for Heart and Lung Transplantation: thirty-fourth adult lung and heart-lung transplantation report - 2017; Focus theme: Allograft ischemic time. J Heart Lung Transplant 2017;36:1047-59.
3. Agence de la biomédecine. Le rapport médical et scientifique de l'Agence de la biomédecine 2016. Greffe cardio-pulmonaire et pulmonaire, 2016:1-49. www.agence-biomedecine.fr
4. Cypel M, Yeung JC, Liu M, et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. N Engl J Med 2011;364:1431-40.
5. Sage E, Mussot S, Trebbia G, et al. Lung transplantation from initially rejected donors after ex vivo lung reconditioning: the French experience. Eur J Cardio Thorac Surg 2014;46:794-9.
6. Thuong M, Ruiz A, Evrard P, et al. New classification of donation after circulatory death donors definitions and terminology. Transpl Int 2016;29:749-59.
7. Stern M, Sage E, Roux A. Transplantation pulmonaire et greffons de donneurs décédés après arrêt circulatoire. Courrier Transplant 2015;3:123-6.
8. Weill D, Benden C, Corris PA, et al. A consensus document for the selection of lung transplant candidates: 2014--an update from the Pulmonary Transplantation Council of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2015;34:1-15.
9. Hosenpud JD, Bennett LE, Keck BM, Edwards EB, Novick RJ. Effect of diagnosis on survival benefit of lung transplantation for end-stage lung disease. The Lancet 1998;351:24-7.
10. Liou TG, Adler FR, Cahill BC, et al. Survival effect of lung transplantation among patients with cystic fibrosis. JAMA 2001;286:2683-9.
11. Vock DM, Durheim MT, Tsuang WM, et al. Survival benefit of lung transplantation in the modern era of lung allocation. Ann Am Thorac Soc 2017;14:172-81.
12. Seiler A, Klaghofer R, Ture M, Komossa K, Martin-Soelch C, Jenewein J. A systematic review of health-related quality of life and psychological outcomes after lung transplantation. J Heart Lung Transplant 2016;35:195-202.
13. Singer JP, Katz PP, Soong A, et al. Effect of lung transplantation on health-related quality of life in the era of the lung allocation score: a U.S. Prospective Cohort Study. Am J Transplant 2017;17:1334-45.
14. Christie JD, Carby M, Bag R, Corris P, Hertz M, Weill D; ISHLT Working Group on Primary Lung Graft Dysfunction. Report of the ISHLT working group on primary lung graft dysfunction part II: definition. A consensus statement of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2005;24:1454-9.
15. Snell GI, Yusen RD, Weill D, et al. Report of the ISHLT working group on primary lung graft dysfunction, part I: Definition and grading – A 2016 Consensus Group statement of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2017;36:1097-103.
16. Van Raemdonck D, Hartwig MG, Hertz MI, et al. Report of the ISHLT working group on primary lung graft dysfunction Part IV: Prevention and treatment: A 2016 Consensus Group statement of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2017;36:1121-36.
17. Machuzak M, Santacruz JF, Gildea T, Murthy SC. Airway complications after lung transplantation. Thorac Surg Clin 2015;25:55-75.
18. Mahajan AK, Folch E, Khandhar SJ, et al. The diagnosis and management of airway complications following lung transplantation. Chest 2017;152:627-38.
19. Hopkins PM, Aboyoun CL, Chhajed PN, et al. Association of minimal rejection in lung transplant recipients with obliterative bronchiolitis. Am J Respir Crit Care Med 2004;170:1022-6.
20. Burton CM, Iversen M, Carlsen J, et al. Acute cellular rejection is a risk factor for bronchiolitis obliterans syndrome independent of post-transplant baseline FEV1. J Heart Lung Transplant 2009;28:888-93.
21. Levine DJ, Glanville AR, Aboyoun C, et al. Antibody-mediated rejection of the lung: A consensus report of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2016;35:397-406.
22. Roux A, Bendib Le Lan I, Holifanjaniaina S, et al.; Foch Lung Transplantation Group. Antibody-mediated rejection in lung transplantation: clinical outcomes and donor-specific antibody characteristics. Am J Transplant 2016;16:1216-28.
23. Tikkanen JM, Singer LG, Kim SJ, et al. De novo DQ donor-specific antibodies are associated with chronic lung allograft dysfunction after lung transplantation. Am J Respir Crit Care Med 2016;194:596-606.
24. Visentin J, Chartier A, Massara L, et al. Lung intragraft donor-specific antibodies as a risk factor for graft loss. J Heart Lung Transplant 2016;35:1418-26.
25. Roux A, Bendib Le Lan I, Holifanjaniaina S, et al. Characteristics of donor-specific antibodies associated with antibody-mediated rejection in lung transplantation. Front Med (Lausanne) 2017;4:155.
26. Verleden SE, Vos R, Vanaudenaerde BM, Verleden GM. Chronic lung allograft dysfunction phenotypes and treatment. J Thorac Dis 2017;9:2650-9.
27. Magruder JT, Crawford TC, Grimm JC, et al. Risk Factors for De Novo Malignancy Following Lung Transplantation. Am J Transplant 2017;17:227-38.