La transplantation pulmonaire permet de prolonger la survie des patients ayant une pathologie respiratoire au stade terminal, tout en améliorant leur qualité de vie. La médiane de survie après transplantation pulmonaire est de six ans, limitée par des facteurs liés au greffon mais aussi au patient.1
Quelles indications ?
En 2019, plus de 4 500 transplantations pulmonaires ont été réalisées dans le monde, dont 384 en France,2 où il existe 11 centres de transplantation pulmonaire, dont 9 actifs et 2 dédiés au suivi.
De façon générale, une transplantation pulmonaire est envisagée quand le patient atteint d’une maladie respiratoire chronique a une espérance de vie estimée inférieure à 50 % à deux ans en l’absence de transplantation, et une espérance de vie estimée supérieure à 80 % à cinq ans avec un greffon fonctionnel.
Par ordre de fréquence, en 2022, les principales indications sont les pneumopathies interstitielles diffuses (PID), la bronchopneumopathie chronique obstructive (BPCO), l’hypertension artérielle pulmonaire (HTP) et la mucoviscidose. Cependant, toute pathologie pulmonaire au stade d’insuffisance respiratoire chronique malgré un traitement médical optimal peut faire discuter un projet de transplantation pulmonaire. Les principales indications, les critères pour orienter un patient vers un centre expert et les critères pour inscrire un patient sur liste d’attente sont résumés dans le tableau 1.3
La sélection des candidats à la transplantation pulmonaire est un processus complexe qui doit idéalement se dérouler sur une période prolongée : l’équipe soignante doit en effet cerner le profil psychologique et les attentes du patient, prendre en charge les contre-indications relatives (obésité, dénutrition, problèmes sociaux…) et le patient doit comprendre les risques et les contraintes liés à cette procédure.
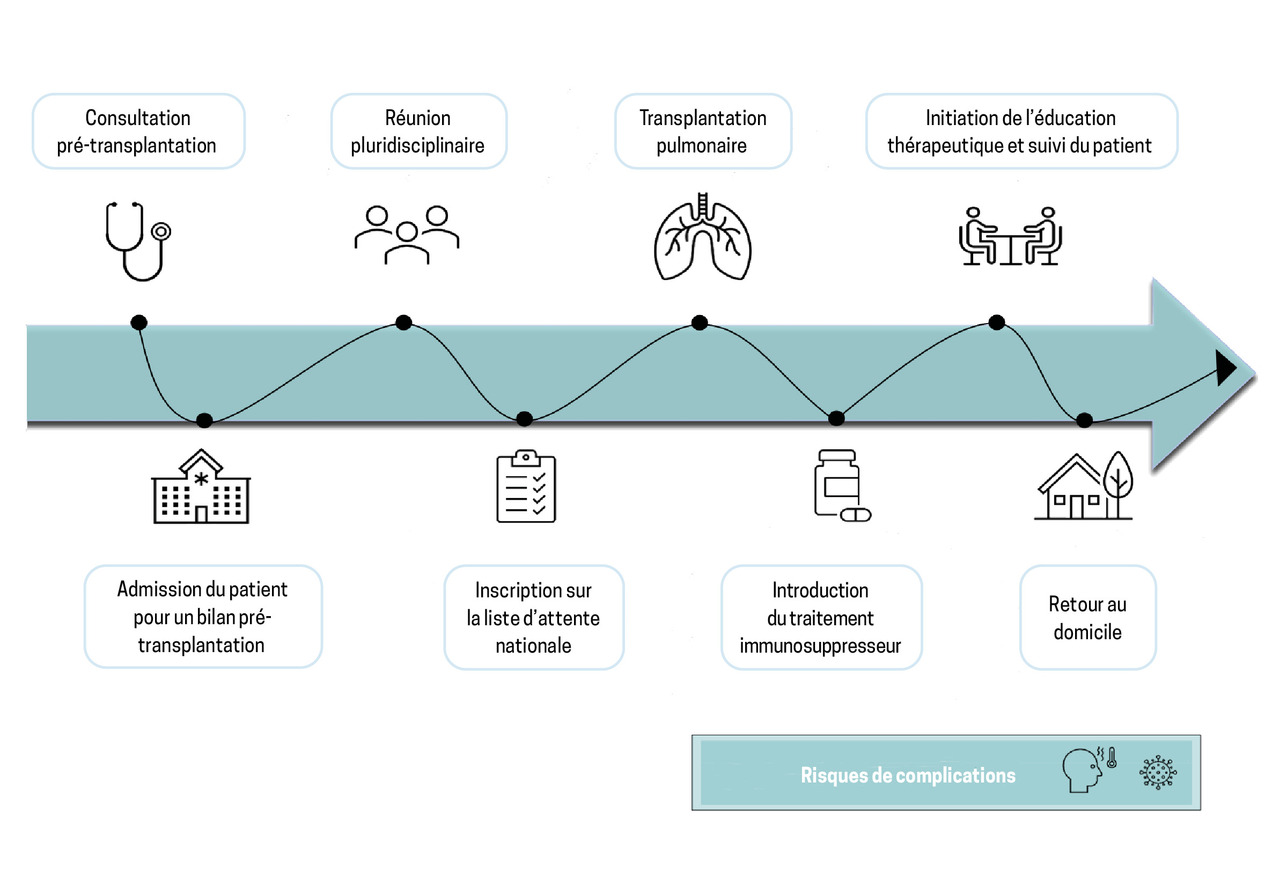
Les contre-indications absolues à la transplantation pulmonaire sont rappelées dans l’encadré.3 Le projet de transplantation pulmonaire (fig. 1) est un parcours complexe, nécessitant que les patients soient adressés à un centre de transplantation le plus tôt possible dès lors qu’ils répondent aux critères.
Déroulement de la transplantation pulmonaire
À l’issue du bilan pré-transplantation, le dossier du patient est discuté en réunion multidisciplinaire en présence des médecins, chirurgiens, anesthésistes et réanimateurs impliqués dans le programme de transplantation pulmonaire. La discussion peut conduire à une inscription sur la liste nationale d’attente, à des recommandations de prise en charge des comorbidités, à une poursuite de la surveillance en cas de gravité encore insuffisante, ou à un arrêt du projet en cas de contre-indication absolue à la transplantation pulmonaire.
Une fois inscrit sur la liste nationale d’attente, le patient doit maintenir un état général optimal pour arriver à la transplantation dans les meilleures conditions. La durée d’attente médiane est de 2,3 mois en France, et 82 % des candidats sont greffés dans les douze mois qui suivent leur inscription (d’après l’Agence de la biomédecine). Quand un greffon compatible est disponible, le candidat est appelé par le centre de transplantation, préparé pour l’intervention, puis transféré au bloc opératoire pendant qu’une équipe chirurgicale du centre de transplantation se déplace dans le centre de prélèvement pour affiner l’évaluation du greffon et procéder au prélèvement.
Une fois la transplantation confirmée, le receveur est placé sous anesthésie générale, positionné en décubitus dorsal. L’abord chirurgical est le plus souvent une bithoracotomie antérieure, qui peut comprendre une section sternale. L’intervention commence d’un côté, par la réalisation d’une pneumonectomie et l’implantation d’un premier poumon, suivi de la même intervention du deuxième côté en cas de transplantation bipulmonaire. Une assistance cardiorespiratoire est parfois nécessaire, le plus souvent par une ECMO (Extracorporeal Membrane Oxygenation), qui correspond à une circulation extracorporelle « légère ».
En France, la durée d’ischémie du greffon pulmonaire est le plus souvent comprise entre cinq et sept heures, et 20 % des transplantations pulmonaires ont lieu en pleine nuit. L’intervention dure entre deux heures – pour une transplantation monopulmonaire simple – et huit heures – pour une transplantation bipulmonaire compliquée. La durée moyenne de séjour en service de réanimation est de dix jours, et celle du séjour hospitalier initial, de trois à cinq semaines.
Toutes sortes de complications…
La mortalité est comprise entre 10 et 30 % dans l’année qui suit la transplantation pulmonaire, en fonction de la typologie du patient et de la pathologie pulmonaire sous-jacente. La morbimortalité durant la première année est principalement liée à la dysfonction primaire du greffon, à des problèmes de cicatrisation bronchique, à des phénomènes immunologiques (rejet aigu) et à des complications infectieuses liées aux immunosuppresseurs.
Au-delà de la première année de greffe, le patient transplanté pulmonaire est principalement exposé à des complications liées à la réponse immunitaire dirigée contre le greffon (rejet chronique principalement) et aux conséquences des médicaments immuno-suppresseurs. Les médicaments antirejet induisent à la fois des complications liées aux effets collatéraux de leur action immunosuppressive « voulue » (complications infectieuses et néoplasiques) et des effets indésirables « non voulus » (diabète, ostéo-porose, insuffisance rénale chronique, risque cardiovasculaire notamment).
Complications immunologiques
Le traitement immunosuppresseur est pris à vie et débuté dès le jour de la transplantation ; des adaptations sont possibles au cours du temps. Il est généralement constitué de trois classes médicamenteuses :
- des corticoïdes, dont la dose d’entretien est la plus faible possible, souvent entre 5 et 10 mg/j. Les patients doivent respecter les règles hygiénodiététiques associées afin de prévenir les effets indésirables, notamment la survenue d’un diabète et d’une ostéoporose ;
- d’un anticalcineurine (ciclosporine ou tacrolimus). Cette classe a permis l’avènement de la transplantation d’organe solide dans les années 1980 - 1990. Les anticalcineurines sont administrées à vie, en vérifiant régulièrement le taux sanguin (tous les 2 ou 3 jours pendant l’hospitalisation initiale, puis toutes les semaines à tous les mois à domicile). La dose est adaptée en fonction de la tolérance rénale – la néphrotoxicité étant plus fréquemment observée avec un taux sanguin élevé –, et les doses administrées peuvent être légèrement diminuées à distance de la transplantation pulmonaire. Les anticalcineurines étant des molécules à risque important d’interactions médicamenteuses, tout nouveau médicament doit être validé par le centre de transplantation référent du patient ;
- d’un antimétabolite, le mycophénolate mofétil, en général. Le taux sanguin des antimétabolites n’est pas systématiquement dosé. Les effets indésirables fréquents (hématologiques notamment) conduisent à en diminuer les doses chez un nombre significatif de patients.
Malgré le traitement immunosuppresseur, un rejet aigu est possible. Il peut être asymptomatique ou associé à des symptômes non spécifiques (fièvre, dyspnée, toux, expectorations). Les examens complémentaires peuvent permettre d’observer des images alvéolaires ou interstitielles mais également une altération des échanges gazeux et/ou des explorations fonctionnelles. On distingue le rejet aigu cellulaire du rejet aigu médié par les anticorps.
Rejet aigu cellulaire : plus d’un tiers des patients sont concernés
D’après le registre de la Société internationale pour la transplantation cardiaque et pulmonaire (ISHLT), 36 % des receveurs ont au moins un épisode de rejet aigu cellulaire dans l’année qui suit la transplantation. L’incidence du rejet aigu cellulaire décroît ensuite rapidement après la première année, bien que la survenue d’un rejet aigu reste possible à n’importe quel moment.
Le rejet aigu cellulaire est caractérisé par des infiltrats mononucléés périvasculaires (rejet vasculaire), parfois accompagnés d’infiltrats lymphocytaires du chorion bronchique (rejet bronchiolaire). Une classification internationale, modifiée en 2007, a permis d’évaluer les lésions histologiques de rejet en degré de sévérité croissante : il existe cinq stades allant de A0 (pas de rejet) à A4 (rejet aigu sévère).4
Le traitement du rejet aigu cellulaire repose sur des bolus de corticoïdes administrés durant trois jours. Dans la plupart des cas, ce traitement permet une résolution spectaculaire des symptômes, de la fonction respiratoire et des anomalies radiologiques. En l’absence d’amélioration, se pose le problème d’un rejet corticorésistant pouvant justifier des traitements plus agressifs, notamment par sérum antilymphocytaire.
Rejet aigu médié par les anticorps : un champ actif de recherche
Les antigènes (Ag) du complexe majeur d’histocompatibilité (CMH ou HLA [human leukocyte antigen]) sont divisés en deux classes (I et II) et sont spécifiques à chaque individu ; ils forment la « carte d’identité » de nos cellules. Les Ag HLA de classe I sont globalement localisés à la surface de toutes les cellules de l’organisme, alors que les Ag HLA de classe II sont principalement présentés par des cellules immunitaires. Les anticorps spécifiques dirigés contre les Ag HLA du donneur ( Donor Specific Antibodies [DSA]) contribuent au rejet médié par les anticorps dans la transplantation d’organe solide. La présence de DSA au moment de la transplantation, ou leur détection au décours, est associée à la dysfonction chronique du greffon.
Le rejet aigu médié par les anticorps (Antibody-Mediated Rejection [AMR]) peut être clinique ou infraclinique.
L’AMR clinique est classé en plusieurs catégories : AMR clinique confirmé, probable ou possible.5 Cette classification dépend de la présence de plusieurs critères, associés à une dysfonction du greffon en cas d’AMR clinique : la présence de DSA, d’arguments histologiques sur les biopsies transbronchiques et/ou d’un marquage du complément positif (C4d) sur les biopsies transbronchiques, et surtout l’élimination des autres causes de dysfonction aiguë du greffon (notamment une infection).
L’AMR infraclinique correspond à la présence de critères histologiques faisant évoquer un AMR découvert sur les biopsies transbronchiques de routine sans signes de dysfonction du greffon.
En cas d’AMR, la majorité des patients ne répond pas aux corticoïdes seuls, contrairement au cas du rejet cellulaire aigu, et l’arsenal thérapeutique est limité et souvent insuffisant. Le traitement de l’AMR est mal codifié ; il repose généralement sur la réalisation de plasmaphérèses et l’administration d’immunoglobulines en intraveineuse ou d’anticorps monoclonaux anti-CD20 (rituximab).
L’AMR est un concept relativement récent. Le champ de recherche, pour mieux caractériser cette entité et développer de nouvelles thérapeutiques, est vaste.
Complications infectieuses
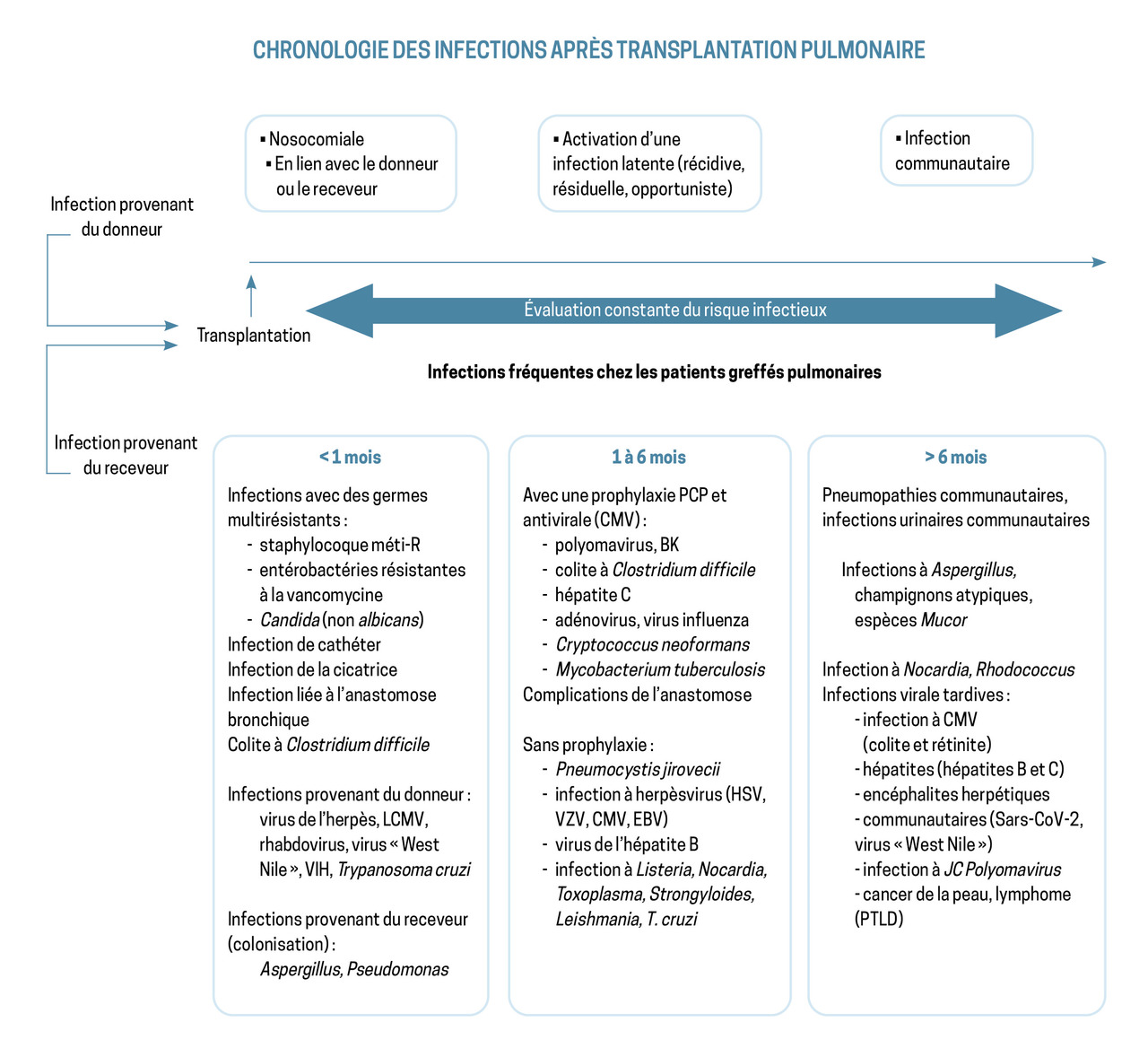
Les immunosuppresseurs, indispensables pour réduire le risque de rejet du greffon, diminuent les défenses immunitaires du patient et augmentent sa sensibilité aux infections qui sont, en règle générale, plus sévères et plus fréquentes que chez un individu sain. Ceci concerne aussi bien les germes communautaires et nosocomiaux que les germes opportunistes.6
Toute fièvre chez un patient greffé doit être rapidement prise en charge : recherche d’une porte d’entrée potentielle, de signes de gravité ou de mauvaise tolérance. La figure 2 résume les germes auxquels le patient est exposé en fonction de la période post-opératoire.
Prophylaxie à vie
Les infections bactériennes sont les plus fréquentes chez les patients transplantés pulmonaires, avec, comme site de prédilection, les poumons en premier lieu. La prescription d’une antibioprophylaxie en postopératoire immédiat permet de retarder l’apparition des pneumonies bactériennes, virales et fongiques.
La prophylaxie anti-infectieuse post-transplantation est constituée :
- d’antibiotiques adaptés aux germes retrouvés chez le donneur ou chez le receveur au cours des premiers jours suivant la transplantation ;
- d’un antibiotique/antiparasitaire pour prévenir le risque de pneumocystose et de toxoplasmose (cotrimoxazole) ;
- d’antiviraux pour prévenir le risque de réactivation du cytomégalovirus (CMV) [valganciclovir] ou du virus Herpes simplex (HSV) [valaciclovir] ;
- d’antifongiques en cas de facteurs de risque, notamment aspergillaire (amphotéricine B en aérosol, antifongiques azolés per os).
Leur durée d’administration est variable selon les centres, en général de six à douze mois pour les prophylaxies virales et fongiques, mais certaines prophylaxies peuvent être poursuivies à vie (prévention de la pneumocystose, par exemple).
Anticiper les vaccinations
Le carnet de vaccination du patient doit être régulièrement mis à jour. Les vaccins vivants atténués sont contre-indiqués après transplantation. Par ailleurs, l’efficacité des vaccins est diminuée avec l’immunosuppression. Il est donc primordial d’être à jour du calendrier vaccinal avant l’inscription sur la liste d’attente.
Les recommandations concernant la vaccination pré- et post-transplantation sont disponibles sur le site https ://vaccination-info-service.fr/ de Santé publique France (tableau 2).
Complications néoplasiques
L’immunosuppression au long cours augmente le risque de cancer chez les patients greffés des poumons, par rapport à la population générale. Les cancers les plus fréquents sont les cancers cutanés (en dehors du mélanome), les cancers du poumon et les syndromes lymphoprolifératifs.7 Selon un rapport récent de l’ISHLT, le cancer représente 17 % des décès de patients greffés pulmonaires, ce qui en fait la deuxième cause de décès cinq à dix ans après l’intervention.2
Les cancers transmis par le donneur sont très rares du fait de la sélection rigoureuse des greffons. En 2011, un rapport de l’OPTN/UNOS (Organ Procurement and Transplantation Network/United Network for Organ Sharing) sur la transplantation d’organes solides suggère que certains cancers (cancers basocellulaire de la peau, du col utérin in situ, et cancer papillaire de la thyroïde) ont un risque minime d’être transmis par le donneur (inférieur à 0,1 %) alors que d’autres (mélanome, cancers du sein, du côlon, du poumon, carcinome rénal à cellules claires) ont un risque élevé de transmission (supérieur à 10 %).8
Dysfonction chronique du greffon (CLAD)
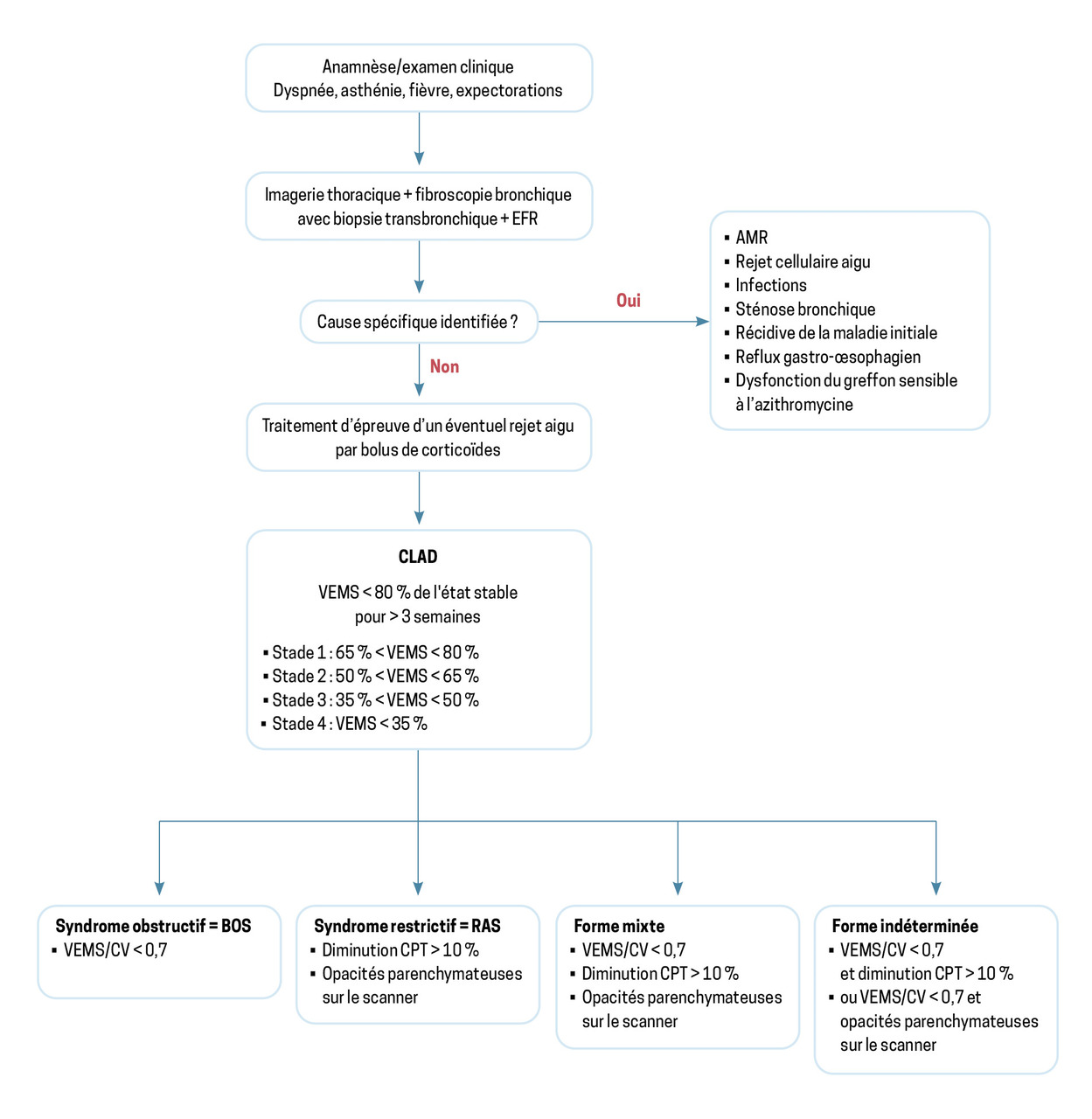
Le rejet chronique du greffon pulmonaire est maintenant appelé dysfonction chronique du greffon (Chronic Lung Allograft Dysfunction [CLAD]). La CLAD est définie par une diminution persistante du volume expiratoire maximal par seconde (VEMS) de plus de 20 % par rapport à la valeur de référence.9 La valeur de référence du VEMS est la moyenne des deux meilleures valeurs mesurées à trois semaines d’intervalle. Le rejet aigu cellulaire ou médié par les anticorps et les infections pulmonaires sont les principaux facteurs de risque de CLAD.
Dans la plupart des centres, des explorations sont faites dès la diminution de plus de 10 % du VEMS afin d’éliminer les diagnostics différentiels, qui comprennent le rejet aigu cellulaire, le rejet aigu médié par les anticorps, les infections, les sténoses bronchiques ou l’insuffisance cardiaque. La figure 3 propose un algorithme décisionnel devant un patient greffé pulmonaire symptomatique.
Quatre formes distinctes
La CLAD peut prendre plusieurs formes.
La forme obstructive (syndrome de bronchiolite oblitérante [BOS]) se manifeste par quatre critères :
- diminution du VEMS de plus de 20 % ;
- coefficient de Tiffeneau inférieur à 0,7 ;
- capacité totale pulmonaire inchangée ;
- absence d’opacités pulmonaires sur le scanner.
La forme restrictive (rCLAD ou restrictive allograft syndrome [RAS]) comprend quatre éléments :
- diminution du VEMS de plus de 20 % ;
- coefficient de Tiffeneau supérieur à 0,7 ;
- capacité totale pulmonaire diminuée de plus de 10 % ;
- opacités pulmonaires sur le scanner.
La forme mixte associe toutes les caractéristiques de la forme obstructive et de la forme restrictive.
La forme indéterminée correspond à l’absence soit d’opacités parenchymateuses sur le scanner thoracique, soit d’une diminution de la capacité pulmonaire totale de plus de 10 %.
Le pronostic, variable, est estimé en fonction de la diminution du VEMS
La survie médiane est de 1,5 an après le diagnostic de CLAD pour les formes précoces survenant dans les deux premières années après la transplantation, alors qu’elle est de 2,5 ans pour les formes plus tardives.10 Il existe néanmoins une variabilité interindividuelle importante : pour certains patients, on observe un déclin initial de la fonction respiratoire suivi d’une stabilisation pendant plusieurs années, alors que pour d’autres la perte du greffon se fait en quelques mois.10 Il existe une classification en cinq stades, selon la quantité de perte du VEMS, qui permet de mieux cerner le pronostic du patient.
Objectif : la stabilisation !
Les protocoles de prise en charge dépendent du centre de référence du patient. L’objectif est, au mieux, de stabiliser la fonction respiratoire. Les stratégies thérapeutiques peuvent impliquer :
- des modifications du protocole d’immunosuppression (augmentation des doses de corticoïdes, changement de la ciclosporine par le tacrolimus…) ;
- un traitement au long cours par azithromycine après un traitement d’épreuve de huit semaines ;
- la prise en charge d’un reflux gastro-œsophagien confirmé, par exemple par fundoplicature ;
- la photophorèse extracorporelle.
Le seul traitement curatif en cas de CLAD est la retransplantation. Cette option doit toujours être évoquée mais est impossible pour la majorité des patients du fait de difficultés chirurgicales ou de la survenue de comorbidités médicales après transplantation.
Que dire à vos patients ?
L’observance thérapeutique est le garant d’une meilleure survie.
Il faut absolument éviter toute automédication.
Des informations supplémentaires concernant les différentes associations des greffés pulmonaires et des fiches d’information sur la transplantation sont disponibles sur le site de la Fédération France greffés cœur et poumons : http ://www.france-coeur-poumon.asso.fr/index.php
Le carnet d’information destiné aux patients candidats à la transplantation pulmonaire à l’hôpital Bichat est disponible à l’adresse suivante : https ://www.chirvtt.fr/carnets/Livret_Accueil_Bichat.pdf
Contre-indications absolues à la greffe bipulmonaire
- Absence de motivation du patient
- Cancer à haut risque de récidive ou de décès
- Débit de filtration glomérulaire inférieur à 40 mL/min/1,73 m2 sauf chez les patients candidats à une greffe multi-organes
- Syndrome coronaire aigu ou infarctus du myocarde dans les trente derniers jours
- Accident vasculaire cérébral dans les trente derniers jours
- Cirrhose hépatique avec hypertension portale sauf chez les patients candidats à une greffe multi-organes
- Insuffisance hépatique aiguë
- Choc septique
- Infection tuberculeuse active
- Infection par le virus de l’immunodéficience humaine (VIH) avec une charge virale détectable
- Déficit cognitif évolutif
- Épisodes répétés de non-observance sans signe d’amélioration
- Dépendance au tabac, au vapotage, à la marijuana ou à d’autres drogues, particulièrement celles injectables
- Autres conditions médicales sévères risquant de limiter la survie du patient après la greffe
2. Chambers DC, Cherikh WS, Harhay MO, et al. The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Thirty-sixth adult lung and heart-lung transplantation Report-2019; Focus theme: Donor and recipient size match. J Heart Lung Transplant 2019;38:1042-55.
3. Leard LE, Holm AM, Valapour M, et al. Consensus document for the selection of lung transplant candidates: An update from the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2021;40:1349-79.
4. Stewart S, Fishbein MC, Snell GI, et al. Revision of the 1996 working formulation for the standardization of nomenclature in the diagnosis of lung rejection. J Heart Lung Transplant 2007;26:1229-42.
5. Levine DJ, Glanville AR, Aboyoun C, et al. Antibody-mediated rejection of the lung: A consensus report of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2016;35:397-406.
6. Dettori M, Riccardi N, Canetti D, et al. Infections in lung transplanted patients: A review. Pulmonology 2022;S2531-0437(22)00118-0.
7. Engels EA, Pfeiffer RM, Fraumeni JF, et al. Spectrum of cancer risk among US solid organ transplant recipients. JAMA 2011;306:1891-901.
8. Nalesnik MA, Woodle ES, Dimaio JM, et al. Donor-transmitted malignancies in organ transplantation: assessment of clinical risk. Am J Transplant 2011;11:1140-7.
Verleden GM, Glanville AR, Lease ED, et al. Chronic lung allograft dysfunction: Definition, diagnostic criteria, and approaches to treatment-A consensus report from the Pulmonary Council of the ISHLT. J Heart Lung Transplant 2019;38:493-503.
10. Finlen Copeland CA, Snyder LD, Zaas DW, et al. Survival after bronchiolitis obliterans syndrome among bilateral lung transplant recipients. Am J Respir Crit Care Med 2010;182:784-9.

 Encadrés
Encadrés