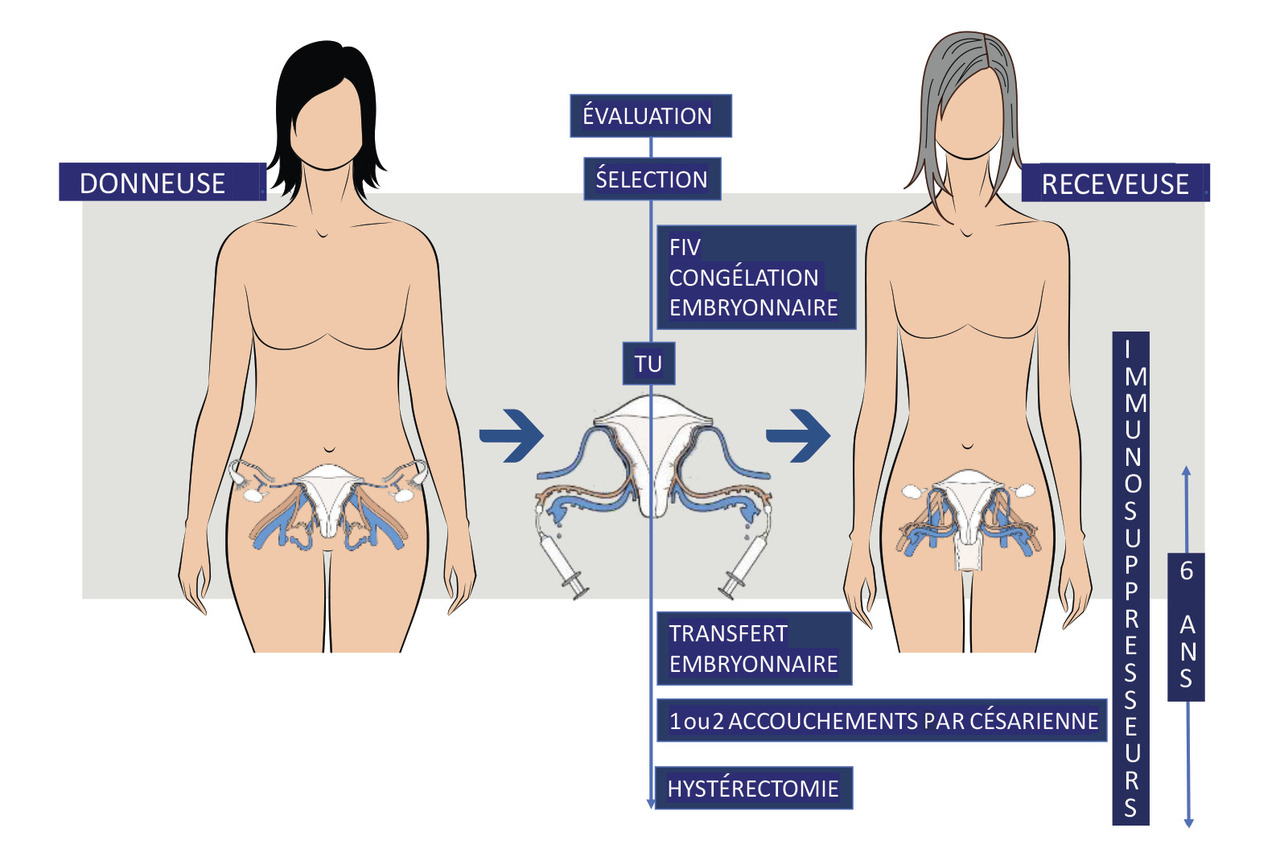
La transplantation utérine, première greffe d’organe de nature transitoire réalisée pour une indication non vitale, est la première intervention proposée pour traiter l’infertilité absolue d’origine utérine. Avec une centaine de greffes réalisées dans le monde, elle se situe encore dans le domaine expérimental.
La transplantation utérine (TU) est un nouveau type de transplantation. En effet, il s’agit d’une transplantation d’organe temporaire dans le but d’améliorer la qualité de vie, en permettant aux patientes dépourvues d’utérus d’être enceintes et d’obtenir la naissance d’un ou de deux enfants bien portants. Le succès de différentes étapes est nécessaire pour garantir celui de la greffe. Les patientes donneuses (D) et receveuses (R) doivent être scrupuleusement sélectionnées et « compatibles » au niveau immunologique. Ensuite, la patiente R doit effectuer une fécondation in vitro (FIV) afin d’obtenir une dizaine d’embryons de bonne qualité. En effet, lors de la greffe, les trompes sont dévascularisées et doivent être retirées, ce qui rend les grossesses spontanées impossibles. La chirurgie de la greffe reste l’étape la plus délicate en raison du petit calibre des vaisseaux utérins. Un traitement immunosuppresseur sur le même modèle que pour les autres greffes d’organes est ensuite instauré, puis adapté afin de permettre le transfert d’embryon, sans la survenue de signes de rejet. La grossesse nécessite un suivi rapproché. Une césarienne est systématiquement réalisée pour la naissance. L’utérus est enfin retiré après une ou deux grossesses, pour éviter les risques des traitements immunosuppresseurs au long cours. Les différentes étapes de la greffe sont résumées dans la figure .
Aujourd’hui, la transplantation utérine relève encore du domaine expérimental, avec environ 100 greffes réalisées dans le monde et plus de 40 enfants nés en bonne santé.1-3 Si elle entrait dans le domaine du soin, elle pourrait potentiellement s’adresser à 150 000 patientes en Europe présentant une infertilité utérine, soit 1 femme sur 500 en âge de procréer.4
Aujourd’hui, la transplantation utérine relève encore du domaine expérimental, avec environ 100 greffes réalisées dans le monde et plus de 40 enfants nés en bonne santé.1-3 Si elle entrait dans le domaine du soin, elle pourrait potentiellement s’adresser à 150 000 patientes en Europe présentant une infertilité utérine, soit 1 femme sur 500 en âge de procréer.4
Une centaine de transplantations utérines dans le monde depuis 2014
La première naissance d’un bébé en bonne santé après transplantation utérine à partir d’une donneuse vivante a été rapportée par le Pr Brännström et son équipe en 2014.6 En effet, un premier essai a été réalisé en Suède à partir de donneuses vivantes pour 9 receveuses : 7 greffons étaient fonctionnels, 6 patientes ont donné naissance à des bébés en bonne santé dont 2 pour 3 receveuses, et 1 a fait plusieurs fausses couches. Cette équipe a réalisé son deuxième essai de 8 transplantations utérines avec une chirurgie par cœlioscopie robot-assistée pour le prélèvement utérin de la donneuse vivante et a rapporté 6 greffons fonctionnels et plusieurs grossesses. À ce jour, plus de 100 transplantations utérines ont été réalisées dans le monde entier, dont 81 ont été publiés, et une vingtaine d’équipes médicales travaillent sur ce sujet.1-3,6 La transplantation utérine a été pratiquée principalement à partir de donneuses vivantes (60, soit 74 % des cas). Vingt et un gestes ont été pratiqués à partir de donneuses décédées. Le succès technique de la transplantation utérine a été de 75 % : 78 % en cas de donneuses vivantes et 66 % en cas de donneuses décédées. Plus de 40 enfants en bonne santé sont nés après transplantation utérine. Si la majorité des enfants sont nés grâce à des donneuses vivantes, plusieurs naissances ont été possibles grâce à des donneuses décédées, ce qui confirme la faisabilité de cette approche. Le taux de naissances vivantes par greffe utérine est de 52 % à ce jour (42/81), 69 % en cas de succès de la procédure (42/61).1-3 La première transplantation utérine française a été réalisée à l’hôpital Foch (Suresnes) en 2019 ; elle a permis la naissance de deux petites filles en bonne santé en 2021 et 2023.7,8 La deuxième transplantation utérine a eu lieu en septembre 2022.
Sélection des donneuses après examen approfondi
Les donneuses peuvent être vivantes ou décédées (en état de mort cérébrale). Les donneuses vivantes sont majoritairement apparentées ou amies. Elles bénéficient d’un examen approfondi avant la transplantation, afin d’évaluer la fonctionnalité utérine et les risques d’une transplantation. Les examens comprennent une évaluation du col de l’utérus pour dépister une dysplasie et une infection par le papillomavirus (HPV), contre-indiquant la greffe. L’examen de l’utérus et des vaisseaux sanguins est réalisé par échographie vaginale, hystéroscopie diagnostique, angioscanner, angio-IRM pelvienne et artériographie selon les équipes ; un utérus sain et des vaisseaux utérins de bon calibre sans artériosclérose sont des prérogatives au succès de la greffe. La compatibilité ABO, HLA, avec notamment l’absence d’anticorps anti-HLA de la receveuse dirigés contre la donneuse sont indispensables avant inclusion, ainsi qu’un bon état général des donneuses et une évaluation psychologique favorable. Les critères d’exclusion et d’inclusion de l’équipe de l’hôpital Foch sont présentés dans le tableau 1 .7
Le prélèvement à partir d’une donneuse décédée, bien que n’exposant pas à des complications, ne permet cependant pas une évaluation aussi optimale du greffon. En raison de l’absence d’évaluation possible des vaisseaux, les donneuses décédées sélectionnées sont plus jeunes. Les difficultés d’organisation de la transplantation utérine et l’accessibilité de greffons constituent les autres limites.
Le prélèvement à partir d’une donneuse décédée, bien que n’exposant pas à des complications, ne permet cependant pas une évaluation aussi optimale du greffon. En raison de l’absence d’évaluation possible des vaisseaux, les donneuses décédées sélectionnées sont plus jeunes. Les difficultés d’organisation de la transplantation utérine et l’accessibilité de greffons constituent les autres limites.
Sélection des receveuses : des critères d’inclusion stricts
Dans la majorité des essais, les receveuses n’avaient pas d’utérus : la plupart d’entre elles de manière congénitale (syndrome de Mayer-Rokitansky-Küster-Hauser [MRKH]), quelques-unes après hystérectomie pour cancer du col et fibromes ; et une patiente avait une infertilité utérine due à un syndrome d’Asherman.
Les critères d’inclusion sont stricts. Les receveuses de plus de 38 ans et avec une faible réserve ovarienne sont exclues, afin de garantir une plus grande chance de réussite de la FIV. Les receveuses doivent être en couple stable et bénéficier d’une évaluation psychologique favorable. L’obtention d’un nombre suffisant d’embryons est nécessaire pour l’inclusion définitive. La limite supérieure de l’indice de masse corporelle (IMC) pour la receveuse est en général de 30 kg/m2. Les receveuses ne doivent pas présenter de comorbidité grave ni d’antécédents médicaux. La plupart des études ont exclu la reconstruction vaginale avec un segment sigmoïde ou jéjunal en raison de l’inflammation et des risques de fausse couche et d’échec de l’implantation.9 Enfin, la longueur vaginale minimale doit être de 6 cm.
Les critères d’inclusion sont stricts. Les receveuses de plus de 38 ans et avec une faible réserve ovarienne sont exclues, afin de garantir une plus grande chance de réussite de la FIV. Les receveuses doivent être en couple stable et bénéficier d’une évaluation psychologique favorable. L’obtention d’un nombre suffisant d’embryons est nécessaire pour l’inclusion définitive. La limite supérieure de l’indice de masse corporelle (IMC) pour la receveuse est en général de 30 kg/m2. Les receveuses ne doivent pas présenter de comorbidité grave ni d’antécédents médicaux. La plupart des études ont exclu la reconstruction vaginale avec un segment sigmoïde ou jéjunal en raison de l’inflammation et des risques de fausse couche et d’échec de l’implantation.9 Enfin, la longueur vaginale minimale doit être de 6 cm.
Chirurgie simultanée chez la donneuse vivante et la receveuse
Prélèvement étendu de l’utérus et des vaisseaux
Le prélèvement de l’utérus est plus étendu qu’une hystérectomie radicale afin d’avoir une longueur suffisante de vaisseaux utérins (généralement des artères et des veines utérines) pour permettre une anastomose termino-latérale sur les vaisseaux iliaques externes de la receveuse. L’utérus doit également être prélevé avec une partie des ligaments ronds, des ligaments utéro-sacrés, une portion étendue de péritoine vésical et une partie du vagin pour l’anastomose avec celui de la receveuse. La dissection des veines utérines est très complexe en raison de leur proximité avec les uretères et de la présence de nombreux plexus et branches. Une urétérolyse complète est systématique, et l’ablation d’un patch des vaisseaux iliaques est souvent nécessaire. Le temps opératoire était d’environ dix heures dans le premier essai suédois réalisé avec laparotomie. L’ablation de l’utérus expose les donneuses vivantes à des risques chirurgicaux, en particulier des complications urétérales : 17 % d’entre elles ont présenté des complications nécessitant une intervention avec anesthésie.10 Le prélèvement utérin est plus facile chez la donneuse décédée car les vaisseaux utérins sont pris en masse avec les vaisseaux iliaques sans nécessiter d’urétérolyse. Cependant, une dissection méticuleuse des vaisseaux et l’oblitération des vaisseaux de petit calibre sont nécessaires afin de ne pas exposer la receveuse à une hémorragie lors du déclampage des vaisseaux à la fin des anastomoses.
Greffe de l’utérus
L’opération chirurgicale pour la receveuse commence avant la fin de l’intervention sur donneuse vivante dans une salle adjacente. La première étape est la dissection du fond vaginal. Les vaisseaux iliaques externes sont ensuite disséqués et le greffon utérin est placé en position orthotopique avec une anastomose termino-latérale sur les vaisseaux iliaques. Puis l’utérus est fixé dans le pelvis. La durée de l’opération a été de près de cinq heures dans l’essai suédois. Le risque d’échec de la greffe est de l’ordre de 25 %, par thrombose principalement, en raison de la petite taille des vaisseaux, ou par infection.1-3 Le succès chirurgical est en général conclu trois mois après la greffe, quand la patiente présente des cycles avec une bonne croissance de l’endomètre. D’autres complications ont été décrites, en particulier des cas de sténoses vaginales, nécessitant parfois une reprise chirurgicale.11
Traitement immunosuppresseur sous surveillance étroite
Le traitement immunosuppresseur est comparable à celui utilisé pour la greffe de rein. Dans le premier essai suédois, l’induction était assurée par des antithymoglobulines 2,5 mg/kg (J0 et J1) et de la méthylprednisolone intraveineuse (500 mg). Ensuite, du mycophénolate mofétil (MMF) était administré avec du tacrolimus et de la prednisone pendant une semaine ou en cas de rejet, puis le MMF, qui est fœtotoxique, était relayé par de l’azathioprine deux mois avant le transfert embryonnaire.12
Ce protocole a ensuite été modifié avec l’induction par basiliximab 20 mg (J0 et J4) à la place des anti–thymoglobulines et, pour certaines équipes, l’azathioprine était administrée d’emblée au lieu du MMF en combinaison avec le tacrolimus.
Une surveillance étroite de la receveuse est effectuée pour rechercher des signes de rejet, qui sont le plus souvent asymptomatiques : les anticorps anti-HLA sont testés régulièrement. En outre, des biopsies du col de l’utérus sont effectuées une fois par semaine pendant le premier mois suivant la transplantation et une fois par mois par la suite, ainsi que pendant la grossesse pour rechercher un rejet cellulaire.13 Des épisodes de rejet ont été rapportés dans 60 % des cas, mais aucun n’a nécessité une explantation. La Société internationale de transplantation utérine (ISUTx) recommande de conserver le greffon pendant six ans au maximum afin de réduire les risques carcinologiques et infectieux de l’immunosuppression à long terme.
Ce protocole a ensuite été modifié avec l’induction par basiliximab 20 mg (J0 et J4) à la place des anti–thymoglobulines et, pour certaines équipes, l’azathioprine était administrée d’emblée au lieu du MMF en combinaison avec le tacrolimus.
Une surveillance étroite de la receveuse est effectuée pour rechercher des signes de rejet, qui sont le plus souvent asymptomatiques : les anticorps anti-HLA sont testés régulièrement. En outre, des biopsies du col de l’utérus sont effectuées une fois par semaine pendant le premier mois suivant la transplantation et une fois par mois par la suite, ainsi que pendant la grossesse pour rechercher un rejet cellulaire.13 Des épisodes de rejet ont été rapportés dans 60 % des cas, mais aucun n’a nécessité une explantation. La Société internationale de transplantation utérine (ISUTx) recommande de conserver le greffon pendant six ans au maximum afin de réduire les risques carcinologiques et infectieux de l’immunosuppression à long terme.
FIV, le plus souvent avant la greffe
La fécondation in vitro (FIV) ne comporte pas de spécificité particulière, hormis le fait que le prélèvement d’ovocytes chez les femmes atteintes du syndrome MRKH peut être réalisé par voie transabdominale en fonction de l’anatomie individuelle. Dans tous les cas actuellement rapportés, ce sont des embryons plutôt que des ovocytes qui ont été congelés. La plupart des équipes exigent actuellement la mise en banque de 5 à 10 embryons avant la transplantation utérine, le plus souvent des blastocystes. Le transfert d’embryons a été d’abord effectué un an après la transplantation utérine, sur la base de recommandations pour d’autres transplantations d’organes solides. Ce délai a ensuite été raccourci entre quatre et six mois dans certaines équipes, en l’absence de rejet, d’infection et en cas de bonne croissance de l’endomètre. La plupart des FIV ont été réalisées avant la greffe. Cependant, dans certains cas, elles ont dû être renouvelées ensuite en raison de l’utilisation de tous les embryons prélevés avant la greffe.
Grossesses à haut risque et naissances par césarienne
Deux patientes ont fait des fausses couches à répétition ; 42 naissances d’enfants en bonne santé ont été rapportées sur 81 greffes, ce qui représente un taux de succès de plus de 50 % de la transplantation utérine.1-3 Ces grossesses étaient à haut risque, comme la plupart des grossesses après greffe d’organe. Des complications ont été décrites : des cas de prééclampsie, d’hypertension artérielle (HTA) gravidique, d’insuffisance rénale, un cas de placenta accreta et des complications infectieuses (pyélonéphrites et chorioamniotites).1-3
De plus, les accouchements étaient le plus souvent prématurés. Une césarienne systématique a été pratiquée entre 31 semaines d’aménorrhée (SA) plus 6 jours et 37 semaines de gestation. Aucune mortalité néonatale ou fœtale, aucun retard de croissance intra-utérin ou malformation congénitale notable n’ont été décrits. De même, aucun risque à moyen terme n’a été mis en évidence chez les enfants issus d’une transplantation utérine. Une attention particulière doit être accordée à la menace d’accouchement prématuré car les contractions utérines ne sont pas ressenties par les patientes, l’utérus ayant perdu toute connexion nerveuse. La césarienne et l’hystérectomie peuvent être pratiquées en même temps, ou séparément.
De plus, les accouchements étaient le plus souvent prématurés. Une césarienne systématique a été pratiquée entre 31 semaines d’aménorrhée (SA) plus 6 jours et 37 semaines de gestation. Aucune mortalité néonatale ou fœtale, aucun retard de croissance intra-utérin ou malformation congénitale notable n’ont été décrits. De même, aucun risque à moyen terme n’a été mis en évidence chez les enfants issus d’une transplantation utérine. Une attention particulière doit être accordée à la menace d’accouchement prématuré car les contractions utérines ne sont pas ressenties par les patientes, l’utérus ayant perdu toute connexion nerveuse. La césarienne et l’hystérectomie peuvent être pratiquées en même temps, ou séparément.
Des limites éthiques
Les enfants ont une place majeure dans notre société moderne. Ils sont associés au bien-être des parents dans les pays développés. En outre, l’acceptation sociale des femmes stériles est encore faible, selon les pays et les religions. Des questions éthiques ont été soulevées depuis les débuts de la transplantation utérine et sont toujours d’actualité. Le fait le plus important est que l’utérus n’est pas un organe vital. La transplantation utérine comporte des risques réels pour les donneuses vivantes, les receveuses et, peut-être, pour leurs enfants potentiels.
Or d’autres options sont disponibles : l’acceptation de la stérilité, l’adoption et la gestation pour autrui (GPA). Mais l’adoption est un processus long et fastidieux. Et, en cas d’adoption, la mère n’expérimente pas la grossesse de son enfant génétique. La GPA ne présente pas de risques physiques pour les futurs parents mais des risques pour la personne qui porte la grossesse. Cette dernière option soulève d’autres questions éthiques. Elle est considérée comme inappropriée dans de nombreuses régions du monde et est illégale dans plusieurs pays européens comme la France ou la Suède.
Une position éthique pourrait être de restreindre les indications de transplantation utérine aux femmes qui ne peuvent, pour des raisons financières, juridiques, éthiques, religieuses ou de disponibilité, poursuivre une option moins risquée. À l’avenir, avec une diminution potentielle des risques de la transplantation utérine, ce paradigme pourrait évoluer. Les critères de Montréal pour la faisabilité éthique de la transplantation utérine, révisés en 2013, sont utiles pour définir les indications et les limites (tableau 2 ).14
Or d’autres options sont disponibles : l’acceptation de la stérilité, l’adoption et la gestation pour autrui (GPA). Mais l’adoption est un processus long et fastidieux. Et, en cas d’adoption, la mère n’expérimente pas la grossesse de son enfant génétique. La GPA ne présente pas de risques physiques pour les futurs parents mais des risques pour la personne qui porte la grossesse. Cette dernière option soulève d’autres questions éthiques. Elle est considérée comme inappropriée dans de nombreuses régions du monde et est illégale dans plusieurs pays européens comme la France ou la Suède.
Une position éthique pourrait être de restreindre les indications de transplantation utérine aux femmes qui ne peuvent, pour des raisons financières, juridiques, éthiques, religieuses ou de disponibilité, poursuivre une option moins risquée. À l’avenir, avec une diminution potentielle des risques de la transplantation utérine, ce paradigme pourrait évoluer. Les critères de Montréal pour la faisabilité éthique de la transplantation utérine, révisés en 2013, sont utiles pour définir les indications et les limites (
Un processus en pleine évolution
De nombreuses évolutions interviendront probablement dans les années à venir afin de simplifier ce processus complexe, d’inclure plus de receveuses et de donneuses, et de diminuer les risques de complications ou d’échecs. Le problème majeur pour les donneuses vivantes est que la chirurgie est beaucoup plus étendue qu’une simple hystérectomie, avec des risques de complications majeures.
La simplification de la chirurgie des donneuses vivantes à l’avenir semble indispensable pour permettre la diffusion de ce type de don. L’utilisation des veines ovariennes pourrait ainsi constituer une alternative aux veines utérines, permettant de raccourcir la durée opératoire et de diminuer les risques. Elle a déjà été rapportée par plusieurs équipes avec succès et permis des grossesses évolutives. La chirurgie robotique mini-invasive pourrait être un autre moyen de simplifier la chirurgie pour les donneuses vivantes.15 Elle offre des avantages significatifs, en particulier lorsque le champ opératoire est profond et étroit, et lorsqu’une dissection fine et des micro-sutures sont nécessaires ; elle a déjà été pratiquée par plusieurs équipes avec succès. Nous avons réalisé notre premier cas français avec l’aide de laparoscopie robotisée.8 Notre deuxième greffe a été entièrement prélevée par chirurgie robotique.
La simplification de la chirurgie des donneuses vivantes à l’avenir semble indispensable pour permettre la diffusion de ce type de don. L’utilisation des veines ovariennes pourrait ainsi constituer une alternative aux veines utérines, permettant de raccourcir la durée opératoire et de diminuer les risques. Elle a déjà été rapportée par plusieurs équipes avec succès et permis des grossesses évolutives. La chirurgie robotique mini-invasive pourrait être un autre moyen de simplifier la chirurgie pour les donneuses vivantes.15 Elle offre des avantages significatifs, en particulier lorsque le champ opératoire est profond et étroit, et lorsqu’une dissection fine et des micro-sutures sont nécessaires ; elle a déjà été pratiquée par plusieurs équipes avec succès. Nous avons réalisé notre premier cas français avec l’aide de laparoscopie robotisée.8 Notre deuxième greffe a été entièrement prélevée par chirurgie robotique.
Traitement de l’infertilité absolue en devenir
La transplantation utérine est le premier traitement de l’infertilité absolue d’origine utérine. Avec plus de 100 actes réalisés dans le monde, sa faisabilité a été démontrée. Une simplification de cette chirurgie complexe est cependant nécessaire pour la faire passer de la phase expérimentale au domaine du soin. Les considérations éthiques restent indispensables afin d’offrir les meilleures options pour ce nouveau traitement de l’infertilité.
Références
1. Ayoubi JM, Carbonnel M, Racowsky C, de Ziegler D, Gargiulo A, Kvarnstrom N, et al. Evolving clinical challenges in uterus transplantation. Reprod Biomed Online 2022;45(5):947-60.
2. Brännström M, Tullius SG, Brucker S, Dahm-Kahler P, Flyckt R, Kisu I, et al. Registry of the International Society of Uterus Transplantation: First report. Transplantation 2023;107(1):10-7.
3. Johannesson L, Richards E, Reddy V, Walter J, Olthoff K, Quintini C, et al. The first 5 years of uterus transplant in the US: A report from the United States Uterus Transplant Consortium. JAMA Surg 2022;157(9):790-7.
4. Sieunarine K, Zakaria FB, Boyle DC, Corless DJ, Noakes DE, Lindsay I, et al. Possibilities for fertility restoration: A new surgical technique. Int Surg 2005;90(5):249-56.
5. Brännström M, Johannesson L, Bokström H, Kvarnström N, Mölne J, Dahm-Kähler P, et al. Livebirth after uterus transplantation. Lancet 2015;385(9968):607-16.
6. Brännström M, Belfort MA, Ayoubi JM. Uterus transplantation worldwide: Clinical activities and outcomes. Curr Opin Organ Transplant 2021;26(6):616-26.
7. Carbonnel M, Revaux A, Menzhulina E, Karpel L, Snanoudj R, Le Guen M, et al. Uterus transplantation with live donors: Screening candidates in one french center. J Clin Med 2020;9(6).
8. Ayoubi JM, Carbonnel M, Kvarnström N, Revaux A, Poulain M, Vanlieferinghen S, et al. Case report: Post-partum SARS-CoV-2 infection after the first french uterus transplantation. Front Surg 2022;9:854225.
9. Erman Akar M, Ozkan O, Aydinuraz B, Dirican K, Cincik M, Mendilcioglu I, et al. Clinical pregnancy after uterus transplantation. Fertil Steril 2013;100(5):1358-63.
10. Richards EG, Farrell RM, Ricci S, Perni U, Quintini C, Tzakis A, et al. Uterus transplantation: State of the art in 2021. J Assist Reprod Genet 2021;38(9):2251-59.
11. Chmel R, Novackova M, Janousek L, Matecha J, Pastor Z, Maluskova J, et al. Revaluation and lessons learned from the first 9 cases of a Czech uterus transplantation trial: Four deceased donor and 5 living donor uterus transplantations. Am J Transplant 2019;19(3):855-64.
12. Brännström M, Johannesson L, Dahm-Kähler P, Enskog A, Mölne J, Kvarnström N, et al. First clinical uterus transplantation trial: A six-month report. Fertil Steril 2014;101(5):1228-36.
13. Mölne J, Broecker V, Ekberg J, Nilsson O, Dahm-Kähler P, Brännström M. Monitoring of human uterus transplantation with cervical biopsies: A provisional scoring system for rejection. Am J Transplant 2017;17(6):1628-36.
14. Lefkowitz A, Edwards M, Balayla J. Ethical considerations in the era of the uterine transplant: An update of the Montreal criteria for the ethical feasibility of uterine transplantation. Fertil Steril 2013;100(4):924-6.
15. Ayoubi JM, Carbonnel M, Pirtea P, Kvarnström N, Brännström M, Dahm-Kähler P. Laparotomy or minimal invasive surgery in uterus transplantation: A comparison. Fertil Steril 2019;112(1):11-8.
2. Brännström M, Tullius SG, Brucker S, Dahm-Kahler P, Flyckt R, Kisu I, et al. Registry of the International Society of Uterus Transplantation: First report. Transplantation 2023;107(1):10-7.
3. Johannesson L, Richards E, Reddy V, Walter J, Olthoff K, Quintini C, et al. The first 5 years of uterus transplant in the US: A report from the United States Uterus Transplant Consortium. JAMA Surg 2022;157(9):790-7.
4. Sieunarine K, Zakaria FB, Boyle DC, Corless DJ, Noakes DE, Lindsay I, et al. Possibilities for fertility restoration: A new surgical technique. Int Surg 2005;90(5):249-56.
5. Brännström M, Johannesson L, Bokström H, Kvarnström N, Mölne J, Dahm-Kähler P, et al. Livebirth after uterus transplantation. Lancet 2015;385(9968):607-16.
6. Brännström M, Belfort MA, Ayoubi JM. Uterus transplantation worldwide: Clinical activities and outcomes. Curr Opin Organ Transplant 2021;26(6):616-26.
7. Carbonnel M, Revaux A, Menzhulina E, Karpel L, Snanoudj R, Le Guen M, et al. Uterus transplantation with live donors: Screening candidates in one french center. J Clin Med 2020;9(6).
8. Ayoubi JM, Carbonnel M, Kvarnström N, Revaux A, Poulain M, Vanlieferinghen S, et al. Case report: Post-partum SARS-CoV-2 infection after the first french uterus transplantation. Front Surg 2022;9:854225.
9. Erman Akar M, Ozkan O, Aydinuraz B, Dirican K, Cincik M, Mendilcioglu I, et al. Clinical pregnancy after uterus transplantation. Fertil Steril 2013;100(5):1358-63.
10. Richards EG, Farrell RM, Ricci S, Perni U, Quintini C, Tzakis A, et al. Uterus transplantation: State of the art in 2021. J Assist Reprod Genet 2021;38(9):2251-59.
11. Chmel R, Novackova M, Janousek L, Matecha J, Pastor Z, Maluskova J, et al. Revaluation and lessons learned from the first 9 cases of a Czech uterus transplantation trial: Four deceased donor and 5 living donor uterus transplantations. Am J Transplant 2019;19(3):855-64.
12. Brännström M, Johannesson L, Dahm-Kähler P, Enskog A, Mölne J, Kvarnström N, et al. First clinical uterus transplantation trial: A six-month report. Fertil Steril 2014;101(5):1228-36.
13. Mölne J, Broecker V, Ekberg J, Nilsson O, Dahm-Kähler P, Brännström M. Monitoring of human uterus transplantation with cervical biopsies: A provisional scoring system for rejection. Am J Transplant 2017;17(6):1628-36.
14. Lefkowitz A, Edwards M, Balayla J. Ethical considerations in the era of the uterine transplant: An update of the Montreal criteria for the ethical feasibility of uterine transplantation. Fertil Steril 2013;100(4):924-6.
15. Ayoubi JM, Carbonnel M, Pirtea P, Kvarnström N, Brännström M, Dahm-Kähler P. Laparotomy or minimal invasive surgery in uterus transplantation: A comparison. Fertil Steril 2019;112(1):11-8.
Dans cet article
- Une centaine de transplantations utérines dans le monde depuis 2014
- Sélection des donneuses après examen approfondi
- Sélection des receveuses : des critères d’inclusion stricts
- Chirurgie simultanée chez la donneuse vivante et la receveuse
- Traitement immunosuppresseur sous surveillance étroite
- FIV, le plus souvent avant la greffe
- Grossesses à haut risque et naissances par césarienne
- Des limites éthiques
- Un processus en pleine évolution
- Traitement de l’infertilité absolue en devenir