Tresiba Flex Touch est un système d’administration de l’insuline dégludec indiqué dans le traitement du diabète de l’adulte, de l’adolescent et de l’enfant à partir de l’âge de 1 an. Depuis le 22 octobre, un problème de production entraîne une tension d’approvisionnement sur cette spécialité (non liée à un problème de sécurité ou de qualité du médicament, d’après les informations fournies par le laboratoire).
Si l’hôpital est approvisionné normalement, la distribution est en revanche contingentée en ville ; un système de dépannage est mis en place en parallèle ; à titre exceptionnel et transitoire, 12 000 boîtes de ce médicament initialement destinées au marché norvégien seront importées (boîtes de 3 stylos préremplis de 3 mL de Tresiba 200 unités/mL, solution injectable). Le délai pour la remise à disposition normale est encore indéterminé.
L’ANSM, en lien avec le laboratoire pharmaceutique, a communiqué des solutions de report, afin d’éviter l’interruption de l’insulinothérapie dont les conséquences peuvent être graves, notamment une hyperglycémie pouvant évoluer vers une acidocétose diabétique :
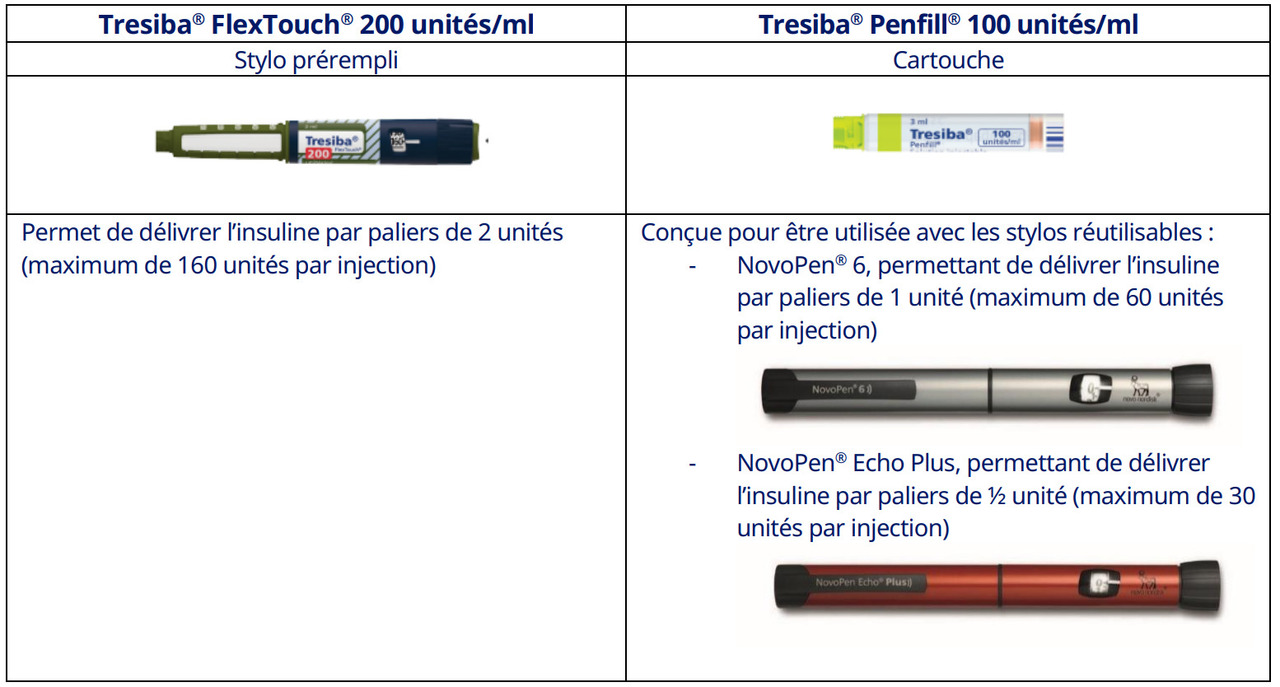
- Lors de la mise en place de l’insulinothérapie, privilégier l’instauration de Tresiba Penfill 100 unités/mL, solution injectable en cartouche, à utiliser avec les stylos réutilisables NovoPen 6 ou NovoPen Echo Plus. La concentration est différente mais il n’y a pas de conversion de dose entre ces deux systèmes d’administration (v. tableau).
- Pour les patients en cours de traitement et confrontés à une difficulté d’approvisionnement en Tresiba FlexTouch, envisager un transfert vers Tresiba Penfill ou une autre insuline basale. En cas de changement de type ou de marque d’insuline, le patient doit faire l’objet d’un suivi médical attentif et potentiellement d’un ajustement de la dose.
Pour rappel, tout effet indésirable suspecté d’être dû à un médicament doit être déclaré au Centre régional de pharmacovigilance (CRPV) ou sur www.signalement-sante.gouv.fr.