DIAGNOSTIQUER un trouble de la conduction intracardiaque.
IDENTIFIER les situations d’urgence et PLANIFIER leur prise en charge.
ARGUMENTER l’attitude thérapeutique et PLANIFIER le suivi du patient.
Introduction et physiopathologie
Les troubles de conduction relèvent d’une altération de cette conduction : ralentissement voire blocage complet provoquant une bradycardie, à différencier des troubles du rythme qui relèvent eux d’une hyperexcitabilité (tachycardie).
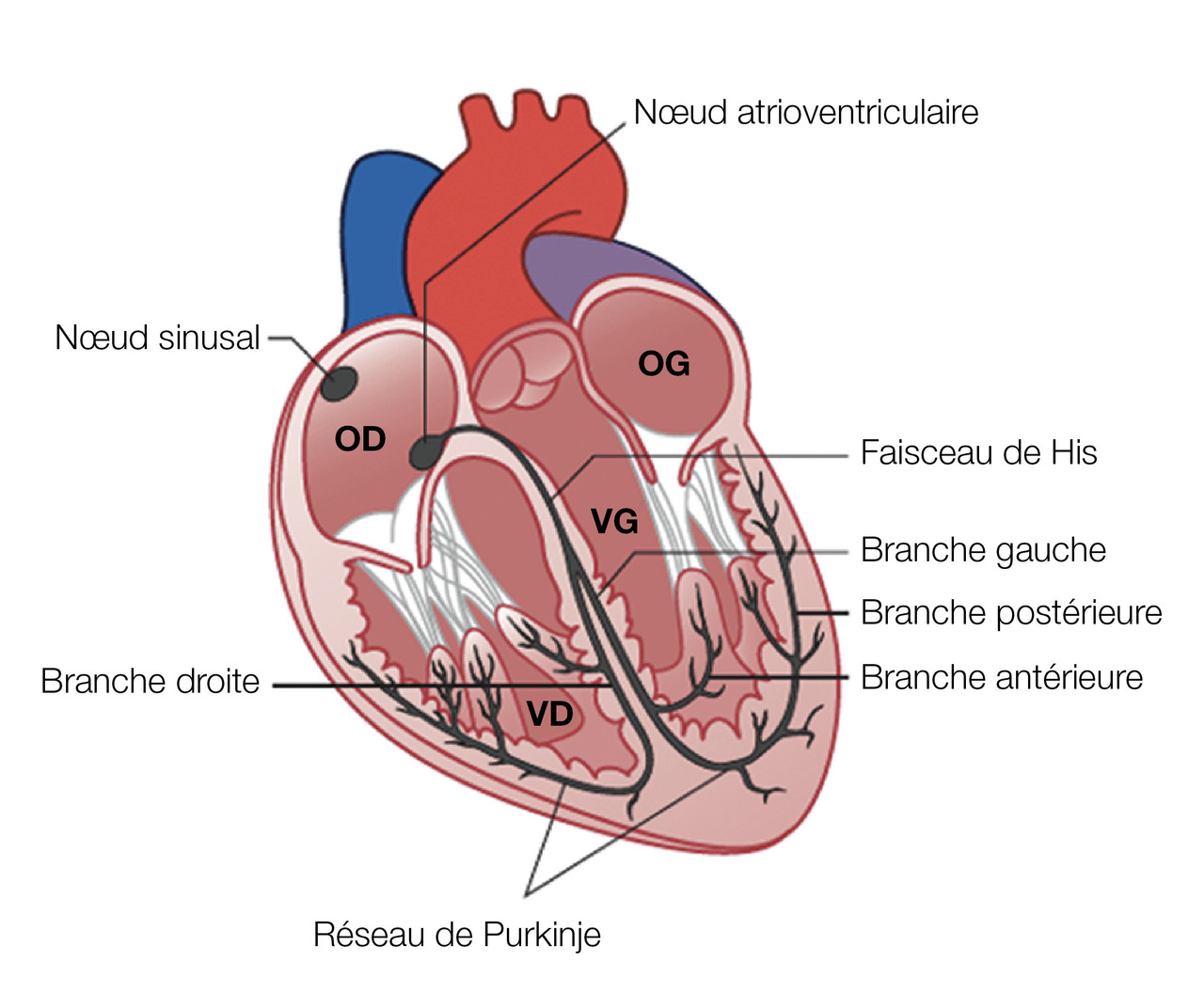
Le nœud sinusal, le nœud atrioventriculaire, le faisceau de His, les branches et le réseau de Purkinje forment le tissu nodal (
L’automatisme du nœud sinusal se fait à une fréquence plus élevée (> 60/min) que le nœud atrioventriculaire (40-50 batt/min), que le faisceau de His (35-40 batt/min), que les branches (< 35 batt/min). Ceci explique qu’en situation normale la seule structure se dépolarisant par automatisme est le nœud sinusal, les autres structures voyant leur automatisme coiffé par cette onde de dépolarisation en amont plus rapide. Un blocage complet à un étage va alors entraîner un échappement à l’étage d’en dessous, avec une fréquence égale à celle de son automatisme. Plus l’échappement sera bas situé, plus il sera lent.
La conduction dans le nœud atrioventriculaire est plus lente que dans le reste du tissu nodal, et comporte une fonction décrémentielle illustrée par le phénomène de Wenckebach : plus la fréquence atriale est rapide, plus le nœud atrioventriculaire va conduire lentement. Ce mécanisme permet de protéger les ventricules des tachycardies supraventriculaires, avec une fréquence ventriculaire maximale alors théorique de (220-âge) batt/min.
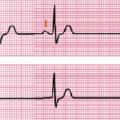
La dysfonction sinusale, regroupant la bradycardie sinusale, le bloc sino-atrial (BSA) et l’insuffisance chronotrope, est un trouble de conduction au niveau du nœud sinusal ou des oreillettes.
Le bloc atrioventriculaire (BAV) est un trouble de conduction se situant soit dans le nœud atrioventriculaire (BAV nodal), soit dans le faisceau de His (BAV hisien), soit sous le faisceau de His en bloquant les branches droite et gauche (BAV infrahisien).
Le bloc de branche est un trouble de conduction dans une branche ventriculaire, droite ou gauche.
L’hémibloc antérieur/postérieur gauche est un trouble de conduction dans les hémibranches antérieure ou postérieure gauches.
Diagnostic clinique et électrocardiographique des troubles de conduction
Une insuffisance chronotrope, c’est-à-dire un défaut d’accélération de la fréquence cardiaque à l’effort, peut également entraîner une dyspnée d’effort.
Les patients ayant un bloc de branche ne sont pas bradycardes, la branche saine permettant une dépolarisation ventriculaire sans retard.
Dysfonction sinusale
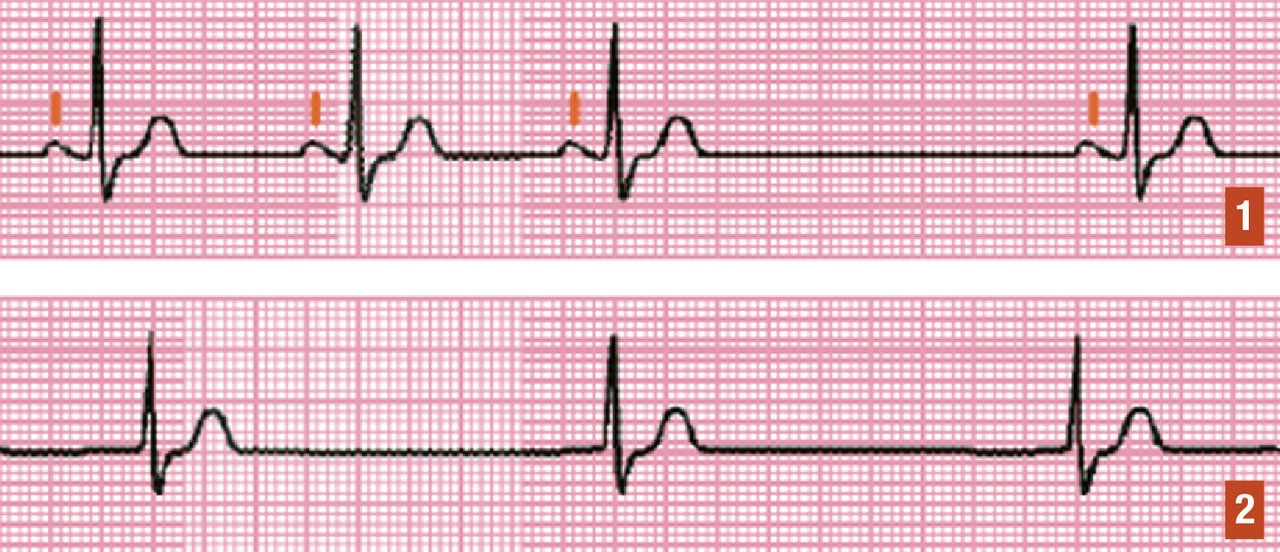
Il existe 3 types de BSA (
- BSA du 1er degré : ralentissement de conduction entre le nœud sinusal et le reste des oreillettes, non visible sur un ECG de surface ;
- BSA du 2e degré : blocage complet intermittent de conduction entre le nœud sinusal et les oreillettes. Ceci se traduit à l’ECG par l’absence intermittente d’onde P (et donc généralement de QRS derrière, sauf si présence d’un échappement jonctionnel) ;
- BSA du 3e degré (BSA complet) : blocage complet permanent de la conduction entre le nœud sinusal et les oreillettes, se traduisant à l’ECG par l’absence d’onde P sinusale.
Il est impossible sur un ECG de distinguer un BSA de type 3 d’une paralysie sinusale (absence d’onde P sinusale dans les deux cas).
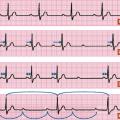
Blocs atrioventriculaires
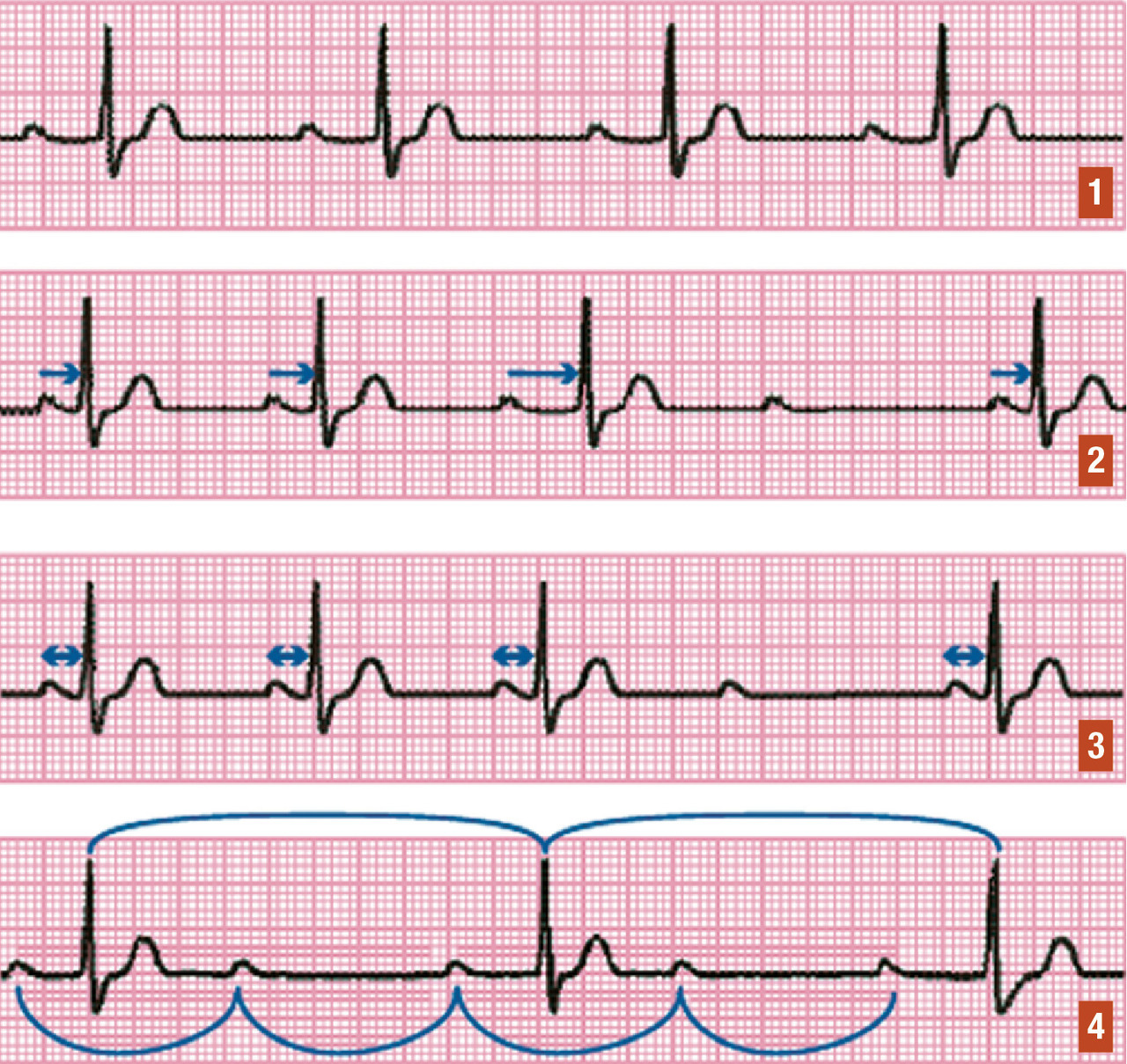
Il existe 3 degrés de blocs atrioventriculaires (
- BAV du 1er degré : allongement constant du temps de conduction dans le nœud atrioventriculaire, se traduisant à l’ECG par un allongement constant et stable de l’espace PR au-delà de 200 ms (= 1 grand carreau) ;
- BAV du 2e degré. Il en existe 4 types : le BAV 2 Mobitz 1, le BAV 2 Mobitz 2, le BAV 2 en 2/1, et le BAV de haut degré :
. BAV 2 Mobitz 2 : l’intervalle PR reste stable (allongé ou non), mais avec un blocage complet intermittent de la conduction entre les oreillettes et les ventricules, se traduisant à l’ECG par une onde P bloquée inopinément. Ce bloc est généralement situé au niveau du faisceau de His ou en dessous, donc infranodal. Étant plus bas situé, il est plus à risque de bradycardie sévère symptomatique,
. BAV 2 en 2/1 : chaque onde P donnant un QRS est suivie d’une onde P bloquée. Il peut alors s’agir d’un BAV 2 Mobitz 1 (avec l’intervalle PR qui s’est tellement allongé d’un coup que la 2e onde P se retrouve d’emblée bloquée) ou d’un BAV 2 Mobitz 2 avec une onde P bloquée de manière intermittente une fois sur 2.
. BAV de haut degré : défini par au moins 2 ondes P bloquées consécutives. Si une onde P conduit et que les 2 suivantes sont bloquées, c’est un BAV 3/1 (3 ondes P pour 1 QRS). Ce BAV de haut degré peut s’aggraver brutalement en BAV complet (aucune onde P conduite) ;
- BAV du 3e degré (BAV complet) : blocage complet entre les oreillettes et les ventricules, avec des ondes P n’étant donc pas suivies de QRS. Il peut être permanent ou paroxystique. Les myocytes du tissu nodal sous le siège du BAV 3 n’étant plus dépolarisés, leur automatisme va prendre le relais, permettant une dépolarisation ventriculaire régulière à la cadence de l’automatisme du foyer d’échappement. Plus l’échappement est bas situé, plus la fréquence ventriculaire sera lente. L’ECG sera celui d’une bradycardie avec dissociation atrioventriculaire complète (ondes P régulières sans lien avec des QRS également réguliers), avec plus d’ondes P que de QRS. Il existe 3 types de BAV 3, en fonction de sa localisation anatomique :
. BAV 3 hisien : au niveau du faisceau de His. L’échappement entraînera alors une fréquence ventriculaire à 35-40 batt/min, avec des QRS fins ou larges en fonction du lieu d’échappement. Il survient classiquement à l’effort, avec un ECG au repos le plus souvent normal,
. BAV 3 infrahisien : sous le faisceau de His, en bloquant la branche droite et la branche gauche simultanément. L’échappement entraînera alors une fréquence ventriculaire < 35 batt/min, avec des QRS larges car l’échappement proviendra d’une des deux branches donc les ventricules ne se dépolariseront pas en même temps. Il s’agit du BAV 3 le plus grave, car la fréquence ventriculaire sera très lente et donc le patient très symptomatique (syncope, asystolie, voire troubles du rythme ventriculaires).
De manière générale, un BAV dit infranodal est un BAV hisien ou infrahisien.
De manière générale, les troubles de conduction de haut degré regroupent les blocs sino-atriaux 2 ou 3, et les blocs atrioventriculaires infranodaux (BAV 2 Mobitz 2, BAV 2 dit de haut degré, BAV 3 infranodal).
Blocs de branche
Le QRS traduit la dépolarisation des deux ventricules. Lorsque les ventricules se dépolarisent simultanément (situation normale), cette dépolarisation est rapide et le QRS est donc fin (< 100 ms). Lorsqu’il existe un bloc de branche, les deux ventricules ne se dépolarisent pas simultanément et le QRS est donc large, traduisant l’allongement du temps global de dépolarisation ventriculaire. Une onde R’ sera alors retrouvée sur les dérivations du côté du bloc de branche, traduisant la dépolarisation avec retard du ventricule en question (onde de dépolarisation retardée arrivant vers l’électrode, donc positive). Le bloc est dit incomplet si le QRS est entre 100 et 120 ms, et complet si le QRS ≥ 120 ms :
- bloc de branche droit : l’ECG retrouvera un aspect rsR’ ou sR’ dans les dérivations droites (V1-V2), le R’ correspondant à la dépolarisation du ventricule droit avec retard depuis le ventricule gauche. Dans les dérivations gauches (V6-DI), l’ECG objectivera une onde S traînante, correspondant à la dépolarisation avec retard du ventricule droit, traduite par une petite onde négative lente fuyant les dérivations gauches à la fin du QRS ;
- bloc de branche gauche : l’ECG retrouvera un aspect RR’ dit en M dans les dérivations gauches (V6-DI), avec le R’ correspondant à la dépolarisation du ventricule gauche avec retard depuis le ventricule droit. La petite onde q septale physiologique dans les dérivations gauches (correspondant à la petite onde r en V1) disparaît, puisque la dépolarisation septale ne se fait plus de gauche à droite. Dans les dérivations droites (V1-V2), les QRS seront très négatifs, avec un aspect QS en V1.
Hémiblocs
Hémibloc postérieur gauche (HBPG) : atteinte de l’hémibranche postérieure gauche. Il se traduit à l’ECG par un axe hyperdroit (≥ 120 °). La branche postérieure gauche étant plus robuste que la branche antérieure, son atteinte traduit une altération plus sévère du tissu conductif.
Devant un axe hypergauche, il convient d’éliminer un bloc de branche gauche, une hypertrophie ventriculaire gauche électrique ainsi qu’une séquelle d’infarctus inférieur, avant de conclure à un hémibloc antérieur gauche.
Devant un axe hyperdroit, il convient d’éliminer une hypertrophie ventriculaire droite avant de conclure à un hémibloc postérieur gauche. En revanche, un axe hyperdroit ne peut être attribué à un bloc de branche droit, donc bloc de branche droit + axe hyperdroit = bloc de branche droit + hémibloc postérieur gauche.
Les branches dites fasciculaires correspondent à la branche droite, l’hémibranche antérieure gauche et l’hémibranche postérieure gauche.
Un bloc bifasciculaire correspond à un bloc de branche droit + hémibloc antérieur gauche, ou bloc de branche droit + hémibloc postérieur gauche.
Le bloc de branche gauche est un bloc bifasciculaire en soit (branches antérieure et postérieure gauche bloquées), même si le terme est peu utilisé en ce sens.
Un bloc trifasciculaire correspond aux 3 branches qui sont altérées, donc :
- soit un bloc de branche droit avec un HBAG alternant avec un HBPG (selon le moment où l’ECG est réalisé) ;
- soit un bloc de branche droit alternant avec un bloc de branche gauche (selon le moment où l’ECG est réalisé), appelé également bloc de branche alternant.
À noter que le terme bloc trifasciculaire est parfois utilisé à tort pour nommer un bloc bifasciculaire avec BAV 1 (le BAV 1 étant habituellement nodal, il n’atteint pas l’une des 3 branches fasciculaires).
Examens complémentaires diagnostiques
Holter-ECG des 24 heures
En cas de symptômes cliniques avec un ECG objectivant des troubles de conduction mais sans bradycardie objectivée (par exemple un seul bloc de branche), il est possible de réaliser un holter-ECG des 24 heures afin d’objectiver un trouble de conduction de haut degré paroxystique.L’enregistrement n’étant que de 24 heures, son absence durant cette surveillance n’élimine évidemment pas le diagnostic. Cet examen devra alors être répété.
Épreuve d’effort
Elle permettra d’objectiver une insuffisance chronotrope, un bloc hisien d’effort, et sera utile pour caractériser le siège nodal (Mobitz 1) ou infranodal (Mobitz 2) d’un BAV 2 en 2/1. En effet, à l’effort, la stimulation sympathique et l’imprégnation en catécholamines vont améliorer la conduction du nœud atrioventriculaire, donc faire disparaître le bloc en cas de BAV nodal (où à l’inverse aggraver un bloc infranodal, qui deviendra plus évident).Exploration électrophysiologique (EEP) endocavitaire
L’objectif est de visualiser le signal hisien, invisible sur l’ECG de surface. Le principe consiste à monter une ou deux sonde(s) via la veine fémorale jusqu’aux cavités cardiaques droites, afin de mesurer le temps que met l’influx pour se propager des oreillettes (A) au faisceau de His (H) = délai AH, puis du faisceau de His (H) jusqu’aux ventricules (V) = délai HV.Cet examen est réalisé en cas de symptômes de type lipothymie/syncope avec anomalies à l’ECG mais sans trouble de conduction de haut degré objectivé. Si le HV est > 70 ms chez un patient symptomatique, cela démontre un trouble de conduction infranodal significatif, et l’hypothèse d’un BAV complet paroxystique devient alors plausible. Un stimulateur cardiaque devra donc être implanté.
Étiologie des troubles de conduction
Causes communes aux blocs sino-atriaux et atrioventriculaires
Dégénératif
Il s’agit de la cause la plus fréquente, touchant préférentiellement le sujet âgé. Le BAV d’origine dégénérative correspond à la maladie de Lenègre. C’est un diagnostic d’élimination.Ischémique
Les troubles de conduction liés à un infarctus inférieur sont à distinguer de ceux liés à un infarctus antérieur.L'infarctus inférieur (coronaire droite) peut se compliquer d’une dysfonction sinusale ou d’un BAV 3 nodal, non pas par une lésion de ces structures, mais par une hyperactivation du nerf vague ralentissant la conduction à ces deux niveaux. L’administration d’atropine, médicament anticholinergique donc inhibant l’effet vagal parasympathique, permet alors de d’accélérer la fréquence cardiaque en réduisant les troubles conductifs. Les troubles de conduction d’un infarctus inférieur sont de bon pronostic à court terme (BAV 3 nodal, donc échappement à QRS fins avec bradycardie modérée) et à long terme (récupération généralement ad integrum après reperfusion coronaire, sans nécessité d’implanter un stimulateur cardiaque définitif).
Infarctus antérieur : le faisceau de His et ses branches sont traditionnellement vascularisés par l’artère interventriculaire antérieure. Un infarctus antérieur, par atteinte de l’interventriculaire antérieure, peut alors entraîner un BAV infrahisien lésionnel. Il nécessite d’emblée la montée d’une sonde d’entraînement électrosystolique. Il n’y a pas de place pour l’atropine, inefficace, ou l’isoprénaline, pro-arythmogène dans le contexte d’infarctus aigu. Ce BAV infrahisien étant lésionnel, il persiste habituellement malgré la reperfusion coronaire, et nécessite alors la pose d’un stimulateur cardiaque définitif.
Médicamenteuse
Les médicaments ralentissant la fréquence cardiaque comme les bêtabloquants, y compris sous forme de collyres, l’ivabradine (dysfonction sinusale seulement), les inhibiteurs calciques bradycardisants, les antiarythmiques, les digitaliques, etc., peuvent être à l’origine de troubles de conduction.Métabolique
L’hyperkaliémie entraîne généralement une hypoexcitabilité du myocarde, donc des troubles de conduction à tous les étages. L’hypercalcémie peut entraîner des BAV également.Vagale
Le système parasympathique via le nerf vague inhibe le nœud sinusal et le nœud atrioventriculaire. Une pause sinusale ou un BAV nodal peuvent alors être déclenchés par une hyperstimulation vagale. Le sportif peut également être bradycarde, physiologiquement, par hypertonie vagale.Post-chirurgie cardiaque
Des lésions du faisceau de His peuvent entraîner des blocs atrioventriculaires, et les cicatrices atriales des blocs sino-atriaux.Autres causes
On retiendra aussi :- l’hypothyroïdie profonde ;
- les maladies de surcharge comme l'amylose.
Causes spécifiques
Dysfonction sinusale
Hypertension intracrânienne, hémorragie sous-arachnoïdienne.Maladie rythmique de l’oreillette : présence de fibrose dans les oreillettes, entraînant des épisodes de fibrillation atriale (fibrose faisant le lit de circuits de réentrées électriques) alternant avec des épisodes de dysfonction sinusale (fibrose autour du nœud sinusal, empêchant l’influx de se propager aux oreillettes).
À ne pas confondre avec la bradyarythmie (bradycardie chez un patient en fibrillation atriale, du fait d’un trouble de conduction atrioventriculaire).
Blocs atrioventriculaires
Valvulopathies, notamment aortiques, car la valve aortique se situe anatomiquement proche du septum et des voies de conduction de la jonction atrioventriculaire. Un remplacement de la valve aortique par voie chirurgicale ou percutanée peut se compliquer d’un BAV, qui peut être réversible si simple œdème postopératoire compressif. Un abcès septal d’une endocardite infectieuse aortique ou une coulée des calcifications d’un rétrécissement aortique calcifié sur les voies de conduction peuvent également entraîner un BAV.BAV congénitaux soit associés à une cardiopathie congénitale, soit liés à la présence d’anticorps lupiques maternels anti-SSA ou anti-SSB.
BAV de la petite enfance (physiopathologie encore inconnue, probable origine infectieuse).
BAV post-radiothérapie.
Maladie de Lyme (BAV classiquement nodal).
Blocs de branche
Bloc de branche droit incomplet isolé : fréquent en population générale, considéré comme bénin.Bloc de branche droit complet : doit faire évoquer une pathologie du ventricule droit, qui peut être congénitale, liée à une cardiomyopathie (dysplasie arythmogène du ventricule droit) ou secondaire à une pathologie pulmonaire (toute cause d’hypertension artérielle pulmonaire, embolie pulmonaire…). Il peut également être bénin si isolé. Il ne faut pas le confondre avec l’aspect d’un syndrome de Brugada.
Bloc de branche gauche : à l’inverse, il est le plus souvent pathologique. Il doit faire rechercher une cardiopathie sous-jacente, bien qu’étant le plus souvent d’origine dégénérative.
Le bilan étiologique d’un trouble de conduction, en plus de l’interrogatoire détaillé et de l’examen clinique, comporte donc :
- une biologie : ionogramme sanguin (hyperkaliémie, hypercalcémie), troponine (infarctus), TSH (hypothyroïdie) ;
- une échographie cardiaque transthoracique : recherche d’une cardiopathie sous-jacente.
Prise en charge thérapeutique
Prise en charge aiguë d’une bradycardie symptomatique
Il est recommandé de commencer par un traitement chronotrope positif médicamenteux :
- isoprénaline par voie intraveineuse à la seringue électrique (IVSE) dans la majorité des cas ;
- atropine en cas de suspicion de mécanisme vagal, notamment dans les dysfonctions sinusales ou les blocs atrioventriculaires des infarctus inférieurs.
Prise en charge au long cours d’un trouble de conduction
Un stimulateur cardiaque est composé d’un boîtier contenant la pile, et d’une, deux ou trois sondes positionnées dans les cavités cardiaques. Chaque sonde présente deux fonctions : une fonction d’écoute (de l’activité électrique spontanée), et une fonction de stimulation (en l’absence d’activité électrique spontanée). La stimulation peut se voir sur l’ECG sous forme de spike (petit trait vertical).
Stimulateur double chambre
Dans la majorité des cas, le stimulateur implanté est double chambre, avec une sonde dans l’oreillette droite et une sonde dans le ventricule droit. En cas de bloc atrioventriculaire complet, la sonde dans l’oreillette droite a pour fonction d’écouter les ondes P afin de synchroniser la stimulation ventriculaire à l’activité atriale spontanée.En cas de dysfonction sinusale isolée, une sonde dans le ventricule droit en plus de celle dans l’oreillette droite sera le plus souvent mise en place car ces patients présentent fréquemment des épisodes de blocs atrioventriculaires lors du suivi.
Stimulateur simple chambre
La principale indication du stimulateur simple chambre est le bloc atrioventriculaire survenant sur de la fibrillation atriale permanente, car il n’y a alors plus d’intérêt à synchroniser la stimulation ventriculaire à l’activité atriale. Seule une sonde dans le ventricule droit sera mise en place.Stimulateur triple chambre (stimulation biventriculaire ou resynchronisation)
Les indications du stimulateur cardiaque triple chambre (oreillette droite + ventricule droit + ventricule gauche) sont plus rares. La resynchronisation peut être proposée en cas de bloc de branche complet (en particulier gauche) associé à une dysfonction ventriculaire gauche, afin d’améliorer l’hémodynamique et le pronostic du patient. Une resynchronisation peut également être indiquée lorsqu’il est craint une aggravation de la fonction systolique ventriculaire gauche par une stimulation permanente inévitable du ventricule droit (désynchronisation interventriculaire, évitée alors par la stimulation biventriculaire du stimulateur triple chambre).Stimulateur sans sonde
De développement récent (POINTS FORTS À RETENIR
Le BSA se traduit à l’ECG par une absence intermittente ou permanente de l’onde P. Le bloc atrioventriculaire se traduit à l’ECG par une anomalie de l’espace PR (allongé, voire bloqué), avec des ondes P non suivies de QRS.
Sur un BAV complet, plus le bloc est bas situé, plus le rythme d’échappement sera lent et symptomatique.
Une bradycardie symptomatique se traite en urgence par des moyens pharmacologiques (isoprénaline, atropine) en première intention, et en cas d’échec par une sonde d’entraînement électrosystolique endocavitaire.
Avant d’implanter un stimulateur cardiaque définitif, il faut éliminer une cause aiguë réversible, notamment une hyperkaliémie ou une ischémie du myocarde inférieur.
Les principales indications du stimulateur cardiaque définitif sont les suivantes :
– troubles de la conduction de haut degré, habituellement symptomatiques : BSA de type 2 ou 3, et BAV infranodal ;
– délai HV > 70 ms à l’exploration électrophysiologique endocavitaire chez un patient ayant présenté une syncope.
Les BAV 1 et BAV 2 Mobitz 1 (de localisation nodale) asymptomatiques, ainsi que les blocs bifasciculaires, ne sont pas des indications à une stimulation cardiaque.

 Encadrés
Encadrés