La tuberculose est encore aujourd’hui la principale cause de mortalité infectieuse dans le monde. Les nouveaux cas sont majoritairement en Asie du Sud-Est, en Afrique subsaharienne et en Europe de l’Est. La lutte contre cette affection est confrontée à une problématique émergente : l’apparition de résistances aux antibiotiques.
La France est considérée désormais comme un pays à faible incidence, avec moins de 10 cas annuels pour 100 000 habitants, ce qui engendre une perte d’expertise progressive dans ce domaine. Si le bacille est sensible, le traitement est largement standardisé : quadrithérapie pendant 2 mois (isoniazide [INH] 5 mg/kg/j, rifampicine 10 mg/kg/j, éthambutol 15-20 mg/kg/j, pyrazinamide 25-30 mg/kg/j), suivie par une bithérapie durant 4 mois (INH + rifampicine aux mêmes doses). Tel n’est pas le cas pour les souches résistantes, dont la prise en charge est complexe.
La France est considérée désormais comme un pays à faible incidence, avec moins de 10 cas annuels pour 100 000 habitants, ce qui engendre une perte d’expertise progressive dans ce domaine. Si le bacille est sensible, le traitement est largement standardisé : quadrithérapie pendant 2 mois (isoniazide [INH] 5 mg/kg/j, rifampicine 10 mg/kg/j, éthambutol 15-20 mg/kg/j, pyrazinamide 25-30 mg/kg/j), suivie par une bithérapie durant 4 mois (INH + rifampicine aux mêmes doses). Tel n’est pas le cas pour les souches résistantes, dont la prise en charge est complexe.
De nouvelles résistances
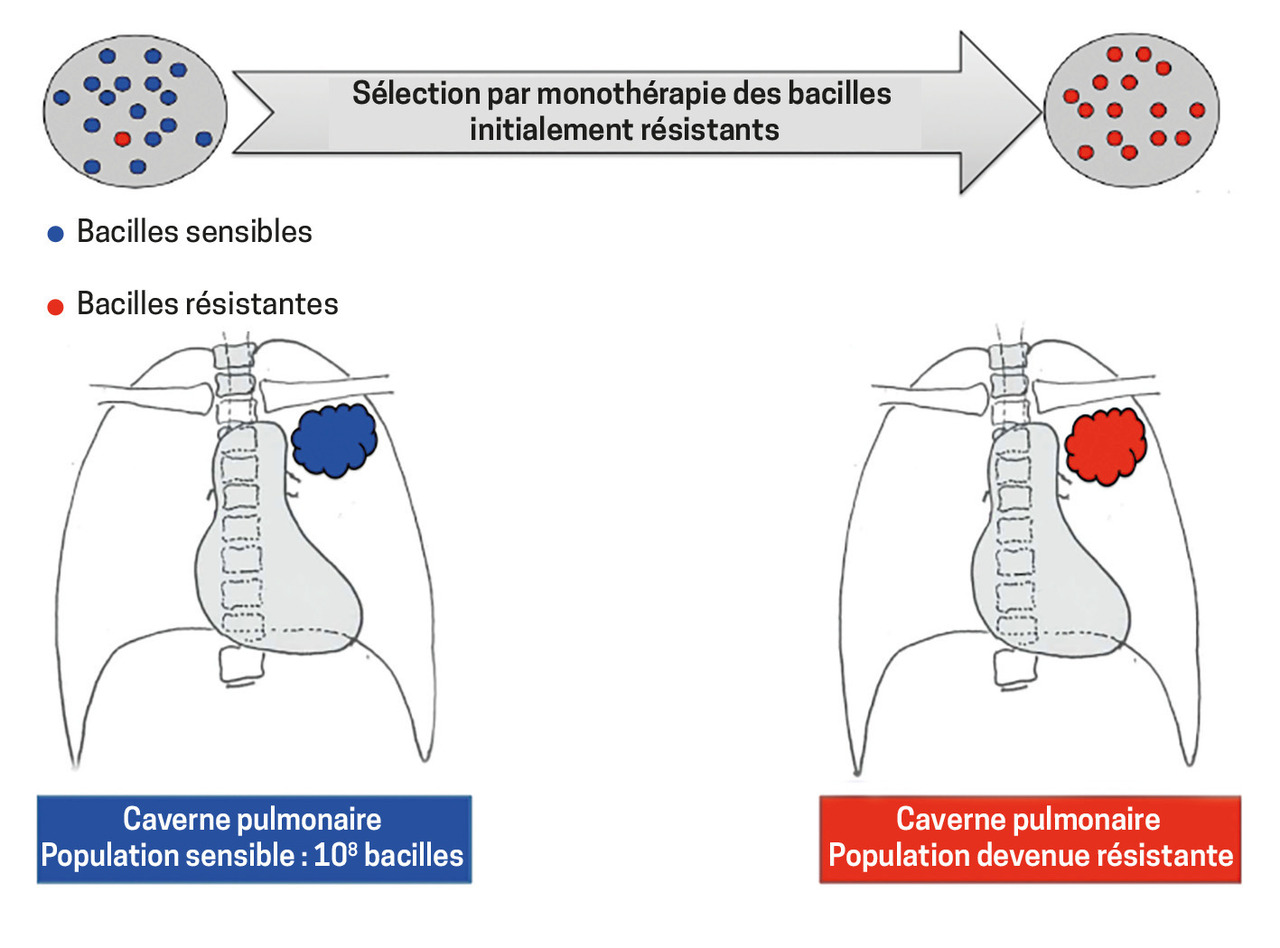
Comme toute bactérie, Mycobacterium tuberculosis développe des mutations de son génome en se répliquant, dont certaines peuvent conférer la résistance aux antituberculeux. La fréquence de survenue est faible : 10-5 pour l’INH et 10-7 pour la rifampicine. De ce fait, une caverne tuberculeuse de 108 bacilles en contient environ 1 000 résistants à l’INH et 10 à la rifampicine. Ainsi, en cas de monothérapie par antibiotique, ces mutants sont progressivement sélectionnés, ce qui aboutit à un échec clinique avec apparition d’une résistance acquise ou secondaire chez un patient donné. Si ce dernier transmet les bacilles à son entourage, les personnes concernées feront une forme d’emblée résistante (résistance primaire).
Pour limiter ce phénomène, on propose toujours un traitement associant plusieurs molécules. En effet, la probabilité que les mutations de résistance à l’INH et à la rifampicine surviennent simultanément est très faible (10-5 x 10-7 = 10-12) chez un patient qui héberge habituellement 108 à 109 bacilles.
Depuis le début des années 1990, des souches plurirésistantes sont apparues. Est dite « multirésistante » (MDR) celle qui met en échec les 2 principaux agents de première ligne (INH et rifampicine). Certains de ces bacilles ont développé des résistances supplémentaires à des molécules de seconde intention (fluoroquinolones et aminosides), devenant ainsi ultrarésistants (XDR), principalement en raison de la mauvaise utilisation de ces antibiotiques (durée de traitement et nombre de molécules insuffisants). Les ressources thérapeutiques sont alors très limitées, ce qui explique le pronostic sombre. La mortalité à 1 an, qui est de 10 % pour les tuberculoses à bacilles sensibles, est augmentée à 17 et 23 % pour les souches MDR et XDR, respectivement.1
Pour limiter ce phénomène, on propose toujours un traitement associant plusieurs molécules. En effet, la probabilité que les mutations de résistance à l’INH et à la rifampicine surviennent simultanément est très faible (10-5 x 10-7 = 10-12) chez un patient qui héberge habituellement 108 à 109 bacilles.
Depuis le début des années 1990, des souches plurirésistantes sont apparues. Est dite « multirésistante » (MDR) celle qui met en échec les 2 principaux agents de première ligne (INH et rifampicine). Certains de ces bacilles ont développé des résistances supplémentaires à des molécules de seconde intention (fluoroquinolones et aminosides), devenant ainsi ultrarésistants (XDR), principalement en raison de la mauvaise utilisation de ces antibiotiques (durée de traitement et nombre de molécules insuffisants). Les ressources thérapeutiques sont alors très limitées, ce qui explique le pronostic sombre. La mortalité à 1 an, qui est de 10 % pour les tuberculoses à bacilles sensibles, est augmentée à 17 et 23 % pour les souches MDR et XDR, respectivement.1
Modifications épidémiologiques
Le nombre de nouveaux cas de tuberculose MDR dans le monde est estimé à environ 500 000 par an, dont 10 % de XDR.2 Chine, Inde et Fédération de Russie concentrent près de 50 % des cas. Dans les pays d’Europe de l’Est, la proportion des formes MDR – par rapport à l’ensemble des nouveaux cas – est la plus importante.
En France, la proportion, stable de 2002 à 2010 – autour de 1 % des tuberculoses – a doublé depuis 2012, atteignant une centaine de cas par an.3 L’Île-de-France en concentre la moitié. Parallèlement, des souches XDR sont apparues, qui représentent désormais 25 % des MDR. Ces modifications épidémiologiques sont dues à l’arrivée de patients en provenance de l’ex-URSS (deux tiers des cas), dont un tiers sont originaires de Géorgie.3 Ces sujets sont jeunes, avec un âge médian de 32 ans. Plus de la moitié des individus venant d’Europe de l’Est ont déjà reçu un antituberculeux dans leur parcours de soin.3
L’enjeu actuel est d’identifier, au sein d’une population générale à faible incidence, les sous-groupes à fort risque de tuberculose résistante, et de les orienter rapidement vers une prise en charge hospitalière. Les principaux facteurs de risque sont un antécédent de traitement antituberculeux et certaines origines géographiques (les pays d’ex-URSS en particulier).
En France, la proportion, stable de 2002 à 2010 – autour de 1 % des tuberculoses – a doublé depuis 2012, atteignant une centaine de cas par an.3 L’Île-de-France en concentre la moitié. Parallèlement, des souches XDR sont apparues, qui représentent désormais 25 % des MDR. Ces modifications épidémiologiques sont dues à l’arrivée de patients en provenance de l’ex-URSS (deux tiers des cas), dont un tiers sont originaires de Géorgie.3 Ces sujets sont jeunes, avec un âge médian de 32 ans. Plus de la moitié des individus venant d’Europe de l’Est ont déjà reçu un antituberculeux dans leur parcours de soin.3
L’enjeu actuel est d’identifier, au sein d’une population générale à faible incidence, les sous-groupes à fort risque de tuberculose résistante, et de les orienter rapidement vers une prise en charge hospitalière. Les principaux facteurs de risque sont un antécédent de traitement antituberculeux et certaines origines géographiques (les pays d’ex-URSS en particulier).
Principes de prise en charge
Détection des patients contaminés
Seule l’indentification de bacilles appartenant au complexe Tuberculosis, qui nécessite plusieurs semaines de culture, fait le diagnostic avec certitude. Toutefois, dans la moitié des formes pulmonaires, l’examen direct des prélèvements au microscope peut les mettre en évidence immédiatement. Les patients très bacillifères, les plus contagieux, sont isolés et traités, sans attendre les résultats de la culture.4
Identifier la résistance
Les délais se sont considérablement réduits grâce aux techniques de biologie moléculaire. Ainsi, le traitement initial tient compte des mutations de résistance retrouvées et peut être éventuellement adapté aux résultats de l’antibiogramme obtenu plusieurs semaines plus tard.
La résistance isolée à la rifampicine est rare en France : elle est associée à celle à l’INH dans 90 % des cas. Ainsi, les mutations du gène rpoB, cible de la rifampicine, sont prédictives de MDR. Il est recommandé de les rechercher systématiquement lors de tout diagnostic microbiologique.4 Des tests commerciaux les identifient en quelques heures.
La résistance isolée à la rifampicine est rare en France : elle est associée à celle à l’INH dans 90 % des cas. Ainsi, les mutations du gène rpoB, cible de la rifampicine, sont prédictives de MDR. Il est recommandé de les rechercher systématiquement lors de tout diagnostic microbiologique.4 Des tests commerciaux les identifient en quelques heures.
Traitement
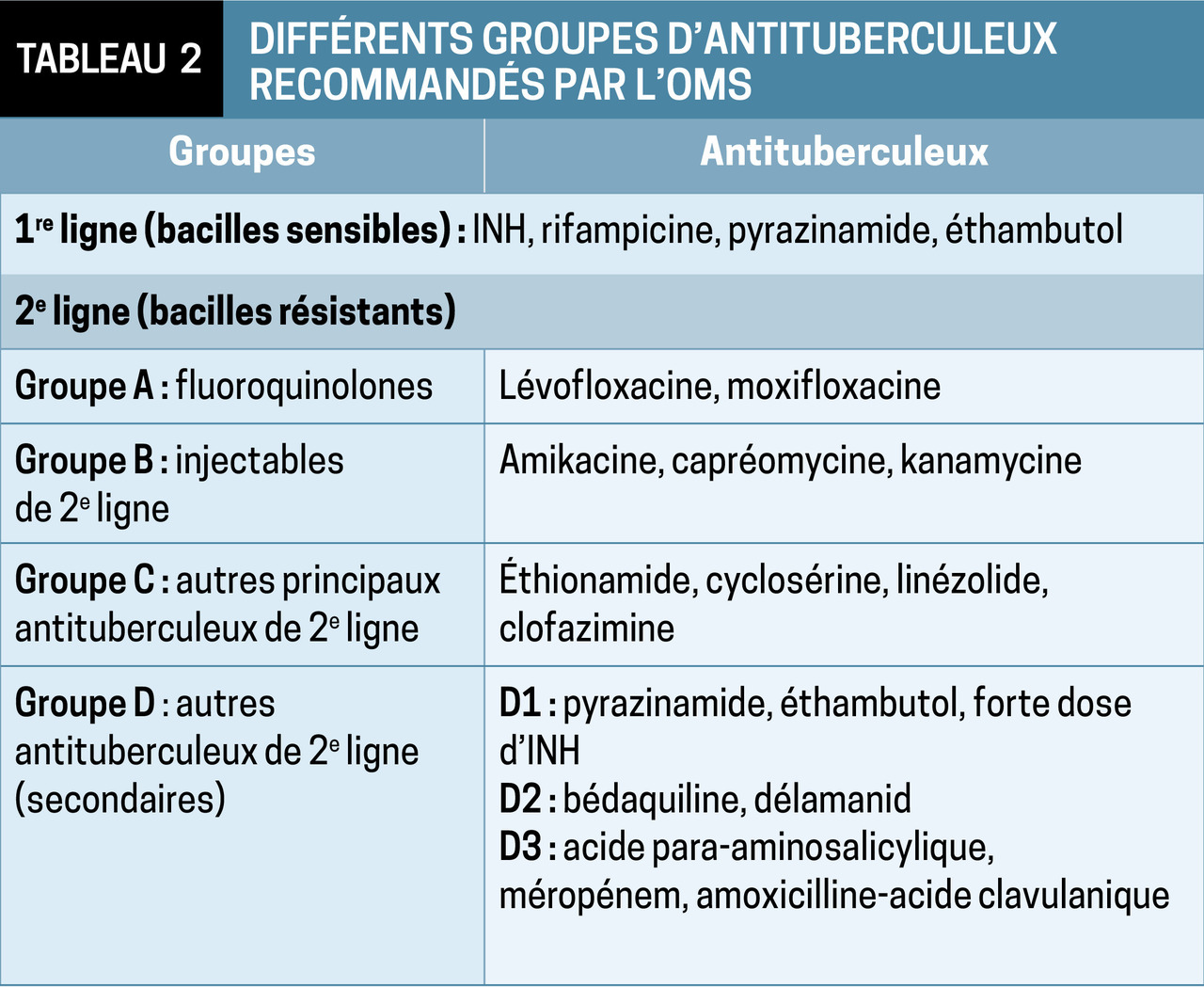
Il est plus contraignant que celui des tuberculoses à bacilles sensibles (tableaux 1 et 2) : antituberculeux de première ligne auxquels la souche reste sensible, accompagnés de molécules de réserve, moins efficaces et plus toxiques. La bonne observance est essentielle pour prévenir l’apparition de résistances secondaires supplémentaires et stériliser durablement les lésions.
Les situations d’impasse thérapeutique, en cas d’inefficacité ou d’intolérance, poussent parfois vers des gestes chirurgicaux (utilisés avant l’ère des antibiotiques), résection des grosses lésions tuberculeuses visant à réduire la charge bacillaire.4
Des transmissions en milieu hospitalier ayant été décrites, les mesures d’isolement respiratoire doivent être strictes et prolongées jusqu’à la négativation des cultures des expectorations.
Le dépistage des sujets contacts est systématique. Traiter une infection latente à bacille résistant n’est pas systématique mais discuté avec le centre national de référence des mycobactéries.
Les situations d’impasse thérapeutique, en cas d’inefficacité ou d’intolérance, poussent parfois vers des gestes chirurgicaux (utilisés avant l’ère des antibiotiques), résection des grosses lésions tuberculeuses visant à réduire la charge bacillaire.4
Des transmissions en milieu hospitalier ayant été décrites, les mesures d’isolement respiratoire doivent être strictes et prolongées jusqu’à la négativation des cultures des expectorations.
Le dépistage des sujets contacts est systématique. Traiter une infection latente à bacille résistant n’est pas systématique mais discuté avec le centre national de référence des mycobactéries.
* Services de pneumologie ; des maladies infectieuses et tropicales expérimentées ; sanatorium de Bligny.
Références
1. Shah NS, et al. Extensively drug-resistant tuberculosis in the United States, 1993-2007. JAMA 2008;300:2153-60.
2. World Health Organization. Global Tuberculosis Report 2017. https://bit.ly/2Vl1PJk
3. CNR des mycobactéries et de la résistance des mycobactéries aux antituberculeux. Rapport annuel d’activité 2016. https://bit.ly/2IeroYX
4. HCSP.Tuberculoses à bacilles résistants : diagnostic et prise en charge. Décembre 2014. https://bit.ly/2WT6McV
5. Appelgren A, et al. Investigation of pre-XDR Beijing Mycobacterium tuberculosis transmission to a healthcare worker in France, 2016. J Hosp Infect 2017;97:414-7.
2. World Health Organization. Global Tuberculosis Report 2017. https://bit.ly/2Vl1PJk
3. CNR des mycobactéries et de la résistance des mycobactéries aux antituberculeux. Rapport annuel d’activité 2016. https://bit.ly/2IeroYX
4. HCSP.Tuberculoses à bacilles résistants : diagnostic et prise en charge. Décembre 2014. https://bit.ly/2WT6McV
5. Appelgren A, et al. Investigation of pre-XDR Beijing Mycobacterium tuberculosis transmission to a healthcare worker in France, 2016. J Hosp Infect 2017;97:414-7.