objectifs
Mélanome
Le mélanome est un cancer développé aux dépens des mélanocytes ; il est moins fréquent mais de pronostic plus sévère que les carcinomes cutanés.
Épidémiologie
Le mélanome touche environ 11 000 personnes chaque année en France (10/100 000 personnes-années), arrivant en 9e position chez l’homme et 6e chez la femme. C’est un des cancers pour lesquels l’incidence a le plus augmenté au cours des dernières décennies. Une hausse continue a été observée au cours des 4 dernières décennies dans les populations blanches des différents pays du monde. Il est responsable de plus de 1 600 décès par an mais la mortalité n’a pas augmenté autant que l’incidence. Le mélanome peut survenir à tout âge, avec un pic d’incidence autour de 55 ans. Il reste très rare chez l’enfant. Si les formes diagnostiquées précocement sont de bon pronostic, les formes métastatiques sont de pronostic redoutable. La prévention repose sur le dépistage précoce des sujets à risque et la protection solaire.
Facteurs de risque
Ce sont :
- l’exposition solaire et aux ultraviolets artificiels, en particulier les expositions intermittentes et intenses (« brûlures solaires ») dans l’enfance mais aussi à l’âge adulte ;
- les facteurs génétiques : environ 10 % des mélanomes surviennent dans un contexte de mélanome familial défini par au moins 2 personnes atteintes de mélanome chez des apparentés au 1er ou 2e degré. Plusieurs gènes sont impliqués dans la prédisposition génétique au mélanome (CDKN2A, CDK4, BAP1 [risque élevé], MC1R, MITF [risque intermédiaire]). Un antécédent personnel de mélanome expose également au risque de second mélanome (5-8 %) ;
- les phototypes clairs (peau claire, roux avec éphélides, blond, yeux bleus) (tableau 1 : phototype selon Fitzpatrick) ;
- un nombre élevé de nævi (> 50) ;
- un syndrome des nævi atypiques : nombre de nævi > 50, de grande taille (> 5 mm) avec des aspects atypiques (bords irréguliers, couleur inhomogène) ;
- l’immunodépression constitutionnelle ou acquise ;
- un nævus congénital géant (> 20 cm). Les nævi congénitaux surviennent chez 1 % des individus et sont souvent recouverts de poils. Ils sont associés à un risque accru de développer un mélanome s’ils sont de grande taille. Ainsi, par précaution, conseille-t-on l’exérèse préventive des nævi congénitaux de plus de 20 cm de diamètre.
Histoire naturelle
La majorité des mélanomes apparaissent de novo, sur peau saine, et non de la transformation maligne d’un nævus pigmentaire.
Les mélanomes se développent typiquement en deux phases :
- une phase initiale d’extension en surface, dite « horizontale » épidermique ;
- puis une phase de croissance verticale invasive vers la profondeur du derme voire de l’hypoderme exposant alors au risque de métastases.
Toutefois, certains mélanomes ont d’emblée une phase de croissance verticale (mélanomes nodulaires).
Diagnostic
Diagnostic clinique
Le diagnostic est suspecté à l’examen clinique, souvent aidé de l’examen en épiluminescence. Ce dernier s’effectue avec un dermoscope, instrument portable qui permet d’analyser la jonction dermo-épidermique et augmente la spécificité et la sensibilité du diagnostic.
Le diagnostic doit être confirmé par l’examen anatomopathologique, après exérèse de la totalité de la lésion.
L’algorithme ABCDE propose une méthode simple, peu spécifique, et surtout utilisée pour l’éducation des patients à l’autodépistage :
- A : asymétrie ;
- B : bords irréguliers ;
- C : couleur inhomogène (polychrome, zones dépigmentées) ;
- D : diamètre > 6 mm ;
- E : évolution récente (extension en taille, modification en forme, en couleur, en relief) qui est le critère le plus fiable.
Dans la pratique courante, les dermatologues utilisent souvent une approche plus globale et prennent particulièrement en compte le critère évolutif fondé sur l’interrogatoire et la comparaison à des photographies antérieures. Une analyse comparative de la lésion par rapport à l’ensemble des nævi du sujet, permettant de repérer le « vilain petit canard », est utile car une lésion pigmentée est d’autant plus suspecte qu’elle est différente des autres. Les mélanomes ne sont pas constamment pigmentés. Ils peuvent être achromiques, notamment dans les formes nodulaires, ce qui correspond à une dé-différentiation avec une diminution ou un arrêt de la synhèse de mélanine par les mélanocytes tumoraux.
L’apparition d’un prurit ou d’un saignement en regard d’une lésion pigmentée mélanocytaire doit inquiéter.
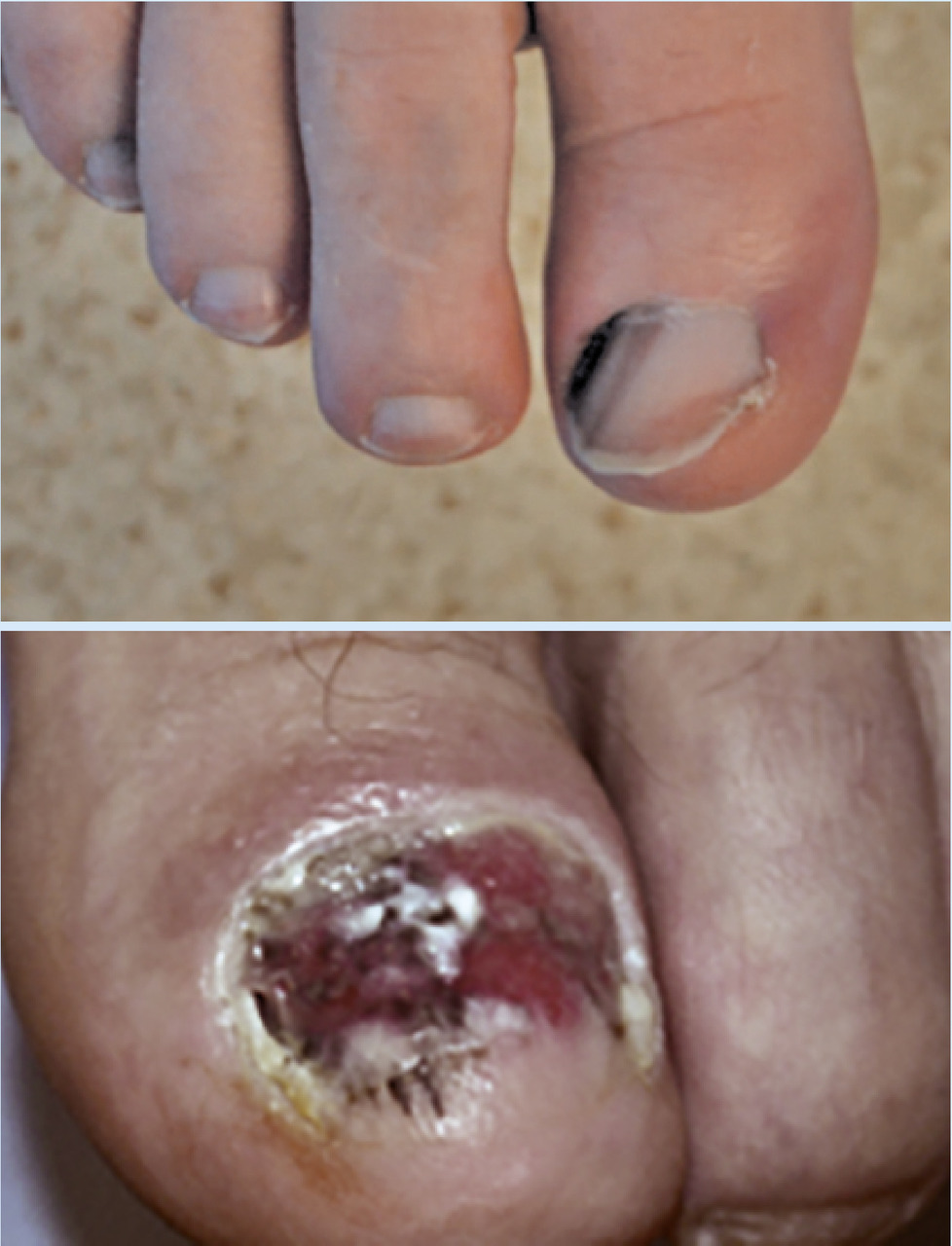
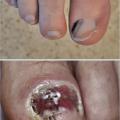
Le mélanome unguéal se présente sous la forme d’une bande pigmentée (mélanonychie) longitudinale hétérochrome à bords flous avec à la phase tardive, un débordement pigmentaire péri- unguéal (signe de Hutchinson) souvent associé à une destruction de la tablette unguéale et à une ulcération ou à une tumeur exophytique. L’élément clinique le plus important est l’évolutivité de la lésion au cours du temps, en particulier son élargissement. Le diagnostic différentiel avec des mélanonychies longitudinales ethniques est assez aisé. Ces dernières sont fréquentes chez les sujets de phototypes foncés, sont souvent multiples et de largeur variable et présentent une pigmentation linéaire homogène. Un autre diagnostic différentiel est celui de nævus pigmentaire de la matrice unguéale, qui donne une bande plus régulière et peu évolutive.
Histologie
Le diagnostic de mélanome est histologique. Une exérèse, qui permet une analyse en totalité de la lésion (contrairement à une biopsie qui réalise une analyse partielle), est effectuée devant toute lésion pigmentée atypique. Une biopsie est néanmoins acceptable en cas de lésion pigmentée de grande taille dont l’exérèse d’emblée serait délabrante (visage). On réalise alors la biopsie sur la zone la plus suspecte cliniquement ou dermoscopiquement.
L’histologie permet de confirmer le diagnostic de mélanome mais également d’analyser les marges d’exérèse pour s’assurer de l’absence de reliquat tumoral et de déterminer des paramètres histopronostiques. On distingue 4 types de mélanomes.
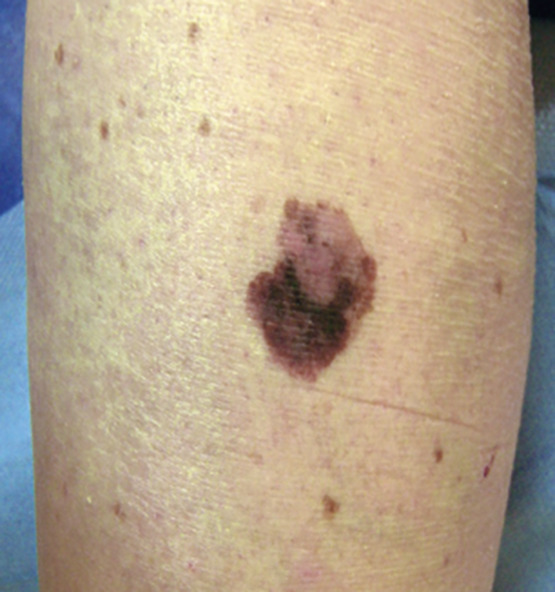
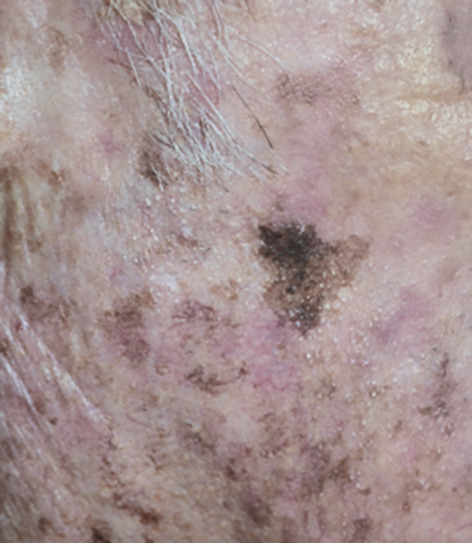
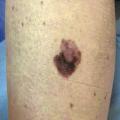
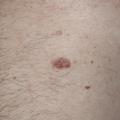
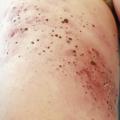
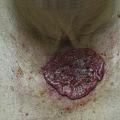
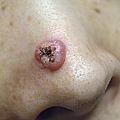
- le mélanome superficiel extensif (SSM) : le plus fréquent (60-70 % des cas) (fig. 1) pouvant également être achromique (fig. 2) ;
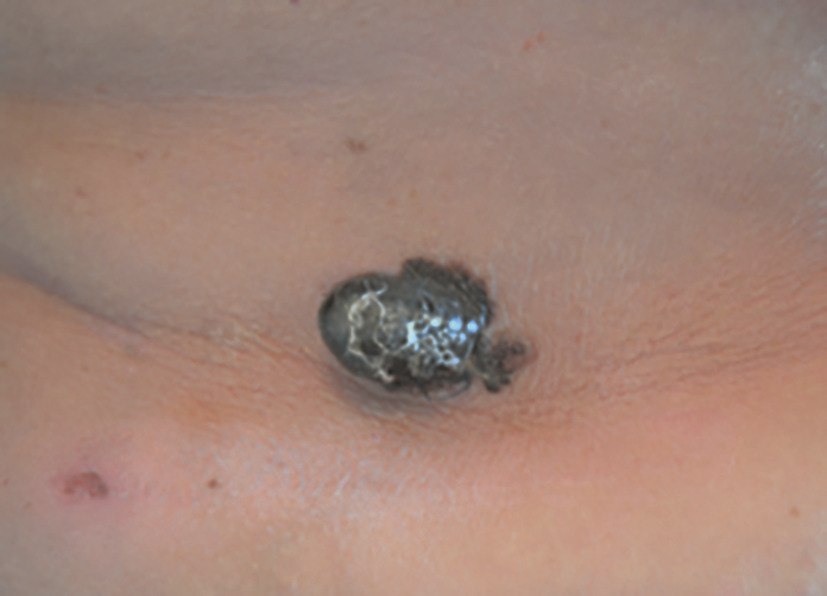
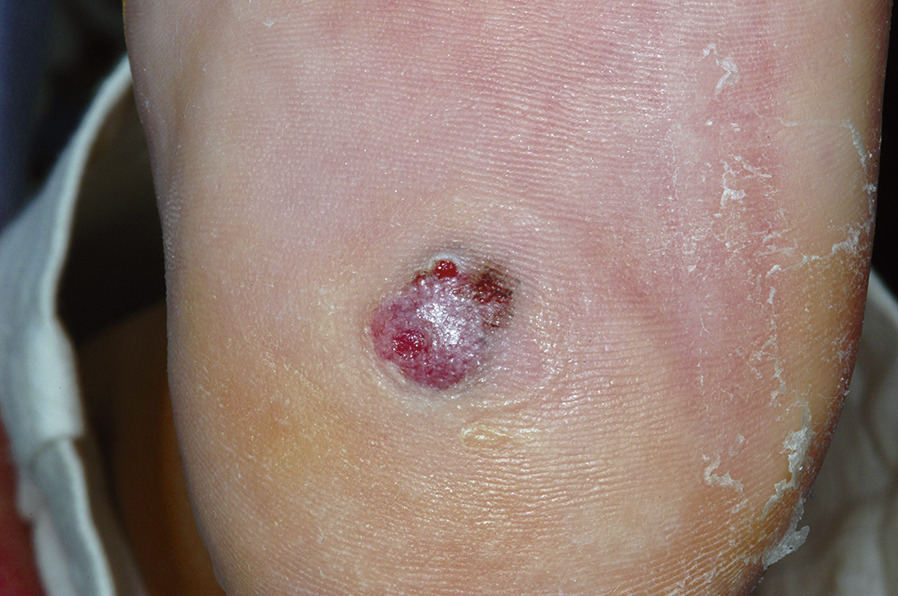
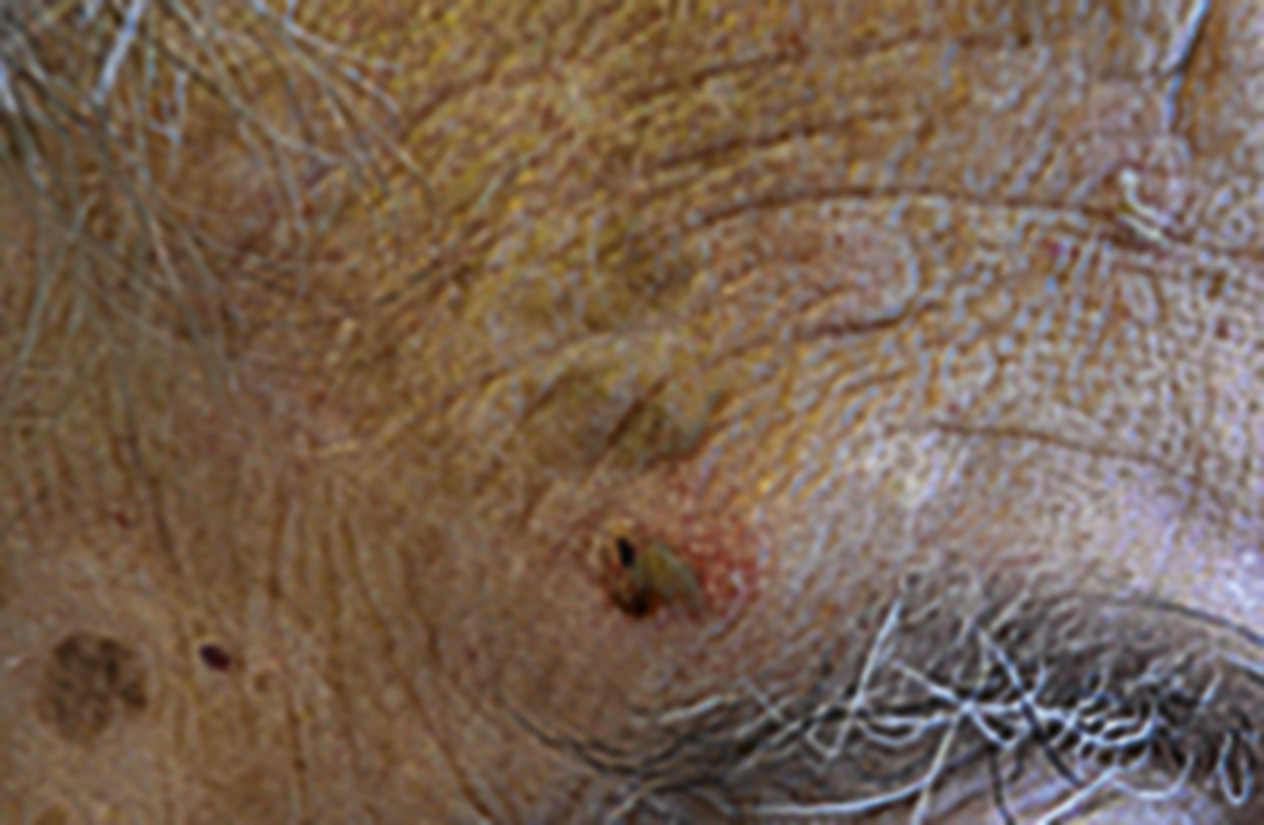
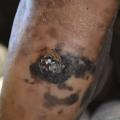
- le mélanome acral lentigineux (2-5 % des cas) : siégeant sur les extrémités (paumes, plantes [fig. 3] et ongles [fig. 4A et B]), pouvant atteindre les patients de phototypes foncés ;
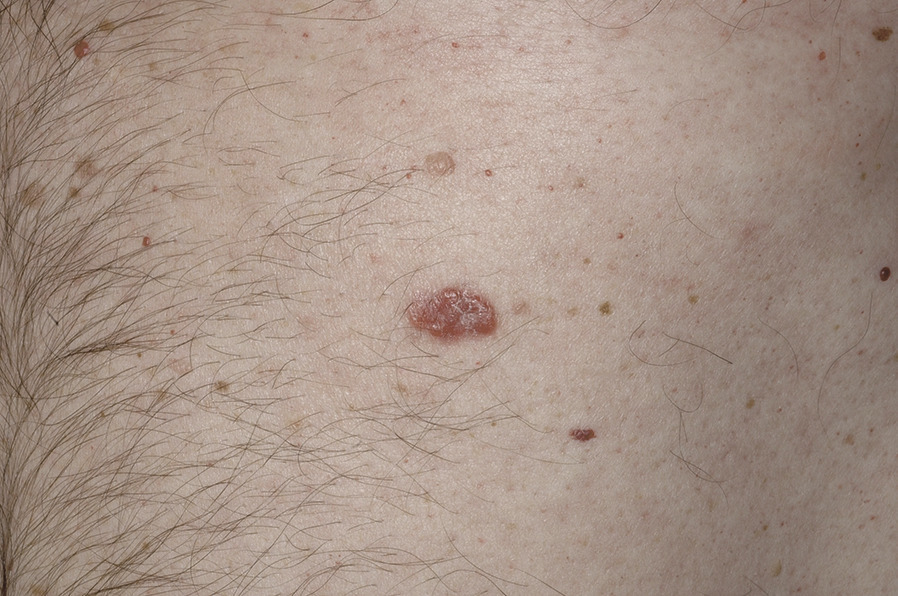
- le mélanome de Dubreuilh (10 % des cas) : siégeant sur les zones photo-exposées (visage +++), d’évolution lente sur des mois ou des années, souvent diagnostiqué tardivement chez les sujets âgés (fig. 5).
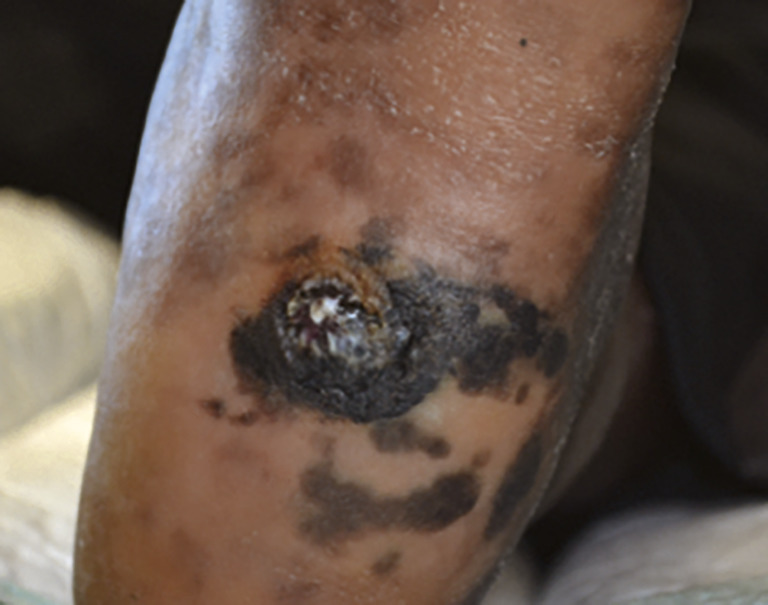
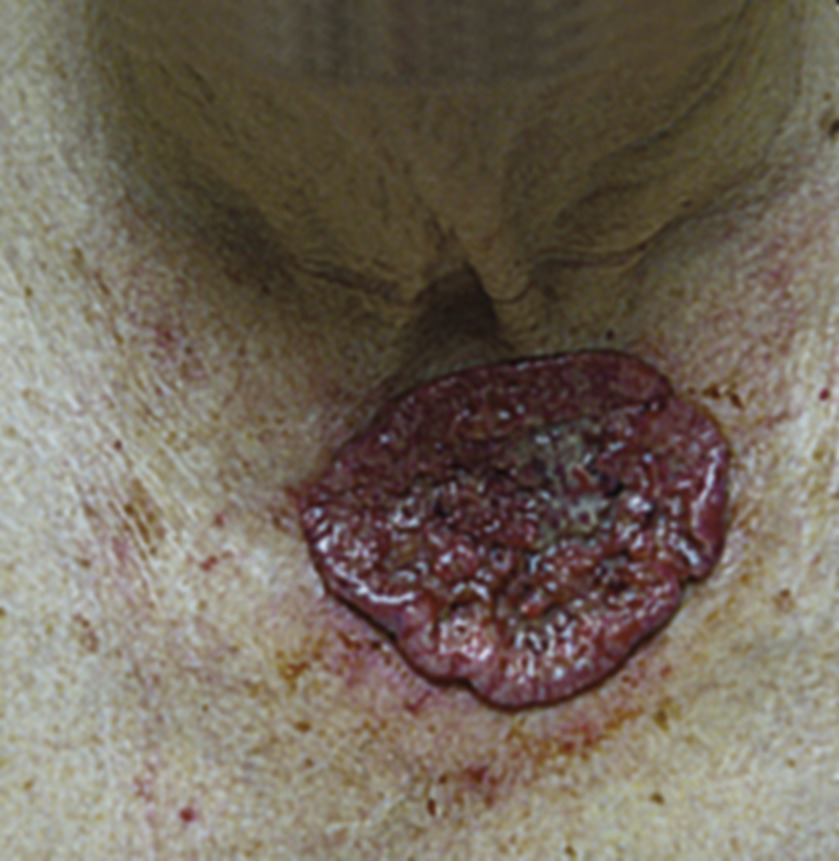
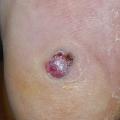
- le mélanome nodulaire (10-20 % des cas) : d’évolution rapidement verticale invasive (fig. 6). Il est volontiers partiellement ou totalement achromique (fig. 7)
- le mélanome « sans primitif » est rapporté chez 10-15 % des patients ayant des métastases de mélanome. Cette situation peut correspondre à un mélanome primitif de localisation interne (muqueux, choroïdien, digestif), à un faux négatif de l’examen anatomo-pathologique d’une lésion enlevée auparavant et diagnostiquée à tort comme bénigne, ou bien à un mélanome régressif, qui a été entièrement détruit par le système immunitaire du patient. On insiste donc sur l’interrogatoire du patient à la recherche d’un antécédent d’exérèse cutanée ou de destruction par cryothérapie d’une lésion pigmentée, ou la notion de lésion ayant spontanément régressé.
Facteurs pronostiques
Les facteurs pronostiques sont surtout histologiques :
- l’indice de Breslow : épaisseur tumorale entre la partie supérieure de la couche granuleuse et la cellule tumorale la plus profonde (souvent repérée par immunohistochimie par l’expression de marqueurs mélanocytaires : Mela-A, protéine S-100, HMB-45), exprimé en millimètres, corrélé au risque de récidive et de décès ;
- la présence d’une ulcération (non mécanique) a une valeur péjorative importante indépendamment du Breslow ;
- le statut du ganglion sentinelle (GS) : l’analyse du (ou des) ganglion(s) sentinelle(s) [1 à 3 ganglions] après repérage scintigraphique des premiers relais ganglionnaires du site de la tumeur, est proposée aux patients ayant un mélanome de Breslow > 1 mm ou ulcéré. Il permet de dépister des métastases intraganglionnaires infracliniques et infraradiologiques. La positivité du ganglion sentinelle est un facteur pronostique péjoratif indépendant, de même que la taille des métastases retrouvées dans le ganglion sentinelle. La réalisation d’un curage ganglionnaire en cas de ganglion sentinelle positif n’est plus systématique car elle n’a pas d’impact sur la survie. L’analyse du ganglion sentinelle est optionnelle et est programmée en accord avec le patient après information sur les avantages (indication pronostique plus précise, accès éventuel à un traitement adjuvant dans le cadre d’études contrôlées) et inconvénients (acte chirurgical plus complexe que la simple reprise d’exérèse, nécessité d’une anesthésie générale) de cette technique ;
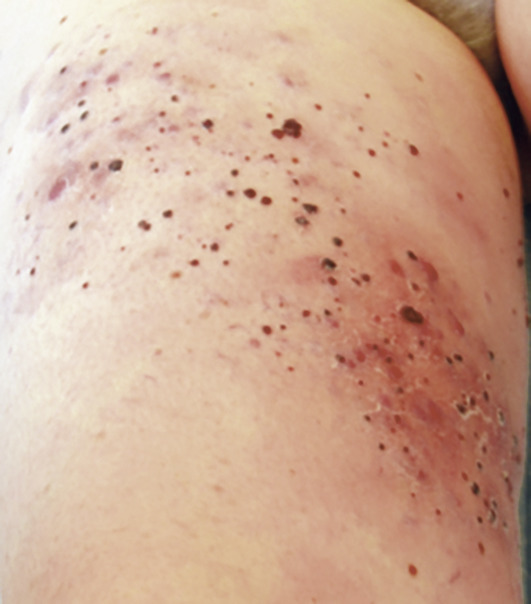
- la présence de métastases cutanées en transit (fig. 8), de métastases ganglionnaires et viscérales constitue des facteurs péjoratifs. Les sites des métastases avec un pronostic de plus en plus sévère sont les localisations cutanées ou ganglionnaires, pulmonaires, tous autres organes, puis enfin localisations cérébrales ;
- le taux de LDH (formes métastatiques uniquement).
Diagnostics différentiels
La majorité des lésions pigmentées sont bénignes. Une lésion pigmentée peut être non mélanocytaire (la prolifération tumorale ne dérive pas du système pigmentaire) ou mélanocytaire.
Tumeurs non mélanocytaires
Ce sont :
- la kératose séborrhéique : lésion bénigne verruqueuse de couleur variée (du beige au noir) recouverte d’un enduit kératosique peu adhérent que l’on peut détacher avec l’ongle ou à la curette. Il s’agit d’une lésion fréquente chez les sujets > 50 ans, et le plus souvent multiples ;
- l’histiocytofibrome pigmenté : petite lentille ferme, enchâssée dans le derme, modérément pigmentée en périphérie, qui siège avec prédilection sur les jambes, liée à une prolifération intradermique de fibroblastes et d’histiocytes ;
- l’angiome thrombosé : nodule noir parfois entouré d’un halo inflammatoire. Le diagnostic différentiel est un mélanome nodulaire ;
- le carcinome basocellulaire tatoué (pigmenté) avec son aspect de papule perlée caractéristique.
Tumeurs mélanocytaires
On distingue :
- le nævus nævocellulaire (ou nævus mélanocytaire) : tumeur bénigne fréquente se présentant cliniquement sous la forme de « grain de beauté » plan ou bombé, de surface lisse ou verruqueuse, parfois pédiculé et de pigmentation variable, pouvant être noir bleuté (nævus bleu), rosé ou même achromique. Les nævi pigmentaires apparaissent dans l’enfance, se modifient très lentement au cours du temps, sauf pendant la grossesse où ils peuvent subir des variations de taille et de couleur plus rapides, et tendent à s’effacer après 60 ans. Histologiquement, il s’agit d’un groupement (ou thèque) de mélanocytes bénins situé dans la couche basale de l’épiderme (nævus jonctionnel), dans le derme (nævus dermique) ou dans le derme et à la jonction dermo-épidermique (nævus mixte ou composé). Les signes orientant vers le caractère bénin d’un nævus sont : une couleur homogène, des contours bien limités, une petite taille (< 6 mm), l’absence d’évolutivité. Cependant, certains nævi peuvent être atypiques cliniquement, rendant le diagnostic différentiel avec un mélanome difficile. Une exérèse au moindre doute sera ainsi réalisée, même chez la femme enceinte ;
- le nævus bleu dont le caractère profond, dermique du pigment explique la couleur bleu « encre de Chine », pose parfois un problème. Le diagnostic différentiel est une métastase en transit d’un mélanome. Le caractère unique bien limité et surtout l’ancienneté orientent vers le caractère bénin ;
- les nævi de Sutton ou halo nævi sont entourés d’un halo dépigmenté lié à une destruction immunologique des mélanocytes et disparaissent progressivement. Ils sont fréquents chez les sujets jeunes parfois après une exposition solaire. Ils peuvent aussi survenir au cours de l’évolution d’un mélanome, mais cela est beaucoup plus rare.
Risque évolutif
Les mélanomes in situ ne se compliquent pas de métastases après une exérèse chirurgicale adaptée. Pour les mélanomes ayant franchi la membrane basale (mélanomes invasifs), le risque évolutif est corrélé à l’épaisseur (indice de Breslow), au caractère ulcéré ou non, et à la présence de métastases dans le ganglion sentinelle. L’extension peut être locale et/ou régionale avec atteintes cutanées (métastases en transit, fig. 8) et/ou ganglionnaires ou à distance (poumons, foie, cerveau…), par voies lymphatique et hématogène. Les métastases peuvent se révéler de façon synchrone au diagnostic du mélanome primitif mais aussi des mois ou des années après l’exérèse du primitif.
Pour se repérer, la survie à 5 ans est de :
- 96 % pour les mélanomes de plus de 1 mm et de moins de 2 mm non ulcérés ;
- 82 % pour les mélanomes primitifs de plus de 4 mm et ulcérés ;
- 84 % pour les mélanomes de toute épaisseur mais avec un ganglion sentinelle positif (métastase microscopique) ;
- 76 % si deux ou trois ganglions sont atteints ou s’il existe des métastases cutanées en transit.
Pour les formes métastatiques, les pronostics ont été révolutionnés par les nouveaux médicaments, accessibles depuis le début des années 2010 : les thérapies ciblées associant anti-BRAF et anti- MEK pour les mélanomes porteurs d’une mutation somatique de BRAF (ce qui est le cas dans environ 50 % des cas), et les immunothérapies par anti-PD1 associés ou non aux anti-CTLA-4, qui permettent d’obtenir des survies médianes de plus de deux ans. Pour environ 20 % des patients, la disparition de toutes les métastases (réponse complète) est observée de façon durable, surtout avec les immunothérapies. Ces nouvelles thérapies évoluent très rapidement, améliorant ainsi le pronostic d’année en année.
Prise en charge
Bilan initial
Le bilan initial comporte un examen dermatologique complet associé à la palpation des aires ganglionnaires périphériques.
Il n’y a pas lieu de faire des examens d’imagerie pour les mélanomes in situ et ceux de stade I (≤ 2 mm non ulcéré).
Une échographie de l’aire ganglionnaire de drainage est recommandée pour les mélanomes ulcérés ou de plus de 2 mm avec ou sans ulcération.
Pour les mélanomes de 4 mm ou plus ulcéré, et pour les mélanomes avec atteinte ganglionnaire ou viscérale au moment du diagnostic, une imagerie corps entier (tomographie par émission de positons-tomodensitométrie [TEP-TDM] ou TDM thoraco- abdomino-pelvienne et cérébrale) est indiquée.
Traitement
Le traitement du mélanome localisé est chirurgical. Après l’exérèse diagnostique, il consiste en une reprise d’exérèse de la cicatrice dont l’objectif est de diminuer le risque de récidive locale en éliminant les cellules tumorales susceptibles de s’être propagées dans la peau périlésionnelle. Les marges d’exérèse latérales dépendant de l’épaisseur du mélanome (tableau 2). Des marges > 3 cm ne sont plus indiquées pour les mélanomes > 4 mm comme proposées auparavant. L’exérèse en profondeur va jusqu’au fascia tout en le respectant.
Le seul traitement adjuvant actuellement autorisé est l’interféron-alpha 2b pour les patients ayant un mélanome d’épaisseur > 1,5 mm ou avec atteinte ganglionnaire, mais son bénéfice est faible et sa toxicité importante. Il est peu prescrit en pratique.
Tout récemment, les thérapies ciblées et l’immunothérapie ont démontré un bénéfice indiscutable chez les patients opérés d’une atteinte ganglionnaire (stade III). Ces traitements vont probablement obtenir une autorisation de mise sur le marché européen très prochainement et supplanter l’interféron.
Le traitement du mélanome métastatique repose sur l’immunothérapie par inhibiteur de point de contrôle du système immunitaire : anticorps anti-CTLA-4 (ipilimumab) et surtout anti-PD1 (pembrolizumab et nivolumab) ou sur la combinaison des deux ainsi que sur les associations de thérapies ciblées (anti-BRAF [dabrafénib ou vémurafénib] + anti-MEK [tramétinib ou cobimétinib]). Ces médicaments ont permis d’améliorer très significativement la durée de survie médiane des patients avec atteinte métastatique disséminée (stade IV) qui est passée de moins de 1 an à plus de 2 ans. Ces traitements ont des effets secondaires en lien avec leurs mécanismes d’action comme les effets immunologiques ressemblant parfois à des maladies auto-immunes avec les immunothérapies, par exemple des colites évoquant des atteintes de Crohn avec l’ipilimumab. Lorsqu’ils sont sévères, ces effets immunologiques sont traités par corticothérapie générale, voire des immunosuppresseurs plus puissants.
Les chimiothérapies cytotoxiques (dacarbazine, fotémustine) ne sont plus que très rarement utilisées. Des combinaisons entre thérapies ciblées et immunothérapies sont évaluées dans le cadre d’essais thérapeutiques.
Suivi
Le rythme et les modalités de la surveillance dépendent du stade du mélanome (tableau 3). La fréquence des examens de surveillance n’est pas standardisée (tableau 4). Ces derniers sont surtout prescrits en fonction des points d’appel.
L’examen clinique est fondamental dans la surveillance et recherche en particulier une récidive cutanée (métastases en transit) et/ou ganglionnaire ainsi qu’un deuxième mélanome.
On insiste sur :
- l’éducation du patient :
- le dépistage des apparentés au premier degré : indication à un examen dermatologique annuel à vie ;
- la prévention et le dépistage précoce (tableau 5) : la prévention primaire a pour but de diminuer l’incidence du mélanome, la prévention secondaire a pour objectif un diagnostic plus précoce des mélanomes. La prise de conscience du risque de mélanome parmi les populations les plus exposées est à la base du dépistage précoce : phototypes clairs, présence de nombreux nævi pigmentaires atypiques, antécédents d’exposition solaire importante, antécédents familiaux de mélanome.
Indications d’une consultation d’oncogénétique
Ce sont :
- 2 mélanomes chez le même individu avant 75 ans ;
- 2 mélanomes ou plus chez deux apparentés au 1er ou 2e degré.
- Dans ce schéma, au moins un mélanome cutané peut être remplacé par un mélanome oculaire, un cancer du pancréas, un cancer du rein, un mésothéliome ou une tumeur du système nerveux central.
À discuter au cas par cas pour :
- les familles à cas multiples de cancer du pancréas sans mélanome (suspicion de mutation de CDKN2A) ;
- les mélanomes sporadiques du sujet jeune (< 18 ans) ;
- l’association chez un même patient d’un mélanome et d’un autre cancer.
Carcinomes cutanés
Les carcinomes cutanés sont les plus fréquents des cancers cutanés.
Les facteurs de risque sont résumés dans le tableau 6.
On distingue :
- les carcinomes basocellulaires (CBC), les plus fréquents (150 cas/ 100 000 par an en France), d’évolution lente, à malignité essentiellement locale mais parfois délabrante, siégeant avec prédilection sur le visage et épargnant les muqueuses. Ils surviennent le plus souvent de novo, en peau saine. Il existe d’exceptionnelles formes métastatiques ;
- les carcinomes épidermoïdes (CE), moins fréquents (30 cas/ 100 000 par an en France), pouvant être d’évolution agressive et présentant un risque d’envahissement ganglionnaire régional et de métastases à distance, siégeant principalement sur la peau mais pouvant également toucher les muqueuses, notamment chez les patients immunodéprimés, se développant en peau saine ou le plus souvent sur des lésions préexistantes ;
- beaucoup plus rares sont les carcinomes de Merkel et les carcinomes annexiels d’évolution potentiellement métastatique par voie lymphatique et/ou sanguine. Le carcinome de Merkel est associé à un polyomavirus dans 80 % des cas (polyomavirus du carcinome de Merkel). Le pronostic des formes métastatiques de carcinomes de Merkel a récemment été radicalement modifié par l’immunothérapie par anticorps anti-PD-L1 (avélumab) et anti-PD1 (nivolumab et pembrolizumab).
Diagnostic
Carcinome épidermoïde
La plupart des carcinomes épidermoïdes sont peu agressifs et se développent sur des kératoses pré-épithéliomateuses, le plus souvent actiniques : lésions fréquentes chez les patients âgés, érythémateuses ou rosées, rugueuses, le plus souvent multiples qui siègent principalement sur les zones photo-exposées (tête et cou, dos des mains, pavillon des oreilles, cuir chevelu alopécique). Elles sont presque constamment associées à des signes d’héliodermie : élastose actinique, dilatations capillaires, rides marquées, lentigos actiniques. Les autres lésions préexistantes favorisant la survenue de carcinomes épidermoïdes sont les plaies chroniques comme par exemple les ulcères des membres inférieurs, les cicatrices de brûlure, même anciennes, les lésions muqueuses (leucoplasie, lichen érosif ou scléro-atrophique).
On distingue :
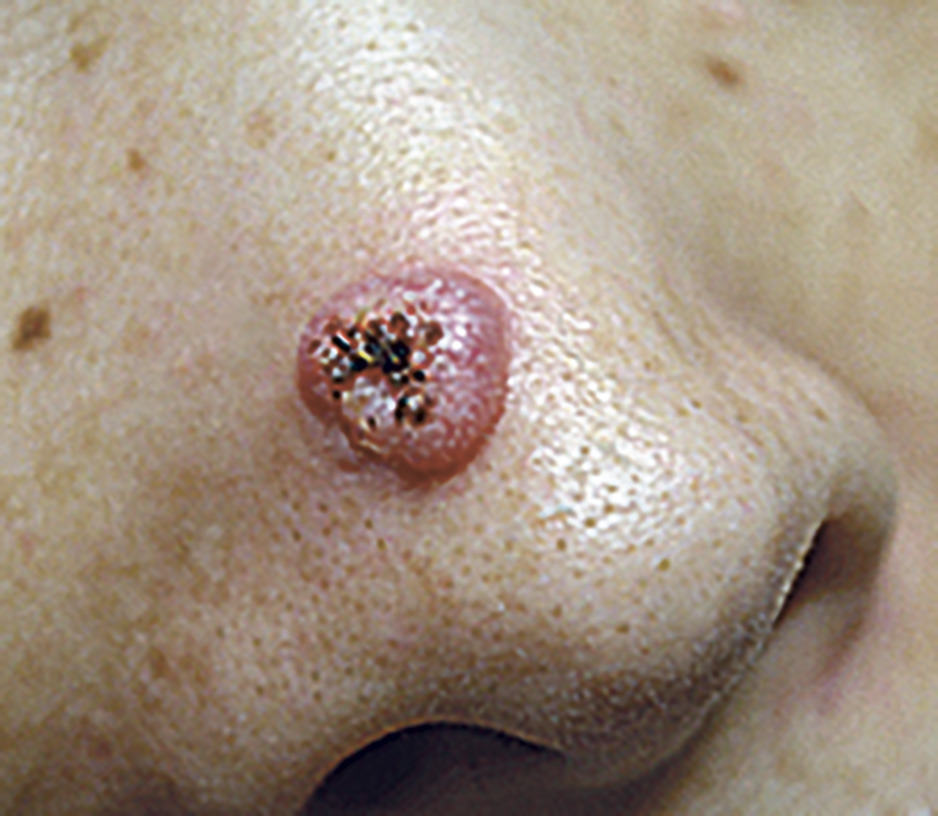
- le carcinome épidermoïde in situ, lésion superficielle n’ayant pas franchi la membrane basale. Il se présente sur la peau sous la forme d’une plaque érythémateuse squamo-croûteuse (maladie de Bowen, fig. 9) et sur les muqueuses sous la forme d’une ulcération ou d’une érosion génitale souvent aspécifique (comme dans l’érythroplasie de Queyrat du gland) ;
- le carcinome épidermoïde invasif : tumeur infiltrée associant de façon variable des aspects ulcérés, végétants
(fig. 10) , croûteux ou verruqueux ;
- la tumeur de Buschke-Lowenstein est un carcinome épidermoïde de la région périnéale agressif lié à une infection par un papillomavirus humain oncogène (HPV 6, 11, 16, 18) transmis par voir sexuelle le plus souvent. Elle réalise une tumeur végétante en « chou-fleur » de croissance rapide.
- Parmi les diagnostics différentiels :
- les kératoses actiniques sont les principaux diagnostics différentiels des carcinomes épidermoïdes peu évolués ;
- les kérato-acanthomes : tumeurs bénignes se présentant sous la forme d’un nodule ulcéré, cratériforme croûteux d’évolution rapide et de régression spontanée impossible à distinguer cliniquement ou histologiquement d’un carcinome épidermoïde très différencié. Dans le doute, il faut réaliser une exérèse complète de cette lésion difficile à diagnostiquer avec certitude ;
- les verrues vulgaires ou papillomes verruqueux peuvent ressembler à des carcinomes épidermoïdes verruqueux ;
- les lésions bénignes hyperkératosiques papillomateuses (kératoses séborrhéiques, hyperplasie verruqueuse (plaques hyperkératosiques bénignes favorisées par le frottement).
Le suivi des patients atteints de carcinomes épidermoïdes à faible risque repose sur un examen clinique annuel. Dans les formes de mauvais pronostic (tableau 7), un suivi clinique et échographique de l’aire ganglionnaire de drainage tous les 3 à 6 mois est recommandé pendant au moins 5 ans.
Carcinome basocellulaire
Il survient de novo le plus souvent et revêt différentes formes cliniques avec un élément sémiologique caractéristique : la perle. Cette perle se présente sous la forme d’une papule ou d’un bourrelet de consistance caoutchouteuse, ferme, translucide, blanchâtre ou rosée, parcourue de télangiectasies.
La forme classique nodulaire est une lésion papuleuse ou nodulaire perlée
La forme superficielle est une plaque érythémateuse squameuse, de contours arrondis où l’aspect perlé manque parfois.
La forme sclérodermiforme a un aspect cicatriciel atrophique mal limité.
Toutes ces formes peuvent être pigmentées (carcinome basocellulaire tatoué), érosives et/ou croûteuses au cours de leur évolution.
Le diagnostic différentiel des carcinomes basocellulaires se fait avec les autres carcinomes cutanés, le mélanome pour les formes tatouées, avec des lésions de psoriasis, ou de dermatophytoses pour les formes superficielles.
Le suivi repose sur un examen clinique annuel pendant au moins 5 ans et au mieux à vie, car le risque de développer d’autres carcinomes cutanés est important après un premier épisode.
Diagnostic histologique
Le diagnostic de certitude de carcinome est histologique.
Les kératinocytes tumoraux sont de grande taille, organisés en lobules ou en travées et plus ou moins différenciés (formations de globes cornés dans les formes bien différentiées) pour les carcinomes épidermoïdes, et ils sont plus petits et basophiles, et de disposition palissadique pour les carcinomes basocellulaires avec des fentes de rétraction autour des lobules.
Évolution et pronostic
Dans la grande majorité des cas, les carcinomes basocellulaires et épidermoïdes sont facilement traités par chirurgie ou traitement médical pour les formes superficielles.
Les carcinomes basocellulaires ont une évolution locale, mais certains facteurs sont associés à un pronostic plus péjoratif : les localisations cervicales, les carcinomes basocellulaires de type sclérodermiformes, les carcinomes basocellulaires récidivants, et les rarissimes carcinomes basocellulaires métastatiques.
Les carcinomes basocellulaires survenant au cours du syndrome de Gorlin, ou nævomatose basocellulaire, sont particuliers par leur multiplicité et sont dus à une activation constitutive de la voie Sonic hedgehog par une mutation germinale de cette voie de signalisation.
Les carcinomes épidermoïdes peuvent dans certains cas donner lieu à une évolution métastatique, ganglionnaire, voire systémique.
Principes thérapeutiques
Le traitement est principalement chirurgical : exérèse chirurgicale avec marges de sécurité en fonction des éléments pronostiques.
L’analyse histologique confirme le diagnostic, précise le type tumoral, les caractères d’agressivité éventuels (engainements périnerveux, emboles intravasculaires), et donne une évaluation des marges de tissu sain péritumoral. L’exérèse doit être complète. Des marges saines de 5 à 10 mm sont requises pour les carcinomes épidermoïdes.
Dans les formes superficielles, la cryothérapie par azote liquide, les traitements topiques par immunothérapie (imiquimod), chimiothérapie (5-fluoro-uacile) ou photothérapie dynamique sont efficaces.
- radiothérapie ;
- thérapie ciblée par inhibiteur de la voie Sonic hedgehog (vismodégib ou sonidégib) pour les carcinomes basocellulaires ;
- chimiothérapie par sels de platine et fluoro-uracile ± thérapie ciblée par anti-EGFR pour les carcinomes épidermoïdes ;
- les anticorps anti-PD1 donnent des résultats préliminaires encourageants dans les formes avancées de carcinomes basocellulaires et épidermoides cutanés et pourraient obtenir des autorisations de mise sur le marché dans ces indications.
Mélanome
Le mélanome est une tumeur maligne à fort potentiel métastatique. Les principaux facteurs de risque sont l’exposition solaire et aux ultraviolets artificiels, un phototype clair, un antécédent personnel ou familial de mélanome, un nombre élevé de nævus, un syndrome des nævus atypique, l’immunodépression, et un antécédent de nævus congénital géant. Les mélanomes apparaissent le plus souvent de novo, mais toute modification d’un nævus préexistant doit alerter le clinicien. Une exérèse en totalité de la lésion sera effectuée devant toute lésion pigmentée atypique. L’histologie permet de déterminer des facteurs histologiques majeurs : indice de Breslow, ulcération, atteinte ganglionnaire (ganglion sentinelle). Le traitement des mélanomes localisés repose sur la chirurgie (reprise de la cicatrice avec marges de sécurité ± technique du ganglion sentinelle).La prévention primaire repose sur le dépistage précoce des sujets à risque, l’autosurveillance et les mesures de photoprotection. Le suivi dépend du stade du mélanome. L’examen clinique est fondamental et comportera un examen cutané de l’ensemble du tégument et la palpation des aires ganglionnaires. Environ la moitié des mélanomes sont porteurs d’une mutation de BRAF, ce qui a une implication thérapeutique potentielle. Le traitement des formes métastatiques repose sur l’immunothérapie et les thérapies ciblées (ces dernières seulement pour les mélanomes mutés sur BRAF).
Carcinomes cutanés
Les carcinomes basocellulaires sont les cancers cutanés les plus fréquents. Ils apparaissent le plus souvent de novo, sont d’évolution lente et locale mais parfois délabrante. Leur traitement repose sur la chirurgie. L’élément sémiologique principal est la papule perlée. Les carcinomes épidermoïdes ont une évolutivité locorégionale mais également à distance. Ils peuvent se développer de novo ou sur des lésions préexistantes (kératoses actiniques, cicatrice de brûlures, plaies chroniques). La prise en charge est avant tout chirurgicale.
Message de l'auteur
Il faudra bien connaître les différents types de mélanomes primitifs : superficiel extensif (le plus fréquent), type Dubreuilh, acrolentigineux et nodulaire d’emblée. Surtout éviter les biopsies partielles quand on suspecte un mélanome et faire une exérèse de toute la lésion. Il faut connaître les facteurs pronostiques, et notamment l’épaisseur (indice de Breslow) et se rappeler que les marges d’exérèse à préconiser dépendent de l’épaisseur du mélanome.Savoir que les facteurs de risque principaux des cancers de la peau sont les UV naturels ou artificiels. On doit donc rechercher d’autres cancers sur la peau d’un patient présentant déjà un cancer cutané.On peut avoir un dossier sur un patient traité par PUVAthérapie pour un psoriasis, par exemple, qui développerait par la suite un carcinome ou un mélanome cutanés.Enfin, savoir que la surveillance doit être prolongée, en général à vie, avec au minimum un examen clinique cutané complet et une palpation des aires ganglionnaires. Selon les stades, on prescrira en plus des échographies des aires ganglionnaires de drainage et des scanners ou TEP-scan.
Actualisation des recommandations de prise en charge du mélanome stade I à III (2016).
Institut national du cancer (INCa) (2013).
Prise en charge diagnostique et thérapeutique du carcinome épidermoïde cutané (spinocellulaire) et de ses précurseurs. Recommandations (2009).
Prise en charge diagnostique et thérapeutique du carcinome basocellulaire de l’adulte (2004).
Gershenwald JE, Scolyer RA, Hess KR, et al. Melanoma staging: evidence-based changes in the American Joint Committee on Cancer (AJCC). Eighth Edition Cancer Staging Manual. CA Cancer J Clin 2017;67:472-92.

 Encadrés
Encadrés