DIAGNOSTIQUER une tumeur de l’estomac.
Introduction – Épidémiologie
Trois types anatomiques peuvent être distingués :
- tumeur du cardia (à moins de 2 cm de la jonction œsogastrique) ;
- tumeur du corps (fundus) ou de la grosse tubérosité ;
- tumeur de l’antre (distale).
- tumeurs épithéliales malignes (adénocarcinomes), type histologique le plus fréquent (90 %) parmi lesquels on distingue deux types d’adénocarcinomes : le type intestinal glandulaire (prédominance chez le sujet âgé) et le type diffus à prédominance de cellules indépendantes mucosécrétantes (dites en « bague à chaton ») incluant les linites ;
- tumeurs épithéliales bénignes (hyperplasique, adénome, polype glandulokystique) ;
- tumeurs neuro-endocrines ;
- lymphomes malins non hodgkiniens ;
- tumeurs sous-muqueuses (dont les tumeurs stromales gastro- intestinales [GIST]).
L’adénocarcinome gastrique
Facteurs de risque (tableau 2)
Helicobacter pylori
Ce bacille à Gram négatif de transmission oro-fécale entraîne un risque relatif de survenue de cancer gastrique (adénocarcinome et lymphome) entre 2 et 6 chez les patients infectés. En effet, certaines souches d’Helicobacter pylori sécrètent des toxines responsables de lésions inflammatoires (gastrite) pouvant évoluer vers une gastrite chronique atrophique, la métaplasie, puis la dysplasie et le cancer (ce qui est le cas pour l’adénocarcinome distal de type intestinal).Cependant, seulement 1 % des patients infectés par Helicobacter pylori développent un cancer gastrique, il existe donc des cofacteurs de risque amenant au développement de ce cancer.
Facteurs génétiques
Certains cancers gastriques peuvent survenir dans le cadre de syndromes familiaux. La recherche de prédispositions familiales est recommandée en cas d’antécédents familiaux de cancer gastrique ou de survenue avant 40 ans. On oriente alors le patient vers une consultation d’oncogénétique.Deux cadres peuvent être distingués :
- l’adénocarcinome gastrique diffus héréditaire. Cette forme très rare est associée le plus souvent à une mutation germinale du gène CDH1 de transmission autosomique dominante et responsable de la perte de fonction de la protéine Cadhérine E. Si la mutation est présente, une gastrectomie prophylactique peut être proposée ;
- l’adénocarcinome gastrique survenant dans le cadre de syndromes familiaux. Le risque de cancer gastrique est augmenté chez les apparentés au premier degré de malades ayant un cancer de l’estomac, les patients ayant un syndrome de Lynch, les patients atteints de polypose adénomateuse familiale (PAF). Dans ces 3 cas, il est recommandé de chercher systématiquement Helicobacter pylori et de l’éradiquer le cas échéant.
Facteurs environnementaux
Les facteurs de risque sont le tabagisme, la consommation élevée en sel, un niveau socio-économique bas, une faible consommation de fruits et légumes.Les facteurs protecteurs sont une alimentation riche en vitamine C, en fruits frais et légumes crus.
Lésions précancéreuses
Comme expliqué ci-dessus, la gastrite chronique atrophique et la métaplasie intestinale induite par Helicobacter pylori peuvent faire le lit du cancer. Il en est de même de la maladie de Biermer, des antécédents de gastrectomie partielle ancienne, au-delà de 10 ans (rôle probable du reflux biliaire), de l’ulcère gastrique, des polypes adénomateux gastriques.La maladie de Biermer peut aussi favoriser la survenue de tumeurs neuro-endocrines gastriques.
La maladie de Ménétrier (gastrite hypertrophique) se complique de cancer chez 14 % des patients.
Diagnostic
Présentation clinique
Le plus souvent, les cancers gastriques sont découverts à un stade avancé du fait de leur caractère pauci-symptomatique ; ce qui explique leur mauvais pronostic.Sur le plan des signes fonctionnels, les patients peuvent se présenter avec une altération de l’état général et notamment un amaigrissement ou une anorexie, une dysphagie dans le cadre des cancers du cardia, une sensation de satiété précoce. L’interrogatoire s’attache à rechercher des vomissements (en cas de cancer du pylore ++), des épisodes d’hématémèse ou du méléna, des douleurs épigastriques, des signes d’anémie (dyspnée d’effort, lipothymies, pâleur cutanéo-muqueuse…) sur hémorragie extériorisée ou occulte.
Sur le plan physique, il faut rechercher des signes directs à type de masse épigastrique (rare), des signes en faveur de localisations à distance : hépatomégalie, ganglion de Troisier, palpation de nodules de carcinose péritonéale ou de l’ascite, palpation d’une masse pelvienne liée à une métastase ovarienne (syndrome de Krukenberg).
Enfin, la maladie peut se présenter par une thrombose veineuse profonde inaugurale telle qu’une phlébite du membre supérieur (syndrome de Trousseau, du nom du médecin qui avait fait son propre diagnostic de cancer de l’estomac) témoignant du phénomène d’hypercoagulabilité, un acanthosis nigricans (plaque cutanée hyperpigmentée à type de végétation rugueuse au niveau du creux axillaire).
Diagnostic positif
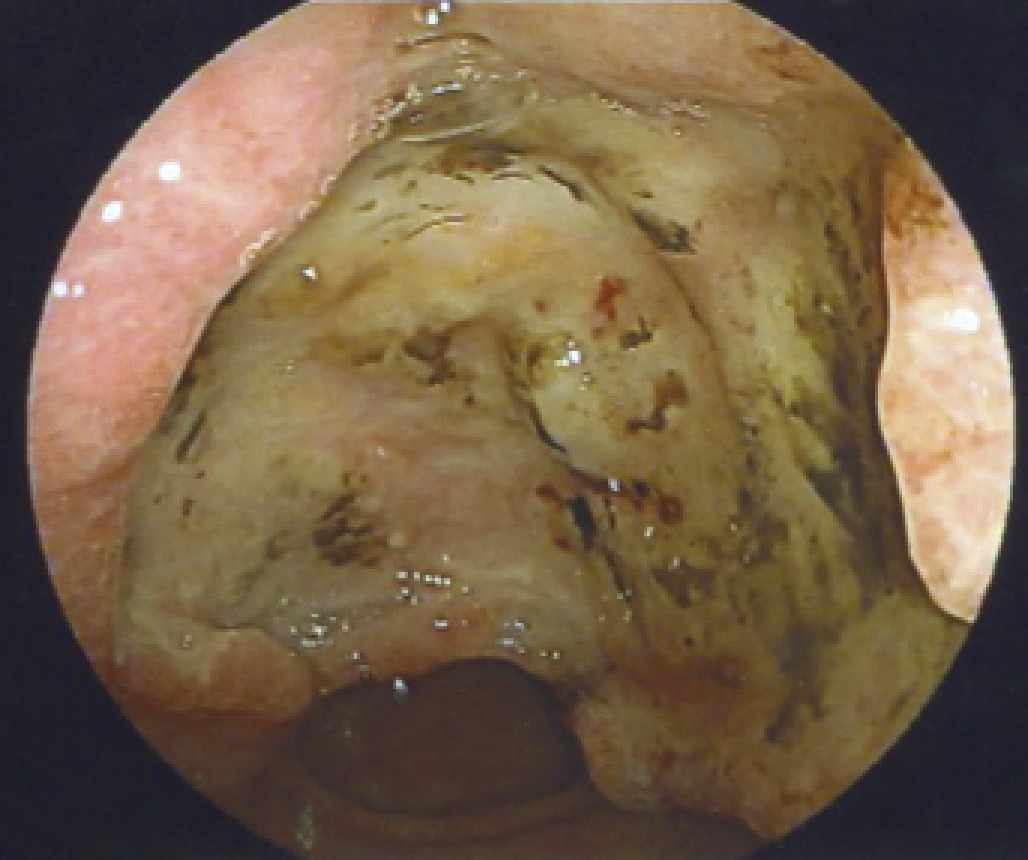
L’examen clé est l’endoscopie œso-gastro-duodénale (fig. 1).Cet examen permet de préciser la localisation de la tumeur (antre 40 %, corps 20 %, grosse tubérosité 20 %, cardia 20 %), sa taille, son extension (notamment par rapport au cardia et au pylore), son aspect (bourgeonnant, végétant, ulcéré, aspect de linite gastrique, c’est-à-dire de paroi gastrique rigide fixée de manière locale ou dans sa globalité). Il permet de faire le diagnostic positif grâce aux biopsies qui doivent être nombreuses (au moins 8) et atteindre si possible la sous-muqueuse. Elles permettent de déterminer le type histologique ainsi que la surexpression du gène codant pour la protéine Her2 (récepteur membranaire) en vue d’une thérapie ciblée. Il faudra de plus réaliser des biopsies à la recherche d’Helicobacter pylori.À noter que les biopsies peuvent s’avérer faussement négatives en cas de linite.
On rappelle que tout ulcère gastrique doit être biopsié.
Bilan d’extension
Il a pour but d’évaluer la résécabilité de la tumeur et l’opérabilité du patient afin de proposer la prise en charge thérapeutique adaptée. Elle permet d’établir la classification TNM (tableau 3).L’extension loco-régionale et à distance est appréciée grâce à une tomodensitométrie thoraco-abdomino-pelvienne avec injection de produit de contraste. Elle est l’examen de référence indispensable. Elle précise la résécabilité de la lésion, l’envahissement local des organes de voisinage (pancréas…), la présence d’adénopathies suspectes, de métastases hépatiques++, péritonéales ou pulmonaires.
L’extension locale peut être appréciée grâce à l’écho-endoscopie qui évalue l’extension pariétale et ganglionnaire. Elle est très utile notamment en cas de suspicion de linite gastrique avec biopsies négatives, de tumeur superficielle pour évaluer la résécabilité par voie endoscopique et avant traitement néo-adjuvant.
La laparoscopie exploratrice (ou cœlioscopie exploratrice) peut être proposée en cas de tumeur volumineuse ou s’il existe un doute sur la résécabilité afin d’éviter une laparotomie « blanche ».
Au niveau biologique, les marqueurs ACE et CA 19.9 peuvent être dosés mais n’ont aucune valeur diagnostique puisque non spécifiques. Ils peuvent être utiles pour le suivi des patients.
Bilan préthérapeutique
L’étude des comorbidités des patients est indispensable. Il faudra donc évaluer l’état général des patients (indice de Karnofsky, statut OMS), leur état nutritionnel (indice de masse corporelle, pourcentage d’amaigrissement, albuminémie), leur fonction cardiaque (ECG, ETT) en fonction du terrain et si une chimiothérapie cardiotoxique est envisagée (anthracyclines+++), et leur fonction pulmonaire si une chirurgie avec thoracotomie est envisagée. De plus, une évaluation oncogériatrique doit être réalisée pour les patients de plus de 70 ans.Principes du traitement
- tumeur résécable non métastatique : traitement à visée curative ;
- tumeur localement avancée non résécable : traitement à visée palliative ;
- tumeur métastatique : traitement à visée palliative.
Traitement à visée curative
Il repose sur l’exérèse chirurgicale plus ou moins associée à un traitement néo-adjuvant et/ou adjuvant comportant une chimiothérapie ou une radiochimiothérapie.Traitement chirurgical : le principe est l’exérèse complète de la tumeur associée à un curage ganglionnaire, puis une anastomose. L’étendue de l’exérèse dépend de la localisation de la tumeur et de son extension :
- gastrectomie totale avec anastomose œsojéjunale en Y, en cas de tumeur proximale ou de linite gastrique. Les complications propres peuvent être le syndrome du dumping (asthénie, malaise, lipothymies, vertiges, somnolence survenant 5 à 20 minutes après le repas et correspondant à l’arrivée précoce des aliments dans le duodénum), la malabsorption (vitamine B12, par l’absence de facteur intrinsèque, stéatorrhée), la diarrhée (50 % des patients) ;
- gastrectomie des 4/5es avec anastomose gastro-jéjunale, en cas de tumeur de l’antre. Cette chirurgie comporte moins de complications, qui sont dominées par la sensation de satiété précoce.
Traitement endoscopique : la résection peut être faite par mucosectomie ou dissection sous-muqueuse. Les indications sont pour des tumeurs de petite taille (< 3 cm) limitées à la muqueuse, bien ou moyennement différenciées après une évaluation écho-endoscopique.
Traitement néo-adjuvant : une chimiothérapie périopératoire (avant et après la chirurgie) est recommandée pour tous les patients à un stade supérieur à I. Elle est à base de 5-fluoro-uracile de sels de platine plus ou moins une anthracycline. Une radiochimiothérapie préopératoire peut être discutée dans les adénocarcinomes de la jonction œsogastrique à prédominance œsophagienne (Siewert I).
Traitement adjuvant : une radiochimiothérapie postopératoire à base de 5-fluoro-uracile (schéma de Mac Donald) doit être proposée aux patients n’ayant pas bénéficié d’un traitement néo-adjuvant dont la tumeur est de stade II ou III et si l’état général et nutritionnel le permet.
Traitement à visée palliative
Il repose sur la chimiothérapie systémique à base de 5-fluoro-uracile, sels de platine ± taxanes ou anthracyclines, qui améliore la survie et la qualité de vie par rapport au seul traitement symptomatique chez des patients sélectionnés dont l’état général est conservé. Une thérapie ciblée (trastuzumab) doit être associée en cas de surexpression des récepteurs HER2 par la tumeur.Les traitements symptomatiques doivent être proposés afin d’améliorer la qualité de vie des patients : chirurgie palliative en cas de tumeur hémorragique nécessitant des transfusions itératives ou de sténose, prothèse posée par voie endoscopique en cas d’obstacle tumoral responsable d’une occlusion haute, radiothérapie à visée hémostatique en cas de tumeur hémorragique. Le maintien d’un état nutritionnel satisfaisant, le traitement de douleurs éventuelles, un soutien psychologique sont essentiels.
Pronostic et surveillance
La surveillance dans le cadre d’un traitement curatif repose sur :
- un examen clinique tous les 6 mois pendant 5 ans puis tous les ans ;
- la surveillance biologique : hémogramme (risque d’anémie par carence martiale ou en vitamine B12) ;
- une échographie abdominale tous les 6 mois pendant 3 ans puis tous les ans associée à une radiographie du thorax de face tous les ans pendant 3 ans, ou un scanner thoraco- abdomino-pelvien tous les 6 mois pendant 3 ans, puis une surveillance échographique et clinique ;
- une supplémentation en vitamine B12 en cas de gastrectomie totale ;
- en cas de splénectomie lors de la chirurgie, penser aux vaccinations antipneumococcique, méningococcique, Haemophilus influenzae B, ainsi qu’à l’antibioprophylaxie par pénicilline ;
- la surveillance du moignon gastrique 10 ans après la chirurgie par endoscopie haute tous les 2 ans et biopsies ; une échoendoscopie haute pour les patients à haut risque de récidive péri-anastomotique.
Forme particulière : la linite gastrique
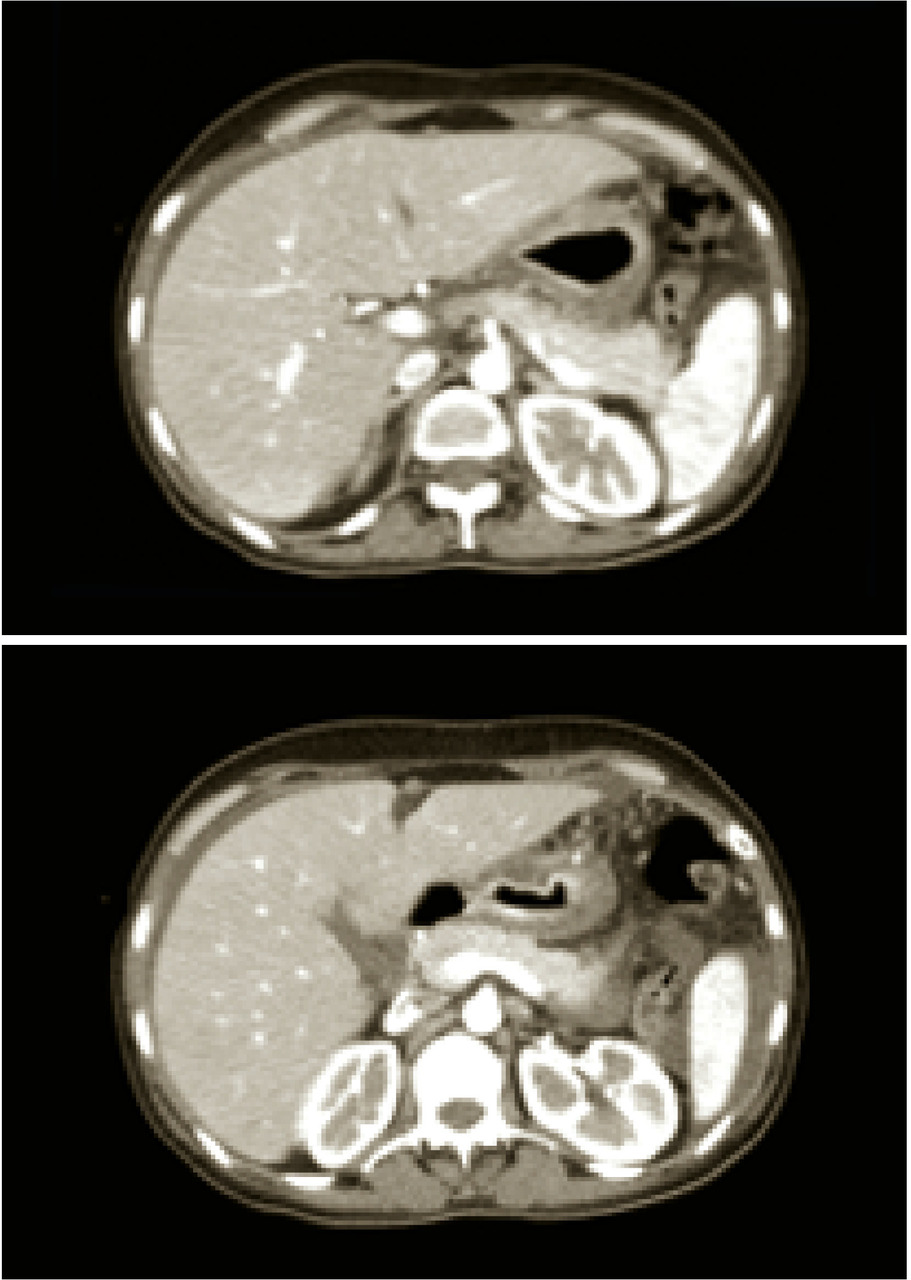
Cliniquement, il se manifeste par une altération importante de l’état général avec un amaigrissement, parfois une occlusion haute. En endoscopie, le diagnostic n’est pas toujours aisé : il peut exister des gros plis rigides d’aspect tumoral, une paroi fixée rigide rendant l’insufflation difficile ou impossible, les biopsies peuvent être faussement négatives du fait du respect fréquent de la muqueuse. Le diagnostic pourra être facilité par l’échoendoscopie (épaississement de la paroi gastrique prédominant au niveau de la sous-muqueuse), la tomodensitométrie montrant un aspect figé rétréci de l’estomac (fig. 2). L’exérèse chirurgicale est rarement curative, et ce type de cancer est peu chimiosensible, rendant son pronostic très péjoratif.
Autres tumeurs gastriques
Lymphomes gastriques
Le lymphome du MALT a pour origine une gastrite chronique à Helicobacter pylori. Il est d’évolution très lente. Il est souvent peu symptomatique et sans signe biologique spécifique.
Les lymphomes à grandes cellules, plus rares, se présentent sous la forme d’une masse tumorale pouvant être volumineuse et ulcérée.
Le diagnostic repose sur l’œso-gastro-duodénoscopie avec réalisation de biopsies multiples (avec recherche d’Helicobacter pylori, anatomopathologie, immunomarquage, biologie moléculaire).
Le bilan d’extension est comparable à celui d’un lymphome ganglionnaire :
- au niveau biologique : hémogramme, électrophorèse et immunofixation des protides sanguins, LDH et β2-microglobuline, sérologies VIH, VHB et VHC, ± étude du liquide céphalo-rachidien pour les lymphomes à haut risque d’atteinte du système nerveux central ;
- écho-endoscopie haute ;
- scanner thoraco-abdomino-pelvien ;
- biopsie ostéomédullaire (BOM) pour les lymphomes du MALT seulement en l’absence de régression après éradication d'Helicobacter pylori ;
- tomographie par émission de positons (TEP-TDM) pour les lymphomes à grandes cellules.
Le traitement des formes à grandes cellules repose quant à lui sur la polychimiothérapie.
Les tumeurs stromales (GIST, pour gastro-intestinal stromal tumours)
Elles sont souvent asymptomatiques et de découverte fortuite sur une endoscopie ou une chirurgie. Lorsqu’elles sont volumineuses, elles peuvent être responsables d’hémorragie digestive, d’occlusion, de douleurs. Le diagnostic est porté par l’endoscopie digestive et l’écho-endoscopie qui mettent en évidence une masse ronde sous-muqueuse parfois ulcérée de développement exogastrique. Ces tumeurs ont un potentiel de malignité (1 sur 4 environ est maligne). Le traitement repose sur la chirurgie pour les tumeurs localisées suivie d’un traitement adjuvant par imatinib (Glivec) [inhibiteur des tyrosines kinases]. Pour les tumeurs non résécables et/ou métastatiques, le traitement par imatinib est indiqué et a considérablement amélioré le pronostic de ces patients.
Tumeurs endocrines
Mais il existe aussi des tumeurs endocrines sporadiques, parfois peu différenciées, de mauvais pronostic.
Tout ulcère gastrique doit être surveillé jusqu’à disparition et biopsié largement afin de ne pas méconnaître un adénocarcinome gastrique.
L’adénocarcinome est la tumeur maligne de l’estomac la plus fréquente et reste un cancer fréquent et grave dans le monde (2e cause de mortalité par cancer dans le monde).
Dans les pays développés, l’incidence de l’adénocarcinome distal (antral) diminue (rôle prépondérant d’Helicobacter pylori dans la carcinogenèse), alors que celle de l’adénocarcinome proximal (jonction œsogastrique ou cardia, et grosse tubérosité) est en augmentation (rôle du surpoids et du tabac).
Le diagnostic repose sur l’œso-gastro-duodénoscopie avec biopsies, le bilan d’extension sur l’examen clinique, la TDM thoraco-abdomino-pelvienne ainsi que l’échoendoscopie pour les tumeurs non métastatiques.
L’éradication d’Helicobacter pylori doit être réalisée chez les apparentés au premier degré de patient atteint de cancer gastrique.
Le facteur pronostique le plus important est l’envahissement ganglionnaire.
Les autres types histologiques sont le lymphome du MALT, de bon pronostic, ainsi que les GIST tumeurs stromales à potentiel malin, et les tumeurs endocrines.
Message de l'auteur
Le cancer de l’estomac est un sujet permettant de traiter des points transversaux de l’ECN tels que bilan d’une anémie occulte ou prise en charge d’une hémorragie digestive haute dans un contexte d’urgence. Le problème de dénutrition souvent associée peut aussi être abordé puisqu’elle peut être un mode d’entrée dans la maladie mais aussi être une complication des traitements (de la gastrectomie avec les carences pouvant être associées, ou de la chimiothérapie).
L’iconographie associée pourrait être une image endoscopique de cancer ou d’ulcère, ou un scanner abdomino-pelvien.
Au sujet des traitements, il s’agit de comprendre que seule la chirurgie permet de guérir les patients, mais elle n’est pas accessible à tous. Comme toujours, il faut distinguer le bilan d’extension (résécabilité, curabilité) et le bilan d’opérabilité. La chimiothérapie périopératoire permet de doubler le taux de survie à 5 ans par rapport à la chirurgie seule ; si la chirurgie est urgente (saignement, sténose…) et qu’il n’a pas été possible de faire une chimiothérapie préopératoire, une chimioradiothérapie postopératoire est indiquée, car elle améliore elle aussi la survie, mais parfois au prix d’une toxicité plus importante. La chimiothérapie peut ouvrir le champ à des questions sur ses complications associées (neutropénie fébrile, toxicités propres à chaque molécule de chimiothérapie).
Abrégé d’hépato-gastro-entérologie, édition 2012 par la Collégiale des universitaires en hépato-gastro-entérologie (CDU-HGE), chapitre 10, « Tumeurs de l’estomac ».

 Encadrés
Encadrés