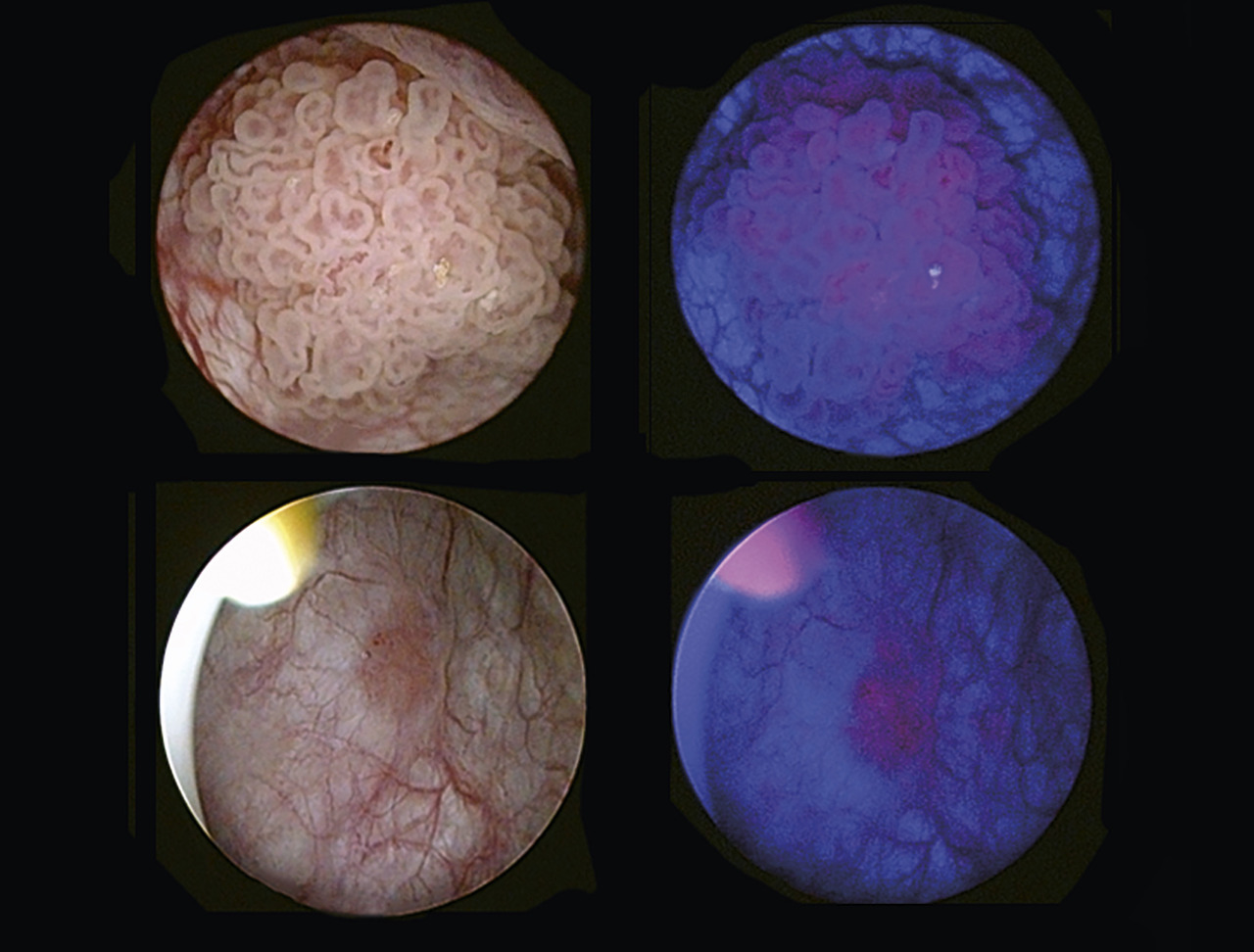
Leur incidence est en augmentation d’environ 1 % par an, en particulier chez la femme. L’hématurie macroscopique, volontiers terminale ou totale, est le principal signe rapporté.
En France, on estimait à 12 305 le nombre de nouveaux cas de tumeur vésicale en 2015, dont 80 % chez l’homme. Elles surviennent le plus souvent après 60 ans et représentent le second cancer urologique, après celui de la prostate.
Les principaux facteurs de risque sont le tabac et les cancérogènes d’origine professionnelle, amines aromatiques et hydrocarbures aromatiques polycyclique (goudrons, huiles et brais de houille, suies de combustion du charbon).
Dans ce contexte, une cytologie urinaire de dépistage doit être instaurée 20 ans après le début de l’exposition, en raison de la grande latence de développement de ces cancers.
Chez un patient atteint d’une tumeur vésicale et en cas d’exposition professionnelle avérée, une déclaration en vue d’une reconnaissance en maladie professionnelle doit être entreprise.
Les principaux facteurs de risque sont le tabac et les cancérogènes d’origine professionnelle, amines aromatiques et hydrocarbures aromatiques polycyclique (goudrons, huiles et brais de houille, suies de combustion du charbon).
Dans ce contexte, une cytologie urinaire de dépistage doit être instaurée 20 ans après le début de l’exposition, en raison de la grande latence de développement de ces cancers.
Chez un patient atteint d’une tumeur vésicale et en cas d’exposition professionnelle avérée, une déclaration en vue d’une reconnaissance en maladie professionnelle doit être entreprise.
Deux types : selon l’atteinte du détrusor
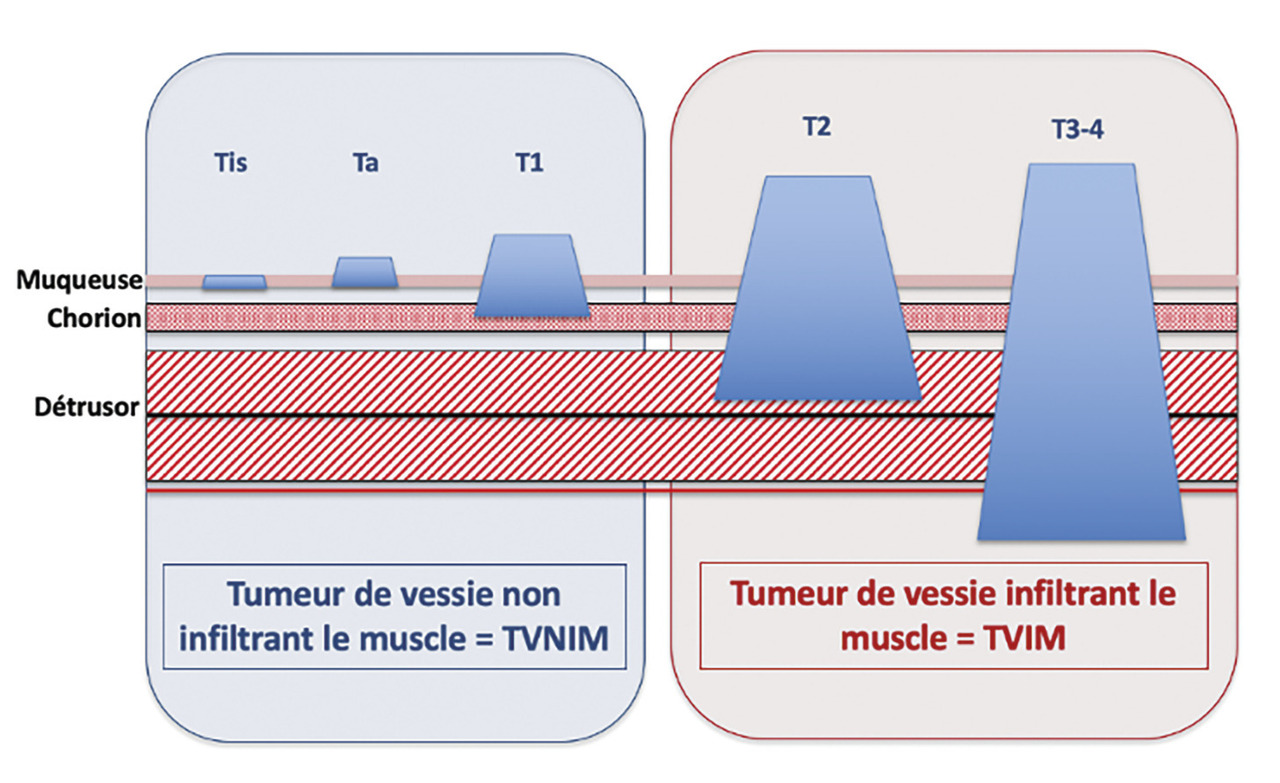
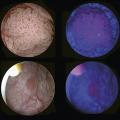
La classification morphologique les segmente en 2 grandes catégories : les tumeurs de vessie non infiltrant le muscle (TVNIM), les plus fréquentes (75 %), et celles infiltrant le muscle (TVIM) [fig. 1] .
La prise en charge des TVNIM est fondée sur la stratification en groupes pronostiques liés aux facteurs de risque (FDR) de récidive ou de progression. Pour la majorité des patients, résection et surveillance endoscopique sont suffisantes. Des instillations endovésicales, dans les suites de la résection, sont parfois adjointes en cas de facteur de risque.
Contre les formes infiltrantes ou métastatiques, les thérapeutiques sont plus lourdes et invasives.
Pour les TVIM localisées, chez les patients opérables, le traitement de référence est la cystectomie radicale (CR) + chimiothérapie néoadjuvante.
La prise en charge des TVNIM est fondée sur la stratification en groupes pronostiques liés aux facteurs de risque (FDR) de récidive ou de progression. Pour la majorité des patients, résection et surveillance endoscopique sont suffisantes. Des instillations endovésicales, dans les suites de la résection, sont parfois adjointes en cas de facteur de risque.
Contre les formes infiltrantes ou métastatiques, les thérapeutiques sont plus lourdes et invasives.
Pour les TVIM localisées, chez les patients opérables, le traitement de référence est la cystectomie radicale (CR) + chimiothérapie néoadjuvante.
Faire le diagnostic
Première étape : résection endoscopique transurétrale
Devant une hématurie macroscopique, l’échographie de l’appareil urinaire est le premier examen à réaliser. Dans cette indication, sa spécificité est très élevée (99 %). Toutefois, sa sensibilité insuffisante (63 %) pour détecter les tumeurs urothéliales vésicales doit faire pratiquer une cystoscopie lorsque l’échographie est normale. En cas de suspicion de TV, un scanner de l’appareil urinaire (uro-TDM) s’impose pour rechercher une lésion urothéliale associée dans les cavités urétéropyélocalicielles.
Le diagnostic initial des TV est effectué après résection endoscopique transurétrale. Certaines méthodes facilitent la visualisation tumorale : la luminofluorescence vésicale après instillation d’hexaminolévulinate et illumination en lumière bleue, la Narrow Band Imaging (NBI) [imagerie en bandes spectrales étroites]. Ces techniques améliorent la qualité de la résection et diminuent le risque de récidive. Une instillation postopératoire précoce de mitomycine C (IPOP) réalisée entre 2 h et 24 h postopératoire est une option thérapeutique. La description endoscopique associée à l’analyse anatomopathologique des prélèvements de la résection transurétrale de vessie (RTUV) permet de classer et de différencier les TV en fonction de l’infiltration ou non du détrusor (TVIM/TVNIM).
Le diagnostic initial des TV est effectué après résection endoscopique transurétrale. Certaines méthodes facilitent la visualisation tumorale : la luminofluorescence vésicale après instillation d’hexaminolévulinate et illumination en lumière bleue, la Narrow Band Imaging (NBI) [imagerie en bandes spectrales étroites]. Ces techniques améliorent la qualité de la résection et diminuent le risque de récidive. Une instillation postopératoire précoce de mitomycine C (IPOP) réalisée entre 2 h et 24 h postopératoire est une option thérapeutique. La description endoscopique associée à l’analyse anatomopathologique des prélèvements de la résection transurétrale de vessie (RTUV) permet de classer et de différencier les TV en fonction de l’infiltration ou non du détrusor (TVIM/TVNIM).
Tumeurs non infiltrantes
La classification pronostique des TVNIM dépend de l’existence de FDR de récidive et de progression. Elle a été définie par une méta-analyse de l’EORTC (European Organisation for Research and Treatment of Cancer ; Organisation européenne pour la recherche et le traitement du cancer), regroupant 7 essais de phase III, soit 2 595 patients.1
– ainsi, 3 FDR de récidive ont été identifiés : multifocalité, diamètre > 3 cm, tumeur récidivante ;
– et 3 FDR de progression : stade pT1, tumeur de haut grade (G3), présence de carcinome in situ (CIS).
L’Association française d’urologie (AFU) a déterminé 4 groupes pronostiques :
– faible risque : aucun FDR de récidive ou de progression ;
– risque intermédiaire : 1 des FDR de récidive ;
– haut risque : 1 des FDR de progression ;
– très haut risque : association de FDR de progression et de récidive.2
Cette classification guide les modalités du traitement (tableau ).
Dans certains cas, une seconde RTUV (second look) est indiquée afin de réévaluer systématiquement l’évolution tumorale après 2 à 6 semaines :
– tumeur de stade pT1 ;
– néoplasie volumineuse et/ou multifocale (pour compléter la résection) ;
– absence de muscle identifié sur la pièce de résection initiale (sauf en cas de pTa de bas grade).
Elle permet de classer plus précisément la tumeur dans un groupe pronostique et surtout d’améliorer la sélection des candidats au traitement endovésical.
– ainsi, 3 FDR de récidive ont été identifiés : multifocalité, diamètre > 3 cm, tumeur récidivante ;
– et 3 FDR de progression : stade pT1, tumeur de haut grade (G3), présence de carcinome in situ (CIS).
L’Association française d’urologie (AFU) a déterminé 4 groupes pronostiques :
– faible risque : aucun FDR de récidive ou de progression ;
– risque intermédiaire : 1 des FDR de récidive ;
– haut risque : 1 des FDR de progression ;
– très haut risque : association de FDR de progression et de récidive.2
Cette classification guide les modalités du traitement (
Dans certains cas, une seconde RTUV (second look) est indiquée afin de réévaluer systématiquement l’évolution tumorale après 2 à 6 semaines :
– tumeur de stade pT1 ;
– néoplasie volumineuse et/ou multifocale (pour compléter la résection) ;
– absence de muscle identifié sur la pièce de résection initiale (sauf en cas de pTa de bas grade).
Elle permet de classer plus précisément la tumeur dans un groupe pronostique et surtout d’améliorer la sélection des candidats au traitement endovésical.
Quand adjoindre des instillations vésicales ?
Pour les TVNIM compliquées de FDR de récidive et/ou de progression, le traitement de référence est la RTUV associée à des instillations endovésicales complémentaires de mitomycine C (MMC) ou de BCG-thérapie qui stimulent la réponse immunitaire locale. Objectif : diminuer le risque de récidive et de progression.
La MMC est recommandée en adjuvant lorsque le risque est intermédiaire. Le protocole comprend 8 instillations hebdomadaires suivies d’une instillation mensuelle pendant 1 an. Elle connaît des difficultés d’approvisionnement depuis juillet 2019 du fait de problèmes de production. Afin d’y pallier, l’utilisation d’épirubicine en alternative à la MMC, validée scientifiquement et expérimentée dans d’autres pays, est admise en première intention.
Le BCG est indiqué dans les TVNIM à risque intermédiaire et haut (le produit est inséré via une sonde urinaire placée dans l’urètre et conservé dans la vessie pendant 2 h). Le schéma d’induction comporte 6 instillations hebdomadaires auxquelles on peut adjointre un traitement d’entretien jusqu’à 3 ans. Il a également connu des tensions d’approvisionnement. Afin d’éviter le passage sanguin, les instillations de BCG débutent après cicatrisation vésicale (disparition de l’hématurie macroscopique). En revanche, il peut être instillé même lorsqu’une hématurie microscopique, une leucocyturie et une bactériurie asymptomatique sont détectées sur l’ECBU. Seules véritables contre- indications : antécédents de réaction systémique, infection tuberculosique active, altération de la barrière urine/sang par traumatisme ou cystite infectieuse avérée ou radique, fièvre d’origine indéterminée et non explorée, et déficit immunitaire. Des effets indésirables locaux (pollakiurie, hématurie, impérosité, douleurs sus-pubiennes et mictionnelles) et généraux (syndrome pseudogrippal) sont possibles. Ils sont traités par AINS et paracétamol. Plus rarement sont rapportées : détresse respiratoire, infection, voire septicémie liée au passage systémique du BCG. Elles nécessitent l’interruption définitive des instillations. Leur prise en charge est urgente : administration immédiate d’ofloxacine (400 mg/j : 7 à 21 j selon gravité), corticoïdes (0,5 à 1 mg/j) et antituberculeux après avis d’un infectiologue.
La MMC est recommandée en adjuvant lorsque le risque est intermédiaire. Le protocole comprend 8 instillations hebdomadaires suivies d’une instillation mensuelle pendant 1 an. Elle connaît des difficultés d’approvisionnement depuis juillet 2019 du fait de problèmes de production. Afin d’y pallier, l’utilisation d’épirubicine en alternative à la MMC, validée scientifiquement et expérimentée dans d’autres pays, est admise en première intention.
Le BCG est indiqué dans les TVNIM à risque intermédiaire et haut (le produit est inséré via une sonde urinaire placée dans l’urètre et conservé dans la vessie pendant 2 h). Le schéma d’induction comporte 6 instillations hebdomadaires auxquelles on peut adjointre un traitement d’entretien jusqu’à 3 ans. Il a également connu des tensions d’approvisionnement. Afin d’éviter le passage sanguin, les instillations de BCG débutent après cicatrisation vésicale (disparition de l’hématurie macroscopique). En revanche, il peut être instillé même lorsqu’une hématurie microscopique, une leucocyturie et une bactériurie asymptomatique sont détectées sur l’ECBU. Seules véritables contre- indications : antécédents de réaction systémique, infection tuberculosique active, altération de la barrière urine/sang par traumatisme ou cystite infectieuse avérée ou radique, fièvre d’origine indéterminée et non explorée, et déficit immunitaire. Des effets indésirables locaux (pollakiurie, hématurie, impérosité, douleurs sus-pubiennes et mictionnelles) et généraux (syndrome pseudogrippal) sont possibles. Ils sont traités par AINS et paracétamol. Plus rarement sont rapportées : détresse respiratoire, infection, voire septicémie liée au passage systémique du BCG. Elles nécessitent l’interruption définitive des instillations. Leur prise en charge est urgente : administration immédiate d’ofloxacine (400 mg/j : 7 à 21 j selon gravité), corticoïdes (0,5 à 1 mg/j) et antituberculeux après avis d’un infectiologue.
Autres thérapeutiques en cours d’évaluation
Thermochimiothérapie : le principe est de maintenir la MMC à 40-44 °C pendant la durée de l’instillation intravésicale pour en accroître la pénétration. Divers dispositifs sont disponibles : échauffement intravésical par micro-ondes délivrées à l’aide d’un cathéter (Synergo) ou extravésical grâce à une pompe entre la vessie et la poche de MMC, qui est mise en circulation à 43 °C durant 1 heure (HIVEC). Cette thérapie est peu diffusée compte tenu de son coût. Lorsqu’elle est disponible, elle peut être proposée pour les TVNIM à risque intermédiaire en cas d’échec de la MMC ou du BCG et pour celles à haut risque en cas d’indisponibilité ou d’intolérance du BCG.2
L’immunothérapie systémique fait l’objet de plusieurs essais thérapeutiques. Une étude française (ALBAN) compare l’efficacité de l’atézolizumab associé au BCG à celle du BCG seul dans les TVNIM à haut risque. Certains patients résistants au BCG (40 %) du fait de mécanismes immunologiques, pourraient bénéficier d’une telle thérapie. L’objectif de l’étude est de mettre en évidence une amélioration de la survie et une diminution du recours à un traitement radical (cystectomie) lié à une progression de la maladie. Cet essai est en cours d’inclusion et accessible dans de nombreux centres français.
L’immunothérapie systémique fait l’objet de plusieurs essais thérapeutiques. Une étude française (ALBAN) compare l’efficacité de l’atézolizumab associé au BCG à celle du BCG seul dans les TVNIM à haut risque. Certains patients résistants au BCG (40 %) du fait de mécanismes immunologiques, pourraient bénéficier d’une telle thérapie. L’objectif de l’étude est de mettre en évidence une amélioration de la survie et une diminution du recours à un traitement radical (cystectomie) lié à une progression de la maladie. Cet essai est en cours d’inclusion et accessible dans de nombreux centres français.
Très haut risque : cystectomie d’emblée ?
Le sous-groupe particulier de TVNIM à très haut risque requiert une prise en charge plus agressive (tableau ). L’association de FDR de progression (pT1 + G3 + CIS) et de certains FDR de récidive (tumeur > 3 cm, multifocalité) augmenterait la probabilité de progression à 10 ans jusqu’à 52 %.3
D’autres études ont complété la liste de ces facteurs très péjoratifs comme la présence de variants histologiques « inhabituels », la forme classique étant le carcinome constitué de cellules urothéliales papillaires. Constatés dans 26 % des cas, ils peuvent être prédictifs d’une évolution péjorative (plasmocytaire, micropapillaire).4
De plus, le pronostic des patients ayant progressé d’une TVNIM vers une TVIM est moins bon que celui des sujets ayant une TVIM de prime abord. La CR d’emblée se discute dans ces formes à très haut risque.
D’autres études ont complété la liste de ces facteurs très péjoratifs comme la présence de variants histologiques « inhabituels », la forme classique étant le carcinome constitué de cellules urothéliales papillaires. Constatés dans 26 % des cas, ils peuvent être prédictifs d’une évolution péjorative (plasmocytaire, micropapillaire).4
De plus, le pronostic des patients ayant progressé d’une TVNIM vers une TVIM est moins bon que celui des sujets ayant une TVIM de prime abord. La CR d’emblée se discute dans ces formes à très haut risque.
Tumeurs infiltrantes
Un bilan d’extension par uro-TDM et un scanner thoracique s’impose. On recherche notamment l’atteinte de la graisse périvésicale et des organes adjacents.
Cystectomie : incontournable
Le traitement chirurgical des TVIM localisées est la pierre angulaire de la prise en charge : exérèse de la vessie et curage ganglionnaire pelvien étendu bilatéral puis dérivation urinaire ou remplacement vésical. À côté de la chirurgie ouverte traditionnelle – la plus utilisée –, la cystectomie laparoscopique avec assistance robotique ou non est en cours de développement. Cette technique mini-invasive est plus longue et nécessite un opérateur entraîné. Elle réduit le saignement et la durée d’hospitalisation, mais sans bénéfice en termes de complications postopératoires et de résultats fonctionnels et carcinologiques.5
Chez l’homme, la CR comporte aussi l’ablation de la prostate et les vésicules séminales. Une préservation de la fonction érectile est envisagée chez des patients sélectionnés (maladie localisée, pas d’atteinte du col vésical ni de la prostate). Chez la femme, la pelvectomie antérieure emporte la vessie, l’utérus et la paroi antérieure du vagin. Pour la patiente jeune : cystectomie seule si la tumeur est située à distance du col, du trigone ou de la face postérieure.
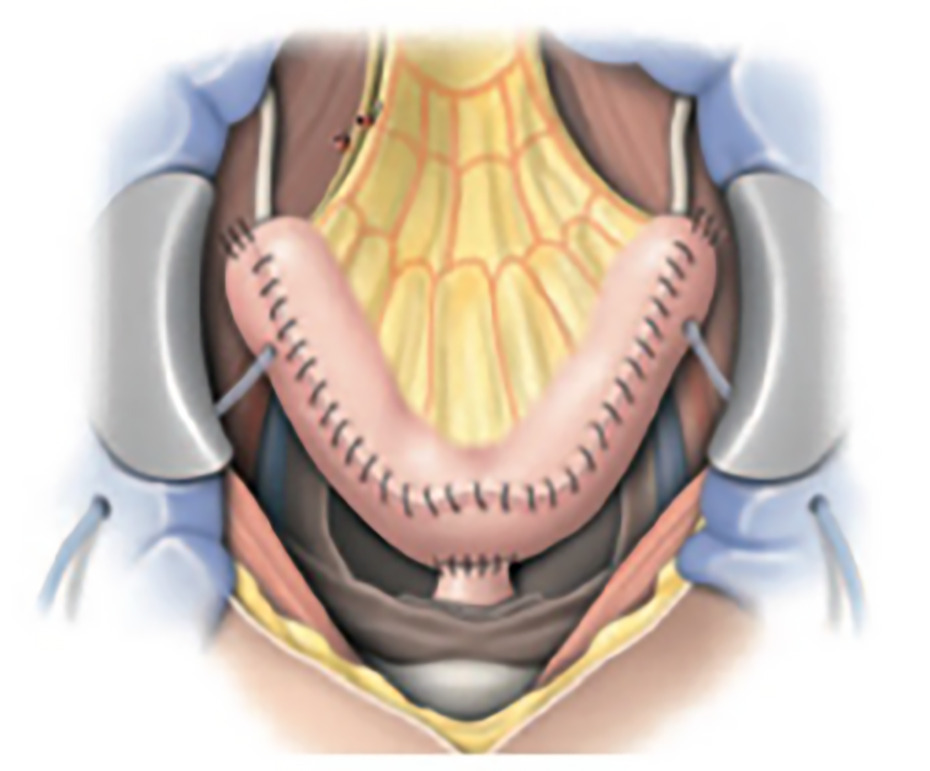
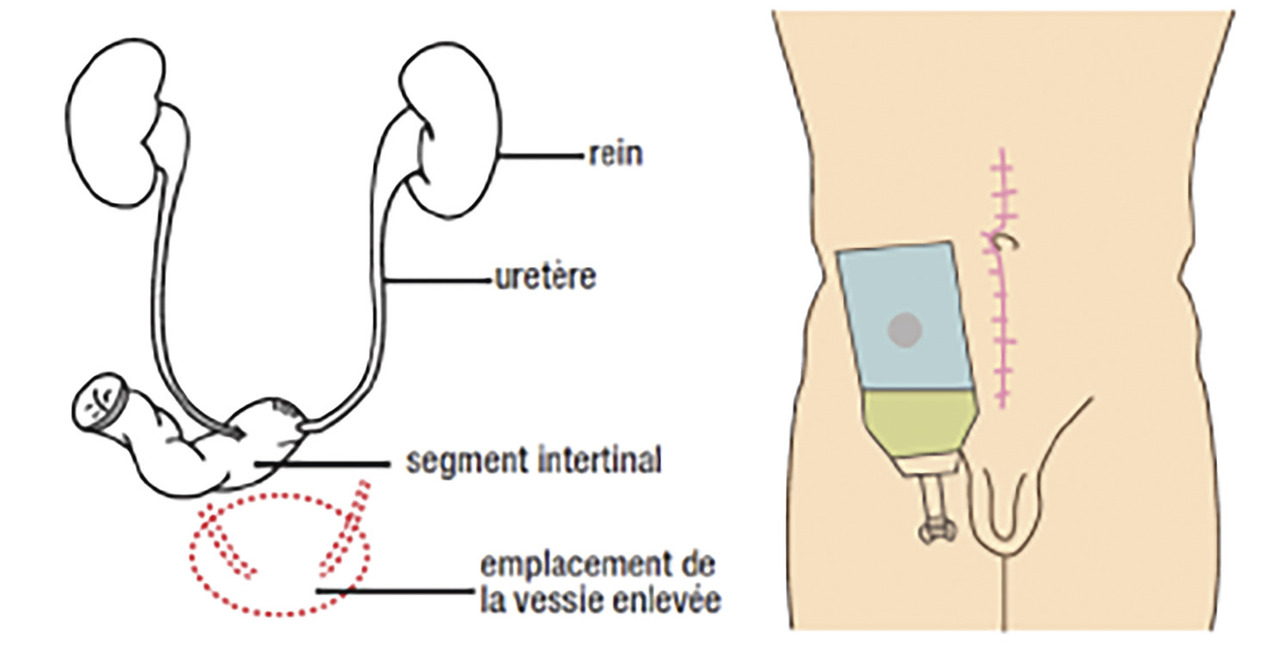
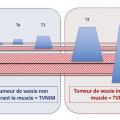
Après cystectomie, plusieurs techniques de dérivation urinaire sont possibles. Chez l’homme, le remplacement vésical par un réservoir iléal (entérocystoplastie) est privilégié chaque fois que l’état du patient le permet, en l’absence de contre-indications (envahissement urétral, insuffisance rénale < 50 mL/min, troubles cognitifs et psychiatriques, pathologies inflammatoires de l’intestin ou irradiation pelvienne à forte dose). Dans ce cas, les uretères sont implantés dans le segment de tube digestif préalablement isolé et utilisé comme réservoir, et qui est anastomosé à l’urètre (fig. 2 ). Le segment digestif est détubulisé afin de permettre le recueil des urines à basse pression, la protection du haut appareil urinaire, la restauration d’une miction volontaire. Cette technique est également possible chez la femme en l’absence d’atteinte du col vésical. Lorsqu’un remplacement vésical n’est pas envisageable, les urines sont dérivées à la peau (stomie). Pour cela les uretères sont anastomosés à un segment d’iléon, lui-même abouché à la peau (Bricker). Cela signifie un seul orifice cutané (fig. 3 ). Cette dérivation est fiable à long terme et plus rapide à réaliser chez les patients pour lesquels la durée opératoire est à prendre en compte. L’urétérostomie cutanée bilatérale (abouchement des uretères directement à la paroi abdominale) est généralement évitée et réservée à de rares cas (cystectomie palliative, contre-indication aux autres modes de dérivations).
Chez l’homme, la CR comporte aussi l’ablation de la prostate et les vésicules séminales. Une préservation de la fonction érectile est envisagée chez des patients sélectionnés (maladie localisée, pas d’atteinte du col vésical ni de la prostate). Chez la femme, la pelvectomie antérieure emporte la vessie, l’utérus et la paroi antérieure du vagin. Pour la patiente jeune : cystectomie seule si la tumeur est située à distance du col, du trigone ou de la face postérieure.
Après cystectomie, plusieurs techniques de dérivation urinaire sont possibles. Chez l’homme, le remplacement vésical par un réservoir iléal (entérocystoplastie) est privilégié chaque fois que l’état du patient le permet, en l’absence de contre-indications (envahissement urétral, insuffisance rénale < 50 mL/min, troubles cognitifs et psychiatriques, pathologies inflammatoires de l’intestin ou irradiation pelvienne à forte dose). Dans ce cas, les uretères sont implantés dans le segment de tube digestif préalablement isolé et utilisé comme réservoir, et qui est anastomosé à l’urètre (
Optimisation périopératoire : primordiale
Une bonne évaluation préopératoire fondée sur l’analyse des comorbidités et de l’état nutritionnel (% de perte de poids, IMC, albumine) prévient les complications post-chirurgicales. La récupération améliorée après chirurgie (RAAC) accélère le rétablissement postopératoire. elle consiste notamment en :
– préopératoire : aide au sevrage tabagique, équilibration d’un diabète et de pathologies chroniques cardiovasculaire ou respiratoire, traitement d’une anémie, préparation nutritionnelle ; informations sur les dérivations urinaires et le parcours de soins ;
– peropératoire : réchauffement actif (prévention de l’hypothermie), maintien d’une bonne volémie (transfusion ou perfusion ≤ 5 mL/kg/h) ;
– postopératoire : prévention de l’iléus, alimentation solide prudente, mobilisation précoce dès le lendemain (fauteuil), marche à J2, bas de contention.
Les sujets âgés ont besoin d’une évaluation et d’une prise en charge spécifiques.6 Leur pronostic est plus péjoratif du fait, d’une part, d’un retard diagnostique et d’autre part de l’accès restreint à la chirurgie curative. La morbi-mortalité de la CR est plus élevée après 75 ans. Elle est envisagée chez des personnes âgées sélectionnées avec une espérance de vie supérieure à 2 ans. Elle doit s’inscrire dans une prise en charge multidisciplinaire pré-, per- et postopératoire.
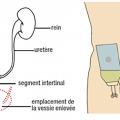
L’outil Oncodage (ou G8) identifie les individus risquant de mal tolérer un traitement anticancéreux du fait d’une dénutrition, de comorbidités, de troubles cognitifs… Une évaluation gériatrique approfondie est recommandée lorsque le score G8 ≤ 14/17 (fig. 4 ).
– préopératoire : aide au sevrage tabagique, équilibration d’un diabète et de pathologies chroniques cardiovasculaire ou respiratoire, traitement d’une anémie, préparation nutritionnelle ; informations sur les dérivations urinaires et le parcours de soins ;
– peropératoire : réchauffement actif (prévention de l’hypothermie), maintien d’une bonne volémie (transfusion ou perfusion ≤ 5 mL/kg/h) ;
– postopératoire : prévention de l’iléus, alimentation solide prudente, mobilisation précoce dès le lendemain (fauteuil), marche à J2, bas de contention.
Les sujets âgés ont besoin d’une évaluation et d’une prise en charge spécifiques.6 Leur pronostic est plus péjoratif du fait, d’une part, d’un retard diagnostique et d’autre part de l’accès restreint à la chirurgie curative. La morbi-mortalité de la CR est plus élevée après 75 ans. Elle est envisagée chez des personnes âgées sélectionnées avec une espérance de vie supérieure à 2 ans. Elle doit s’inscrire dans une prise en charge multidisciplinaire pré-, per- et postopératoire.
L’outil Oncodage (ou G8) identifie les individus risquant de mal tolérer un traitement anticancéreux du fait d’une dénutrition, de comorbidités, de troubles cognitifs… Une évaluation gériatrique approfondie est recommandée lorsque le score G8 ≤ 14/17 (
Chimio- et immunothérapie
La chimiothérapie néoadjuvante (CN) avant cystectomie a confirmé un intérêt modeste mais réel quel que soit le stade initial de la tumeur. Elle améliore la survie globale de 8 % à 5 ans.7 Comportant du cisplatine avec méthotrexate, vinblastine et doxorubicine, elle s’administre en 4 à 6 cycles sur une durée de 2 à 3 mois.
Il semblerait que certains patients n’en tirent pas de bénéfice. Les facteurs prédictifs d’une mauvaise réponse sont encore à déterminer, mais des sous-types moléculaires pourraient améliorer la sélection des malades.8 La CN serait bénéfique au sous-type basal, au contraire du luminal – de meilleur pronostic spontané – et du p53-like. Cette classification moléculaire, encore à l’essai, contribuera peut-être au choix des traitements complémentaires à la CR, chimio- et immunothérapie. Quant à la chimiothérapie postopératoire (adjuvante) son utilité reste débattue. La radiothérapie adjuvante est, elle, en cours d’évaluation.
Si la cystectomie demeure la référence, les malades chez qui elle ne peut être envisagée et certains patients bien sélectionnés (tumeur unique, T2 maximum, sans CIS, sans hydronéphrose avec résection complète) ont comme alternative un traitement multimodal : RTUV complète puis radiochimiothérapie concomitante. Enfin, l’immunothérapie systémique est en cours d’étude en néoadjuvant ou en adjuvant après cystectomie. Elle est testée en monothérapie et en association à la chimiothérapie.
Il semblerait que certains patients n’en tirent pas de bénéfice. Les facteurs prédictifs d’une mauvaise réponse sont encore à déterminer, mais des sous-types moléculaires pourraient améliorer la sélection des malades.8 La CN serait bénéfique au sous-type basal, au contraire du luminal – de meilleur pronostic spontané – et du p53-like. Cette classification moléculaire, encore à l’essai, contribuera peut-être au choix des traitements complémentaires à la CR, chimio- et immunothérapie. Quant à la chimiothérapie postopératoire (adjuvante) son utilité reste débattue. La radiothérapie adjuvante est, elle, en cours d’évaluation.
Si la cystectomie demeure la référence, les malades chez qui elle ne peut être envisagée et certains patients bien sélectionnés (tumeur unique, T2 maximum, sans CIS, sans hydronéphrose avec résection complète) ont comme alternative un traitement multimodal : RTUV complète puis radiochimiothérapie concomitante. Enfin, l’immunothérapie systémique est en cours d’étude en néoadjuvant ou en adjuvant après cystectomie. Elle est testée en monothérapie et en association à la chimiothérapie.
Tumeurs métastatiques
Leur pronostic est très mauvais, la médiane de survie étant de 14 à 15 mois.2 Environ 50 % de ces patients sont inéligibles à une chimiothérapie à base de cisplatine du fait de leur fonction rénale (clairance < 60 mL/min) ou leur état général (Performance Status > 1). Elle se compose en 1re ligne de MVAC (méthotrexate, vinblastine, adriamycine, cisplatine) ou de GC (gemcitabine, cisplatine) en cycle de 4 semaines.
Depuis plusieurs années, l’immunothérapie systémique – principalement les inhibiteurs de PD-1 et PD-L1 (pembrolizumab [Keytruda], atézolizumab [Tecentriq], nivolumab [Opdivo], avélumab [Bavencio]– offre de nouvelles possibilités thérapeutiques. Elle a initialement été évaluée chez les patients métastatiques, en seconde ligne après chimiothérapie. Le pembrolizumab, qui a déjà l’AMM dans cette indication, est remboursé en France depuis janvier 2020. Actuellement, des études de phase III sont en cours pour évaluer l’immunothérapie en 1re ligne dans les tumeurs métastatiques. Pour les tumeurs localement avancées ou métastatiques inéligibles à la chimiothérapie par cisplatine, des études de phase II (pembrolizumab, KEYNOTE-052, atézolizumab, IMvigor 210) ont montré des résultats intéressants.
Par ailleurs, l’immunothérapie a aussi été expérimentée en association à la chimiothérapie de 1re ligne. Un traitement d’entretien par avélumab (anti-PDL1) après réponse à une 1re ligne de chimiothérapie a montré un bénéfice en survie globale. Cette option est en attente de mise à disposition.
L’immunothérapie systémique pourrait devenir prochainement un des traitements de référence.
Depuis plusieurs années, l’immunothérapie systémique – principalement les inhibiteurs de PD-1 et PD-L1 (pembrolizumab [Keytruda], atézolizumab [Tecentriq], nivolumab [Opdivo], avélumab [Bavencio]– offre de nouvelles possibilités thérapeutiques. Elle a initialement été évaluée chez les patients métastatiques, en seconde ligne après chimiothérapie. Le pembrolizumab, qui a déjà l’AMM dans cette indication, est remboursé en France depuis janvier 2020. Actuellement, des études de phase III sont en cours pour évaluer l’immunothérapie en 1re ligne dans les tumeurs métastatiques. Pour les tumeurs localement avancées ou métastatiques inéligibles à la chimiothérapie par cisplatine, des études de phase II (pembrolizumab, KEYNOTE-052, atézolizumab, IMvigor 210) ont montré des résultats intéressants.
Par ailleurs, l’immunothérapie a aussi été expérimentée en association à la chimiothérapie de 1re ligne. Un traitement d’entretien par avélumab (anti-PDL1) après réponse à une 1re ligne de chimiothérapie a montré un bénéfice en survie globale. Cette option est en attente de mise à disposition.
L’immunothérapie systémique pourrait devenir prochainement un des traitements de référence.
Références
1. Sylvester RJ, van der Meijden AP, Oosterlinck W, et al. Predicting Recurrence and Progression in Individual Patients with Stage Ta T1 Bladder Cancer Using EORTC Risk Tables: A Combined Analysis of 2596 Patients from Seven EORTC Trials. Eur Urol 2006;49:466‑77.
2. Rouprêt M, Neuzillet Y, Pignot G, et al. French ccAFU guidelines – Update 2018–2020: Bladder cancer. Prog Urol 2019;28(S1):R48‑80.
3. Gontero P, Sylvester R, Pisano F, et al. Prognostic Factors and Risk Groups in T1G3 Non–Muscle-invasive Bladder Cancer Patients Initially Treated with Bacillus Calmette-Guérin: Results of a Retrospective Multicenter Study of 2451 Patients. Eur Urol 2015;67:74‑82.
4. Monn MF, Kaimakliotis HZ, Pedrosa JA, et al. Contemporary bladder cancer: Variant histology may be a significant driver of disease. Urol Oncol 2015;33:18.e15-18.e20.
5. Rai BP, Bondad J, Vasdev N, et al. Robotic versus open radical cystectomy for bladder cancer in adults. Cochrane Database Syst Rev 2019;4:CD011903.
6. Neuzillet Y, Geiss R, Paillaud E, Mongiat-Artus P. Optimizing the management of bladder cancer in older patients. Prog Urol 2019; 29:849‑64.
7. Yin M, Joshi M, Meijer RP, et al. Neoadjuvant Chemotherapy for Muscle-Invasive Bladder Cancer: A Systematic Review and Two-Step Meta-Analysis. Oncologist 2016;21:708‑15.
8. Choi W, Porten S, Kim S, et al. Identification of Distinct Basal and Luminal Subtypes of Muscle-Invasive Bladder Cancer with Different Sensitivities to Frontline Chemotherapy. Cancer Cell 2014;25:152‑65.
2. Rouprêt M, Neuzillet Y, Pignot G, et al. French ccAFU guidelines – Update 2018–2020: Bladder cancer. Prog Urol 2019;28(S1):R48‑80.
3. Gontero P, Sylvester R, Pisano F, et al. Prognostic Factors and Risk Groups in T1G3 Non–Muscle-invasive Bladder Cancer Patients Initially Treated with Bacillus Calmette-Guérin: Results of a Retrospective Multicenter Study of 2451 Patients. Eur Urol 2015;67:74‑82.
4. Monn MF, Kaimakliotis HZ, Pedrosa JA, et al. Contemporary bladder cancer: Variant histology may be a significant driver of disease. Urol Oncol 2015;33:18.e15-18.e20.
5. Rai BP, Bondad J, Vasdev N, et al. Robotic versus open radical cystectomy for bladder cancer in adults. Cochrane Database Syst Rev 2019;4:CD011903.
6. Neuzillet Y, Geiss R, Paillaud E, Mongiat-Artus P. Optimizing the management of bladder cancer in older patients. Prog Urol 2019; 29:849‑64.
7. Yin M, Joshi M, Meijer RP, et al. Neoadjuvant Chemotherapy for Muscle-Invasive Bladder Cancer: A Systematic Review and Two-Step Meta-Analysis. Oncologist 2016;21:708‑15.
8. Choi W, Porten S, Kim S, et al. Identification of Distinct Basal and Luminal Subtypes of Muscle-Invasive Bladder Cancer with Different Sensitivities to Frontline Chemotherapy. Cancer Cell 2014;25:152‑65.