Tumeurs du col utérin
Épidémiologie (rang B)
Physiopathologie (rang B)
Le col de l’utérus est tapissé par une muqueuse exocervicale (malpighienne), qui se prolonge par une muqueuse endocervicale (glandulaire). La zone de rencontre entre les deux est nommée zone de jonction pavimento-cylindrique. Elle est le réservoir principal de l’HPV.
Les cancers du col peuvent donc être épidermoïdes (développés à partir de la muqueuse exocervicale malpighienne [de 80 à 90 % des cas]) ou des adénocarcinomes (développés à partir de la muqueuse endocervicale, glandulaire [de 10 à 20 % des cas]). La très grande majorité des cancers du col est liée à l’HPV.
Facteurs de risque (rang B)
Les HPV associés à un fort risque de cancer du col de l’utérus sont appelés les HPV-HR (haut risque) ou oncogènes. Il s’agit des HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 et 82. On retient surtout les HPV 16 et 18, les plus virulents. Les HPV 6 et 11 sont, quant à eux, responsables de lésions bénignes (verrues génitales ou papillomatose respiratoire).
L’infection à HPV est une infection sexuellement transmissible qui se transmet surtout en début d’activité sexuelle. Les méthodes barrières (préservatifs, diaphragmes…) ne permettent pas de se protéger complètement des HPV. Quatre-vingts pour cent des personnes auront une infection à HPV au cours de leur vie, mais 90 % guériront spontanément dans les deux ans : c’est la clairance naturelle de l’HPV. Les lésions précurseurs puis cancéreuses sont liées à la persistance de l’HPV chez certains patients ou patientes.
Les facteurs de risque d’infection à HPV sont le nombre élevé de partenaires sexuels, l’âge précoce lors du premier rapport sexuel et le bas niveau socio-économique. Les facteurs de risque de persistance de l’infection à l’HPV sont l’immunodépression (notamment par infection au VIH) et le tabagisme.
Prévention (rang A)
Primaire : le vaccin (rang A)
La vaccination protège contre les HPV oncogènes et contre certains non oncogènes. Le vaccin recommandé à ce jour est le nonavalent (9 HPV, Gardasil 9) qui protège contre les HPV non oncogènes 6 et 11, et oncogènes 16, 18, 31, 33, 45, 52 et 58.Le vaccin nonavalent doit être utilisé pour toute nouvelle vaccination (qui est remboursée). Le schéma vaccinal est le suivant pour les filles et les garçons :
- de 11 à 14 ans : vaccin nonavalent en 2 doses (M0, puis entre M6 et M13) ;
- rattrapage possible de 15 à 19 ans en 3 doses (M0, M2, M6) ;
- possibilité chez les hommes ayant des relations avec les hommes de bénéficier d’un schéma à 3 doses jusqu’à 26 ans ;
- possibilité d’une vaccination dès l’âge de 9 ans chez les patients candidats à une transplantation d’organe solide.
La vaccination ne se substitue pas au dépistage.
Secondaire (rang A)
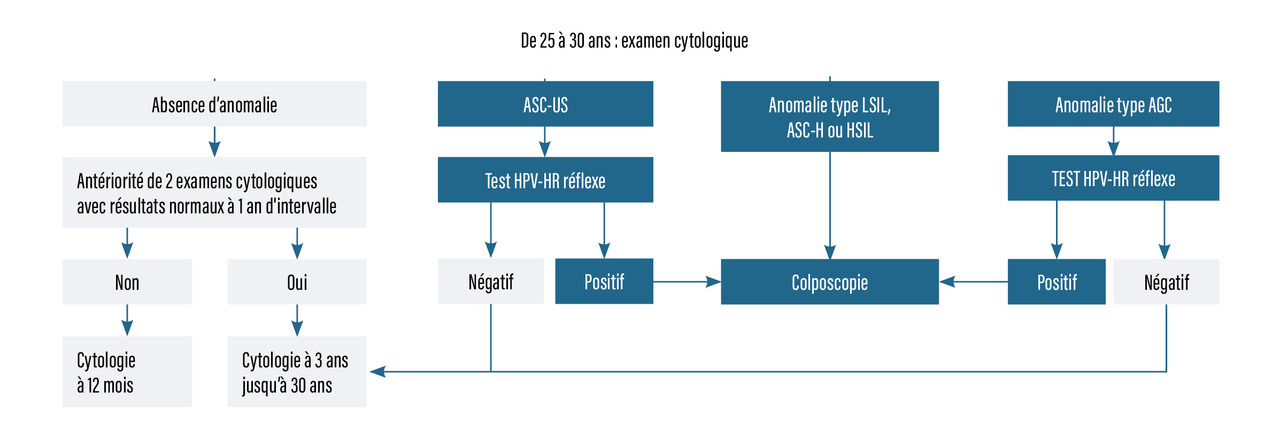
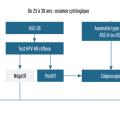
L’objectif de la prévention secondaire est de détecter les lésions précancéreuses. Le dépistage est proposé à toutes les femmes asymptomatiques, ayant un col de l’utérus et ayant déjà eu un rapport sexuel, de l’âge de 25 à 65 ans. Il consiste en un examen cytologique (frottis cervico-utérin) et/ou un test HPV-HR.Il est pris en charge à 100 % et sans avance de frais.
En France, en 2017, il était estimé que 58 % des femmes seulement étaient à jour dans leur dépistage.
Dépistage cytologique : frottis cervico-utérin
L’examen cytologique peut donner plusieurs résultats selon la terminologie de Bethesda (
Le double immunomarquage p16-Ki67 permet d’identifier les patientes à risque. Le marquage p16 témoigne de l’infection à l’HPV, le marquage Ki67 est un indice de la prolifération cellulaire.
Dépistage virologique : test HPV
Le test HPV est un examen très sensible mais peu spécifique concernant les lésions précancéreuses. Du fait de la forte prévalence des infections HPV-HR transitoires chez les femmes âgées de moins de 30 ans, celui-ci n’est pas indiqué en première intention pour elles.
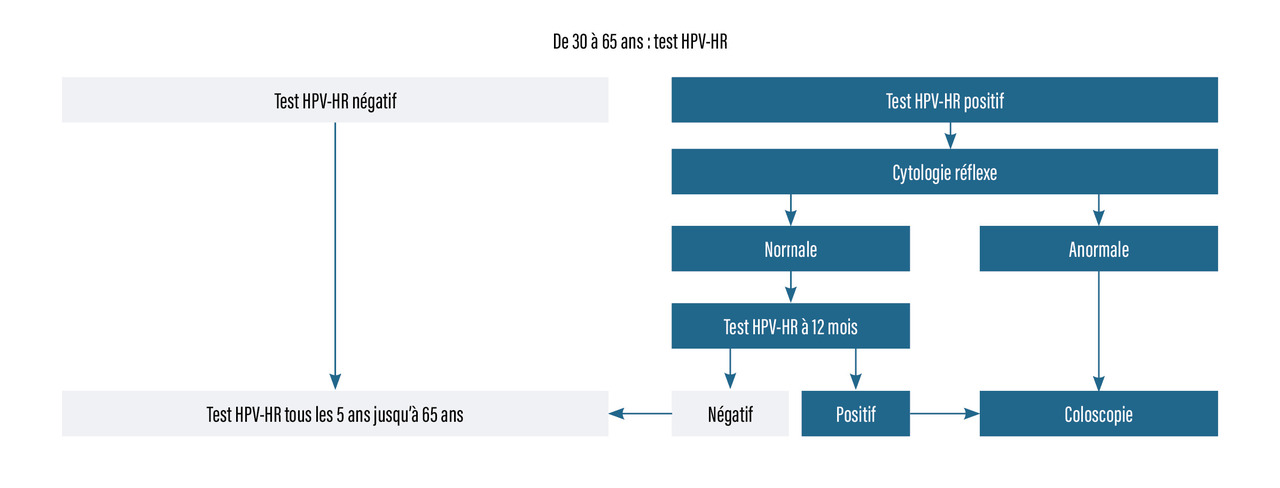
Modalités du dépistage (rang A)
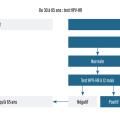
Le premier frottis est recommandé à l’âge de 25 ans. S’il est normal, il est de nouveau effectué un an plus tard, puis tous les trois ans si les deux premiers étaient normaux. De 30 à 65 ans, c’est le test HPV-HR qui est recommandé, tous les cinq ans. Celui-ci est débuté trois ans après le dernier examen cytologique normal (Chez une patiente avec une cytologie ASC-US ou LSIL, un double immunomarquage p16-Ki67 peut être proposé. S’il est positif, une colposcopie est réalisée. S’il est négatif, une cytologie (avant l’âge de 30 ans) ou un test HPV-HR (après l’âge de 30 ans) est proposé à douze mois.
En cas d’AGC, la réalisation d'un curetage endocervical est recommandée. Une exploration utérine doit être préconisée après 45 ans.
Cas particuliers (rang C)
Chez les patientes atteintes du VIH et les patientes immunodéprimées, un dépistage annuel par examen cytologique est recommandé.Chez les patientes exposées au diéthylstilbestrol, un examen cytologique annuel est recommandé, même après l’âge de 65 ans.
La fréquence et le type de dépistage sont les mêmes chez la femme enceinte. Il doit être effectué au premier trimestre s’il n’est pas à jour. Il n’est pas recommandé de l’effectuer au deuxième ou troisième trimestre. Chez une patiente enceinte âgée de moins de 30 ans avec une cytologie ASC-US ou LSIL, une nouvelle cytologie est proposée deux à trois mois après l’accouchement. Chez une patiente âgée de moins de 30 ans avec une cytologie ASC-H, AGC ou HSIL, une colposcopie est réalisée.
Il n’existe pas à ce jour de recommandations pour une patiente âgée de plus de 30 ans avec un test HPV-HR positif et une cytologie réflexe anormale. Il est de pratique courante de proposer une colposcopie.
Diagnostic clinique (rang A)
Interrogatoire et signes cliniques (rang A)
L’interrogatoire est effectué selon les modalités classiques en gynécologie. Il doit néanmoins s’appuyer particulièrement sur la recherche d’une immunodépression ou d’un tabagisme. Il faut aussi rechercher l’âge du premier rapport sexuel, l’existence de partenaires multiples et un bas niveau socio-économique (facteurs de risque). Il est essentiel d’interroger la patiente sur la date du dernier dépistage.Le cancer du col est le plus souvent asymptomatique et découvert lors du dépistage. Néanmoins, les métrorragies provoquées post-coïtales (peu abondantes, indolores) sont un signe clinique du cancer du col, qui peut aussi être responsable de métrorragies spontanées ou de leucorrhées.
En cas de stade avancé, les symptômes dépendent de l’extension locorégionale : douleurs neuropathiques, œdème des membres inférieurs ou phlébite, signes digestifs, vésicaux ou rénaux.
Examen physique (rang A)
L’examen physique débute toujours par une information complète de la patiente sur l’examen gynécologique et ses particularités. Le recueil du consentement est indispensable. En cas de cancer du col, l’examen abdominal est généralement pauvre, sauf en cas de stade avancé.L’examen se poursuit par l’inspection de la vulve, de la marge anale et de l’anus afin de rechercher des lésions bénignes liées à HPV (type condylomes) ou d’autres lésions associées.
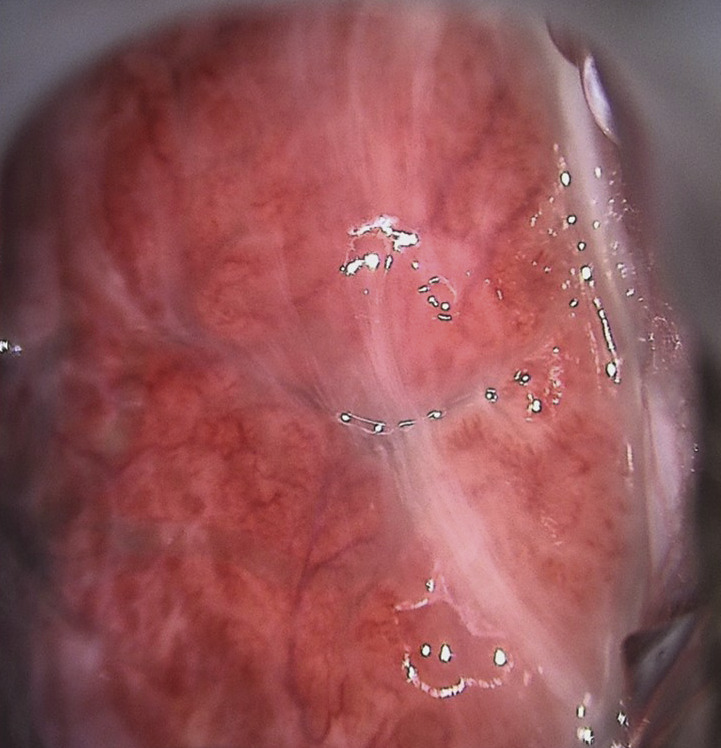
Le toucher vaginal permet de repérer une masse cervicale indolore et d’évaluer son extension locale (vaginale, paramétriale). L’examen du col se fait surtout par l’inspection lors de l’examen au spéculum. Le col se modifie selon le statut hormonal (grossesse, puberté, ménopause, prise de traitement hormonal) et la parité. Chez la femme nullipare, l’orifice cervical est punctiforme. Chez la femme multipare, celui-ci est plus ouvert et allongé (en museau de tanche). La zone de jonction pavimento-cylindrique (zone de jonction entre les muqueuses endocervicales et exocervicales) peut être visible à l’œil nu. Pendant la puberté, la grossesse ou sous traitement hormonal, la muqueuse endocervicale peut apparaître, il s’agit d’un ectropion (
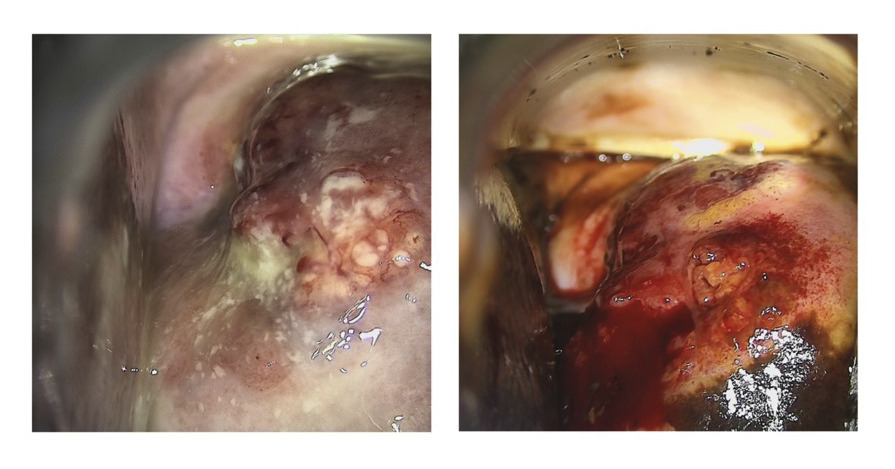
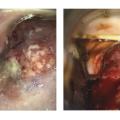
L’examen du col peut aussi mettre en évidence une cervicite, un polype, un fibrome ou de l’endométriose cervicale. L’examen cytologique ou test HPV est effectué à ce moment si le col présente un aspect normal. Un col suspect est un col rouge, irrégulier, saignant au contact ou avec une masse cervicale bourgeonnante ou ulcérée. Au moindre doute, une biopsie du col utérin doit être réalisée.
En cas de masse cervicale, une palpation des aires ganglionnaires inguinales est essentielle. Il faut effectuer une biopsie. Le toucher rectal permet de présager d’une atteinte paramétriale.
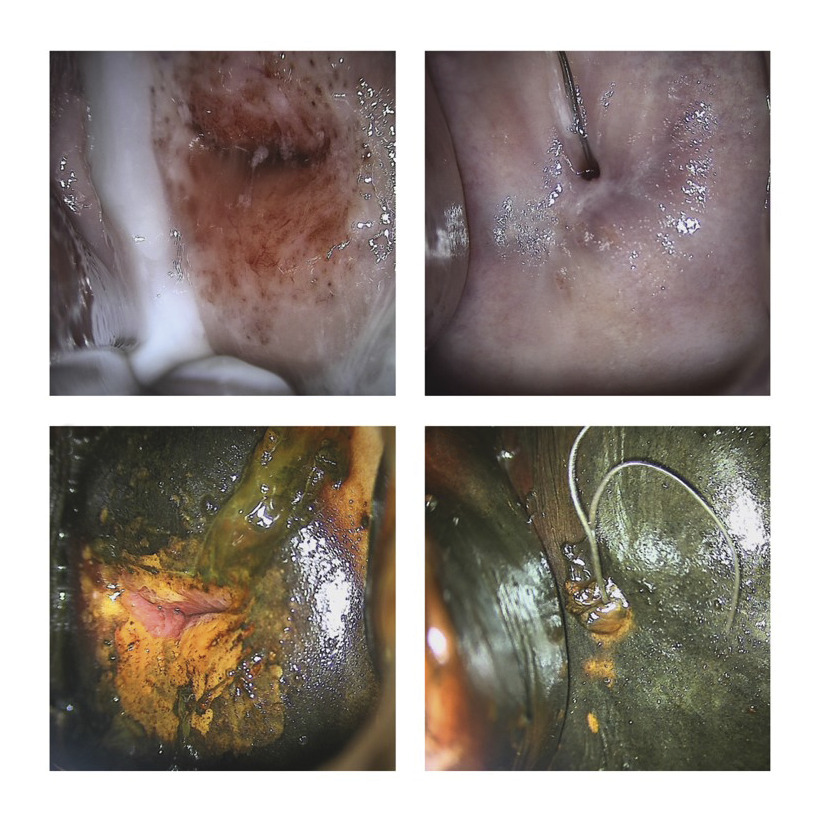
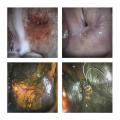
Colposcopie (rang B)
La colposcopie est un examen du col de l’utérus à la loupe binoculaire. Elle se fait en consultation, à l’aide d’un spéculum. Un schéma détaillé et bien codifié est systématique. Trois temps sont nécessaires :- examen du col sans préparation afin d’inspecter au mieux le col avec la loupe binoculaire ;
- examen du col après application d’acide acétique. L’acide acétique entraîne un blanchiment des cellules malpighiennes anormales par œdème tissulaire et coagulation des protéines cellulaires. On recherche donc une acidophilie anormale. Elle permet aussi la visualisation de la zone de jonction ;
- examen du col après application de Lugol (test de Schiller). Les zones ne se colorant pas en brun foncé sont les zones suspectes (atrophie, immaturité, dysplasie, ulcération).
Confirmation diagnostique
Le diagnostic est obtenu par histologie, sur l’analyse d’une biopsie (avec ou sans colposcopie) ou d’une pièce de conisation.Examens paracliniques du bilan d’extension (rang B)
La tomographie par émission de positons au 18-fluorodéoxyglucose (TEP-TDM) permet d’évaluer l’atteinte ganglionnaire et à distance à partir du stade FIGOIB1.
Le marqueur tumoral sérique SCC (squamous cell carcinoma) est utile pour les carcinomes épidermoïdes.
Le stade de la Fédération internationale de gynécologie et d’obstétrique (FIGO) (rang C) permet de guider la prise en charge (
Autres lésions liées à l’HPV
Tumeurs du corps utérin
Épidémiologie (rang B)
Facteurs de risque (rang A)
- l’âge ;
- l’obésité (par le biais de l’aromatisation des œstrogènes) ; le diabète de type 2 est aussi un facteur de risque ;
- l’exposition prolongée aux hormones. Le cancer de l’endomètre est un cancer hormonodépendant ; la nulliparité, l’âge précoce de la puberté, l’âge tardif de la ménopause augmentent le risque, tandis que la multiparité le diminue. Un traitement hormonal de la ménopause (THM) mal pris (sans progestatif) augmente le risque de cancer de l’endomètre (4 à 5 fois plus fréquent). Le tamoxifène augmente aussi le risque de cancer de l’endomètre (2 à 7 fois plus fréquent) ;
- les prédispositions génétiques, la plus connue étant le syndrome de Lynch. Celui-ci est lié à une mutation sur l’un des gènes impliqués dans la réparation des mésappariements de l’ADN (mismatch repair gene [MMR]), et son altération conduit à une instabilité du génome dans les cellules tumorales, particulièrement visible au niveau des loci de type microsatellite (phénotype MSI+ [microsatellite instability]). Il est responsable de cancers colorectaux, de l’endomètre, de l’intestin grêle, des voies urinaires, des voies biliaires, de l’estomac et des ovaires. En cas de mutation, le risque cumulé de développer un cancer de l’endomètre à l’âge de 70 ans peut atteindre 50 %.
Classification histologique et moléculaire (rang B)
- carcinome endométrioïde, le plus fréquent et de meilleur pronostic, comprenant les adénocarcinomes endométrioïdes de bas ou haut grade ;
- carcinome non endométrioïde, de moins bon pronostic, comprenant les carcinomes séreux, à cellules claires et les carcinosarcomes.
Certains marqueurs moléculaires, qui doivent être systématiquement recherchés, permettent d’affiner le pronostic des patientes. De manière schématique, quatre groupes de patientes peuvent être définis avec le résultat de ces marqueurs :
- bon pronostic en cas de mutation du gène POLE ;
- pronostic intermédiaire :
- en cas de tumeur MSI (instabilité des microsatellites)
- ou en l’absence d’anomalie moléculaire identifiée (NSMP [non specific molecular profile]) ;
- pronostic réservé en cas de mutation du gène TP53.
Diagnostic
Interrogatoire (rang A)
L’interrogatoire recherche notamment des facteurs de risque de cancer de l’endomètre : parité, âge de la ménopause et de la puberté, exposition au THM ou tamoxifène, obésité, diabète et antécédents familiaux.Il n’existe pas de dépistage pour le cancer de l’endomètre, sauf pour les patientes ayant un syndrome de Lynch, pour lesquelles il est actuellement proposé d’effectuer un dépistage annuel comportant un examen clinique, une échographie pelvienne et une biopsie endométriale.
Signes cliniques (rang A)
Les métrorragies post-ménopausiques sont le signe classique du cancer de l’endomètre : « Toute métrorragie post-ménopausique est en lien avec un cancer de l’endomètre jusqu’à preuve du contraire. » Il s’agit de métrorragies de sang rouge vif, à type de traces ou plus abondantes, pouvant être spontanées. D’autres signes peuvent être présents tels que des ménorragies, une hydrorrhée, une pyorrhée ou des signes digestifs ou urinaires en cas de stade avancé. Il peut aussi être découvert de manière fortuite sur un examen complémentaire fait de manière systématique ou pour une autre pathologie.Examen physique (rang A)
L’examen général comprend le poids, la taille et le calcul de l’indice de masse corporelle. Il est essentiel de faire le point sur les comorbidités chez ces patientes souvent fragiles.Comme détaillé précédemment, l’examen physique commence toujours par l’information et le recueil du consentement de la patiente. La palpation et l’inspection de l’abdomen sont généralement pauvres, en dehors des stades avancés. L’inspection vulvaire et de la marge anale ont ici peu d’intérêt. Le toucher vaginal peut retrouver une augmentation de la taille de l’utérus, qui est mou et globuleux avec éventuellement une masse utérine. La mobilité utérine est aussi appréciée, de même que l’accès vaginal, dans l’anticipation de la voie d’abord chirurgicale. Des masses latéro-utérines (métastases ovariennes) ou bien un blindage pelvien en cas de forme avancée peuvent être présents. L’examen au spéculum recherche des métrorragies, une hydrorrhée ou une pyorrhée. Il permet d’éliminer un diagnostic différentiel.
Il ne faut pas oublier de rechercher les autres cancers hormonodépendants, notamment le cancer du sein.
Confirmation diagnostique (rang A)
Les examens paracliniques sont essentiels dans le cancer de l’endomètre. L’échographie par voie abdominale et vaginale retrouve un endomètre épaissi (plus de 5 mm chez la femme ménopausée). Il peut être irrégulier, hétérogène et hypervascularisé. Une masse utérine peut être mise en évidence. Une pyorrhée ou hydrorrhée doit faire évoquer le diagnostic.En présence d’une hypertrophie endométriale, il convient de réaliser une biopsie d’endomètre, qui est effectuée en consultation, lors de l’examen au spéculum. Une pipelle de Cornier, insérée dans l’utérus par voie vaginale, permet d’aspirer le contenu endo-utérin par dépression et donc de récupérer des fragments d’endomètre, qui sont analysés histologiquement. Cet examen est très spécifique mais peu sensible. En effet, cette biopsie est effectuée « à l’aveugle » et un résultat normal ne peut exclure le diagnostic. Elle n’a de valeur que si elle est positive.
Le curetage biopsique à l’aide d’une curette permet également d’effectuer de larges biopsies à l’aveugle.
L’hystéroscopie est le passage d’une caméra optique dans la cavité utérine par voie vaginale. Elle peut être diagnostique (en consultation) ou opératoire (avec dilatation cervicale sous anesthésie permettant une résection plus large). Elle permet de visualiser la cavité utérine, des lésions éventuelles et d’effectuer des biopsies dirigées. Elle est utile en cas de suspicion de cancer de l’endomètre et d’examen à la pipelle normal ou non contributif. Elle est aussi utile en cas de sténose cervicale rendant impossible un prélèvement à la pipelle.
Examens paracliniques du bilan d’extension (rang B)
Classification FIGO (rang C)
Le dépistage du cancer du col est recommandé à partir de l’âge de 25 ans. Entre 25 et 30 ans, il repose sur un frottis cervico-utérin. En cas de normalité du premier frottis, il est recontrôlé à un an puis tous les trois ans. Chez les patientes âgées de plus de 30 ans, le dépistage repose sur un test HPV-HR effectué tous les cinq ans en cas de négativité.
La vaccination anti-HPV est recommandée chez les filles et les garçons âgés de 11 à 14 ans (schéma à 2 doses), avec un rattrapage possible de 15 à 19 ans (schéma à 3 doses).
Le diagnostic de cancer du col repose sur une biopsie cervicale faite à la pince à biopsie en consultation en cas de lésion macroscopique, ou sous colposcopie en cas d’anomalie du dépistage.
Toute métrorragie post-ménopausique doit être explorée par une échographie pelvienne en première intention. En cas d’épaississement endométrial, une biopsie d’endomètre doit être réalisée.
En cas de cancer de l’endomètre, les comorbidités des patientes doivent être recherchées, car elles peuvent avoir un impact sur la prise en charge.
Drapeaux rouges
La présence de métrorragies provoquées doit faire évoquer le diagnostic de cancer du col jusqu’à preuve du contraire.
Le frottis cervico-utérin est un examen cytologique. Le diagnostic de cancer du col repose sur une biopsie cervicale (histologie).
La présence de métrorragies post-ménopausiques doit faire évoquer le diagnostic de cancer de l’endomètre jusqu’à preuve du contraire.
En cas de cancer de l’endomètre et d’histoire familiale, il s’agit de penser au syndrome de Lynch.
La biopsie d’endomètre à la pipelle n’a de valeur que si elle est positive.
Conduite à tenir devant une femme ayant une cytologie cervico-utérine anormale. Collection Recommandations et Référentiels, version interactive, INCa, décembre 2016.
Recommandation pour la pratique clinique. Vaccination contre les papillomavirus chez les garçons. HAS, décembre 2019.
Bulletin épidémiologique hebdomadaire. Calendrier des vaccinations et recommandations vaccinales, 2023.
Concin N, Matias-Guiu X, Vergote I, et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2021;31(1):12-39.
Berek, JS, Matias-Guiu, X, Creutzberg, C, et al. FIGO staging of endometrial cancer: 2023. Int J Gynecol Obstet 2023;162:383-94.

 Encadrés
Encadrés